Introducción
La ciencia construye su cuerpo de conocimientos a modo de estructura firme, que se muestra a través de un discurso basado en definiciones concretas y precisas, para las que emplea conceptos compatibles con el paradigma reinante. No obstante, algunas denominaciones de paradigmas anteriores sobreviven por simple tradición histórica, incluso si su empleo actual no guarda estricta rigurosidad con una dada fenomenología. Esto genera una suerte de polisemia que puede dar lugar a confusiones.
Un caso especial es el de los cambios de estado y los equilibrios de fases, que son temas centrales en muchos cursos iniciales de química en todos los niveles de enseñanza, difiriendo esencialmente en el nivel de descripción y de profundidad conceptual con el que se discuten. Y dentro de estas temáticas, la enseñanza de los conceptos de ebullición y temperatura de ebullición, en línea con los desarrollos que figuran en todos los libros de texto básicos, da lugar a inconsistencias y contradicciones que influyen negativamente en el aprendizaje.
En este trabajo presentaremos un análisis crítico de las definiciones ampliamente empleadas en relación con los fenómenos involucrados y una propuesta para evitar la inducción de errores conceptuales durante la enseñanza y el aprendizaje.
Los cambios de estado y los equilibrios de fases
Las sustancias químicas se caracterizan por una composición química definida y por valores definidos en sus propiedades intensivas. Las «temperaturas de los cambios de estado» (TCE), tales como la temperatura de fusión o la temperatura de ebullición, figuran entre las propiedades intensivas más frecuentemente usadas como ejemplos, tanto por docentes como por alumnos.
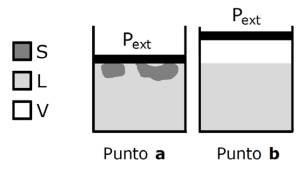
Las TCE son definidas usualmente como las temperaturas, para una dada presión externa (Pext), a las que tienen lugar los cambios de estado (CE) que refieren (así, la temperatura de fusión es aquella a la cual tiene lugar la fusión). De esta manera, esas temperaturas características se asocian a trayectos (procesos) en un diagrama de fases tal como se señala en la Figura 1 (que esquemáticamente corresponde a una sustancia como el agua que disminuye su volumen molar al fundir). El trayecto 1 hace referencia a una temperatura límite a partir de la cual se produce la fusión. De igual modo el trayecto 3 se asocia a la ebullición. De manera equivalente, se pueden considerar los trayectos inversos (2: solidificación o congelación; 4: condensación). Por lo tanto, esta conceptualización lleva a la afirmación de que la temperatura a la que se produce un cambio de fase es igual a aquella a la que se produce el cambio inverso. Ahora bien, el hecho de que la temperatura límite para que ocurra la fusión sea igual a la temperatura límite para que ocurra la solidificación (hipótesis basada originalmente en observaciones dentro del error experimental), no necesariamente debe dar lugar a la idea de equilibrio de fases (para advertir esta posibilidad debemos despojarnos por un momento de nuestros conocimientos actuales). Los puntos a y b del diagrama de fases de la Figura 1 representan los equilibrios sólido-líquido (S-L) y líquido-vapor (L-V), respectivamente. Desde el punto de vista termodinámico, para una dada Pext, las temperaturas están unívocamente definidas. Pero las denominaciones para estas temperaturas hacen referencia a procesos (los CE) y no a estados de equilibrio. A su vez, las definiciones encontradas en los libros de texto hacen convivir ambos enfoques. Es decir, podemos encontrar las siguientes definiciones:
Temperatura de fusión: temperatura a la cual un sólido se convierte en líquido (temperatura de un proceso).
Temperatura de fusión: temperatura a la cual el sólido y el líquido están en equilibrio (temperatura de un estado de equilibrio).
Temperatura de ebullición: temperatura a la cual un líquido se convierte en vapor (temperatura de un proceso).
Temperatura de ebullición: temperatura a la cual la presión de vapor de un líquido iguala a la presión externa.

Figura 1 Diagrama de fases y temperaturas de fusión (Ta) y ebullición (Tb). S, L, V, corresponden a sólido, líquido y vapor, respectivamente. El punto vacío del final de la curva L-V es el punto crítico.
Para las tres primeras opciones en algunos textos incluso se suele obviar la referencia a la Pext.
La última definición para temperatura de ebullición es la que se encuentra como la más rigurosa en la bibliografía básica y la denominaremos temperatura de ebullición por definición, (TEPD).
Es posible que estas dobles alternativas para definir una temperatura característica generen confusiones que los docentes pueden no advertir en su tarea de enseñanza.
En realidad, un CE es un proceso, una transformación de una fase a otra. Esta transformación puede ocurrir de modo irreversible (ΔGP,T < 0) como ocurre al colocar un trozo de hielo (agua sólida) en un ambiente bajo la presión de 1 atmósfera y a temperaturas superiores a 0°C. En estos casos, el sistema no está en equilibrio en ningún momento mientras dure el CE: la temperatura del hielo diferirá significativamente de la temperatura ambiente al que está ligado térmicamente. No obstante, aquella transformación también puede producirse de modo reversible (ΔGP,T = 0) si a un trozo de hielo, a la presión de 1 atmósfera y a 0°C, se le cede energía que se utiliza en la fusión sin modificaciones de la temperatura y, consecuentemente, con las fases siempre en equilibrio. Estas ambigüedades tienen mayor incidencia negativa para el caso del equilibrio L-V. A continuación se presentará esa problemática.
El equilibrio L-V y la ebullición
Previo al tratamiento de esta sección resulta imprescindible destacar que un diagrama de fases como el de la Figura 1 corresponde al de una sustancia pura en un sistema cerrado. Los puntos de equilibrio bifásico a y b se corresponden con diferentes situaciones en un recipiente provisto de un pistón móvil sin roce que ejerce una presión constante e igual a Pext, tal como se representa en la Figura 2. Pero normalmente, las operaciones de laboratorio son efectuadas en sistemas abiertos al aire. Tales sistemas pueden aproximarse a estados de equilibrio si se considera el entorno próximo a las superficies libres de las fases condensadas, y para ellos es inevitable en todos los estados la presencia de vapor de la sustancia (eventualmente mezclado con aire). Para sistemas abiertos, entonces, es posible emplear diagramas de fase aunque con modificaciones (Andrade-Gamboa, Mártire y Donati, 2010): el eje de ordenadas de presión externa se reemplaza por el de presión de vapor (pv) de la sustancia; desaparece la rama S-L; para cada Pext se tiene un diagrama diferente (diferentes desplazamientos que sólo son importantes para variaciones muy grandes de Pext), y los estados posibles son los indicados por las ramas S-V, L-V y los puntos por debajo de ellas. La Figura 3 muestra el diagrama de fases equivalente al de la Figura 1 pero para un sistema abierto.
Respecto del CE de L a V, se distingue entre el proceso superficial (denominado evaporación) y el proceso masivo que ocurre en el seno del líquido y que se denomina ebullición. Aunque vaporización es el término más general, la TCE utiliza el término «ebullición» y no hace referencia a la vaporización.
La evaporación es el proceso de vaporización más simple, que requiere que algunas moléculas de la superficie tengan suficiente energía (un valor mínimo, Emín) para vencer las fuerzas de atracción con las moléculas que las rodean. Las energías de las moléculas siguen una distribución de Maxwell-Bolztmann (Chang, R., 2010), por lo que a cualquier temperatura habrá probabilísticamente cierta proporción de moléculas con un valor de energía igual o superior a Emín que, de encontrarse en la superficie, se escaparán a la fase vapor. Es por eso que en un sistema abierto donde el vapor formado sea removido más o menos eficientemente, si mantenemos la temperatura del líquido constante, todas las moléculas del líquido finalmente se evaporarán (el sistema quedará representado por un punto en la curva L-V de la Figura 3). Obviamente, la cinética de evaporación dependerá de la geometría del sistema: así, para un dado volumen de líquido, mayor superficie provocará una evaporación más rápida, mientras que, a una superficie constante, mayor cantidad de líquido requerirá más tiempo. Por otro lado, si el vapor se acumulara por sobre la superficie del líquido, la condensación (cuya velocidad es proporcional a la presión de la fase vapor) aumentará su contribución, competirá con la evaporación y la vaporización neta disminuirá (motivo por el cual la ropa mojada colgada al aire libre tarda más en secarse en un día con mayor humedad ambiente). En cambio, si el líquido está contenido en un recipiente hermético rígido con una cámara de vapor y a temperatura constante (el recipiente y la situación sería como lo representado en la Figura 2 a la derecha, pero con el émbolo fijo), se alcanzará un estado en el que la presión de vapor adquiere un valor constante, las velocidades de evaporación y condensación se igualarán, la cámara superior estará saturada de vapor y no habrá un proceso neto de vaporización ni de condensación. En estas condiciones, para esa temperatura (la temperatura de saturación) y para esa presión de vapor (presión de saturación), ΔGP,T vap = 0 y el sistema habrá alcanzado el equilibrio. Si la temperatura se incrementa, mayor proporción de moléculas estará en condiciones de evaporarse, se produce un momentáneo desbalance entre los procesos de evaporación y condensación, hasta que vuelve a alcanzarse, pero una presión más elevada. Este diseño experimental, provisto de un dispositivo interno de medición de presión, permite delinear la curva de equilibrio L-V desde el punto triple al punto crítico de la Figura 1.
Por otro lado, la ebullición es el proceso de formación de burbujas en el seno de líquido, que suben hasta la superficie libre del líquido (interfase L-V), tal cual corresponde a su etimología: ebullición proviene del latín ebullitǐo que conjuga “e” por “ex” (fuera de medida) y bullǐre (bullir), que significa formar burbujas (bulla, burbuja). Este término (ebullición) también se emplea con el significado amplio de estado de agitación (social, por ejemplo), y la palabra derivada, bullicio, hace referencia a ruido o tumulto. De aquí que la ebullición sea un modo de vaporización que transcurre, tal cual indica el contexto semántico, de manera intensa, tumultuosa o violenta. La ebullición constituye un hecho cotidiano, fuera del ámbito científico, y familiar para la mayoría de las personas por lo que la palabra ebullición (o su sinónimo, hervor) forma parte del vocabulario de los estudiantes mucho antes de tener contacto con alguna formación científica.
Ahora bien, durante la descripción del CE de L a V, sólo se mencionó el fenómeno de evaporación. Las preguntas obligadas son, ¿qué relevancia especial tiene el fenómeno de ebullición para definir una TCE?, ¿cuándo tiene lugar el proceso de ebullición?, y una semejante y asociada, ¿tiene lugar a la temperatura de ebullición definida por igualdad de presiones tal como nos indica la TEPD?
Para que exista el proceso de ebullición, es decir, una corriente permanente de burbujas resulta necesario que las mismas se generen y subsistan mientras migran hacia la superficie de separación L-V.
La permanencia de la burbuja con un tamaño determinado requiere de un equilibrio mecánico, en el que la presión del vapor en su interior debe ser igual a la suma de la presión del líquido en la interfase de la burbuja, más la presión equivalente a la tensión de interfase L-V, σ. Por ende, la presión de vapor pB en el interior de la burbuja esférica de radio r, viene dada por (Collier y Thome, 1994)
donde r es el radio de la burbuja (considerada esférica) y pL es la presión del líquido que será la suma de la presión sobre la superficie del líquido (Pext) más la presión hidrostática que ejerce la columna del líquido por debajo de la superficie, a una profundidad h y que estará dada por el producto h δ g, siendo δ la densidad del líquido y g la aceleración de la gravedad. De este modo, la ecuación 1 queda:
Para que la burbuja no colapse pB debe ser al menos igual al miembro de la derecha. La ecuación 2 indica que la presión de vapor en la burbuja debe ser mayor que la presión externa, por lo tanto, la condición explicitada para la TEPD (pB = Pext) no permite la existencia de burbujas en el seno del líquido. Esto significa que ¡el líquido no estará en ebullición a la temperatura de ebullición! Una evidencia experimental sencilla para esta afirmación la proporciona el experimento representado en la Figura 4; el agua contenida en el recipiente interno, que está sumergido dentro de otro con agua en ebullición, si bien se encuentra a la temperatura a la que el agua bulle, no entra en ebullición.
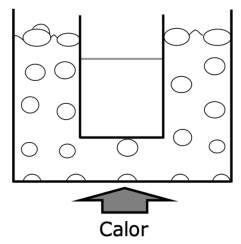
Figura 4 El agua del recipiente sumergido no está en ebullición a la temperatura a la cual está en ebullición el agua del recipiente mayor.
Si consideramos una profundidad nula (h = 0) y un radio de burbuja infinito, la ecuación 2 converge a pB = Pext y las condiciones impuestas representan la superficie libre del líquido. La condición de igualdad de presiones solamente se dará para dicha superficie a la temperatura de saturación y la vaporización corresponderá a la evaporación ya descripta, siendo el único fenómeno que cumple con las condiciones impuestas en la TEPD, y el sistema alcanzará el equilibrio que corresponde al punto b de la Figura 3 (no requiriendo ningún otro mecanismo de vaporización como por ejemplo la ebullición).
Entonces, para que un líquido alcance la ebullición, la temperatura debería ser (paradójicamente) superior a la TEPD, de modo de garantizar una presión de vapor dentro de la burbuja capaz de garantizar su subsistencia. Esta condición experimental para que se produzca la ebullición se denomina sobrecalentamiento y se explica mediante un modelo de nucleación de burbujas y su posterior crecimiento. La nucleación es un proceso elemental que requiere la formación de una burbuja, denominada núcleo o embrión, que tenga un tamaño mínimo, denominado radio crítico r*. El cambio de energía libre ΔG(r) para la formación de un núcleo de radio r está dado por (Collier y Thome, 1994):
A pequeños valores de r, domina el término superficial (primer término) mientras que, a grandes r, domina el término de volumen (segundo término); debido a ello, la ΔG(r) tiene un máximo que corresponde a r = r* (ver Figura 5). El tamaño crítico se adquiere por fluctuaciones de densidad u otras perturbaciones en el líquido que suministran la energía necesaria y es el caso de la denominada nucleación homogénea. Los núcleos con r < r* colapsarán (no pueden crecer espontáneamente porque implicaría un incremento en energía libre); en cambio, aquellos para los que r ≥ r* crecerán espontáneamente, mientras se dé la condición impuesta por la ecuación 2. La formación de embriones de radio r* requerirá del sobrecalentamiento mencionado.
El proceso global de la ebullición involucra un número infinitamente grande de núcleos de tamaño crítico por unidad de volumen de líquido, el cual está dado por (Collier y Thome, 1994)
donde k es la constante de Boltzmann y N es una constante proporcional al número de moléculas por unidad de volumen. Luego, la cinética del proceso corresponderá a la velocidad v de crecimiento de burbujas dado por:
donde λ es el número de moléculas de líquido por unidad de tiempo que colisionan con los núcleos críticos. La estimación de velocidad eficiente para la ebullición da valores en el rango 109-1013 s-1 m-3 (Simpson y Walls, 1965). Para el agua a 100 °C y a 1 atm, para obtener una velocidad de 1013 s-1 m-3, se calcula un sobrecalentamiento de 221 °C (Collier y Thome, 1994). Dada la fuerte dependencia con la temperatura (ecuación 5) para sobrecalentamientos un poco por debajo del necesario para la formación embriones, el proceso de la ebullición no ocurrirá apreciablemente. El agua muy pura en recipientes sin imperfecciones (solo posibilidad de nucleación homogénea) se ha calentado uniformemente hasta unos 300 °C, manteniéndose en estado líquido metaestable (Hewitt, 1998). La ebullición es un posible mecanismo para relajar o romper ese estado metaestable del líquido, lo cual ocurre a una temperatura superior a TEPD, de manera enérgica y hasta violenta, según el grado de sobrecalentamiento alcanzado.
La ebullición que se observa frecuentemente, tanto en el hogar como en el laboratorio, tiene lugar debido a la nucleación heterogénea. Este tipo de nucleación se origina en imperfecciones (cavidades, relieves) en las paredes del recipiente que contiene al líquido; el ΔG* para esta nucleación es sensiblemente menor al de la nucleación homogénea. Esto reduce el sobrecalentamiento requerido y la ebullición puede transcurrir a través de unos pocos centros de nucleación heterogénea. Precisamente, este sobrecalentamiento se produce en la zona en contacto con la superficie calentada (la base calentada directamente en el caso del recipiente externo de la Figura 4). Usualmente, sobrecalentamientos de 5-10 °C por encima de la TEPD, bastarán para generar burbujas. Estas, incluso, se pueden generar cuando la temperatura de la zona superior de líquido es inferior a TEPD. En ese caso, las burbujas podrán formarse, pero quedan restringidas a una zona cercana al flujo entrante de calor ya que a medida que ascienden esas burbujas desaparecen al perder calor por transferencia al líquido. Este burbujeo producido inicialmente es eficiente para aumentar la transferencia de calor hacia el resto del líquido. Cuando el seno del líquido adquiere una temperatura cercana a la TEPD, las burbujas no sólo no colapsan, sino que crecen y alcanzan la superficie generando el proceso masivo y ciertamente tumultuoso que habitualmente observamos y denominamos hervor. La ebullición también puede producirse muy lentamente, tal como para agua saturada de aire, en la que a temperatura ambiente y con ΔTsat del orden de 5 °C las burbujas crecerían hasta un diámetro de 0,5 mm al cabo de unos 50 minutos. (Andrade-Gamboa y Donati, 2021).
A esta altura, cabe la siguiente pregunta: ¿por qué para un sistema abierto la temperatura sigue aumentando por encima del TEPD si de todos modos hay un mecanismo de vaporización funcionando? Efectivamente, como hemos visto, la vaporización no está restringida por los fenómenos de formación de burbujas y, aun cuando pudiera requerir bajo determinadas condiciones alguna activación, funciona a cualquier temperatura en la medida que exista una superficie libre para el líquido. El sobrecalentamiento se produce cuando el flujo de calor no es conducido rápidamente hacia la superficie del líquido y/o la evaporización neta no es suficientemente rápida como para evitar la acumulación de energía y el consecuente incremento de la temperatura en el seno del líquido. La transferencia de energía a través del líquido y hacia la superficie, en ausencia de ebullición, se produce solo a expensas del fenómeno de convección que no es demasiado eficiente; durante la ebullición, en cambio, las burbujas trasladan energía con gran eficiencia hacia la superficie. La evaporización consume gran cantidad de energía, pero está limitada a una capa infinitesimal sobre la superficie del líquido. Estos hechos provocan que, en ausencia de nucleación, se produzca el sobrecalentamiento, fundamentalmente si el calentamiento es rápido y uniforme y hay una muy baja relación superficie libre/volumen para el líquido.
Este fenómeno que requiere un sobrecalentamiento para que la ebullición se produzca solamente es posible para sistemas abiertos. En un sistema cerrado, a presión externa constante, con líquido y vapor en equilibrio (Figuras 1 y 2), no es posible que la presión de vapor supere a la Pext. Cualquier aumento de temperatura redundará en mayor producción de vapor a presión constante. Por lo tanto, no es posible en estos sistemas cerrados que la ebullición se produzca. Luego, para un sistema abierto, si bien la ebullición es un proceso factible, no se produce a la temperatura Tb de la Figura 3. Por estas razones, la TEPD, tanto en sistemas abiertos como cerrados, se corresponde con una condición de equilibrio para la que la ebullición no se pone en juego. Esto es un cuestionamiento severo a incluir el fenómeno de ebullición para definir la temperatura de equilibrio L-V.
Podemos, entonces, dar respuesta a los interrogantes que fueron guiando la discusión:
• ¿Qué relevancia especial tiene el fenómeno de ebullición para definir una TCE?
Ninguna
• ¿Cuándo tiene lugar el proceso de ebullición?
Cuando las condiciones de sobrecalentamiento permiten la nucleación y crecimiento de burbujas.
• ¿Tiene lugar a la temperatura de ebullición definida por igualdad de presiones tal como nos indica la TEPD?
Definitivamente, no.
Un breve relevamiento a través de una encuesta
Para indagar los posibles efectos de influencia del tratamiento convencional extendido en todos libros de texto de la temática que nos ocupa, se diseñó un par de encuestas simples, de respuesta rápida y uno de los autores la llevó a cabo con ocho docentes auxiliares de su Cátedra de química inicial universitaria. Los resultados (ver Apéndice), muestran la existencia de confusiones1:
Las respuestas a la pregunta 1, podrían mostrar la influencia de la ambigüedad presente en la definición convencional de temperatura de ebullición (TEPD).
Las respuestas a la pregunta 2, parecen mostrar que, independientemente de la definición de punto de ebullición (la condición de igualdad en presiones no condiciona ya que se afirma que el líquido está en su punto de ebullición normal), en general se considera que corresponde al proceso de ebullición.
Las respuestas a la pregunta 3, muestran que ante la necesidad de recurrir a la ebullición como manifestación fenomenológica (a través de la definición) se la invoca en situaciones en las que es imposible que ocurra. Parecería haber cierta tendencia a considerar que para que se alcance el equilibrio L-V a una dada presión externa debe ocurrir la ebullición.
Un refuerzo posible para considerar (erróneamente) a la ebullición como fenómeno que puede y/o debe ocurrir en sistemas cerrados puede originarse en ciertos experimentos mostrativos que suelen ser muy vistosos y llamativos. Así la ebullición se logra en un sistema cerrado ejerciendo vacío (con una bomba de vacío) en un líquido contenido en un balón (lo mismo se puede reproducir de manera sencilla con una jeringa llena de agua caliente, tapando la punta y tirando bruscamente del émbolo hacia atrás), o en el clásico experimento de agua que ha cesado de bullir en un balón abierto que inmediatamente se tapa y en posición invertida se baña con agua fría de canilla. Estos experimentos indican que existe una alternativa al sobrecalentamiento en un sistema cerrado que es mediante el descenso brusco de la Pext. Esto provoca un estado transitorio, fuera del equilibrio, que se denomina cavitación y equivale a un trayecto vertical descendente a través de la curva L-V de la Figura 1. Para una dada temperatura, el estado del sistema transitoriamente se caracteriza por una presión de vapor superior a la Pext, por lo que se inicia una ebullición que cesa una vez que la presión de vapor iguala a Pext.
La influencia de las tradiciones como una posible explicación de la jerga heredada
La asociación implícita entre el concepto de CE y el de un estado de equilibrio que puede encontrarse en muchos libros de texto, puede tener un origen en las circunstancias en las que la ciencia de la termometría requirió de puntos fijos para la construcción de las escalas de temperatura (Chang, H. 2004). Estos puntos fijos debían ser accesibles experimentalmente, altamente reproducibles y sostener su temperatura constante durante un tiempo prolongado. Previo a los trabajos de Gibbs (mitad del siglo XIX) sobre el equilibrio de fases, los fenómenos empleados para definir puntos fijos eran la fusión, la solidificación y la ebullición de sustancias puras. Naturalmente, los desarrollos en la termometría atendían a la medición de las temperaturas de sistemas isotérmicos, es decir a base de puntos fijos.2 La escala centígrada (de la que se deriva la actual escala Celsius) tomaba como puntos fijos las temperaturas de fusión del hielo (0 °C) y de ebullición del agua (100 °C)3, para una Pext = 1 atm. El punto de fusión del hielo se obtenía midiendo la temperatura del líquido rodeado de pequeños trozos de hielo, a la temperatura ambiente y en presencia de aire (Figura 6). Bajo esas condiciones se produce la fusión de manera isotérmica, y dada la presencia de aire, el estado del sistema se corresponde con el punto a del diagrama de fases de la Figura 3, para Pext = 1 atm. Por lo tanto, se trata de una situación próxima a la correspondiente al punto triple del agua (punto a del diagrama de fases de la Figura 1 para P = 1 atm), que se denomina punto de hielo y sigue siendo una aproximación aceptable al punto triple para el que la temperatura es 0,0098 °C (Andrade-Gamboa, Mártire y Donati, 2010). Para el punto de ebullición, la determinación de la temperatura del líquido no daba valores únicos ni reproducibles (además dependía de la zona del líquido en la que se colocaba el termómetro)4, de modo que a principios del siglo XIX se terminó acordando que la mejor determinación se obtenía midiendo la temperatura del vapor a una distancia próxima de la superficie libre del líquido (Figura 6). Esta se denominó temperatura de vapor y define el estado llamado punto de vapor, pero se siguió empleado la denominación «punto de ebullición» aunque el fenómeno de burbujeo lo único que permitía era proveer de vapor5. La escala de temperatura Celsius (y, consecuentemente, la escala Kelvin) actualmente vigente no contempla estos puntos fijos y solamente conserva el punto triple del agua de acuerdo con la escala internacional de temperatura del año 1990 (International Scale Temperature, ITS-90).
En la actualidad, la determinación de puntos fijos en los laboratorios de los organismos de metrología contemplan el hecho de que resulta necesario que el estado se aproxime lo más posible, dentro del diseño experimental de medición, a un estado de equilibrio el cual está definido inequívocamente por las variables necesarias según la regla de las fases6. Si la medición se efectúa bajo una presión constante y se cuenta con dos fases y un componente, en un procedimiento estándar de laboratorio, solo queda la temperatura como la variable a medir. Es evidente que la determinación experimental se simplifica con su asociación con un CE; sin embargo, los puntos fijos están localizados en el estado del sistema (el CE neto es innecesario). Luego, los puntos triples para un sistema de un componente, que representan sistemas invariantes (cero grados de libertad), constituyen sistemas experimentales que no exigen el control de variables y es por eso que varios de ellos son tenidos en cuenta como puntos fijos en la ITS-90.
Propuesta de terminología y algunas recomendaciones
Todos los CE llevan asociado un mecanismo de nucleación y crecimiento con las correspondientes barreras cinéticas que hacen que una dada transformación de una fase a la otra no ocurra exactamente a la TCE. Respecto de la Figura 1, los trayectos 1 y 3 tienen una temperatura límite mayor a Ta y Tb, respectivamente (se requiere un sobrecalentamiento) y los trayectos 2 y 4 tienen una temperatura límite menor a Ta y Tb, respectivamente (se requiere un sobreenfriamiento). Más allá de que en algunos casos, como la fusión sin inhibición superficial provocada (Cahn, 1986), pueden ocurrir a temperatura muy próxima a la de equilibrio, sería conveniente reemplazar todos los términos de TCE por temperaturas de equilibrio. Así, por ejemplo, la denominación «temperatura (punto) de fusión» se reemplazaría por «temperatura (punto) S-L». De igual manera, en el caso de los puntos fijos vinculados con el equilibrio L-V, la denominación «temperatura (punto) de ebullición» se reemplazaría por «temperatura (punto) L-V». En general, para una sustancia pura cada punto (como sinónimo de estado de equilibrio) está caracterizado por un juego de valores de P y T y la propuesta es indicarlos como PX-Y y TX-Y (donde X e Y son las fases involucradas) y referirnos a ellos como la presión y la temperatura correspondientes al punto X-Y o simplemente presión X-Y y temperatura X-Y. Entonces las temperaturas de fusión y ebullición se simbolizarían como TS-L y TL-V.
Además, proponemos evitar el uso del término ebullición como un CE y considerar asociarlo a uno de los mecanismos de vaporización que requiere condiciones especiales. Es conveniente que en relación con el equilibrio L-V, los docentes introduzcan una breve descripción de las condiciones para que la ebullición ocurra. De esa manera se evita asociar al burbujeo con un estado de equilibrio.
¿Qué se determina en las mediciones de laboratorio de temperaturas características?
Es frecuente en laboratorios de enseñanza la práctica de caracterizar sustancias a los efectos de evaluar estados de pureza y/o para poder realizar una identificación química (determinación de constantes físicas). En tal sentido, las determinaciones de «temperaturas de fusión y ebullición» son una práctica corriente (Marambio, Acuña y Pizarro, 2007). Los procedimientos aplicados poseen una exigencia mucho menor que las determinaciones de los laboratorios metrológicos, pero aún se pueden obtener valores que son comparables con los tabulados para los puntos de equilibrio S-L y L-V (TS-L y TL-V). Por ejemplo, para determinar una TS-L, se mide la temperatura de la primera aparición de líquido en un calentamiento lento, lo cual sumado al mencionado bajo sobrecalentamiento para la fusión se aproxima al valor termodinámico. Más importante aún son las precauciones en ciertas determinaciones de valores para TL-V. Los métodos de laboratorio son alternativas experimentales que conceptualmente se acercan a una temperatura de equilibrio, por cuanto, si bien miden la temperatura del líquido, no lo hacen durante la ebullición. Por ejemplo, en el método de Siwoloboff (Marambio, Acuña y Pizarro, 2007), un capilar cerrado en un extremo se introduce boca abajo en un líquido; se provoca la ebullición, se quita la calefacción y finalmente se mide la temperatura del baño en el momento en que una última burbuja no puede escapar de la boca del capilar. Esta temperatura, salvo por la pequeña diferencia por la presión hidrostática, corresponde a la igualdad entre la presión de vapor y la presión externa, por lo tanto la temperatura medida se aproxima a la de equilibrio, TL-V a la correspondiente presión externa. Por otro lado, durante un procedimiento de destilación, los valores de temperatura que permiten evaluar los diferentes cortes de destilación corresponden a puntos de vapor, que corresponden a la condensación en un estado muy similar al de equilibrio que también son muy próximos a las TL-V.
¿Se puede definir una verdadera temperatura de ebullición?
La definición tradicional de temperatura de ebullición (TEPD) mezcla dos características incompatibles (equilibrio e irreversibilidad). Indirectamente, parte de la definición refiere a una temperatura de carácter termodinámico (equilibrio dado por pv = Pext) para un fenómeno que se produce a una temperatura que permite que se supere un límite cinético.
De manera general, la temperatura de X, donde X es un proceso o estado, puede hacer referencia a (opción 1) una condición que se elige para llevar adelante X (pudiendo no ser única), o una condición única impuesta por el fenómeno para que pueda producirse (opción 2). Por ejemplo la temperatura de fermentación de un vino es aquella a la que se decide llevar adelante el proceso (opción 1). Por otro lado, la temperatura de equilibrio L-V para una sustancia pura a una dada presión, queda unívocamente fijada como condición termodinámica (opción 2). Pero también, la opción 2 podría incluir ejemplos de naturaleza diferente. Por ejemplo, la temperatura de ignición o inflamación de un material combustible, es la temperatura mínima a la que dicho material, a una dada presión externa de aire, se inflama, para dar lugar a un proceso irreversible. Para producir la ignición se requiere que los vapores de la sustancia y el aire superen la energía de activación para la combustión, de manera que la temperatura mínima para dicha condición es un límite de naturaleza cinética. Por lo expuesto, esta misma naturaleza tendría una TCE, ya que todas están asociadas a una barrera cinética para su producción. En especial, una definición para una temperatura que involucre efectivamente el proceso de ebullición podría ser:
Temperatura de ebullición: temperatura de un líquido, a una dada presión externa, para la que se produce la formación de burbujas de vapor y su migración hacia la interfase líquido-vapor. El valor es mayor que la temperatura de equilibrio líquido-vapor a la dada presión externa y depende del fenómeno de nucleación que intervenga.
Reflexiones finales
En la vida cotidiana, los usos y costumbres son muy difíciles de reemplazar por otros aun cuando se acepte su conveniencia y las ventajas que eso implicaría. La ciencia y su argot no son ajenas a esta regla general y muy humana. Es por eso que cualquier propuesta como la presente, aun cuando los lectores coincidan plenamente con ella, chocará necesariamente con la costumbre diseminada en libros, docentes y estudiantes. Aun así, nuestra intención es provocar una reflexión y una discusión sobre estos temas que se pueda extender al aula (con las precauciones y límites convenientes a cada curso). Esa práctica permitirá una mayor comprensión sobre los cambios de estado, sobre los puntos fijos y las variables que los definen, desnudará concepciones alternativas tanto de estudiantes como de los propios docentes y, fundamentalmente, permitirá una revisión del significado que tienen conceptos y terminología en los estudiantes que puede diferir sensiblemente de los aceptados científicamente y/o del que los docentes pretenden.











 text new page (beta)
text new page (beta)