Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista del Instituto Nacional de Enfermedades Respiratorias
Print version ISSN 0187-7585
Rev. Inst. Nal. Enf. Resp. Mex. vol.17 n.4 México Dec. 2004
Rev Inst Nal Enf Resp Méx 2004; Vol. 17(4):272279
CASO CLÍNICO
SÍNDROME DE EMBOLIA GRASA SECUNDARIA A INYECCIÓN INTRAMUSCULAR DE MATERIAL OLEOSO
LUIS EFRÉN SANTOS MARTÍNEZ
TOMÁS PULIDO
EDGAR BAUTISTA
MATEO PORRES
JOSÉ GOTES
GERARDO ROJAS
MARÍA LUISA MARTÍNEZ GUERRA
ALICIA CASTAÑÓN
ARTURO CARRILLO
CARLOS IBARRA PÉREZ
JULIO SANDOVAL ZÁRATE
Departamento de Cardioneumología, Instituto Nacional de Cardiología "IGNACIO Chávez".
Trabajo recibido: 30-XI-2004;
Aceptado: 15-XII-2004
Correspondencia
M en C. Luis Efrén Santos Martínez.
Departamento de Cardioneumología. Instituto Nacional de Cardiología "Ignacio Chávez".
Juan Badiano No. 1, colonia Sección XVI. Delegación Tlalpan.
México DF., 14080.
Teléfono: 55 73 29 11, extensión 1355
E-mail: sanlui@cardiologia.org.mx
RESUMEN
La embolia grasa describe la presencia de grasa en la circulación sanguínea, asociado o no al desarrollo de un síndrome clínico identificable por sus signos y síntomas. Puede ser secundaria a traumatismos, cirugía ortopédica, causas no traumáticas y al uso de sustancias y procedimientos con fines estéticos. Presentamos el caso clínico de una mujer que desarrolló el síndrome de embolia grasa después de la inyección de una sustancia oleosa en ambos glúteos, con fines estéticos. Hubo manifestaciones clínicas del aparato respiratorio, del sistema nervioso central y hematológicos. El diagnóstico fue establecido por los criterios clínicos de Gurd y Lindeque. La paciente presentó el síndrome de dificultad respiratoria del adulto por lo que requirió de ventilación mecánica. La evolución fue hacia la mejoría, y egresó del hospital con recuperación completa de sus funciones, que ha mantenido durante un año.
PALABRAS CLAVE:Embolia pulmonar grasa, síndrome de dificultad respiratoria del adulto, daño pulmonar agudo.
ABSTRACT
The term fat embolism refers to the presence of fat droplets in the circulation; patients can be asymptomatic or present with a full blown clinical syndrome. Fat embolism can develop after trauma, orthopedic surgery and cosmetic procedures. We present the case of a 15-year-old female that developed the fat embolism syndrome after a single intra-muscular injection in each buttock of an oily substance, for cosmetic reasons. The clinical picture was associated with respiratory failure, neurological impairment and blood abnormalities. The diagnosis was established according to the Gurd and Lindeque criteria. The patient developed the acute respiratory distress syndrome and required mechanical ventilation. The patient had a complete recovery and is without any sequelae after a one-year follow up.
KEY WORDS: Pulmonary fat embolism, acute respiratory distress syndrome, acute lung injury.
INTRODUCCIÓN
El síndrome de embolia grasa (SEG) es una entidad poco frecuente en la población general. Habitualmente es debida a eventos traumáticos secundarios a fracturas óseas y procedimientos quirúrgicos ortopédicos o traumatológicos. La incidencia reportada en estudios retrospectivos ha sido <1% 1 ; sin embargo, de manera prospectiva, se ha referido entre el 11-19% 2,3 . Este síndrome también ha sido descrito como complicación de padecimientos y eventos aparentemente no traumáticos, como pancreatitis 4 , anemia de células falciformes 5 , necrosis hepática 6 , hepatitis viral fulminante 7 , infusión de lípidos 8 , propofol 9 , ciclosporina A 10 , e histerosalpingografía 11
El uso creciente e indiscriminado de materiales diversos y/o procedimientos estéticos ha permitido demostrar que éstos no están libres de riesgo. Se han informado complicaciones con el uso de grasa autóloga 12 , aceite vegetal 13 , los implantes de silicón en su forma líquida 14 o semilíquida 15 , petrolato y parafina 16,17 e implantes de colágena bovina 18 . El SEG se ha presentado posterior a liposucción 19,20 y en la mamoplastia 13 . Según lo que conocemos, el SEG ha sido informado en dos casos previos de modelaje glúteo por inyección aguda y crónica de silicón 14
Presentamos el caso clínico de una paciente, quien después de la inyección de una sustancia oleosa en los glúteos, con fines estéticos, desarrolló el SEG y el síndrome de dificultad respiratoria aguda (SDRA).
CASO CLÍNICO
Historia médica: Mujer de 15 años de edad, estudiante de actuación, cuyo único antecedente de importancia fue haber recibido una inyección oleosa intramuscular en cada glúteo, con fines estéticos, tres días antes a su ingreso al Instituto Nacional de Cardiología "Ignacio Chávez" (INC "Ignacio Chávez").
El mismo día, después de la inyección intramuscular de este material oleoso, presentó tos seca y disnea de leve intensidad, acompañada de mareos, náusea, vómito de contenido alimentario, palidez generalizada y visión borrosa. Al segundo día, la tos se hizo productiva y la disnea incrementó hasta ser de medianos esfuerzos, sin tolerar caminata mayor a 100 metros en plano horizontal, el mareo aumentó sin llegar al síncope. Al tercer día hubo mayor deterioro clínico, y apareció dolor precordial leve, transfictivo, irradiado a la espalda, por lo que fue hospitalizada en otro sitio, en donde se encontraron palidez tegumentaria, cianosis leve peribucal, taquicardia, esputo hemoptoico y probable derrame pleural derecho. Un gammagrama pulmonar ventilatorio/perfusorio (V/Q) fue interpretado como de alta probabilidad para tromboembolia pulmonar (Figura 1). Se inició tratamiento con heparina de bajo peso molecular, oxígeno por puntas nasales, antibiótico de amplio espectro y broncodilatador inhalado. No hubo mejoría clínica por lo que se trasladó al INC "Ignacio Chávez".

En Urgencias, se le encontró con ansiedad, peso corporal de 50 kilogramos, frecuencia respiratoria (FR) de 40 por minuto, frecuencia cardiaca (FC) de 130 por minuto, palidez generalizada, cianosis central y distal moderada, presión arterial sistémica (PAS) de 110/60 milímetros de mercurio (mmHg) y temperatura (T) de 36.7°C, somnolencia moderada; respondió a la estimulación verbal y obedeció órdenes sencillas. Orofaringe con rasgos hemáticos, cuello con discreta plétora yugular, sin soplos, precordio con levantamiento paraesternal izquierdo bajo; segundo ruido pulmonar moderadamente aumentado de intensidad, con presencia de cuarto ruido constante. Disminución generalizada del ruido respiratorio, estertores subcrepitantes bibasales, frote pleural bilateral, sin confirmarse el derrame pleural. Resto de la exploración normal o negativa.
El electrocardiograma (ECG) (Figura 2) de ingreso demostró ritmo sinusal, FC de 120 por minuto, eje de AQRS a 60°, onda P con aumento en su voltaje de 2mm en D-II, AVF, imagen de S1Q3T3 , complejo QRS isodifásico de V-1 a V-4 y eje de transición hasta V-5, sugestivo de crecimiento y dilatación de cavidades derechas.

Figura 2. Electrocardiograma de 12 derivaciones: Ritmo sinusal, con frecuencia cardiaca ...
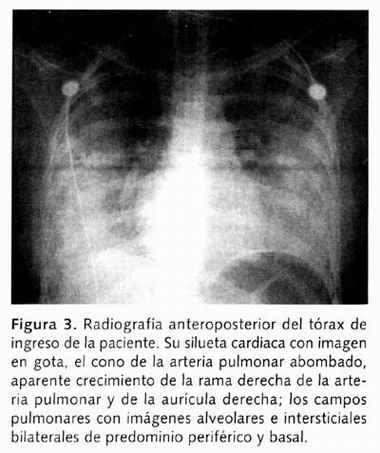
La radiografía anteroposterior (AP) del tórax mostró la silueta cardiaca en gota, el cono de la arteria pulmonar convexo, aparente crecimiento de la rama derecha de la arteria pulmonar y de la aurícula derechas; los campos pulmonares con imágenes alveolares e intersticiales bilaterales, sugestivas de edema pulmonar (Figura 3).
La gasometría arterial (GA) obtenida a su ingreso con fracción inspirada de oxígeno (FiO2 ) al 21%, reportó el potencial hidrógeno (pH) de 7.45, presión arterial de bióxido de carbono (PaCO2 ) 29.6mmHg, presión arterial de oxígeno (PaO2 ) 34.5mmHg, bicarbonato sérico (HCO_ 3) 20.6mMol/litros, bióxido de carbono total (CO2T) 29.6mmHg, déficit de base (DB) -2.3mMol/litros, saturación arterial de oxígeno (SatO2) 66.6%, la relación PaO2 /FiO2 (índice de oxigenación) de 164 y un gradiente alveoloarterial de 48.6. Los valores de laboratorio obtenidos a su ingreso se muestran en la Tabla I.
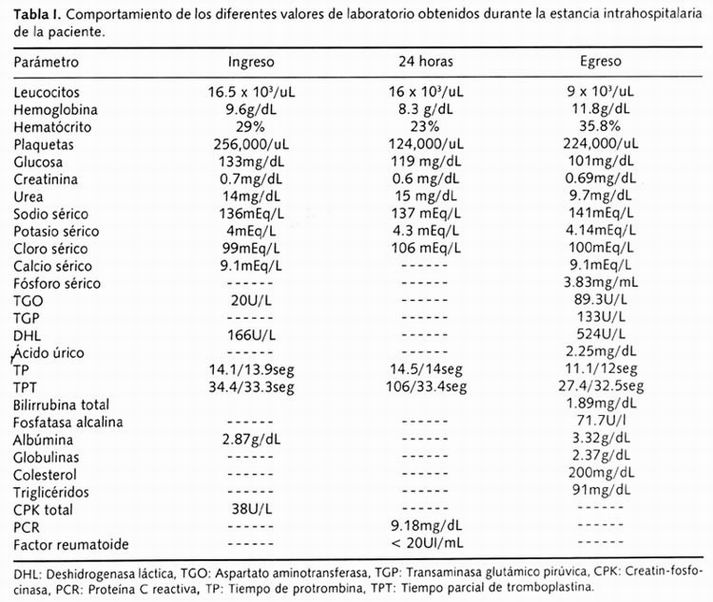
Evolución: 24 horas después a su internamiento en el INC "Ignacio Chávez", la paciente presentó incremento de la FR de 50 por minuto, PAS de 90/60mmHg, y somnolencia, por lo que se decidió su sedación, intubación y asistencia mecánica de la respiración, sin presentar complicaciones durante el procedimiento. Los parámetros ventilatorios fueron, volumen corriente de 500mL, FR de 16 por minuto, presión positiva al final de la espiración (PEEP) de 5cmH2O, FiO 2 al 100%, en modalidad asistida/controlada; los valores en la GA de control obtenidos con estos parámetros fueron: pH 7.41, PaCO2 39.1mmHg, PaO2 93.5mmHg, HCO-3 24.5mMol/litros, CO2T 25.7mmHg, DB 0.2mMol/litros, SatO2 97.1% para una relación PaO2 /FiO2 de 93.5 y el gradiente alveoloarterial de oxígeno fue de 404.4. La PAS disminuyó a 80/50, por lo que se agregó apoyo inotrópico con noradrenalina, dopamina e hidrocortisona 250mg cada 6 horas por vía intravenosa. El laboratorio comunicó la presencia de glóbulos grasos en sangre y gotas de grasa en la orina.
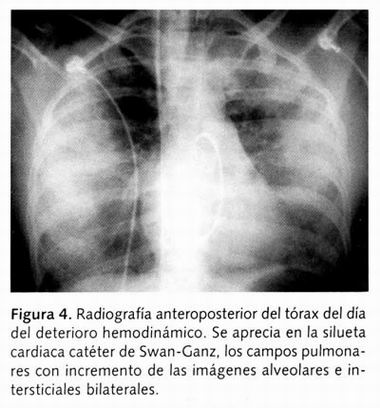
Se le colocó un catéter de flotación en la arteria pulmonar (Figura 4), y se determinaron parámetros hemodinámicos, obteniendo un gasto cardiaco (GC) de 4.6 litros/minuto, índice cardiaco (IC) de 3.5 l/min/m2 , presión sistólica de la arteria pulmonar (PSAP) de 37mmHg, presión diastólica de la arteria pulmonar (PdAP) 24mmHg, presión media de la arteria pulmonar (PMAP) 32mmHg, presión capilar pulmonar (PCP) 9mmHg, presión venosa central (PVC) 8.1cmH2O, gradiente PdAP-PCP 15mmHg, resistencias vasculares pulmonares (RVP) 388d/s/cm-5 , resistencias vasculares sistémicas (RVS) 962d/s/cm-5 , PAS 90/50. Los valores de laboratorio correspondientes determinados se acotan en la Tabla I.
Cinco días después del evento, la paciente fue retirada de la ventilación mecánica; los valores del control de gases arteriales fue: pH de 7.45, PaCO2 de 39mmHg, PaO2 de 69mmHg, HCO-3 de 27 y la SatO2 de 94%, con una FiO2 al 50%, para una relación PaO2 /FiO2 de 138 y un gradiente alveoloarterial de 160.5. Los cultivos de sangre, orina y secreciones bronquiales fueron negativos.
Estando ya sin sedación, 24 horas después de su extubación, la paciente presentó somnolencia intensa, bradipsiquia, bradilalia, cuadriparesia, con discreto aumento del tono muscular del hemicuerpo izquierdo con signo de Babinsky y mioclonías ipsilaterales, por lo que se dio tratamiento con difenilhidantoina (DFH). Se realizaron electroencefalograma y resonancia magnética nuclear de cráneo, ambas normales.
El control radiológico del tórax demostró disminución importante de las imágenes alveolares e intersticiales bilaterales (Figura 5). La paciente fue hemotransfundida. Valores de los exámenes de laboratorio previo al egreso se muestran en la Tabla I.
La evolución en días subsecuentes fue hacia la mejoría clínica, con recuperación total, que conserva un año después.

DISCUSIÓN
Este caso permite informar la presentación del SEG y SDRA con la inyección de material oleoso líquido en ambos glúteos, y también hacer dos observaciones importantes:1) algunos procedimientos "estéticos" pueden ser llevados a cabo en clínicas de "belleza" por personal no médico, situación ya comentada por otros autores 13,16 ; y 2) pueden ocurrir complicaciones agudas y crónicas con el uso de sustancias empleadas para tal fin, algunas de ellas pueden ser el petrolato, la parafina 16,17 (actualmente en desuso), aceite vegetal 13 , silicón líquido 14 o semilíquido 15 que, pueden estar mezclados con otros materiales como silicones impuros, industriales, o con aceite de oliva, aceite de castor o ácido ricinoleico con la finalidad de causar reacciones inflamatorias locales 16 . Sin embargo, estos compuestos forman triacilglicerol, el cual es un éster de glicerol y ácido graso; el ácido graso es una grasa neutra y no tiene, por ende, toxicidad, mientras que el ácido graso en su forma libre es muy tóxico, tal es, que el ácido oleico (un ácido graso libre) causa daño pulmonar agudo y edema pulmonar, mismo que es aceptado para el desarrollo de modelos animales de SDRA 13, 21,22 . Este evento adverso pone en riesgo la vida de los pacientes que se someten a estos procedimientos sin la información adecuada. Similar a otros 13,16 , en nuestro caso no fue posible conocer el compuesto causal del SEG. Sólo fue posible obtener la información de la característica oleosa de las inyecciones por lo que, aunado a las características clínicas y en el curso del padecimiento, el diagnóstico de síndrome de embolia grasa parece no tener duda alguna.
El término embolia grasa describe la presencia de grasa en la circulación sanguínea, y un síndrome clínico identificable por sus manifestaciones sistémicas de intensidad variable.
Las manifestaciones clínicas del SEG habitualmente se observan en las primeras 72 horas del evento desencadenante 1-3 y traducen la afectación de órganos blanco. Los signos y síntomas respiratorios se presentan en la totalidad de los pacientes 23 , desde leves (disnea, taquipnea y cianosis) hasta severos (hemoptisis y SDRA), a menos que el foramen oval esté permeable 24 , y el material graso pase a la circulación sistémica sin pasar por el filtro pulmonar causando manifestaciones en otros órganos, como el cerebro y el riñón. El compromiso neurológico, desde cefalea, irritabilidad, delirio, afasia y hemiplejia hasta convulsiones y coma, ocurre a continuación del respiratorio; en menor proporción se presentan manifestaciones hematológicas, anemia y trombocitopenia y dermatológicas, petequias; la secuencia de eventos no necesariamente es en este orden, como ocurrió en nuestra paciente.
El diagnóstico del SEG continúa siendo clínico 25 ; se han descrito dos clasificaciones basadas en criterios clínicos, una es la de Gurd 26 que utiliza criterios mayores y menores para establecer el diagnóstico requiriéndose de al menos de uno mayor y dos menores, y otra la de Lindeque 26 , que utiliza parámetros respiratorios (el antecedente traumático y un criterio) con la misma finalidad. En el caso de nuestra paciente, el diagnóstico fue establecido de acuerdo con ambos criterios; en cuanto a los de Gurd, presentó dos criterios mayores (síntomas respiratorios y síntomas neurológicos) y al menos dos menores (trombocitopenia y disminución de la hemoglobina); de los de Lindeque, presentó una PaO2 < 60mmHg (<8kPa) con una FiO2 al 21%, FR >35, e incremento del trabajo respiratorio manifestado por disnea y utilización de músculos respiratorios accesorios, y taquicardia asociados a ansiedad.
La incidencia reportada del SEG es muy variable, según el estudio sea prospectivo o retrospectivo o a la manera de definirlo por criterios clínicos, de imagen, monitoreo fisiológico o material de autopsias 26 . No obstante, la incidencia, que es el mejor reflejo de la enfermedad, se ha descrito entre el 11-19% 2,3 , cuando la presentación del SEG es secundaria a traumatismos y procedimientos traumatológicos u ortopédicos; esta presentación es la más frecuente. Sin embargo, la aparición del SEG puede ser debida a eventos no traumáticos, como los ya señalados en la introducción, donde la prevalencia o la incidencia son desconocidas. Existe el peligro de presentar SEG en aquéllos sometidos a procedimientos estéticos, como la paciente que presentamos, y en otros, como a los que se les realiza liposucción; en éstos, la incidencia del SEG en una serie en nuestro medio, es del 0.19% 20 . En el Censo de Cirujanos Cosméticos de Estados Unidos se refiere una tasa de mortalidad de 19.1 por 100,000 procedimientos realizados de 1994 a 1998; la tromboembolia pulmonar (TEP) fue la principal causa de muerte con un 23.1% y la cuarta causa fue la debida al SEG con 8.5% 19
En nuestra paciente, sin enfermedad previa, la relación causa-efecto entre el procedimiento y la aparición del deterioro clínico es muy evidente. En un principio la sintomatología respiratoria obligó a pensar en tromboembolia pulmonar, ya que el gammagrama pulmonar V/Q fue reportado como positivo. Sin embargo, este gammagrama pulmonar V-Q no es concluyente de TEP, ya que al comparar las imágenes de la fase ventilatoria con la perfusoria, los defectos no corresponden, aunque podemos observar la afectación generalizada de ambas fases, lo que podría estar en relación con un proceso pulmonar severo, como el que se ve en edema pulmonar (Figura 1).
El mecanismo de daño propuesto en este caso inició con la inyección intramuscular, que pudo haber producido la ruptura de vasos sanguíneos y de adipocitos; hubo formación de microtrombos de lípidos, que se llevaron hacia la circulación venosa por la fuerza de la aplicación. Una vez alojados en los capilares pulmonares e hidrolizados por una lipasa pulmonar, los ácidos grasos libres causaron daño tóxico directo a las unidades alveolocapilares, lo que causó liberación de aminas vasoactivas y prostaglandinas 27 . El resultado final fue edema pulmonar de bajas presiones (SDRA), como fue sugerido por la radiografía de tórax y luego demostrado hemodinámicamente. Los hallazgos descritos en el examen de histopatología pulmonar y asociados a SEG han sido edema intersticial, trasudado, exudado alveolar tardío, muerte de neumocitos tipo II, e incluso formación de membranas hialinas 28 ; estos cambios histopatológicos consecutivos se traducen en el desequilibrio de la relación V/Q pulmonar y cortocircuito intrapulmonar que condicionó hipoxemia, vasoconstricción pulmonar hipóxica e hipertensión pulmonar, incremento de la poscarga (resistencia vascular pulmonar) y dilatación del ventrículo derecho, sugerido en nuestro caso por el perfil hemodinámico, la radiografía de tórax y el patrón electrocardiográfico sugestivo de crecimiento y dilatación de cavidades derechas 29
Los diversos hallazgos neurológicos pueden ser encontrados hasta en el 80% de los casos y son precedidos por el compromiso respiratorio del SEG. La tomografía axial computarizada (TAC) suele brindar poca información. La resonancia magnética es promisoria para detectar, clasificar y correlacionar la gravedad del compromiso cerebral 30 con las manifestaciones clínicas cerebrales, pero aún es limitado el número de pacientes estudiados, lo cual sesga la información; en nuestra paciente no se evidenció compromiso anatómico encefálico. Otros signos y síntomas, de índole dermatológica y oftalmológica no se presentaron en esta paciente.
Otros estudios en el SEG, como la presencia de grasa en orina, o en producto de lavado broncoalveolar, no son concluyentes 31 dado que pueden aparecer en la infusión de lípidos 7 y en otras entidades 29 . La TAC de alta resolución 32 es promisoria. No obstante, se requieren estudios controlados para conocer la exacta contribución de estos avances de la tecnología en el diagnóstico de SEG, que continúa siendo clínico.
REFERENCIAS
1. Bulger EM, Smith DG, Maier RV, Jurkovich GJ. Fat embolism syndrome: a 10-year review. Arch Surg 1997;132:435-439. [ Links ]
2. Fabian TC, Hoots AV, Patterson CR. Fat embolism syndrome: prospective evaluation in 92 fractures patients. Crit Care Med 1990;18:42-46. [ Links ]
3. Lindeque BG, Schoeman HS, Dommisse GF, Boeyens MC, Vlok AL. Fat embolism and the fat embolism syndrome. A double-blind therapeutic study. J Bone Joint Surg Br 1987;69:128-131. [ Links ]
4. Lynch M. Nephrosis and fat embolism in acute haemorrhagic pancreatitis. Arch Intern Med 1954;94:70-72. [ Links ]
5. Maitre B, Habibi A, Roudot-Thoraval F, Bachir D. Acute chest syndrome in adults with sickle cell disease. Chest 2000;117:1386-1392. [ Links ]
6. Schulz F, Trubner K, Hildebrand E. Fatal fat embolism in acute hepatic necrosis with associated fatty liver. Am J Forensic Med Pathol 1996;17:264-268. [ Links ]
7. Schulz F, Puschel K. An unusual form of a pulmonary fat embolism in fulminant viral hepatitis. Pathology 1996;17:154-156. [ Links ]
8. Kusumoto S, Imamura A, Watanabe K. Case report: the incidental lipid embolization to the brain and kidney after lymphography in a patient with malignant lymphoma: CT findings . Clin Radiol 1991;44:279-280. [ Links ]
9. El-Ebiary M, Torres A, Ramirez J, Xaubet A, Rodriguez-Roisin R. Lipid deposition during the long-term infusion of propofol. Crit Care Med 1995;23:1928-1930. [ Links ]
10. Hoefnagels WAJ, Gerritsen EJA, Brouwer OF, Souverijn JHM. Cyclosporin encephalopathy associated with fat embolism induced by the drug´s solvent . Lancet 1988;15:90-91. [ Links ]
11. Uzun O, Findik S, Danaci M, Katar D, Erkan L. Pulmonary and cerebral oil embolism after hysterosalpingography with oil soluble contrast medium. Respirology 2004;9:134-136. [ Links ]
12. Thaunald O, Thaler F, Loiral P, Decroix JP, Boulin A. Cerebral fat embolism induced by facial fat injection. Plast Reconstr Surg 2004;113:2235-2236. [ Links ]
13. Kiyokawa I, Utsumi K, Minemura K, Kasuga I, Torii Y, Yonemaru M, et al. Fat embolism syndrome caused by vegetable oil injection. Intern Med 1995;34:380-383. [ Links ]
14. Chastre J, Basset F, Viau F, Dournovo P, Bouchama A, Akesbi A, et al. Acute pneumonitis after subcutaneous injections of silicone in transsexual men. N Engl J Med 1983;308:764-767. [ Links ]
15. Spiera RF, Gibofsky A, Spiera H. Silicone gel filled breast implants and connective tissue disease: An overview. J Rheumatol 1994;21:239-245. [ Links ]
16. Ortiz-Monasterio F, Trigos I. Management of patients with complications from injections of foreign material into the breast. Plast Reconstr Surg 1972;50:42-47. [ Links ]
17. Appleton BE, Lee P. The development of systemic sclerosis (Scleroderma) following augmentation mammoplasty. J Rheumatol 1993;20:1052-1054. [ Links ]
18. Cukier JC, Beauchamp RA, Spindler JS, Spindler S, Lorenzo C, Trentham DE. Association between bovine collagen dermal implants and a dermatomyositis-like syndrome. Ann Intern Med 1993;118:920-928. [ Links ]
19. Grazer FM, de Jong RH. Fatal outcomes from liposuction: Census survey of cosmetic surgeons. Plast Reconstr Surg 2000;105:436-446. [ Links ]
20. Cárdenas-Camarena L. Lipoaspiration and its complications: A safe operation. Plast Reconstr Surg 2003; 112:1435-1441. [ Links ]
21. Atabai K, Matthay MA. The pulmonary physician in critical care 5: Acute lung injury and the acute respiratory distress syndrome: definitions and epidemiology. Thorax 2002;57:452-458. [ Links ]
22. Bellingan GJ. The pulmonary physician in critical care 6: The pathogenesis of ALI/ARDS. Thorax 2002;57:540-546. [ Links ]
23. Robinson CM. Current concepts of respiratory insufficiency syndromes after fracture. J Bone Joint Surg Br 2001;83:781-791. [ Links ]
24. Pell ACH, Hughes D, Keating J, Christie J, Busuttil A, Sutherland GR. Fulminant fat embolism syndrome caused by paradoxical embolism through a patent foramen ovale. N Engl J Med 2003;329:926-929. [ Links ]
25. Georgopoulos D. Fat embolism syndrome: clinical examination is still the preferable diagnostic method. Chest 2003;123:982-983. [ Links ]
26. Mellor A, Soni N. Fat embolism. Anaesthesia 2001;56:145-154. [ Links ]
27. Hulman G. Pathogenesis of non-traumatic fat embolism. Lancet 1988;6:1366-1367. [ Links ]
28. Fourme T, Vieillard-Baron A, Loubieres Y, Julie C, Page B, Jardin F. Early fat embolism after liposuction. Anesthesiology 1998;89:782-784. [ Links ]
29. Peltier LF. Fat embolism: a perspective. Clin Orthop 2004; 422:148-153. [ Links ]
30. Takahashi M, Suzuki R, Osakabe Y, Asai J, Miyo T, Nagashima G, et al. Magnetic resonance imaging findings in cerebral fat embolism: Correlation with clinical manifestations. J Trauma 1999;46:324-327. [ Links ]
31. Nedrinne JM, Guillaume C, Gagnieu MC, Gratadour P, Fleuret C, Motin J. Bronchoalveolar lavage in trauma patients for diagnosis of fat embolism syndrome. Chest 1992;102:1323-1327. [ Links ]
32. Malagari K, Economopoulos N, Stoupis Ch. High-Resolution CT findings in mild pulmonary fat embolism. Chest 2003;123:1196-1201. [ Links ]














