INTRODUCCIÓN
La caña de azúcar (Saccharum spp.) es el cultivo agroalimentario más productivo del mundo; de ésta se obtienen diversos productos agroindustriales como sacarosa, melaza, etanol y energía (Gómez-Merino et al., 2017). Actualmente, México ocupa el octavo lugar mundial en producción caña de azúcar (FAO, 2023; Statistica, 2023), y su cultivo tiene enorme impacto en la economía y el desarrollo social de las comunidades donde se produce (SADER, 2021); sin embargo, esta cadena de valor enfrenta serios retos tecnológicos, económicos y ambientales.
El cambio climático, el incremento poblacional y la creciente demanda de alimentos aumenta la necesidad de encontrar soluciones que atiendan la producción de alimentos en condiciones de estrés ambiental y presión por recursos naturales (Shao et al., 2015). Alternativas biotecnológicas como la utilización de bioestimulantes pueden favorecer la productividad y calidad de los cultivos (Gómez-Merino et al., 2022). Los bioestimulantes pueden inducir mecanismos de tolerancia, resistencia o defensa contra factores de estrés abiótico. El aluminio (Al3+) aplicado en bajas dosis puede detonar efectos benéficos en las plantas, como la mejora en la absorción de nutrimentos (nitrógeno, fósforo y potasio), el crecimiento radicular y el incremento de biomasa (Bojórquez-Quintal et al., 2017); además, el Al3+ puede promover tolerancia al estrés abiótico en plantas adaptadas a suelos ácidos (Singhal et al., 2022) y puede mejorar el crecimiento de tejidos vegetales en cultivo in vitro (Al-Mayahi, 2019).
La micropropagación de caña de azúcar es una tecnología determinante para obtener plántulas libres de patógenos, genéticamente homogéneas y vigorosas (Bello-Bello et al., 2018); sin embargo, la regeneración de plantas a partir de esta tecnología puede ser tardada, lo que eleva los costos de producción en las biofábricas. El aluminio ha mostrado efectos estimulantes en el crecimiento de las plantas, especialmente en las primeras etapas de crecimiento (Bojórquez-Quintal et al., 2017; Moreno Alvarado et al., 2017). En palma datilera (Phoenix dactylifera L.), la adición de aluminio al medio de cultivo in vitro incrementó el número de vástagos emitidos por los tejidos micropropagados (Al-Mayahi, 2019). Con el objetivo de reducir los tiempos de multiplicación in vitro de caña de azúcar y aumentar el crecimiento de los explantes, en esta investigación se evaluaron los efectos de diferentes dosis de aluminio (Al3+) en el crecimiento e indicadores bioquímicos de dos variedades de caña de azúcar (Saccharum spp.) en condiciones in vitro.
MATERIALES Y MÉTODOS
Material vegetal y establecimiento in vitro
Se utilizaron vitroplantas de caña de azúcar de las variedades Mex 69-290 y CP 72-2086. Estos dos genotipos se encuentran entre los de mejor desempeño en campo, y junto con Mex 79-431, ocupan 70 % de la superficie destinada a este cultivo en México (Lavín-Castañeda et al., 2022). La introducción de ápices se realizó bajo campana de flujo laminar. Previo a la siembra, los explantes fueron lavados con solución de hipoclorito de sodio al 20 % (Cloralex®, Industrias Allen; Ciudad de México, México) con 20 gotas de Tween® 20 durante 20 min. En seguida, los explantes fueron lavados con agua destilada, y finalmente se realizó la siembra en medio MS (Murashige y Skoog, 1962) en condiciones asépticas.
Tratamientos con aluminio
Se evaluó la respuesta al aluminio (AlCl3 6H2O) (Sigma-Aldrich®; St. Louis, Missouri, EUA) en dosis de 0, 50, 100 y 150 µM Al3+ en las variedades Mex 69-290 y CP 72-2086 de caña de azúcar. Cada variedad se consideró un experimento independiente. El Al3+ fue agregado al medio de cultivo MS líquido (sin gelificante), suplementado con 30 g sacarosa L-1, 100 mg ácido ascórbico L-1, 150 mg ácido cítrico L-1, 1 mg kinetina L-1, 0.65 mg AIA L-1 y 0.3 mg BAP L-1. El pH del medio de cultivo se ajustó a 4.6 con NaOH o HCl (0.1-1.0 N). El medio fue esterilizado a 120 °C por 20 min en una autoclave vertical (Lab-Tech LAC5060s; Namyangju, Corea del Sur). Se introdujeron 12 vitroplantas de 2 cm de longitud en biorreactores Rita® (Alvard et al., 1993) que contenían 200 mL del medio de cultivo. En cada biorreactor se estableció un periodo de cultivo de 30 días. El tiempo de inmersión fue de 5 min con una frecuencia de 4, 8 y 12 h. El flujo de fotones fue entre 40 y 50 µmol m-2 s-1 con un fotoperiodo de 16 h luz provisto por lámparas fluorescentes de luz blanca (General Electric; Wayne, Pennsylvania, EUA) y 8 h de oscuridad, con una temperatura de 25 ± 2 °C/18 ± 2 °C (día/noche).
Medición de variables de crecimiento
Después de 30 días de tratamiento, se contabilizó el número de brotes y hojas. Para la medición del tamaño de brotes, así como del largo y ancho de hojas, las vitroplantas se colocaron sobre hojas de papel milimétrico junto a una escala de 10 mm y se utilizó el programa ImageJ (https://imagej.nih.gov/ij/download.html) (Rueden et al., 2017). El peso de biomasa fresca se determinó pesando una vitroplanta completa en una balanza analítica digital (VELAB, VE-204, 049022; Monterrey, N. L., México). El peso de la biomasa seca se determinó después del secado en una estufa de circulación de aire forzada HCF-125D (Riossa; Monterrey, N. L., México) por 72 h a 72 °C.
Concentración de clorofilas en hojas
La concentración foliar de clorofilas a, b y total se determinó con el método de Harborne (1973). El tejido foliar fresco se colocó en acetona 80 %, se maceró y se incubó por 24 h a 4 °C; después, los extractos se filtraron y fueron leídos a una absorbancia de 645 y 665 nm en un espectrofotómetro UV/Vis (Benchmark Scientific; Nueva York, NY, EUA).
Concentración de azúcares solubles totales en hojas
La concentración foliar de azúcares solubles totales se determinó con antrona (Brummer y Cui, 2005; basado en Southgate, 1976). Las muestras se colocaron en 40 mL de etanol 80 % (v/v) y se incubaron en baño María (Benchmark Scientific; Nueva York, NY, EUA) a 125 °C hasta que el sobrenadante se evaporó. Al precipitado se le agregaron 20 mL de agua destilada. Se tomó una alícuota de 500 μL y se adicionaron 500 μL de etanol 80 % (v/v). Se agregaron 5 mL de antrona (Meyer; Querétaro, Querétaro, México). Las muestras fueron transferidas a baño María a 95 °C durante 15 min y luego colocadas en hielo. Se usó una curva estándar con glucosa (Sigma-Aldrich; St. Louis, Missouri, EUA). Las muestras se leyeron a 620 nm en un espectrofotómetro UV/Vis (Benchmark Scientific; Nueva York, NY, EUA).
Concentración de proteínas solubles en hojas
La concentración de proteínas totales se determinó por el método de Bradford (1976) modificado por Jones et al. (1989). El tejido fue macerado y se agregó 1 mL de NaOH 0.1 N (Merck; Darmstadt, Alemania). La mezcla se homogenizó y se dejó reposar por 30 min a temperatura ambiente; posteriormente, se centrifugó a 5000 rpm durante 5 min. Se tomaron alícuotas de 100 μL del sobrenadante y se agregó 1 mL de reactivo Bradfort Dye (Bio-Rad; Berkeley, California, EUA). Las muestras se leyeron en un espectrofotómetro UV/Vis (Benchmark Scientific) a una longitud de onda de 562 nm.
Concentración de aminoácidos libres totales en hojas
La concentración foliar de aminoácidos libres totales se determinó por el método de ninhidrina [Moore y Stein (1954), modificado por Sun et al. (2006)]. Las muestras se colocaron en 500 μL de etanol 80 % y se incubó en baño María (Benchmark Scientific) a 80 °C durante 20 min. Se tomaron 250 μL del sobrenadante y se añadieron 250 μL de solución de citrato de sodio (16 mM)/ácido ascórbico (34 mM), pH 5.2 y 500 μL de ninhidrina (1 %; p/v) (Sigma Chemical; Querétaro, Querétaro, México) en etanol 70 % (v/v). Se incubó a 95 °C durante 20 min y se dejó enfriar a temperatura ambiente. Se construyó una curva estándar con leucina (Sigma-Aldrich; St. Louis, Missouri, EUA). Se cuantificó en el espectrofotómetro UV/Vis Benchmark Scientific a 570 nm.
Diseño experimental y análisis de datos
Se condujeron dos experimentos (uno por cada variedad) y la unidad experimental fue un biorreactor Rita® con 12 plántulas. Cada tratamiento tuvo tres repeticiones y se distribuyeron en un diseño completamente al azar. La normalidad y homogeneidad de varianzas fueron verificadas con las pruebas de Shapiro-Wilk y de Levene, respectivamente. Los datos fueron sometidos a análisis de varianza y las medias fueron comparadas por la prueba de Tukey (P ≤ 0.05), usando el software R 4.0.1.V (R Core Team, 2013).
RESULTADOS Y DISCUSIÓN
Efectos del Al3+ en el crecimiento de caña de azúcar in vitro
De manera general, todas las dosis de Al3+ evaluadas promovieron el crecimiento en las variedades de caña de azúcar estudiadas. En Mex 69-290, dosis de 50 y 100 µM Al3+ incrementaron el número de brotes de 3.2 a 9.5, lo que representó aumentos promedio de 197.9 % con respecto al testigo. El tamaño de brotes también aumentó de 0.55 cm en el testigo a 1.46 cm en los tratamientos con Al3+, con un aumento medio de 166.3 % con respecto al testigo (Figuras 1A y 1B).

Figura 1 Efecto del aluminio (Al3+) en el número y tamaño de brotes en plantas de caña de azúcar de las variedades Mex 69-290 (A y B) y CP 72-2086 (C y D) después de 30 días de tratamiento. Letras distintas sobre las columnas indican diferencias significativas entre tratamientos para cada variedad (Tukey, P ≤ 0.05)
En la variedad CP 72-2086, con las dosis de 50, 100 y 150 µM Al3+ se obtuvo el mayor número de brotes, 9.4 en promedio (Figura 1C), siendo superior en promedio en 159.4 % a las plántulas del testigo, que tuvieron 3.6 en promedio. Las dosis 50 y 100 µM Al3+ produjeron el mayor tamaño de brotes, 1.36 cm en promedio (Figura 1D), lo que representó un aumento de 180.6 % en comparación con el testigo, que tuvo un promedio de 0.54 cm por brote.
En la variedad Mex 69-290, la dosis de 100 µM Al3+ incrementó el número de hojas a 70, lo que representó un aumento de 130.9 % respecto al testigo, que tuvo 30 hojas en promedio (Figura 2A). Las dosis de 50 y 100 µM Al3+ aumentaron el largo de hojas, de un promedio de 5.24 cm en el testigo, a 8.57 en los tratamientos de 50 y 100 µM Al3+, lo que representó un incremento promedio de 63.3 % (Figura 2B). La dosis de 50 µM Al3+ incrementó el ancho de hojas de 0.25 cm en el testigo, a 0.61 en las tratadas con Al3+ (Figura 2C), con un aumento del 162 %, en comparación con el testigo.
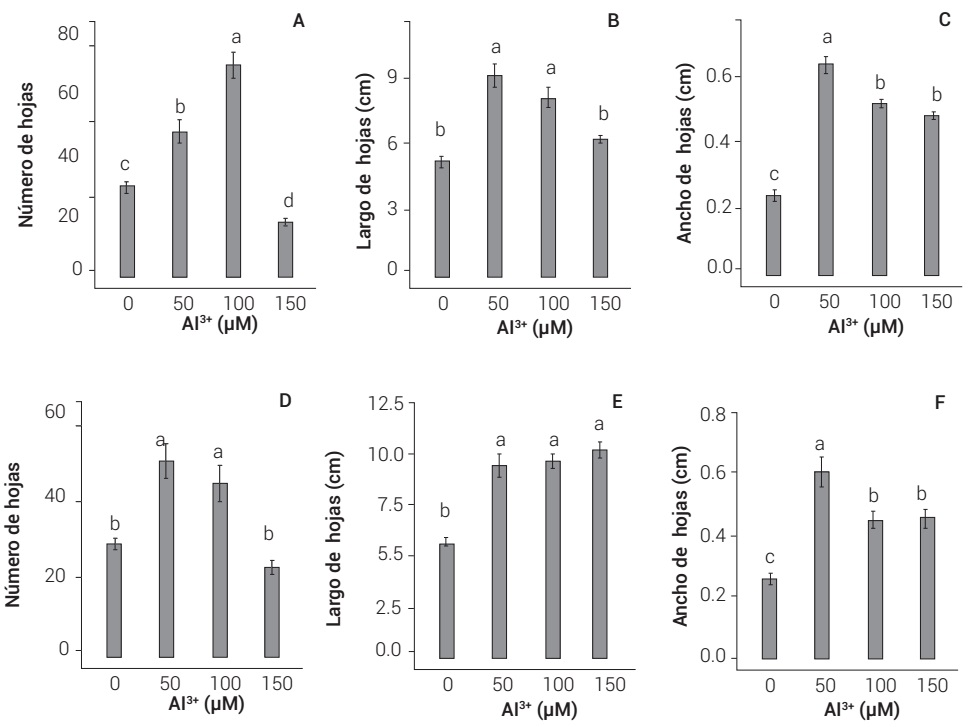
Figura 2 Efecto del aluminio (Al3+) en el número, largo y ancho de hojas en plantas de caña de azúcar de las variedades Mex 69-290 (A, B y C) y CP 72-2086 (D, E y F), después de 30 días de tratamiento. Letras distintas sobre las columnas indican diferencias significativas entre tratamientos para cada variedad (Tukey, P ≤ 0.05)
En la variedad CP 72-2086, las dosis de 50 y 100 µM Al3+ aumentaron el número de hojas a 37.7, en tanto que el testigo tuvo 27.7 (Figura 2D), con un incremento en promedio en 63.6 %. Las dosis de 50, 100 y 150 µM Al3+ aumentaron el largo de hojas a 9.75 cm, lo que representó un incremento de 73.1 % en promedio con respecto al testigo, que mostró una media de 5.64 cm (Figura 2E). La dosis de 50 µM Al3+, incrementó el ancho de hojas a 0.61 cm, de 0.25 cm que presentó el testigo (Figura 2F).
Las dosis de 50, 100 y 150 µM Al3+ incrementaron el peso de biomasa fresca en la variedad Mex 69-290 a 2.75 g en promedio, de 1.67 g en el testigo (Figura 3A); además, las dosis de 50 y 100 µM Al3+ aumentaron el peso de la biomasa seca de 0.74 g en el testigo a 1.17 g en las plántulas tratadas, con un aumento de 57.5 % en comparación con el testigo (Figura 3B).

Figura 3 Efecto del aluminio (Al3+) en el peso de la biomasa fresca y seca en plantas de caña de azúcar de las variedades Mex 69-290 (A y B) y CP 72-2086 (C y D) después de 30 días de tratamiento. Letras distintas sobre las columnas indican diferencias significativas entre tratamientos para cada variedad (Tukey, P ≤ 0.05)
Las dosis de 50, 100 y 150 µM Al3+ incrementaron en el peso de la biomasa fresca en la variedad CP 72-2086 a 2.86 g en promedio, lo que representó 52.7 % de aumento con respecto al testigo, el cual tuvo un peso promedio de 1.87 g en materia fresca (Figura 3C). En esta variedad, la aplicación de 50 y 100 µM Al3+ causó un efecto negativo al disminuir el peso de biomasa seca en 55.4 % en promedio con respecto al testigo (Figura 3D).
Los bioestimulantes, como elementos benéficos, inducen respuestas horméticas, un fenómeno dosis-respuesta en el que a bajas dosis se producen efectos positivos o estimulatorios, mientras que en dosis altas se inducen efectos negativos o inhibitorios (Jalal et al., 2021). En arroz (Oryza sativa L.), la dosis 200 µM Al3+ produjo respuestas estimulantes en variables morfológicas, fisiológicas y bioquímicas, y en dosis de 400 µM Al3+ tuvo efectos inhibitorios del crecimiento (Moreno-Alvarado et al., 2017). En plantas de Arabidopsis susceptibles a aluminio, dosis de 0, 5 y 20 µM Al3+ no promovieron cambios en crecimiento y expresión génica, en tanto que dosis superiores a 50 µM Al3+ ocasionaron cambios en el crecimiento de raíces y en la expresión de genes de resistencia y adaptación al estrés (Le Poder et al., 2022). En tabaco (Nicotiana tabacum L.), dosis de 50 µM Al3+ promueve respuestas favorables, mientras que 100 µM Al3+ induce efectos inhibidores en el crecimiento (Trejo-Téllez y Gómez-Merino, 2007). En caña de azúcar, dosis de 220 µM Al3+ causaron efectos inhibidores en el crecimiento (Rosa-Santos et al., 2020). El Al3+ es un ion que, dependiendo de su solubilidad y concentración, puede tener efectos benéficos o ejercer efectos limitativos en indicadores de crecimiento, desarrollo y rendimiento de plantas (Schmitt et al., 2016).
La respuesta de las plantas a la aplicación de Al3+ también depende de la capacidad genética de adaptación al catión. En variedades de frijol común (Phaseolus vulgares L.) tratadas con 50 y 100 µM AlCl3 se observaron diferentes capacidades de adaptación y susceptibilidad a la presencia de este catión (Landa et al., 2010). El mismo fenómeno fue observado en plantas de baya-zafiro (Symplocos paniculata) tratadas con 1 mM Al3+ (Schmitt et al., 2016). En variedades de caña de azúcar también se han reportado diferentes respuestas y capacidad de adaptación a la presencia de Al3+ (Oliveira et al., 2021). Si bien la resistencia a Al3+ se ha investigado en los principales cultivos, los mecanismos precisos que llevan al desarrollo de tales respuestas a nivel bioquímico y molecular no han sido elucidados en su totalidad. Este vacío científico se debe principalmente a la interferencia del ion Al3+ en múltiples sitios en apoplasto, y a la complejidad de los mecanismos de autodefensa de la planta (Ribeiro et al., 2021). A pesar de lo anterior, el análisis del transcriptoma en caña de azúcar ha mostrado que la tolerancia al aluminio puede explicarse por un mecanismo de desintoxicación eficiente combinado con la formación de raíces laterales y la activación de enzimas redox (Rosa-Santos et al., 2020).
Concentración de clorofilas
En la variedad Mex 69-290, la dosis 50 µM Al3+ incrementó la concentración de clorofila a de 0.63 mg g-1 BF en el testigo a 0.97 mg g-1 BF en el tratamiento con Al3+, lo que representó un aumento de 53 %. La dosis 100 µM Al3+ aumentó la concentración de clorofila b a 0.48 mg g-1 BF, lo que representó un incremento de 54 % en comparación con el testigo, que tuvo 0.32 mg g-1 BF (Cuadro 1). En la variedad CP 72-2086 la dosis de 100 µM Al3+ incrementó la concentración de clorofilas a y b a 1.14 y 0.83 mg g-1 BF, equivalente a 86 y 137 % de aumento, respectivamente, en comparación con el testigo, el cual mostró 0.61 y 0.35 mg g-1 BF para las clorofilas a y b, respectivamente (Cuadro 2).
Cuadro 1 Efecto del aluminio (Al3+) en la concentración foliar de clorofilas a, b y total en plantas de caña de azúcar de la variedad Mex 69-290, después de 30 días de tratamiento.
| Variedad | Al3+ (µM) | Clorofila a | Clorofila b | Clorofila total |
|---|---|---|---|---|
| (mg g-1 PBF) | ||||
| Mex 69-290 | 0 | 0.63 ± 0.01 b | 0.31 ± 0.01 b | 0.94 ± 0.13 bc |
| 50 | 0.97 ± 0.01 a | 0.44 ± 0.01 a | 1.42 ± 0.08 a | |
| 100 | 0.51 ± 0.01 c | 0.48 ± 0.01 a | 1.00 ± 0.09 b | |
| 150 | 0.47 ± 0.01 c | 0.42 ± 0.03 a | 0.89 ± 0.03 c | |
Medias ± error estándar con letras diferentes en las columnas indican diferencia estadística significativa (Tukey, P ≤ 0.05). PBF: peso de la biomasa fresca.
Cuadro 2 Efecto del aluminio (Al3+) en la concentración foliar de clorofilas a, b y total en plantas de caña de azúcar de la variedad CP 72-2086, después de 30 días.
| Variedad | Al3+ (µM) | Clorofila a | Clorofila b | Clorofila total |
|---|---|---|---|---|
| (mg g-1 PBF) | ||||
| CP 72-2086 | 0 | 0.61 ± 0.01 c | 0.35 ± 0.0 1c | 0.97 ± 0.02 c |
| 50 | 0.97 ± 0.39 b | 0.55 ± 0.43 b | 1.50 ± 0.06 b | |
| 100 | 1.14 ± 0.06 a | 0.83 ± 0.48 a | 1.98 ± 0.10 a | |
| 150 | 0.95 ± 0.02 b | 0.41 ± 0.01 c | 1.37 ± 0.02 b | |
Medias ± error estándar con letras diferentes en las columnas indican diferencia estadística significativa (Tukey, P ≤ 0.05). PBF: peso de la biomasa fresca.
Estos resultados ponen en evidencia que el tratamiento con Al3+ en concentraciones de 50 y 100 µM influye positivamente en las concentraciones foliares de clorofilas, moléculas determinantes en la fotosíntesis y por ende en el crecimiento y desarrollo de la planta. En condiciones de estrés hídrico y salino, las concentraciones de clorofilas pueden incrementarse en diversas hortalizas (Bulgari et al., 2019); sin embargo, cuando el Al3+ se suministra fuera del rango hormético, el aparato fotosintético puede ser irrumpido, lo que causa una disminución en la concentración y alteración en las estructuras de clorofilas y del fotosistema II, cierre de los centros de reacción (RCS) e inhibición del transporte de electrones (Negreanu-Pirjol et al., 2019; Oliveira et al., 2021). En frijol común, si bien la aplicación de 50 µM Al3+ por 72 h no tuvo efectos en las concentraciones de clorofilas, al aumentar la dosis y el tiempo de exposición, se observaron efectos fitotóxicos (Chico et al., 2021). El incremento de las clorofilas se ha reportado como un mecanismo de resistencia asociado con el incremento de la clorofila b, lo cual se ha asociado como una respuesta al estrés. Respuestas horméticas al Al3+ pueden causar aumento en fotosíntesis, intercambio gaseoso, apertura de estomas y eficiencia nutrimental, procesos que pueden persistir durante el ciclo de desarrollos de las plantas (Agathokleous, 2021).
Concentración de azúcares, proteínas y aminoácidos
En la variedad Mex 69-290, la dosis de 50 µM Al3+ aumentó la concentración de azúcares de 0.07 mg g-1 BF en el testigo a 0.30 mg g-1 BF en las plantas expuestas al tratamiento de Al3+ ya referido, lo cual representó un incremento de 328.6 % del valor medio de esta variable en comparación con el testigo. De forma similar, en plantas tratadas con 50 µM Al3+, la concentración foliar de proteínas aumentó de 314.11 µg g-1 BF en el testigo a 406.61 µg g-1 BF en el tratamiento citado, lo cual fue superior en 29.4 % al comparar con el testigo. La dosis 100 µM Al3+ aumentó de manera significativa la concentración de aminoácidos libres totales en comparación con el testigo (Cuadro 3).
Cuadro 3 Efecto del aluminio (Al3+) en la concentración foliar de azúcares, proteínas y aminoácidos en plantas de caña de azúcar de la variedad Mex 69-290 después de 30 días de tratamiento.
| Variedad | Al3+ (µM) | Azúcares (mg g-1 PBF) |
Proteínas (µg g-1 PBF) |
Aminoácidos (nM g-1 PBF) |
|---|---|---|---|---|
| Mex 69-290 | 0 | 0.07 ± 0.00 d | 314.11 ± 9.36 b | 0.05 ± 0.00 d |
| 50 | 0.30 ± 0.02 a | 406.61 ± 0.43 a | 0.24 ± 0.03 b | |
| 100 | 0.19 ± 0.00 b | 244.35 ± 4.13 c | 0.39 ± 0.02 a | |
| 150 | 0.16 ± 0.00 c | 307.39 ± 11.78 b | 0.16 ± 0.01 c |
Medias ± error estándar con letras diferentes en las columnas indican diferencia estadística significativa (Tukey, P ≤ 0.05). PBF: peso de la biomasa fresca.
En la variedad CP 72-2086, la dosis 100 µM Al3+ incrementó la concentración de azúcares en 166.7 % con respecto al testigo. La dosis de 100 µM Al3+ promovió un incremento de proteínas del 39.2 % con respecto al testigo (Cuadro 4).
Cuadro 4 Efecto del aluminio (Al3+) en la concentración de azúcares, proteínas y aminoácidos en plantas de la variedad CP 72-2086 de caña de azúcar después de 30 días de tratamiento.
| Variedad | Al3+ (µM) | Azúcares (mg g-1 PBF) |
Proteínas (µg g-1 PBF) |
Aminoácidos (nM g-1 PBF) |
|---|---|---|---|---|
| Mex 69-290 | 0 | 0.09 ± 0.00 d | 323.90 ± 15.80 c | 0.05 ± 0.00 d |
| 50 | 0.15 ± 0.00 b | 410.70 ± 6.57 b | 0.24 ± 0.03 b | |
| 100 | 0.24 ± 0.00 a | 450.95 ± 4.63 a | 0.39 ± 0.02 a | |
| 150 | 0.16 ± 0.00c | 139.95 ± 29.14d | 0.16 ± 0.01c |
Medias ± error estándar con letras diferentes en las columnas indican diferencia estadística significativa (Tukey, P ≤ 0.05). PBF: peso de la biomasa fresca.
La disminución de los procesos fotosintéticos está directamente relacionada con la disminución de la concentración de azúcares. En lentejilla (Azolla microphylla), la exposición a una concentración de 100 µM Al3+ indujo un aumento en los azúcares solubles, pero en concentraciones de 500 µM Al3+ provocó una deficiencia fotosintética del 50 % e inhibición en la síntesis de azúcares como la sacarosa (Chakraborty et al., 2019). En los resultados obtenidos en este estudio se observa que el Al3+ estimula la concentración de clorofilas y azúcares solubles totales en ambas variedades de caña de azúcar evaluadas.
La acumulación de azúcares solubles se asocia como una respuesta al estrés, que depende del tipo y concentración del factor estresante. En cultivares de arándano (Vaccinium corymbosum L.), la exposición a 200 µM Al3+ aumentó la concentración de azúcares solubles (Cárcamo et al., 2019). Aparte de su función en procesos metabólicos y en la estructura celular, los azúcares también actúan como moléculas señalizadoras que regulan diferentes procesos asociados con el crecimiento y desarrollo de las plantas (Van den Ende, 2014). En frijol, la aplicación de Al3+ en concentración de 50 µM causó un aumento de 35 % en el contenido de proteínas con respecto al testigo (Chico et al., 2021). A altas concentraciones, el Al3+ se asocia con un declive en los procesos de síntesis de proteínas, ya que inhibe rutas metabólicas, además de retardar los procesos de crecimiento, absorción de nutrimentos y desarrollo morfológico (Niedziela et al., 2022).
En células vegetales, la exposición a Al3+ detona la activación de proteínas útiles en la adaptación a las condiciones de estrés ocasionadas por el mismo aluminio, lo que a su vez provoca una mayor síntesis de proteínas relacionadas con señalización de auxinas, detoxificación y de protección contra especies reactivas de oxígeno (ROS) (Rosa-Santos et al., 2020). El incremento de ROS promueve la maleabilidad de la pared celular que permite la entrada de agua al interior, provocando una expansión celular (Jalal et al., 2021), lo que a su vez permite un mayor crecimiento de la planta.
Los resultados del presente estudio muestran que la aplicación de la dosis baja de Al3+ produjo niveles más altos de aminoácidos, y que, al elevar la dosis de este elemento benéfico en el medio de cultivo esta variable tiende a disminuir; sin embargo, las concentraciones en hojas de plantas tratadas con Al3+ son mayores a las encontradas en hojas de plantas del tratamiento testigo. El incremento en la concentración de aminoácidos, precursores de las proteínas, correlaciona con la síntesis proteica e indica que no se presentó un proceso de desnaturalización de las proteínas (Hajiboland et al., 2013). El uso de bioestimulantes permite lograr un mejor ajuste osmótico e induce la síntesis de aminoácidos esenciales para las plantas y de otros osmoprotectantes (Bulgari et al., 2019).
En resumen, los efectos benéficos del aluminio en plantas pueden verse reflejados en la promoción del crecimiento, la estimulación de la absorción de nutrimentos esenciales y la reducción de los efectos negativos de factores de estrés abiótico, así como la estimulación del metabolismo (Bojórquez-Quintal et al., 2017). Estas respuestas pueden estar sustentadas por las interacciones sinérgicas del Al3+ con fitohormonas reguladoras del crecimiento vegetal y con genes relacionados con la proliferación celular y la síntesis de ADN (Escobar-Sepúlveda et al., 2017; Moreno-Alvarado et al., 2017), además de promover eficiencia en la absorción, transporte y utilización de nutrimentos y el metabolismo (Bojórquez-Quintal et al., 2017).
CONCLUSIONES
En las condiciones experimentales aquí descritas, el Al3+ ejerció efecto bioestimulante en las dos variedades de caña de azúcar evaluadas (Mex 69-290 y CP 72-2086), siendo superior en CP 72-2086 en las variables concentración de clorofilas, número y tamaño de brotes. Con el uso del aluminio en el medio de crecimiento in vitro es posible obtener plantas más sanas y vigorosas en menor tiempo, lo que permite recomendar su empleo como potente bioestimulante inorgánico para la micropropagación de caña de azúcar.











 text new page (beta)
text new page (beta)


