INTRODUCCIÓN
La palomilla dorso de diamante, Plutella xylostella (Linnaeus, 1758) (Lepidoptera: Plutellidae), es una especie cosmopolita y la principal plaga de brasicáceas en el mundo (Bujanos et al., 2013; Furlong et al., 2013). El principal método de combate es el uso de insecticidas químico sintéticos; sin embargo, éste es cada vez menos eficiente debido a que la plaga ha desarrollado resistencia a un gran número de moléculas químicas (Pudasaini et al., 2022; Sarfraz et al., 2005a) y a productos a base de Bacillus thuringiensis (Tabashnik et al., 1997), por lo que se han buscado alternativas como el uso de agentes de control biológico como parte de un programa de manejo integrado de plagas (Norris y Kogan, 2005). El uso de agentes de control biológico ha demostrado en diversos sistemas ser uno de los componentes más importantes en programas de manejo integrado y presenta como gran ventaja ser ecológicamente más amigable, tiene nulos efectos secundarios y no causa daño a la salud humana.
Hay gran cantidad de enemigos naturales de P. xylostella, tanto en el área de origen como en las de introducción. De acuerdo con Sarfraz et al. (2005b), esta plaga cuenta con más de 130 especies de parasitoides, entre las que destacan especies del género Diadegma (Hymenoptera: Ichneumonidae) como reguladores de poblaciones de P. xylostella (Ooi, 1992; Munir et al., 2018; Waage, 1983). Este género incluye 201 especies (Yu y Horstmann, 1997), aunque Diadegma insulare (Cresson, 1865) (Hymenoptera: Ichneumonidae) es el parasitoide más común de P. xylostella en América, desde el sur de Canadá hasta Venezuela (Furlong et al., 2013), por lo que se ha sugerido su inclusión en los programas de manejo integrado de la plaga (Bolter y Laing, 1983; Wang y Keller, 2002).
En programas de control biológico, una fuente rica en carbohidratos y proteínas es un elemento indispensable para parasitoides sinovigénicos, como es el caso de D. insulare, ya que su biología y comportamiento suelen estar sujetos al estado nutricional del insecto (Leatemia et al., 1995; Wäckers, 2004). Las principales fuentes de nutrientes disponibles de forma natural para los parasitoides son el polen, néctar floral, extrafloral y las mielecillas producidas por algunos hemípteros (Idris y Grafius, 1995; Tena et al., 2013; Wäckers y van Rijin, 2005). Idris y Grafius (2001) señalaron que D. insulare prefiere permanecer en ambientes con refugios y fuentes de alimento como inflorescencias de varias especies, tanto cultivadas como silvestres; además, el control biológico de P. xylostella también mejoró cuando se liberaron parasitoides en ambientes donde existían esas especies de plantas (Badenes-Pérez, 2019; Johanowicz y Mitchell, 2000). Se ha demostrado que el néctar y polen son importantes fuente de alimento alterno de enemigos naturales, y en adultos de parasitoides indispensable; sin embargo, esos recursos son limitados o inexistentes en algunos monocultivos (Gurr et al., 2004); por esa razón, se ha propuesto incrementar la disponibilidad de alimento alterno mediante la incorporación de plantas con flores; o bien, con la aspersión directa de sustancias ricas en carbohidratos que emulen mielecilla de áfidos o néctar floral, con lo que se podría mejorar la conservación de enemigos naturales e incrementar su acción de control biológico en el cultivo (Jervis et al., 1993; Olson et al., 2005; Wade et al., 2008).
Por lo anterior, el presente estudio tuvo como objetivo evaluar el efecto de tres fuentes de carbohidratos y tres de proteínas sobre la longevidad de D. insulare; adicionalmente, considerando los resultados de las pruebas de laboratorio, a nivel de campo se evaluó el grado de control que ofrecen los parasitoides sobre P. xylostella en cultivos de brócoli (Brassica oleracea var. italica) donde se incorporaron plantas de alyssum (Lobularia maritima) y la aplicación de suplementos alimenticios.
MATERIALES Y MÉTODOS
Efecto de suplementos alimenticios en la longevidad de Diadegma insulare
Se adquirió un pie de cría de D. insulare de la empresa Rancho Medio Kilo (San Francisco de los Romo, Aguascalientes, México). En laboratorio, las pupas se colocaron en una caja Petri (diámetro de 10 cm) dentro de un recipiente de plástico (26 × 13 × 13 cm) con un orificio lateral (13 × 7 cm), cubierto con tela de organza para favorecer ventilación. Los experimentos se iniciaron con adultos de D. insulare ≤ 24 h de edad; cada individuo se aisló en un criotubo de polipropileno (2 mL) al cual se le hizo una perforación en la tapa (diámetro 1 cm), misma que se cubrió con tela de organza para favorecer la ventilación y suministrar alimento.
El ensayo incluyó 15 tratamientos, de los cuales tres tenían carbohidratos (sacarosa, melaza y fructosa), tres tenían proteínas (leche en polvo, levadura de cerveza y proteína hidrolizada) y nueve tenían las posibles combinaciones; además, se incluyó un testigo que sólo dispuso de agua (Cuadro 1). Como fuente de fructosa se utilizó jarabe de maíz de alta fructosa (Miel Karo®); para la sacarosa se utilizó azúcar refinada comercial; para la melaza se usó el producto comercial azúcar mascabado (Zulka®). Como fuente de proteína se usó levadura de cerveza en polvo (Royal®), para la proteína hidrolizada se utilizó el producto Captor 300®, y para la leche en polvo se usó un producto comercial (Nido®). Las concentraciones de los tratamientos se estimaron de acuerdo con la composición de la mielecilla de algunos áfidos (Lamb, 1959; Van Neerbos et al., 2020), que pudiera ser alimento natural de diversos depredadores y parasitoides (Hagenbucher et al., 2014). Los suplementos se disolvieron en 100 mL de agua para tener una solución de 5 % de carbohidratos y 1 % de proteína.
Cuadro 1 Tratamientos de carbohidratos, proteínas y sus combinaciones, evaluados como alimento de Diadegma insulare en condiciones de laboratorio (25 ± 3 °C, 70 ± 10 % HR, 12:12 h luz:obscuridad).
| Clave | Tratamiento | Cantidad del producto comercial |
|---|---|---|
| Sac | Azúcar | 5.56 g |
| Sac/Lp | Azúcar + leche en polvo | 5.56 g + 0.49 g |
| Sac/Lv | Azúcar + levadura de cerveza | 5.56 g + 0.83 g |
| Sac/Ph | Azúcar + proteína hidrolizada | 5.56 g + 1 mL |
| Mel | Melaza | 5.56 g |
| Mel/Lp | Melaza + leche en polvo | 5.56 g + 0.49 g |
| Mel/Lv | Melaza + levadura de cerveza | 5.56 g + 0.83 g |
| Mel/Ph | Melaza + proteína hidrolizada | 5.56 g + 1 mL |
| Fruc | Jarabe de fructosa | 6.25 mL |
| Fruc/Lp | Jarabe de fructosa + leche en polvo | 6.25 ml + 0.49 g |
| Fruc/Lv | Jarabe de fructosa + levadura de cerveza | 6.25 ml + 0.83 g |
| Fruc/Ph | Jarabe de fructosa + proteína hidrolizada | 6.25 ml + 1 mL |
| Lp | Leche en polvo | 0.49 g |
| Lev | Levadura de cerveza | 0.83 g |
| Ph | Proteína hidrolizada | 1 mL |
| Ag | Agua (testigo) |
Fase de laboratorio
Se empleó un diseño experimental complemente al azar con 23 repeticiones por tratamiento, cada criotubo se consideró como una unidad experimental. Los tratamientos se ofrecieron a los parasitoides en una torunda de algodón (diámetro = 1 cm) saturada con 1 mL de solución de cada tratamiento. La torunda de cada tratamiento se colocó sobre la tela de la tapa de los criotubos correspondientes y fue reemplazada cada 24 h para evitar formación de hongos. Todos los ensayos se mantuvieron en una cámara bioclimática a 25 ± 3 °C, 70 ± 10 % HR y fotoperiodo de 12:12 h luz:obscuridad. Diariamente se registró el número de parasitoides vivos hasta que el último ejemplar de cada tratamiento murió. Para los datos de longevidad de los parasitoides, alimentados con los diferentes tratamientos, se hizo un análisis de supervivencia mediante la prueba no paramétrica de logrank; se hicieron seis contrastes incluyendo: i) todos los tratamientos, ii) los tratamientos con carbohidratos, sin combinaciones, iii) los tratamientos con agua, carbohidratos o proteínas, sin combinaciones, iv) todos los tratamientos con fructosa, v) todos los tratamientos con melaza y vi) todos los tratamientos con sacarosa. El análisis se hizo con el programa R, versión 4.0.5, se usó la librería survival (Therneau, 2021). El tratamiento que incrementó la probabilidad de supervivencia de los parasitoides se evaluó en el experimento de campo.
Efecto de alyssum y el suplemento alimenticio más promisorio
La fuente de carbohidratos que proporcionó los mejores resultados en longevidad de D. insulare en laboratorio se evaluó en campo (fructosa), y se comparó con la presencia de plantas con flores y un testigo regional (manejo tradicional en la plaga en la región). El experimento se desarrolló en el Rancho Los Aguilares (20° 34’ 30.87” N 101° 04’ 30.89” W), Salamanca, Guanajuato, México, en una superficie de 24 ha. Se utilizó un diseño experimental completamente al azar con seis tratamientos, cada uno se aplicó en una superficie de 4 ha (200 × 200 m) de brócoli para asegurar la representatividad; se delimitaron cinco unidades experimentales, dispuestas en cinco de oros, anidadas en la superficie de cada tratamiento. Los tratamientos evaluados fueron: T1 aplicación de fructosa, T2 presencia de plantas de alyssum, T3 liberación de parasitoides, T4 aplicación de fructosa + liberación de parasitoides, T5 presencia de plantas de alyssum + liberación de parasitoides y T6 testigo regional.
Para los tratamientos donde se liberaron parasitoides (adultos de D. insulare ≤ 72 h de edad) se realizaron tres liberaciones de manera homogénea a una dosis de 800 individuos ha-1, con intervalos de 15 días entre cada liberación. La primera liberación se realizó 30 días después del trasplante, periodo en el que se ha disipado el efecto de insecticidas sistémicos aplicados en pre-trasplante.
Para los tratamientos con aplicación de fructosa se realizaron aspersiones semanales de una solución al 5 %, en el 10 % de las plantas de brócoli y se utilizaron 20 L de la mezcla por hectárea; la aspersión se realizó de manera mecanizada con un tanque montado al tractor en uno de cada 10 surcos. En los tratamientos en los que se incorporaron plantas de alyssum, éstas tenían una edad de 30 días y ya contaban con flores al momento del trasplante. Estas plantas fueron establecidas en el campo de cultivo el mismo día del trasplante del brócoli. Se colocaron 1000 plantas con flores por hectárea, en un surco se colocó una planta de alyssum (intercalada entre plantas de brócoli) cada tres metros, ésto se repitió cada 10 surcos. En cada uno de los surcos intermedios se colocó una planta de alyssum cada 10 m; de esta manera, se formó una cuadrícula (Figura 1), procurando que las estaciones de alimentación para los parasitoides estuvieran uniformemente repartidas en toda la superficie. Las plántulas de alyssum las proporcionó la empresa Grupo U, propietaria de los campos donde se estableció el experimento.
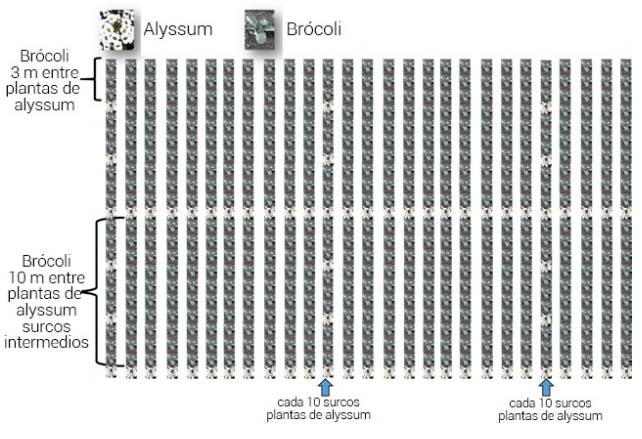
Figura 1 Distribución espacial de plantas de alyssum y brócoli en el rancho Los Aguilares, Salamanca, Guanajuato, México.
Los muestreos en campo se realizaron semanalmente, en cada tratamiento se tomaron datos y se colectaron muestras en las cinco unidades experimentales dispuestas en “cinco de oros”, cada punto fue delimitado para asegurar la independencia de las observaciones. En cada unidad experimental se revisaron 10 plantas al azar (n = 50, cinco repeticiones) y se registró el número de las que presentaban daño reciente por larvas de P. xylostella. Adicionalmente, en cada unidad experimental se tomaron 10 plantas al azar (n = 50, cinco repeticiones) en las que se contó, por muestreo exhaustivo-destructivo, el número de larvas pequeñas, medianas y grandes. Finalmente, se realizó un recorrido sistemático para colectar 10 larvas grandes y/o pupas de P. xylostella en cada unidad experimental, estas muestras se colocaron en cajas de Petri con un disco de hoja de brócoli, el cual fue reemplazado cada dos días hasta que se formó la pupa; los especímenes emergidos se separaron e identificaron utilizando un estereomicroscopio. Los adultos de P. xylostella y los parasitoides se identificaron utilizando las claves de Azidah et al. (2000) para las especies de Diadegma, y material de referencia depositado en la colección de insectos del Colegio de Postgraduados, fruto de proyectos anteriores.
Al porcentaje de plantas con daño se le aplicó la transformación angular (arcoseno p), donde p fue el valor proporcional de plantas dañadas; para esta variable se analizaron los datos al principio y el daño promedio al final del experimento. El porcentaje de parasitismo se calculó sobre larvas de los estadios 3 y 4 (grandes), ya que son las susceptibles a parasitismo por D. insulare. Se consideró el número de parasitoides emergidos en relación con la cantidad total de organismos emergidos (parasitoides + palomillas), aunque se analizó estadísticamente la cantidad de parasitoides emergidos al principio y el total acumulado al final del experimento; de manera similar, se analizaron los datos de la variable número de larvas de tercer y cuarto estadio por planta. Para evaluar el efecto de los tratamientos sobre las variables medidas se realizó un análisis de varianza y prueba de comparación de medias (Tukey, P ≤ 0.05), se utilizó el lenguaje de programación R, versión 4.0.5 (R Core Team, 2021).
RESULTADOS
Efecto de suplementos alimenticios en la longevidad de Diadegma insulare
La longevidad de adultos de D. insulare depende en forma significativa del tipo de suplemento alimenticio (contraste i, = 2389, P ≤ 0.0001). De manera general, la probabilidad de sobrevivencia fue significativamente mayor cuando los parasitoides dispusieron de una fuente de carbohidratos sin combinar, en comparación con parasitoides alimentados con proteínas sin combinar o únicamente agua (contraste iii, = 793, P ≤ 0.0001); el 75 % de los parasitoides alimentados con carbohidratos (fructosa, melaza o sacarosa) vivieron al menos 15 días, mientras que con agua o proteínas el 100 % de los individuos murió antes del día seis (Figura 2a).

Figura 2 Análisis de supervivencia de adultos de Diadegma insulare alimentados con diferentes tipos de proteínas, carbohidratos o su combinación
La fructosa propició la mayor probabilidad de supervivencia de parasitoides durante el ensayo; este suplemento alimenticio ocasionó que el 75 % de los individuos viviera al menos 22 días, ese porcentaje de supervivencia se mantuvo únicamente por 18 días con sacarosa y 15 días con melaza (contraste ii, = 8.8, P = 0.012). La fructosa sin combinar propició mayor longevidad de los parasitoides, en comparación con los tratamientos en los que se combinó este carbohidrato con proteínas (contraste iv, = 12, P = 0.0073) (Figura 2b). Este mismo patrón se observó para los tratamientos con melaza (contraste v, = 42.8, P ≤ 0.0001) (Figura 2c), mientras que la longevidad en los tratamientos con sacarosa no mostró diferencias significativas (contraste vi, = 2.5, P = 0.47) (Figura 2d).
Impacto de recursos florales y fructosa en campo
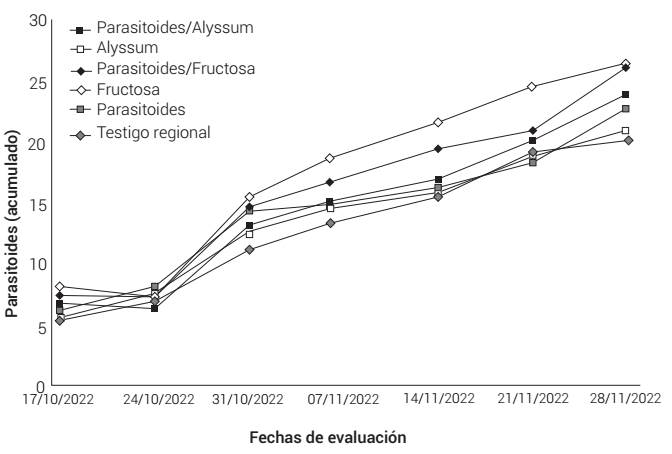
En la variable que midió la abundancia de larvas de P. xylostella en plantas de brócoli no se detectaron diferencias significativas entre tratamientos al momento de la primera evaluación (F5,24 = 1.96, P = 0.1201), la densidad media registrada estuvo entre 0.8 y 2.2 larvas por planta. A través de las evaluaciones, los conteos acumulados mostraron un mayor incremento en los tratamientos en los que se incorporaron plantas de alyssum (Figura 3); sin embargo, no se detectaron diferencias significativas en el número acumulado de larvas (F5,24 = 1.59, P = 0.1985) (Cuadro 2). Al principio del experimento, el porcentaje de plantas con daño reciente no fue estadísticamente distinto entre los tratamientos (F5,24 = 1.81, P = 0.1495). Los datos de evaluaciones subsecuentes se promediaron y el análisis global indicó que los tratamientos no ejercieron un efecto significativo en el porcentaje de plantas con daño reciente (F5,24 = 1.81, P = 0.1495) (Figura 3).
Cuadro 2 Efecto de los tratamientos en el porcentaje de parasitismo y número de larvas de tercer y cuarto instar.
| Tratamientos | Promedio de larvas por planta | Parasitoides emergidos | ||
|---|---|---|---|---|
| Inicio | Acumulado | Inicio | Acumulado | |
| Parasitoides | 0.4 ± 0.2 | 6.2 ± 2.0 | 6.2 ± 0.6 | 22.8 ± 1.0 AB |
| Fructosa | 1.0 ± 0.4 | 8.6 ± 2.3 | 8.2 ± 0.7 | 26.4 ± 0.5 AB |
| Alyssum | 2.2 ± 0.7 | 12.6 ± 2.3 | 5.4 ± 0.7 | 20.8 ± 1.4 AB |
| Parasitoides/fructosa | 0.6 ± 0.2 | 8.2 ± 1.2 | 7.4 ± 0.5 | 26.0 ± 1.9 AB |
| Parasitoides/alyssum | 1.2 ± 0.5 | 11.0 ± 1.7 | 6.8 ± 0.4 | 24.0 ± 1.9 AB |
| Testigo regional | 0.8 ± 0.4 | 7.2 ± 1.7 | 5.4 ± 1.0 | 20.2 ± 1.2 AB |
| F5,24 = 1.96 P = 0.1201 |
F5,24 = 1.59 P = 0.1985 |
F5,24 = 2.50 P = 0.0584 |
F5,24 = 3.35 P = 0.0194 |
|
Medias ± error estándar (ES) con la misma letra dentro de columnas no difieren estadísticamente (α ≤ 0.05). Sólo se incluyó la separación de medias cuando se detectaron diferencias significativas.
Al inicio del experimento, antes de la primera liberación de parasitoides, no se detectaron niveles de parasitismo estadísticamente diferentes entre tratamientos (F5,24 = 2.50, P = 0.0584). En la última evaluación, en el tratamiento T6 (testigo regional) se registró 42 % de parasitismo, mientras que en el tratamiento T1 (fructosa) el nivel de parasitismo alcanzó el 82 %; estos tratamientos fueron estadísticamente distintos en el número acumulado de parasitoides emergidos (F5,24 = 3.35, P = 0.0194) (Cuadro 2); en los dos tratamientos en los que se aplicó fructosa se observó una mayor acumulación de parasitoides emergidos (Figuras 4 y 5), aunque las diferencias estadísticas únicamente fueron patentes para los tratamientos antes referidos.
DISCUSIÓN
Las soluciones de carbohidratos, especialmente la fructosa, incrementaron la longevidad de D. insulare, los adultos vivieron 12 días más que cuando sólo se les proporcionó agua o alguna proteína. Resultados similares fueron reportados por Wäckers (2001), quien encontró que la fructosa, sacarosa y glucosa son los azúcares que favorecieron mayor longevidad (> 30 días) en el parasitoide Cotesia glomerata (Linnaeus, 1758) (Hymenoptera: Bracondiae); en ese ensayo se compararon soluciones acuosas de 14 azúcares diferentes. Bacca et al. (2012) reportaron una situación similar para el parasitoide Prorops nasuta Waterston, 1923 (Hymenoptera: Bethylidae), la longevidad de este parasitoide se incrementó (> 30 días) cuando existió disponibilidad de fructosa, maltosa y miel de abeja. Los resultados del presente estudio son semejantes a los datos proporcionados por Lee et al. (2004), quienes mencionaron que el parasitoide D. insulare emerge con altos niveles de lípidos y glucógeno y bajos niveles de azúcares, sus resultados sugieren que la incorporación de los carbohidratos evaluados a la dieta evitó la inanición e incrementó su longevidad.
En el caso de la alimentación de los adultos de D. insulare con las proteínas evaluadas, la longevidad no fue superior a la registrada en adultos a los que se ofreció sólo agua (< 3 días). Bacca et al. (2012) ya habían indicado que un suplemento alimenticio con proteína no representó una ventaja a P. nasuta en comparación con las dietas ricas en carbohidratos. Por otro lado, McDougall y Mills (1997), en experimentos con Trichogramma platneri Nagarkatti, 1975 (Hymenoptera: Trichogrammatidae), encontraron que proteínas derivadas de la levadura carecieron de efecto con respecto a la alimentación con agua; ésto puede deberse a que la proteína por sí sola adolece de algún efecto fisiológico en parasitoides adultos, contrario a los carbohidratos como la fructosa, que se utilizan para la producción de energía y se almacenan como glucógeno en el cuerpo graso, o como trehalosa en la hemolinfa (Rivero y Casas, 1999). Olson y Andow (1998) destacaron la importancia de los carbohidratos en la alimentación de especies sinovigénicas como D. insulare, estos compuestos coadyuvan a la maduración de huevos y, de acuerdo con Heimpel y Rosenheim (1998), evitan la reabsorción. En el presente estudio sólo se exploraron tres fuentes de proteína, y es probable que al probar otras fuentes pudieran tenerse efectos positivos, por lo que existe la necesidad de seguir explorando, ya que en la mayoría de los insectos el acceso a una proteína es esencial para su reproducción.
La longevidad de los parasitoides alimentados con la combinación de carbohidratos y proteínas en ninguno de los casos superó los resultados obtenidos con fructosa; este tratamiento incrementó de forma significativa la probabilidad de supervivencia de los parasitoides. En algunos casos se observó que, cuando a los carbohidratos se les adicionó alguna proteína, se redujo significativamente la longevidad de los parasitoides (Figura 2b y c), esto podría ser originado por una menor aceptación del alimento. Por su parte, Van Neerbos et al. (2020) demostraron que la composición de las mezclas de azúcares y proteínas tiene un efecto que puede incrementar o reducir la longevidad de algunos parasitoides.
Cuando el parasitoide D. insulare obtiene carbohidratos a través de los exudados de algunos áfidos, o bien del néctar de plantas con flores, se favorece su incremento y permanencia en el cultivo (Ochoa et al., 1989), con lo que podría aumentarse el nivel de control que ejerce sobre la palomilla dorso de diamante (Idris y Grafius, 1995). En los cultivos de crucíferas con muy bajos niveles de biodiversidad (una sola variedad de planta), la aplicación foliar de sustancias azucaradas pudiera reducir la carencia de estos compuestos, ya que en esos agroecosistemas la presencia de plantas con flores es escasa o nula, y está restringida a periodos cortos de tiempo (Mensah y Singleton, 2003).
La aplicación de compuestos que sirven como alimentos alternativos para D. insulare es resultado del estudio de la ecología nutricional de este insecto; asimismo, representa una medida de bajo costo y fácil acceso que podrían tener implicaciones directas en programas de control biológico por conservación (Wade et al., 2008). En este estudio se observó que la presencia de fuentes de alimento ricas en carbohidratos favorece la permanencia del parasitoide en el agroecosistema, ésto se reflejó en mayores niveles de parasitismo a través del tiempo; adicionalmente, se ha reportado mayor longevidad, fecundidad y fertilidad de parasitoides, aunque el hospedero se encuentre en bajas densidades (Gourdine et al., 2003; Olson et al., 2005 Wade et al., 2008).
En relación con la abundancia de larvas de palomilla dorso de diamante, en este estudio se registró mayor densidad poblacional en los dos tratamientos que incorporaron plantas de alyssum; esta tendencia se confirmó en las últimas cuatro evaluaciones, aunque no se detectaron diferencias significativas en los conteos acumulados (Cuadro 2). La asociación de brócoli-alyssum debería analizarse en trabajos futuros para estimar su factibilidad, ya que ambas plantas son de la misma familia botánica (Brassicaceae) y también es un hospedante alterno para P. xylostella; algunos estudios indican que el néctar podría servir como alimento para los adultos de la plaga e incrementar su potencial reproductivo (Maulina y Muflihayati, 2013; Winkler et al., 2010). El alyssum se ha utilizado como fuente de néctar en diversos programas de control biológico por conservación (Balmer et al., 2013; Landis et al., 2000,), incluyendo a P. xylostella y su parasitoide D. insulare (Johanowicz y Mitchell, 2000; Lavandero et al., 2005). Es importante mencionar que, además de ser una fuente rica en néctar y polen, alyssum también funciona como refugio para adultos de diversos depredadores y parasitoides, por lo que incrementa la presencia en campo de éstos y, en algunos casos, los niveles de control natural de plagas (Idris y Grafius, 1995).
Los tratamientos no tuvieron un efecto significativo sobre la variable que midió el daño de P. xylostella sobre plantas de brócoli (Figura 3). Los resultados de este estudio dan un indicio de una correlación negativa entre la variable porcentaje de daño y porcentaje de parasitismo, aunque las evidencias no son concluyentes. Por los niveles de parasitismo observados, se considera que D. insulare es un buen agente de control biológico para P. xylostella; no obstante, las liberaciones inundativas por sí solas no produjeron los mejores resultados en el experimento de campo, ello sugiere que se requiere de una acción combinada de liberaciones inundativas y del suministro de fuentes de alimento para favorecer la acción y permanencia de los adultos de estos parasitoides, especialmente en un cultivo como brócoli, donde los umbrales de acción son muy bajos, 0.5 insectos por planta en etapa vegetativa y 0.2 en la de fructificación (Bujanos et al., 2013). Si bien, el estudio se llevó a cabo en una época de baja abundancia de P. xylostella, los resultados sugieren que las aspersiones de fructosa, al 5 % en el 10 % de las plantas, pueden favorecer la presencia de agentes de control biológico y estas concentraciones no causan daños a la planta como pudiera ser la formación de fumagina, en el caso de plantas con flores se debe seguir experimentando con alyssum u otras especies para lograr una proporción adecuada en campo, ya que es necesaria la presencia de alguna fuente de carbohidratos para incrementar la biología reproductiva y para fomentar la búsqueda de presas (Jervis et al., 1993; Olson et al., 2005; Wade et al., 2008). La presencia de estas fuentes de alimentación también puede favorecer la capacidad reproductiva de P. xylostella (Winkler et al., 2010), por lo que es necesario realizar estudios donde se combine la presencia de plantas con flores y mecanismos de control de esta plaga directamente en las plantas como puede ser el uso de una aspiradora, como se ha propuesto para otros cultivos (Pickel et al., 1994, Weintraub y Horowitz, 1999).
CONCLUSIONES
La solución de fructosa puede ser una medida de bajo costo y potencialmente positiva en la biología de D. insulare, se trata de un carbohidrato de fácil adquisición en el mercado en comparación con miel. La aplicación de suplementos alimenticios fomentó el parasitismo en P. xylostella. El uso del control biológico por conservación dentro del concepto de manejo integrado de plagas puede favorecer el establecimiento y aumento del parasitoide D. insulare en el agroecosistema.











 text new page (beta)
text new page (beta)