Introducción
El amaranto (Amaranthus hypochondriacus L.) es un pseudocereal de la familia Amarantaceae que se distribuye en América, África, Asia y Europa (Zhigila et al., 2014). El grano de amaranto tiene importancia agronómica y nutracéutica, sobresale por su alto contenido de proteína (13.56 %), minerales como Ca, Fe, Zn, Mg, K (Gebhardt et al., 2008) y lisina (Amare et al., 2015). Desde la perspectiva agronómica, el amaranto es un cultivo redituable, ya que además de su buen precio en el mercado, se produce a bajo costo, es de ciclo corto, resiste condiciones ambientales de sequía y altas temperaturas, resiste plagas y enfermedades y se adapta bien a diversas condiciones agroclimáticas (Hoidal et al., 2020).
En general, se tienen suficientes conocimientos del manejo agronómico del cultivo; en cuanto a su fertilización, se sabe que ésta varía de acuerdo con la cantidad y distribución de la lluvia (Mposi, 1999), el tipo de suelo, cultivos anteriores e historia de fertilización al suelo (Stallknecht y Schulz-Schaftfer, 1993). La información acerca de las necesidades de fertilidad de suelo y de la demanda y extracción de nutrimentos a lo largo del ciclo de cultivo es escasa (Olaniyi et al., 2008) y casi nula para variedades de producción de grano (Basantes y Terán, 2017), especialmente, en los lugares donde el cultivo es de reciente introducción (Nyankanga et al., 2012).
En México, la nutrición mineral y la respuesta a la aplicación de fertilizantes en el cultivo de amaranto se ha relacionado con la cantidad y distribución de la lluvia, ya que se cultiva principalmente bajo condiciones de temporal, donde se pueden usar entre 60 y 80 kg de N ha-1 y hasta 50 kg de P ha-1 (Ramírez et al., 2011), pero no se tiene calculada la dosis de fertilización con base en una metodología que considere tanto el aporte de nutrientes por el suelo, como la demanda y extracción de los mismos por el cultivo desde la siembra hasta la cosecha. La demanda de nutrientes por el cultivo está dada por la producción de biomasa y por las concentraciones totales de éstos en los tejidos de la planta, a partir de lo cual se construye la curva de extracción nutrimental durante el ciclo del cultivo y es útil para identificar las épocas de mayor absorción de cada nutriente, así como para definir un programa de fertilización adecuado para el cultivo (Bertsch, 2009). Lo anterior muestra la necesidad de generar las curvas de extracción nutrimental de amaranto para la producción de grano, que permitan diseñar estrategias de manejo de la nutrición del cultivo, por lo que se llevó a cabo el presente estudio con el objetivo de elaborar la curva de extracción de N, P, K, Ca y Mg durante el ciclo de cultivo de amaranto variedad Nutrisol.
Materiales y métodos
Sitio experimental
El estudio se realizó en el año 2018 en el Campo Experimental Valle de México del INIFAP, ubicado en Coatlinchán, Texcoco, Estado de México, a los 19° 26′ 56″ latitud norte y 98° 52′ 20″ longitud oeste, a una altitud de 2300 m. El suelo de la parcela experimental fue de textura franco arcillosa, con pH de 7.0, materia orgánica de 2.3 % y conductividad eléctrica (C.E.) de 0.16 dS m-1. El contenido de minerales del suelo (mg kg-1) y su interpretación, según Castellanos et al. (2000), fue: N (91, muy alto), P (55, alto), K (780, alto), Ca (2660, moderadamente alto), Mg (816, alto), Fe (13, moderadamente alto), Cu (1, medio), Zn (2, medio) y Mn (41, alto).
Material vegetal
Se utilizó amaranto variedad Nutrisol, que es una variedad mejorada, de ciclo vegetativo tardío con alto potencial para la producción de grano en la región de Valles Altos de los Estados de México, Hidalgo, Puebla y Tlaxcala, con buen comportamiento en regiones semitropicales como Guanajuato, Morelos y Querétaro (Espitia-Rangel, 1994).
Diseño y unidad experimental
El experimento se estableció en campo bajo condiciones de temporal en un diseño experimental de bloques completos al azar con seis repeticiones. La unidad experimental fue una parcela de cinco surcos de 0.8 m de ancho por 5.0 m de largo (20 m2).
Manejo agronómico
Previo a la siembra, la semilla se mezcló con estiércol de caballo y vermicomposta; posteriormente, se hizo la siembra en forma mateada colocando al fondo del surco un puño de la mezcla preparada cada 25 cm, sin tapar con suelo. Se usó la fórmula de fertilización 80-40-00, la mitad del N y todo el P se aplicó al momento de la siembra y el resto en la segunda escarda; como fuente de N y P, se usó urea y superfostato de calcio triple, respectivamente. Un mes después de la siembra se realizó un aclareo para dejar entre cuatro y seis plantas por mata.
Para obtener la curva de extracción de N, P, K, Ca y Mg, se realizaron las siguientes actividades:
1) Muestreos del material vegetal
Se realizaron cada 15 días con inicio a partir de los 38 días después de siembra (dds), consistieron en cortar al nivel del suelo de los cuatro surcos centrales cuatro plantas al azar por unidad experimental; las plantas se separaron en hojas, tallos, inflorescencias y grano, las partes se colocaron en bolsas de papel; las inflorescencias y grano fueron evaluadas a partir del tercer muestreo (67 dds).
2) Determinación de materia seca (MS)
Con una báscula con precisión de 0.1 g se determinó el peso fresco (g) por órgano de las cuatro plantas (P1); de éstas, se tomó una submuestra de 200 g en fresco (P2), la cual se colocó en una estufa de secado por convección (Binder ED400, Nueva York, EUA) a 65 oC hasta peso constante (P3); con estos datos se obtuvo la MS del órgano por planta:
También se obtuvo el índice de cosecha (IC) en la etapa de madurez fisiológica mediante la relación: IC (%) = [MS de grano / MS total (tallos + hojas + inflorescencia + grano)] × 100
3) Determinación de macronutrimentos
La materia seca obtenida de la submuestra de 200 g fue procesada en un molino de acero inoxidable (Thomas Wiley Mill ED-5, Swedesboro, New Jersey, EUA) y se tomó una submuestra de 0.5 g; esta última se sometió a una digestión húmeda con 5 mL de una mezcla de ácido sulfúrico y perclórico (4:1) y 3 mL de peróxido de hidrógeno 30 %; ésto se colocó en una plancha de digestión a 200 °C por 5 h. Después de la digestión, la muestra se aforó a 50 mL con agua destilada, a partir de la cual se hicieron las determinaciones de N por el método de micro Kjeldahl, P mediante el método del molibdovanadato amarillo a 420 nm en un espectrofotómetro (Thermo electron Scientific Genesys 10S, Madison, Wisconsin, EUA); las determinaciones de N y P se realizaron según la metodología de Chapman y Pratt (1973), de K por flamometría (Sherwood M410, Cambridge, Inglaterra) y de Ca y Mg por espectrofotometría de absorción atómica (GBC Avanta Techlab, Lima, Perú).
Análisis estadístico
Se realizó con la información de la materia seca y las extracciones de nutrimentos por órgano en la etapa de madurez fisiológica. Los datos fueron sometidos a análisis de varianza y comparación de medias de Tukey (P ≤ 0.05) con el paquete estadístico SAS versión 9.0 (SAS Institute, 2004).
Resultados y discusión
Acumulación y distribución de la materia seca e índice de cosecha
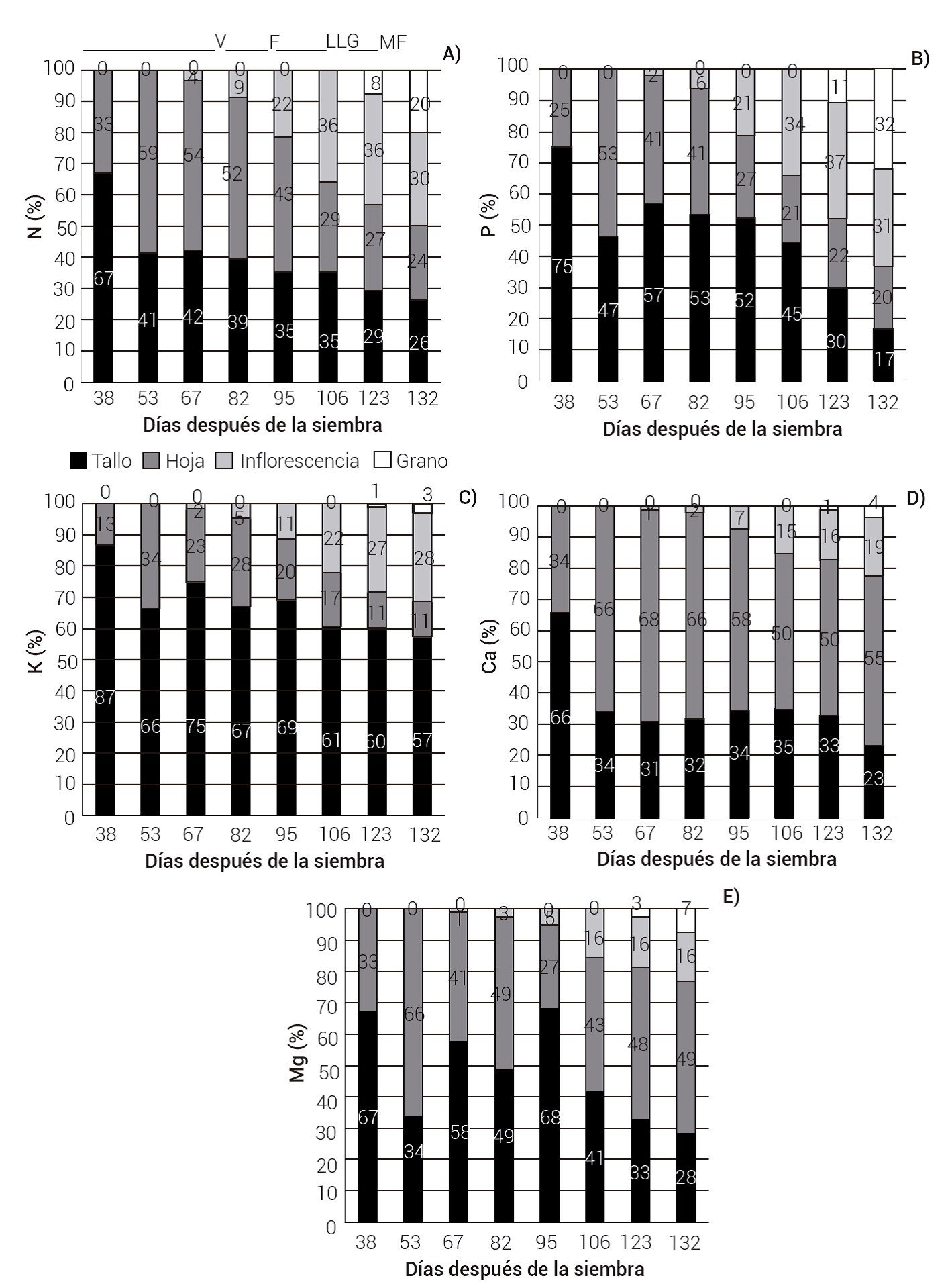
En las Figuras 1A y 1B se muestra la acumulación y distribución relativa de la materia seca (MS) por órgano con respecto a la MS total en las diferentes etapas fenológicas del cultivo: vegetativa (0-95 dds), floración (53-95 dds), llenado de grano (123 dds) y madurez fisiológica (132 dds). Durante el desarrollo vegetativo se encontró que la acumulación de MS se presentó principalmente en el tallo (53 a 80 %) y hoja (20 a 47 %) (Figura 1B). De la floración al llenado del grano (95 a 123 dds) la MS del tallo pasó de 62 a 44 % y la de las hojas de 24 a 17 %, mientras que en la inflorescencia pasó de 14 a 33 % (+19 %) y en el grano pasó a 6 %, lo que indica una removilización de fotoasimilados de alrededor del 18 % de los tallos y 7 % de las hojas hacia la inflorescencia (19 %) y el grano (6 %). Del llenado de grano a madurez fisiológica (123-132 dds), la MS del tallo pasó de 44 a 43 %, en las hojas de 17 a 16 % y en la inflorescencia pasó de 33 a 26 (-7 %), que correspondió a una removilización de fotoasimilados de estas estructuras al grano de 9 % en total (Figura 1B). La disminución de la MS en hojas fue consecuencia de un incremento de la senescencia de las hojas a partir de los 82 dds (Figuras 1A y 1B). Al llegar a madurez fisiológica, la acumulación y distribución de la MS de mayor a menor cantidad en los distintos órganos fue la siguiente: tallos (43 %, 83.4 g) > inflorescencia (26 %, 55.6 g) > hojas (16 %, 30.3 g) > grano (15 %, 30.1 g) (Figura 1B y Cuadro 1). Estos resultados fueron similares a los reportados por Monroy-Pedroza et al. (2021) en Amaranthus hypochondriacus variedad Frondosa cultivada en San Luis Potosí, donde el 42 % de la materia seca correspondió a tallo y más del 30 % a panoja (inflorescencia y grano); en contraste, Rivelli et al. (2008), al evaluar diferentes genotipos de Amaranthus sp. en Italia, entre ellos Amaranthus hypochondriacus Accesión 604577 de México, reportaron hasta 83 % de la MS en los tallos, 12 % en las hojas y 6% en la inflorescencia.
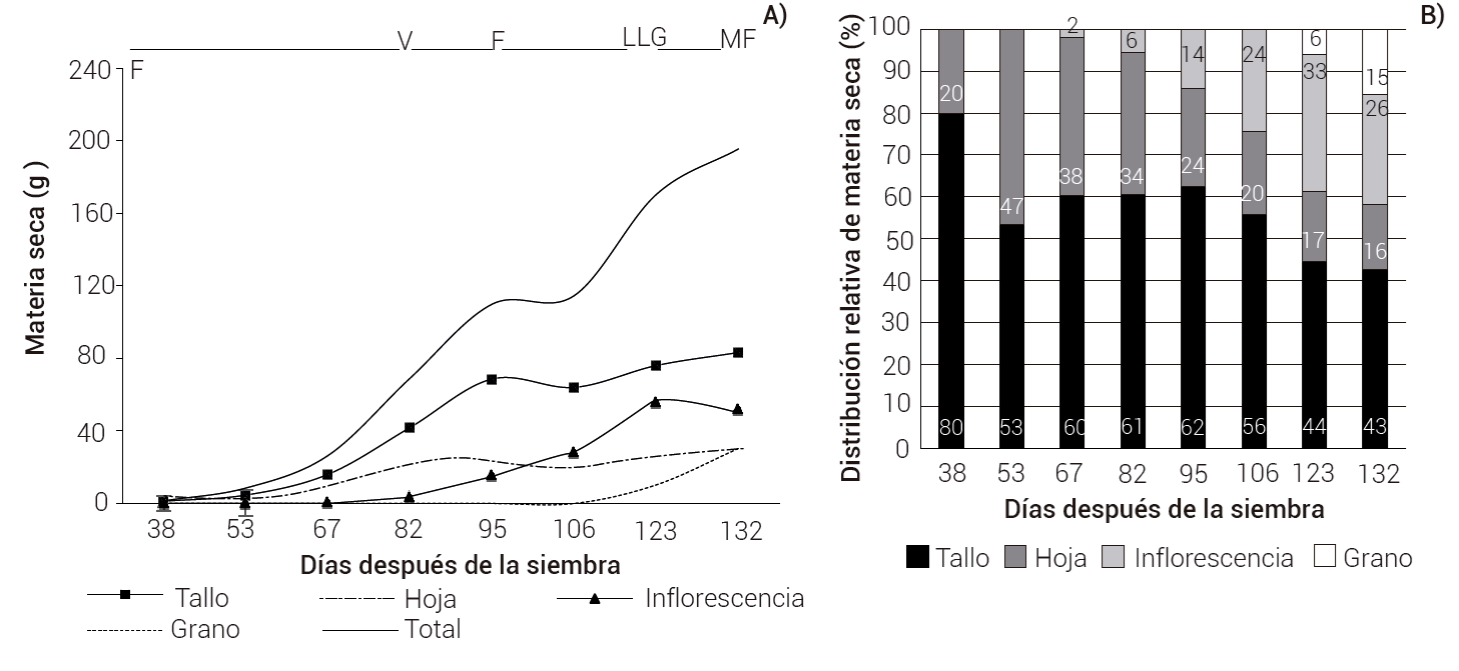
Figura 1 Distribución de materia seca (A) y distribución relativa de materia seca (B) por órgano durante el desarrollo del cultivo de amaranto variedad Nutrisol. Etapas fenológicas: V: etapa vegetativa, F: floración, LLG: llenado de grano, MF: madurez fisiológica.
Cuadro 1 Distribución de materia seca y extracción de macronutrientes por órgano y total en amaranto variedad Nutrisol en madurez fisiológica del cultivo a los 132 días después de la siembra .
| Órgano | Materia seca | N | P | K | Ca | Mg |
| (g) | ||||||
| Tallo | 83.14 a | 0.77 ab | 0.10 a | 3.81 a | 0.46 b | 0.48 b |
| Hoja | 30.37 c | 0.70 ab | 0.12 a | 0.75 c | 1.09 a | 0.83 a |
| Inflorescencia | 51.66 b | 0.87 a | 0.18 a | 1.87 b | 0.37 b | 0.27 c |
| Grano | 30.17 c | 0.59 b | 0.19 a | 0.20 c | 0.07 c | 0.13 c |
| Total | 195.34 | 2.92 | 0.58 | 6.63 | 2.00 | 1.71 |
| DSH | 13.672 | 0.245 | 0.093 | 0.6101 | 0.2554 | 0.1709 |
| IC (%) | 15.4 |
Medias con letras iguales en las columnas no son estadísticamente diferentes (Tukey, P ≤ 0.05). DSH: diferencia significativa honesta.
El índice de cosecha (IC) fue 15.4 % [(30.17/195.34) × 100)] (Cuadro 1), resultado que es congruente con lo reportado en la literatura. Monroy-Pedroza et al. (2021), para la variedad Frondosa, obtuvieron un IC de 18 %; Schulte auf’m Erley et al. (2005) para Amaranthus hypochondriacus × A. hybridus, reportaron valores de 22-23 %; las variedades de Amaranthus hypochondriacus L. Tulyehualco (tardía) y Frondosa (precoz) tuvieron en promedio 12 % (Torres et al., 2006), en tanto que para otras variedades de grano se encontraron valores de 9-15 % (Elbehri, 1993). Otros cereales como trigo, cebada y maíz, muestran IC más altos; por ejemplo, se reporta 42 % para variedades de cebada provenientes de Suecia y Dinamarca (Bertholdsson y Brantestam, 2009) y de 45 a 53 % para maíz (Russell, 1991).
Acumulación y distribución de macronutrientes
El orden de acumulación total de macronutrientes en la planta de amaranto en la etapa de madurez fisiológica se presenta en el Cuadro 1 y fue el siguiente: K > N > Ca > Mg > P. Estos resultados siguieron la misma tendencia que los encontrados por Basantes y Terán (2017) en Amaranthus caudatus L. variedad Alegría. En la acumulación de P no hubo diferencias estadísticas entre órganos, pero en la acumulación de N el orden fue el siguiente: inflorescencia ≥ tallo ≥ hoja > grano; para K fue tallo > inflorescencia > hoja ≥ grano; para Ca fue hoja > tallo ≥ inflorescencia > grano y para Mg fue hoja > tallo > inflorescencia ≥ grano.
Extracción de nutrientes
La extracción de macronutrimentos para producir una tonelada de grano y la extracción por planta se presentan en el Cuadro 2. Al extrapolar a una densidad de población de 135,000 plantas por ha y un rendimiento de 4.6 Mg ha-1, la extracción en grano y total respectivamente, de mayor a menor fue la siguiente en kg ha-1: K (195 y 896) > N (86 y 395) > Ca (59 y 270) > Mg (50 y 231) > P (17 y 79). Basantes y Terán (2017) encontraron que el amaranto variedad Alegría en floración extrajo cantidades tan elevadas de N como 500 kg ha-1 a los 120 dds. Aufhammer et al. (1995) reportaron que genotipos de amaranto que produjeron de 1.4 a 3.0 t de grano ha-1, extrajeron de 130 a 210 kg de N ha-1. Los siguientes estudios, aunque no indican las extracciones por la planta, dan idea de las necesidades de fertilización al suelo y de la extracción por las plantas de amaranto, según la variedad y la humedad disponible en el suelo: Stallknecht y Schulz-Schaffer (1993) encontraron que en genotipos con rendimiento de grano de 2 t ha- 1 fueron suficientes 112 a 135 kg ha-1 de N total, 15 a 30 mg kg-1 de P y 80 a 120 mg kg-1 de K reportados en el análisis químico de suelo de las grandes planicies de Estados Unidos; Ojo et al. (2007) aplicaron dosis de N entre 60 y 80 kg ha-1 en condiciones de temporal; Arellano (2000), para genotipos en México en condiciones de temporal y con rendimiento de 1.86 t ha-1, reportó que 86 kg N aplicados al suelo fueron suficientes para producir una tonelada de grano; Elbehri et al. (1993) encontraron que el amaranto Plainsman, con rendimiento entre 754 y 1980 kg ha-1, responde a dosis de fertilización nitrogenada mayor de 180 kg ha-1 y no encontraron respuesta a la aplicación de P cuando el suelo tenía 68 kg de P ha-1, pero sí cuando la concentración de este elemento en el suelo fue de 11 kg ha-1, concluyeron que el rendimiento en grano aumenta en 2.81 kg por cada kg de P aplicado; Ojo et al. (2007) no observaron incremento en el rendimiento de grano en amaranto en Nigeria con fertilización mayor de 90 kg N ha-1, pero encontraron que la dosis de 50 kg de P ha-1 fue adecuada; Pandey et al. (2018) indicaron que se produjeron 388.4 kg ha-1 de materia seca total con la extracción de 1.0 kg de P disponible. En el presente estudio fueron producidos 336.8 kg de MST por cada kg de P extraído por la planta. En el caso de México, la nutrición y la respuesta a la aplicación de fertilizantes en el cultivo de amaranto se ha relacionado con la cantidad y distribución de la lluvia, ya que se cultiva principalmente bajo condiciones de temporal, donde se pueden usar entre 60 y 80 kg de N ha-1 y hasta 50 kg de P ha-1 (Ramírez et al., 2011).
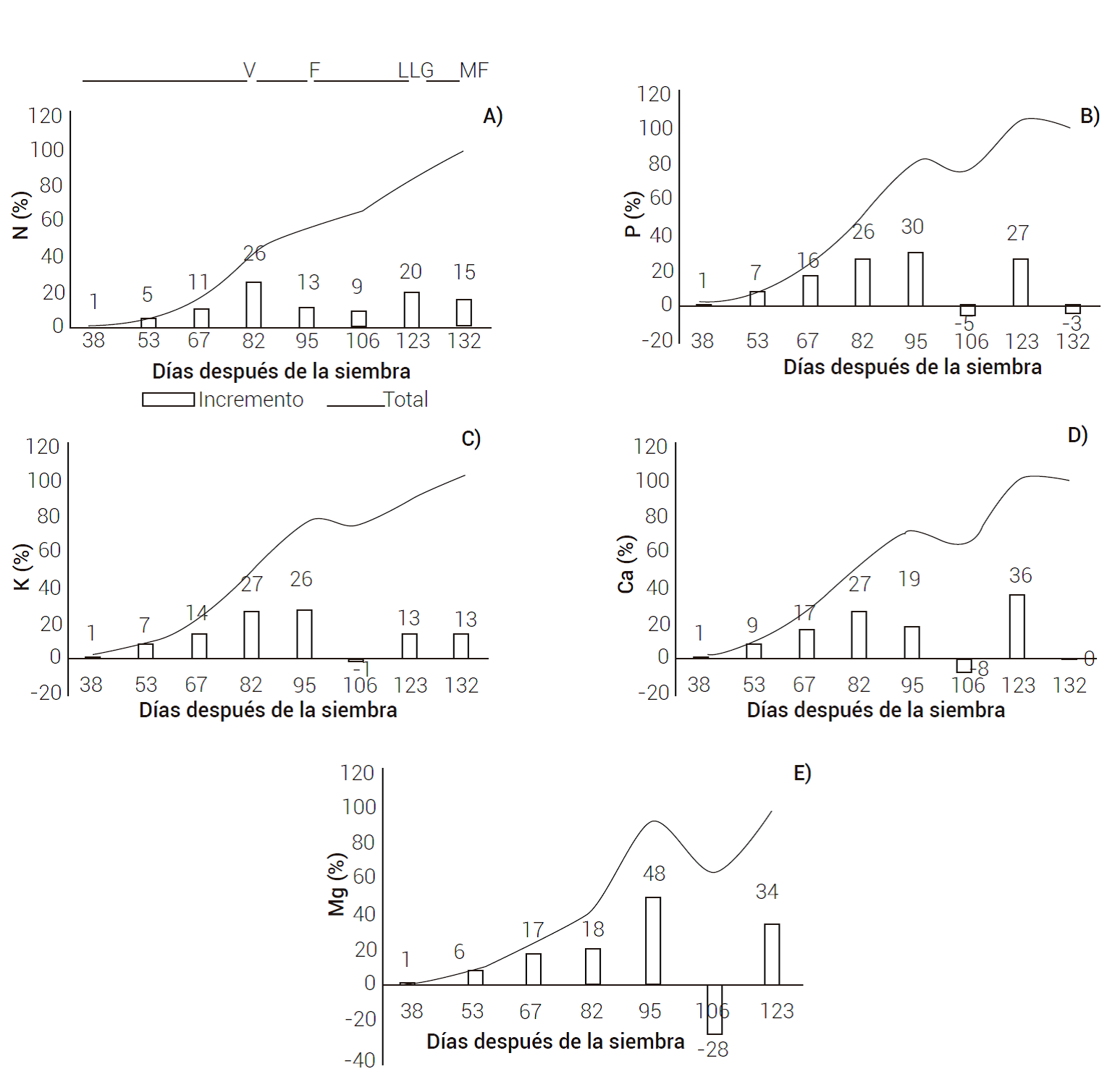
Dinámica de extracción nutrimental
Las curvas de extracción de nutrientes por órgano y total durante el ciclo del cultivo se presentan en la Figura 2. En el caso del N, se observó una extracción mayor por las hojas y tallos en la etapa vegetativa (antes de los 95 dds) y en el llenado de grano (123 dds); el orden de acumulación fue: inflorescencias > tallos > hojas > granos. Al respecto, Novoa y Loomis (1981) mencionaron que las hojas tienen un papel importante en el metabolismo del N, ya que son los órganos más importantes en la síntesis de aminoácidos y almacenamiento de este elemento. En general, el N es fundamental en el metabolismo vegetal y mejora tanto en cantidad como en calidad del rendimiento de grano ya que, bajo condiciones deficientes de N, el número de semillas y rendimiento son reducidos en cultivos de cereales y leguminosas (Fageria, 2001).

Figura 2 Curva de extracción de N (A), P (B), K (C), Ca (D) y Mg (E) en amaranto variedad Nutrisol durante su ciclo de cultivo. Etapas fenológicas V: etapa vegetativa, F: floración, LLG: llenado de grano y MF: madurez fisiológica.
En floración (95 dds), el punto de máxima extracción de P se presentó en los tallos, seguido de las hojas e inflorescencias, y durante el llenado de grano (123 dds) predominó su consumo por las inflorescencias. Mengel et al. (2001) indicaron que los valores más altos de extracción de P se presentan en la etapa vegetativa y reproductiva, debido a que las hojas jóvenes contienen relativamente altas cantidades de P orgánico en forma de ácidos nucleicos y fosfolípidos, que son acumulados y translocados posteriormente a la parte reproductiva. De acuerdo con Hawkesford et al. (2012) y Mengel et al. (2001), el P es indispensable para la división celular durante la floración y fecundación en la etapa reproductiva.
La extracción de K fue alta en los tallos durante todo el ciclo de cultivo, a diferencia de lo reportado en otras especies, donde se presenta en mayor cantidad en estructuras de reserva, flores y frutos (Bertsch, 2009); ésto se explica porque el K es importante en funciones relacionadas con la activación enzimática, neutralización de cargas negativas, en el mantenimiento de la turgencia de la planta, y por ende, para el crecimiento expansivo (Hawkesford et al., 2012); grandes cantidades de este elemento son transportadas en la savia a través del xilema y se distribuyen a los tejidos de la parte aérea, entre éstos, los tallos y hojas (Ahmad y Maathuis, 2014).
La magnitud de acumulación de calcio, de la etapa vegetativa al llenado de grano, fue en el orden siguiente: hojas > tallos > inflorescencias > grano, y de llenado de grano a madurez fisiológica esta tendencia se mantuvo, excepto que en las inflorescencias disminuyó. La acumulación en hojas fue importante y alcanzó hasta un 68 % del total de la planta; de acuerdo con Conn y Gilliham (2010), este elemento en las hojas puede representar del 70 al 90 % del Ca total en la planta, que se explica por su movilidad alta en el flujo de la traspiración; así, los niveles de concentración de Ca en los órganos de mayor traspiración como las hojas son mayores que en los órganos de baja transpiración como los frutos (Taiz y Zeiger, 2002).
La extracción de Mg en la floración fue mayor por los tallos y hojas, así como del llenado de grano a madurez fisiológica, etapas en las que se mantuvo el orden de acumulación siguiente: hojas > tallos > inflorescencia > grano. Según Mengel et al. (2001) y Taiz y Zeiger (2002), la mayor acumulación del Mg se presenta en las hojas, puesto que es ahí donde se sintetiza gran cantidad de clorofila y otros pigmentos; se sabe que del 15 a 30 % del total de Mg en las plantas se asocia con la molécula de clorofila y el otro 70 a 85 % actúa como cofactor en varios procesos enzimáticos de la fotosíntesis y respiración.
En general, en la curva de extracción nutrimental se observó que después de los picos de consumo a los 95 y 123 dds se desaceleró el consumo de todos los nutrimentos en tallos y hojas, identificado al decrecer la curva de consumo en esas estructuras, al tiempo que en las flores (95 dds) y el grano (123 dds) continuaron ascendiendo, comportamiento congruente con lo descrito por Bertsch (2009). Durante el llenado de grano, el N y P fueron los de mayor extracción por la inflorescencia y el grano; por su parte, Basantes y Terán (2017) señalaron que estos órganos tienen mayor demanda de P y Ca.
Distribución relativa de los nutrimentos
La distribución relativa de los nutrimentos en las diferentes estructuras de la planta cambió con la etapa fenológica, especialmente a partir de floración (Figuras 3 A, B, C, D y E). En el periodo vegetativo (antes de los 95 dds), todos los elementos alcanzaron valores máximos en tallos y hojas. Durante el desarrollo del cultivo, el orden de acumulación de los macronutrimentos fue el mismo en las estructuras vegetales: tallo > hoja >inflorescencia > grano, excepto para Ca donde la tendencia fue hoja > tallo > inflorescencia > grano, esto último se explica por la poca movilidad del elemento a estructuras reproductivas (White y Broaley, 2003). Todos los nutrimentos fueron decreciendo desde el inicio de la floración (67 a 82 dds) hasta la madurez fisiológica, donde la traslocación hacia las inflorescencias y grano fue alta para N (50 %), P (64 %) y K (63 %), pero baja para Ca (22 %) y Mg (24 %). Fageria et al. (1997) indicaron que la removilización de nutrientes es particularmente importante durante la fase reproductiva, cuando se forman las semillas, frutos y órganos de almacenamiento. En el caso del N, estos resultados coinciden con lo reportado por Basantes y Terán (2017), quienes indicaron que el amaranto requiere mayor cantidad de N en etapas tempranas (etapa vegetativa); posteriormente, la planta orienta su mayor actividad metabólica al desarrollo de inflorescencias; por su parte, Aufhammer et al. (1995) encontraron que en amaranto con un rendimiento de 1.4 a 3.0 t de grano ha-1, el N total se distribuyó en 66 % en la biomasa vegetativa (105 kg ha-1) y 33 % en el grano (53 kg ha-1).
Curva de extracción nutrimental
De acuerdo con la distribución porcentual, en la etapa vegetativa (antes de 95 dds) el amaranto extrajo más del 40 % del requerimiento total de N y Mg y más del 50 % de P, K y Ca (Figuras 4A, B, C, D y E). Sobresale un periodo de mayor demanda para todos los nutrimentos, que comprendió el crecimiento vegetativo máximo, la floración y el llenado de grano (82 a 123 dds); en ese periodo (82 a 123 dds) se presentó más del 70 % de la extracción total de P, K, Ca y Mg y de 68 % del N; también, en el periodo de llenado de grano a madurez fisiológica (123 a 132 dds) las extracciones fueron iguales o mayores a 35 % para N, Ca y Mg y mayores a 20 % para K y P. La identificación de estos periodos de mayor requerimiento nutrimental del cultivo en función de la etapa fenológica es útil para establecer programas de fertilización (Bertsch, 2009; Vargas-Canales et al., 2014). En el caso del amaranto variedad Nutrisol, el conocimiento de los momentos de mayor extracción de cada nutrimento y la extracción total de los mismos es clave para ajustar las dosis de fertilización durante el desarrollo del cultivo, ya sea en condiciones de riego o temporal, donde además deben considerarse otros factores como el nivel de la fertilidad del suelo, las fuentes de fertilización utilizadas, la forma de aplicación, la solubilidad del fertilizante, el tipo de suelo, la concentración de la materia orgánica, la cantidad y distribución de las lluvias, así como los tiempos de manejo del suelo (escardas) que se aprovechan para hacer las aplicaciones de fertilizantes.
Conclusiones
De acuerdo con la curva de extracción nutrimental obtenida, el amaranto variedad Nutrisol es altamente demandante de nutrimentos, en especial entre los 82 y 123 días después de la siembra, donde demanda más del 60 % del requerimiento total de los nutrimentos evaluados; este periodo corresponde al crecimiento vegetativo máximo, floración y llenado de grano. El elemento extraído en mayor cantidad fue el potasio, seguido en orden por el nitrógeno, calcio y magnesio. Al final del ciclo del cultivo la mayor parte del N, P y K se traslocó al fruto (inflorescencia y grano) mientras que el Ca y Mg permanecieron en las hojas y tallos. La extracción nutrimental para producir una tonelada de grano y la extracción total de amaranto variedad Nutrisol en las condiciones de este estudio en orden decreciente fue K > N > Ca > Mg > P.











 text new page (beta)
text new page (beta)