INTRODUCCIÓN
El aluminio representa 7 % de la corteza terrestre y su abundancia es menor sólo a la del oxígeno y el silicio (Matsumoto y Motada, 2012; Matsumoto et al., 2015); al igual que el selenio y el cobalto, no se considera elemento esencial para las plantas, aunque se puede acumular en los tejidos vegetales en concentraciones de 0.1 a 500 µg g-1 de materia seca (Taiz et al., 2015).
El aluminio es el factor limitante del crecimiento de las plantas en suelos ácidos, los cuales ocupan hasta el 70 % de la tierra potencialmente cultivable del mundo. El aluminio se solubiliza en suelos con pH menor a 5; en esas condiciones, la mayoría de aluminio existe como Al3+, que es la forma más tóxica para las plantas (Kochian et al., 2005; Ma et al., 2001).
El efecto del aluminio en las plantas cultivadas se ha estudiado en investigaciones fisiológicas (Mihailovic et al., 2008; Moreno-Alvarado et al., 2017; Rengel, 1996; Schmitt et al., 2016). Las investigaciones de Darkó et al. (2004), Meriga et al. (2004), Chen, (2006) y He et al. (2014) coinciden en señalar su efecto tóxico en las plantas, sobre todo al inhibir el crecimiento de las raíces; sin embargo, existen evidencias que indican un efecto benéfico del aluminio en concentraciones menores a 2.0 mg L-1 en ciertos procesos fisiológicos de plantas cultivadas. En regiones tropicales, donde abundan los suelos ácidos, el aluminio estimula el crecimiento de las plantas, así como la absorción del fósforo, y se ha demostrado que la estimulación del crecimiento por la aplicación de aluminio en plantas adaptadas a suelos ácidos en regiones tropicales y templadas se debe al efecto en la absorción de nitrógeno, fósforo y potasio (Osaki et al., 1997).
El cultivo de maíz es más sensible al efecto del aluminio que otros cereales (Wang et al., 2015), pero las investigaciones referentes a su efecto benéfico no abundan o son muy variadas (Mihailovic et al., 2008). Casierra-Posada y Cárdenas-Hernández (2009) investigaron el crecimiento de plantas de maíz crecidas en soluciones nutritivas con baja relación Ca + K + Mg/Al y demostraron que el área foliar, peso seco y longitud de la raíz no mostraron diferencias estadísticas entre los tratamientos con relaciones (Ca + Mg + K)/Al de 0.5 a 1.0; sin embargo, todos los tratamientos con aluminio fueron estadísticamente diferentes al testigo. Los valores de la relación raíz/vástago mostraron una tendencia inversa a la relación (Ca + Mg + K)/Al; estos resultados sugieren que la variedad de maíz estudiada fue sensible al aluminio, independientemente de si la relación bases/aluminio fuese baja o en balance.
En el caso de México, particularmente, en la región Frailesca de Chiapas, México, 40 % de los suelos son ácidos y con porcentaje de saturación de Al3+ superior al 40 % (López et al., 2016; van Nieuwkoop et al., 1994), de ahí que cobren interés las investigaciones sobre su efecto en el crecimiento del cultivo de maíz.
El objetivo de esta investigación fue determinar el efecto fisiológico de Al3+ en la germinación, el crecimiento inicial y el contenido de clorofila en plántulas de maíz. La hipótesis planteada es que plántulas de maíz crecen más y acumulan más clorofila cuando las semillas son embebidas con bajas concentraciones de aluminio.
MATERIALES Y MÉTODOS
Material vegetal y acondicionamiento de la semilla
Semillas de maíz híbrido Pioneer P4083W se mantuvieron en hipoclorito de sodio al 1 % durante 10 min, se lavaron inmediatamente con agua destilada y se secaron a temperatura ambiente de 28 °C.
Tratamientos, diseño y unidad experimental
Para establecer los tratamientos experimentales, las semillas fueron embebidas 24 h en soluciones acuosas de Al3(SO4)2 14H2O, pH 4.5, a concentraciones de 0 (agua destilada), 0.5, 1.0 y 2.0 mg L-1 de Al3+. El diseño experimental fue completamente al azar con siete repeticiones. La unidad experimental estuvo conformada por 25 semillas colocadas en contenedores de poliestireno expandido, de 21.00 × 14.03 × 2.00 cm, cubiertos con papel filtro. Las semillas se humedecieron diariamente con 25 mL de agua por cada contenedor. Los contenedores se lavaron con solución de hipoclorito de sodio al 10 % y se dispusieron al azar en mesas del Laboratorio de Ciencias del Campus Villa Corzo, de la Facultad de Ingeniería de la Universidad de Ciencias y Artes de Chiapas, México. Las condiciones en el laboratorio fueron temperatura media diurna de 28.86 ± 0.25 °C, 65.86 ± 0.38 % de humedad relativa y 7.66 ± 0.18 µmol m-2 s-1 de flujo fotónico fotosintético.
Variables de crecimiento de las plántulas
Desde el segundo día de establecido el experimento se contaron diariamente las semillas germinadas y se calculó el porcentaje de germinación (PG). A los 10 d se seleccionaron cinco plántulas al azar por cada repetición, a las cuales se determinó el área foliar por plántula (AFP) en cm2 con un medidor portátil de área foliar (CI-202 Bio-Science®, Camas, WA, EUA), se calculó el porcentaje de plántulas con hojas (PCH), el diámetro del vástago (DV) en mm a 0.5 cm de la base, la cantidad de raíces por plántula (RP), así como la masa seca de la raíz (MSR) y del vástago (MSV) en g, definida como la suma de la masa seca foliar y del tallo. Con estas dos últimas variables se calculó la relación raíz/vástago (RRV). Para determinar la masa seca se colocaron las muestras vegetales en una estufa de aire forzado a 80 °C hasta peso constante y pesadas en una balanza analítica (Sartorius®, Bohemia, NY, EUA).
Contenido de clorofila
El contenido de clorofila total (a + b) se determinó con un medidor portátil de contenido de clorofila (MC-100, Apogee Instruments®, Logan, Utah, EUA) en las cinco plantas seleccionadas para el análisis del crecimiento. Los valores de clorofilas se expresaron en µmol cm-2 de área foliar.
Análisis estadístico
Los datos se sometieron a análisis de varianza de una sola vía, previa comparación de los supuestos de normalidad y homogeneidad de varianza. Las diferencias entre las medias se determinaron con la prueba de Tukey (P ≤ 0.05). Se realizaron análisis de regresión (P ≤ 0.05) para determinar las concentraciones máximas de Al3+ a partir de las cuales se inhibe la síntesis de clorofilas y el crecimiento inicial de las plántulas.
RESULTADOS Y DISCUSIÓN
Crecimiento de raíces, tallos y hojas
Concentraciones de aluminio superiores a 0.5 mg L-1 redujeron la germinación. Se registró 12.8 % de imbibición en el tratamiento con 1.0 mg L-1 en relación con el testigo (Figura 1). No se observaron diferencias entre el tratamiento testigo y las concentraciones de 0, 0.5 y 1.0 mg L-1 Al3+. Los resultados coincidieron con los de Casierra-Posada et al. (2008), quienes encontraron que en variedades de trigo (Triticum aestivum) y maíz se observaron reducciones significativas de la germinación a concentraciones de aluminio de 0.5 a 2.0 mg L-1. Estos autores mostraron que las reducciones en la germinación de semillas de maíz y trigo dependen de las variedades utilizadas y que se afectó más la germinación en trigo que en maíz.
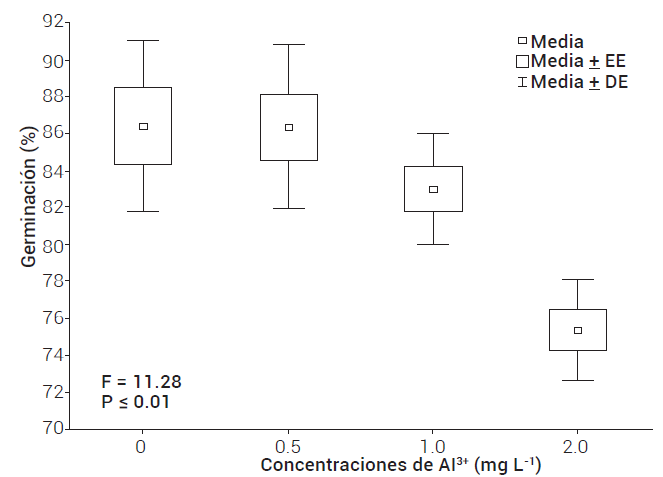
Figura 1 Efecto de concentraciones de aluminio sobre la germinación de semillas de maíz. EE: error estándar; DE: desviación estándar.
Iqbal y Shafiq (2003) reportaron reducciones significativas de la germinación de semillas de trigo cv. Blue Silver y Faisalabad 85 a concentraciones de 20 y 25 mg L-1 de Al3+, respectivamente, lo cual indica que el efecto del Al+3 no sólo depende de las concentraciones de Al, sino de la variedad estudiada, y lo atribuyeron a la acelerada degradación de las reservas alimenticias almacenadas en las semillas (Baccouch et al., 2001; Pandey y Sharma, 2002).
La cantidad de raíces por planta fue mayor en los tratamientos con Al+3 que en el testigo; a partir de 0.5 mg L-1 de Al3+ se duplicó la cantidad de raíces (Figura 2A). Al respecto, Nasr (2013) demostró que el tratamiento con aluminio de 50 a 200 mg L-1 afectó la longitud de la raíz de plantas de maíz. Liu et al. (1993) encontraron efectos variables de Al3+ en el crecimiento radicular de Allium sativum L., la tasa de crecimiento de las raíces disminuyó con concentraciones de Al3+ de 10-3 M, y a mayores concentraciones (10-2 10-1 M de Al3+) el efecto inhibidor fue severo y las raíces no crecieron en las primeras 24 h, lo cual se relacionó con las afectaciones del índice mitótico, el cual mide la frecuencia de la división celular y se considera como un parámetro importante para evaluar la tasa de crecimiento de las raíces (Liu et al., 1993).

Figura 2 A) Efecto del aluminio sobre la cantidad de raíces, B) altura de la planta, C) diámetro del tallo y D) área foliar de plantulas de maíz. EE: error estándar, DE: desviación estándar.
La altura de plántula (Figura 2B) y el diámetro del tallo (Figura 2C) fueron significativamente mayores (P ≤ 0.01) en los tratamientos con 1.0 y 2.0 mg L-1 de Al3+. En la altura de la planta no se observaron diferencias significativas entre los tratamientos con 1.0 y 2.0 mg L-1 de Al3+, pero sí con el tratamiento testigo y con el de 0.5 mg L-1. Los resultados fueron similares a los de Nhan y Hai (2013) en plantas de arroz (Oryza sativa), quienes observaron aumento del 35 % en la altura de los brotes en las plantas expuestas a 400 μM de Al durante 8 d.
El diámetro del tallo de las plántulas no se modificó en los tratamientos testigo y 0.5 mg L-1; los mayores valores se observaron a concentraciones de 1.0 y 2.0 mg L-1 de Al3+. El área foliar de las plántulas (Figura 2D) fue mayor a concentraciones de 0.5 y 1.0 mg L-1, para luego disminuir significativamente en el tratamiento de 2.0 mg L-1 de Al3+, sin diferencias significativas con el tratamiento testigo.
El análisis de regresión entre el área foliar y las concentraciones de Al3+ corroboró una respuesta a un máximo de crecimiento a la concentración de 1.2 mg L-1 de Al3+, por encima del cual se inhibió el crecimiento foliar. Resultados similares se observaron en el porcentaje de plantas con hojas, con máximo a 1.1 mg L-1 de Al3+, lo cual demuestra que la emisión de hojas y el crecimiento foliar se inhiben a concentraciones de aluminio superiores a 1.1-1.2 mg L-1. Esta respuesta de las plántulas de maíz a las bajas concentraciones de aluminio se debe, según Carreño y Chaparro-Giraldo (2013), a la estimulación de reacciones de defensa de la planta ante la presencia de aluminio, que llevan a la activación general del metabolismo.
Los resultados del presente estudio son similares a los de Casierra-Posada y Cárdenas-Hernández (2009), quienes encontraron que en maíz la proporción de aluminio con respecto a las bases en la solución nutritiva redujo el área foliar en proporciones que oscilaron entre 38.6, 39,1 y 41.7 % para las relaciones (Ca + Mg + K)/Al. En plantas de abedul (Betuna pendula), concentraciones menores de 5 ppm de Al incrementaron significativamente la expansión foliar, concentraciones mayores de 25 ppm provocaron un efecto contrario en las hojas (Kidd y Proctor, 2000). Symeonidis et al. (2004) observaron disminución estadísticamente significativa en el área foliar, equivalente a 52 % en plantas de melón (Cucumis melo) expuestas a Al+3, en comparación con plantas testigo sin la presencia del elemento, lo cual, como lo afirman Casierra-Posada et al. (2008), es un índice de la toxicidad producida como consecuencia de la liberación de los protones en presencia de Al+3 (Andersson y Brunet, 1993; Kinraide, 1993; 1997; Llugany et al., 1995).
Acumulación de biomasa
La acumulación de biomasa en hojas y tallos (Figura 3A) incrementó con la concentración de Al3+; sin embargo, no se observaron diferencias significativas entre los tratamientos con las mayores concentraciones, ni entre el testigo y el tratamiento de 0.5 mg L-1.

Figura 3 Efecto de concentraciones de aluminio sobre la acumulación de biomasa en plántulas de maíz. A) hoja y tallo, B) raíz, C) tallo/raíz.
La biomasa seca de las raíces fue significativamente mayor en los tratamientos testigo y 0.5 mg L-1, sin diferencias entre ellos, pero sí con los tratamientos de 1.0 y 2.0 mg L-1 de Al3+. Estas evidencias corroboran que la acumulación de biomasa en la raíz es sensible al efecto tóxico del aluminio, como consecuencia de la alteración de la arquitectura de la raíz y la interrupción de los procesos que influyen en el crecimiento radicular (Pilon-Smits et al., 2009), aunque el mayor número de raíces por planta observado en el tratamiento de 2.0 mg L-1 de Al3+ indica que más que la formación de raíces, el aluminio provocó afectaciones en el crecimiento, tal como lo indicaron Chico et al. (2016)), quienes observaron que en plantas de frijol (Phaseolus vulgaris) el crecimiento relativo de la raíz se redujo con la concentración de 100 μM de aluminio y las raíces secundarias y las auxiliares nuevas fueron las más afectadas, las cuales comenzaron a crecer en mayor número, pero no fueron capaces de desarrollar de manera notoria (Figura 3).
El efecto inhibitorio del crecimiento de la raíz se evidenció mediante la relación de peso seco raíz/tallo (Figura 3B). Se observó una disminución significativa (P ≤ 0.01) de la relación raíz/tallo en los tratamientos con 1.0 y 2.0 mg L-1, y con diferencias significativas entre éstos y los tratamientos testigo y 0.5 mg L-1 de Al3+, lo cual corrobora la sensibilidad de este órgano a la presencia de Al3+, tal como ha sido reportada por diversos autores.
Contenido de clorofilas
El mayor contenido de ambos tipos de clorofila se registró en el tratamiento con 0.5 mg L-1 Al3+, sin diferencias significativas con los tratamientos con 1.0 y 2.0 mg L-1 Al3+ y el menor valor se registró en el tratamiento testigo, este último con diferencias significativas con el resto de los tratamientos (Cuadro 1). Al respecto, Moreno-Alvarado et al. (2017) reportaron que los contenidos de clorofila a, b y total en plantas de arroz incrementaron como consecuencia de la aplicación de bajas concentraciones de Al.
Cuadro 1 Efecto de concentraciones de Al en el contenido de clorofilas a + b en plantas de maíz.
| Tratamientos de Al3+ (mg L-1) | Contenido de clorofilas a + b (µmol cm-2)† |
|---|---|
| 0 | 0.016 b |
| 0.5 | 0.019 a |
| 1.0 | 0.018 a |
| 2.0 | 0.018 a |
| DSH (0.05) | 0.0018 |
†Letras iguales indican ausencia de diferencias significativas (Tukey, P ≤ 0.05).
En plantas de té (Camellia sinensis), Hajiboland et al. (2013) reportaron que la aplicación de 300 μM de Al estimuló la biosíntesis de clorofila en las hojas jóvenes, pero no en las hojas maduras. Moreno-Alvarado et al. (2017) demostraron que las concentraciones de clorofila aumentaron en hojas jóvenes de las variedades de arroz Cotaxtla, Huimanguillo y Temporalero tratadas con Al; estos resultados coinciden con los reportados por Nhan y Hai (2013) en plantas de arroz cultivar OM4900, ya que tanto la clorofila a como la b fueron significativamente más altas en las plantas tratadas con 200, 300, 400 y 500 μM de AlCl3, en comparación con el testigo.
Las variables respuesta que caracterizan el crecimiento foliar y el contenido de clorofilas a + b en función de las concentraciones de Al3+ estudiadas se ajustaron a ecuaciones de regresión polinómicas de segundo grado (Cuadro 2). Los coeficientes de determinación oscilaron entre 0.45 y 0.97 en todas las variables, mayores para el área foliar y porcentaje de plantas con hojas verdaderas.
Cuadro 2 Análisis de regresión entre las variables de crecimiento, contenido de clorofilas a + b y las concentraciones de aluminio y valores máximos de Al3+ en plántulas de maíz.
| Variable | Parámetros del modelo | r | R2 | Valores máximos de Al3+ | ||
|---|---|---|---|---|---|---|
| a | b | c | ||||
| Raíces por planta | 4.66 | 7.54 | -2.47 | 0.97 | 0.94 | 1.5 |
| Plantas con hojas (%) | 29.75 | 47.18 | -21.42 | 0.90 | 0.80 | 1.10 |
| Área foliar por planta (cm2) | 9.07 | 11.50 | -4.79 | 0.98 | 0.97 | 1.20 |
| Contenido de clorofilas a + b (μmol cm-2) | 0.017 | 0.0026 | -0.0011 | 0.74 | 0.54 | 1.18 |
| Masa seca de la planta (g) | 0.268 | 0.0047 | -0.0047 | 0.69 | 0.45 | 0.50 |
Las concentraciones de Al3+ por encima de las cuales se afecta la emisión de hojas y el área foliar oscilaron entre 1.10 y 1.20 mg L-1 de Al3+, similar al máximo detectado para el contenido de clorofilas (1.18 mg L-1). La materia seca de la planta resultó ser un indicador más sensible al Al3+, reflejado en la baja concentración detectada como inhibitoria para el cultivo del maíz, al menos en la fase de crecimiento temprano (Cuadro 2).
Trejo-Téllez y Gómez-Merino (2007) reportaron que concentraciones de aluminio en el medio nutritivo superiores a 50 µM redujeron la cantidad de hojas emitidas en plantas de tabaco (Nicotiana tabacum L.). Estos autores encontraron que en las plantas tratadas con la solución nutritiva con 100 mM de Al registraron decremento en el área foliar, altura de planta y peso fresco del orden de 4, 13 y 27 %, respectivamente, en comparación con las plantas del tratamiento testigo.
CONCLUSIONES
La respuesta de las plántulas de maíz al aluminio en las fases tempranas de crecimiento es diferente en función de los órganos de la planta estudiados. La germinación y la acumulación de biomasa en las raíces fueron más sensibles al Al3+. Concentraciones superiores a 1.0 mg L-1 inhibieron la formación de hojas y la expansión del área foliar. La síntesis de clorofilas se inhibió con concentraciones superiores a 1.18 mg L-1 de aluminio.











 text new page (beta)
text new page (beta)


