INTRODUCCIÓN
El cacao (Theobroma cacao L.) en México se cultiva en una superficie de 59,594 ha, distribuidas en los estados de Tabasco, Chiapas y Guerrero con 40,913, 18,426 y 255 ha, respectivamente (SIAP, 2019). Este cultivo enfrenta diversos problemas provocados principalmente por la edad avanzada de las plantaciones y la presencia de enfermedades como la moniliasis, que afectan directamente la producción nacional (Gardea et al., 2017). Dada la problemática que enfrenta el cultivo, es necesario continuar con acciones de control, dentro de los cuales el control genético es una de las vías para hacer frente a esta enfermedad; por tanto, se debe apoyar a los programas de mejoramiento genético con herramientas que permitan seleccionar, en poco tiempo, materiales resistentes a esta enfermedad. La aplicación de herramientas biotecnológicas como los marcadores moleculares en los procesos de selección constituyen una alternativa eficaz para este fin (Nadeem et al., 2018).
Los marcadores moleculares aplicados en T. cacao se han enfocado a reducir la redundancia y datos mal etiquetados en bancos de germoplasma, evaluar la diversidad genética de colecciones ex situ en bancos de germoplasma y en plantaciones productivas, obtener información genealógica y la generación de mapas de ligamiento para la obtención de loci de caracteres cuantitativos (QTLs por sus siglas en inglés) (Monteiro et al., 2009).
El polimorfismo amplificado de secuencias relacionadas (SRAP), basado en la amplificación de marcos de lectura abiertos (ORFs) podría apoyar a los programas de mejoramiento genético para la diferenciación de materiales que sobresalen por su resistencia a enfermedades y por su buena calidad de grano. Algunas ventajas que presenta esta técnica es que es multilocus y de características multialélicas, altamente rentable y no es específica para una especie (Li y Quiros, 2001). La aplicación de los marcadores SRAP se ha ampliado a un gran número de géneros y especies vegetales, desde su introducción en 2001. Los estudios abarcan temas como análisis de la diversidad poblacional a nivel intra e interespecífica, hibridación, biogeografía, genética de la conservación y ecología (Robarts y Wolfe, 2014).
Los marcadores ITAP amplifican regiones de intrones y de secuencias de empalme intrón-exón. El principio de esta técnica se basa en los SRAP, el polimorfismo amplificado de regiones dirigidas (TRAP) y el polimorfismo amplificado de regiones conservadas (CoRAP). Los intrones son secuencias no codificantes que pertenecen a los genes y están intercaladas a lo largo del genoma. Los intrones son más variables y adecuados para el desarrollo de marcadores de ADN, en comparación con los exones. El polimorfismo revelado por esta técnica puede atribuirse a la variabilidad en la longitud de los intrones y a mutaciones puntuales en los sitios de unión de los iniciadores ITAP (Xiong et al., 2013).
Los marcadores más utilizados en Theobroma cacao incluyen RFLP, RAPD, AFLP y microsatélites (SSR). Éstos presentan algunas desventajas tales como baja estabilidad y reproducibilidad, observada generalmente en los marcadores RAPD, mientras que los AFLPs son costosos y laboriosos, y la principal desventaja de estos dos marcadores, así como de los SSRs, es que los alelos que se generan tienen alta probabilidad de estar distantes de genes de interés (Xiong et al., 2013), desventajas que son superadas por los marcadores SRAP e ITAP, debido a que amplifican regiones de marcos de lectura abiertos, exones e intrones, e incrementan la posibilidad de generar bandas relacionadas con regiones génicas.
Los iniciadores SRAP constan de 17 o 18 nucleótidos de longitud, los cuales consisten de una secuencia núcleo, con una longitud de 13 a 14 bases, donde los primeros 10 u 11 nucleótidos a partir del extremo 5’ son de constitución no específica (secuencia de relleno), seguida por la secuencia constante CCGG en el iniciador sentido, secuencia que reconoce regiones ricas de GC presentes en exones y marcos de lectura abiertos y AATT en el iniciador anti-sentido, secuencia que reconoce regiones ricas en AT, comunes en intrones y promotores. La secuencia núcleo está seguida por tres nucleótidos selectivos en el extremo 3’. La variación en estos tres nucleótidos selectivos genera un conjunto de iniciadores que comparten la misma secuencia núcleo; asimismo, las secuencias de relleno del iniciador sentido y anti-sentido deben ser diferentes una de otra (Li y Quiros, 2001).
Por su parte, los iniciadores en sentido de ITAP consisten de 18 nucleótidos, con un núcleo que contiene una secuencia ACCTGCA en anti-sentido en el extremo 3’, complementaria a la secuencia conservada TGCAGGT, común en regiones de empalme intrón-exón; en tanto que utiliza el iniciador anti-sentido del marcador SRAP, descrito anteriormente, el cual reconoce intrones y promotores (Xiong et al., 2013). Debido a que los exones, marcos de lectura abiertos, intrones y sitios de empalme exón-intrón (región codificante y no codificante), son variables entre diferentes individuos, la diferencia intrínseca entre ellos hace factible la generación de bandas polimórficas, por lo que, el desarrollo de este tipo de marcadores en cacao es altamente deseable para la detección de secuencias relacionadas con características de resistencia a moniliasis y de calidad de grano, como apoyo a los programas de mejoramiento genético.
Por otro lado, durante el diseño de los iniciadores sentido y anti-sentido de los marcadores SRAP e ITAP es necesario evaluar y seleccionar únicamente aquellos que sean altamente informativos; es decir, que sean capaces de detectar la mínima variación en la población de estudio, lo cual está relacionado con su capacidad de detectar el mayor nivel de polimorfismo, contenido de información polimórfica y poder de resolución (Prevost y Wilkinson, 1999; Roldán-Ruiz et al., 2000). Por lo anterior, el objetivo de este estudio fue seleccionar iniciadores SRAP e ITAP altamente informativos para caracterización molecular de genotipos de T. cacao L. y especies relacionadas al género.
MATERIALES Y MÉTODOS
Material vegetal
Para la selección de iniciadores se utilizaron diferentes tipos genéticos de T. cacao, Forasteros (PMCT 58, CATIE R1 y CATIE R6), Trinitario (Carmelo) y Criollo (Lagarto), y para la validación de los iniciadores seleccionados se utilizaron como Forasteros PMCT 58, UF-273 y PA-169, como Trinitarios Carmelo y RIM-117 y como Criollo Lagarto, además de las especies T. mammosum, T. bicolor, T. angustifolium y la especie Herrania sp., que pertenece a un taxón diferente.
Extracción de ADN
Para la extracción de ADN se emplearon 100 mg de hojas jóvenes de los tipos genéticos de T. cacao y de las otras especies de Theobroma, establecidos en el banco de germoplasma del Campo Experimental Rosario Izapa del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (CERI-INIFAP),. éstas fueron desinfestadas por inmersión en cloro comercial [Cloralex® 6 % de NaClO (v/v)] durante 30 s, alcohol 70 % (v/v) por 30 s y un enjuague con agua, posteriormente, fueron procesadas para la extracción de ADN con el protocolo descrito por Youssef et al. (2015). Se estimó la concentración de ADN por espectrofotometría. La concentración de ADN fue ajustada a 25 ng µL-1. Se verificó la integridad y la pureza del ADN mediante electroforesis en geles de agarosa 1 %.
Condiciones de PCR
La reacción de amplificación se llevó a cabo en un termociclador de gradiente bajo las condiciones siguientes: desnaturalización a 94 ºC durante 2 min (1 ciclo), pre-amplificación con cinco ciclos de 94 ºC por 30 o , 94 ºC durante 30s y 50 ºC durante 1min, seguido de 35 ciclos a 94 ºC durante 30 s, alineamiento a 50 ºC durante 30 s y extensión a 72 ºC durante 1 min, seguido de una extensión final durante ٥ min a 72 ºC.
Cada tubo de reacción contenía 1.25 ng µL-1 del ADN molde genómico, 1X amortiguador de PCR, 0.25 mM dNTPs, 2 mM MgCl2, 0.8 pmol de iniciador en sentido y reverso (Me y Em, para SRAP, e Itpr y Em para ITAP, respectivamente), 0.06 U µL-1 Taq DNA-polimerasa y 12.25 μL de agua libre de nucleasas para completar un volumen final de 20 µL. Se evaluó un total de 43 combinaciones de pares de iniciadores SRAP de acuerdo con lo descrito por Li y Quiros (2001) y 51 combinaciones de pares de iniciadores ITAP (Xiong et al., 2013). Los productos de amplificación se analizaron por electroforesis en geles de agarosa 1.8 %, de acuerdo con lo descrito por López-Gómez et al. (2017) usando como referencia la escalera molecular Thermo Scientific GenRuler 100 bp Plus DNA Ladder.
Análisis de datos
Para el análisis de los datos y evaluación del nivel de polimorfismo las bandas SRAP e ITAP de igual tamaño y movilidad generadas por la misma combinación para los genotipos evaluados se trataron como idénticas para ese locus; se registró la ausencia (0) o presencia (1) de bandas para cada locus, y se generó una matriz binaria con la información generada con todos los iniciadores. Esta matriz se analizó con el programa NTSYS-PC versión 2.21t (Rohlf, 2009) para calcular la similitud genética con el coeficiente de Jaccard. Los valores de similitud de Jaccard obtenidos se utilizaron para generar un dendrograma mediante el procedimiento UPGMA (Unweighted Pair-Group Method with Arithmetic Mean), el cual se sustentó con un bootstraping de 1000 repeticiones con el programa FreeTree (Hampl et al., 2001).
Con la matriz binaria se calculó el contenido de información polimórfica (PIC) de acuerdo con la siguiente fórmula:
donde: fi es la frecuencia con la que están presentes los fragmentos del marcador.
Por otro lado, se calculó el poder de resolución (RP) con la fórmula:
donde: Ib = 1 - [2 |0.5 - p|] y p es la proporción de accesiones que contienen una banda I (Prevost y Wilkinson, 1999; Roldán-Ruiz et al., 2000).
RESULTADOS Y DISCUSIÓN
Al momento de la revisión de literatura, este estudio representa el primero en el que se utilizan los marcadores SRAP e ITAP para el análisis de genotipos de cacao y especies relacionadas al género Theobroma.
Selección de iniciadores SRAP e ITAP
En el Cuadro 1 se presentan los resultados obtenidos en relación con el número total de bandas amplificadas, número de bandas polimórficas, porcentaje de polimorfismo, contenido de información polimórfica y poder de resolución de 43 combinaciones de pares de iniciadores SRAP y 51 combinaciones de pares de iniciadores ITAP, en la comparación de las huellas genéticas de los genotipos Carmelo, Lagarto, PMCT 58, CATIE R1 y CATIE R6 de cacao.
Cuadro 1 Número total de bandas (NTB), número de bandas polimórficas (NBP), porcentaje de polimorfismo (P), contenido de información polimórfica (PIC) y poder de resolución (RP) con combinaciones SRAP e ITAP en cinco genotipos de cacao.
| Combinación SRAP | NTB | NBP | P (%) | PIC | RP | Combinación ITAP | NTB | NBP | P (%) | PIC | RP |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Me1/Em7 | 12 | 6 | 50 | 0.22 | 4.4 | Itpr1/Em1 | 18 | 9 | 50 | 0.16 | 4.4 |
| Me3/Em3 | 7 | 1 | 14 | 0.04 | 0.4 | Itpr1/Em2 | 13 | 8 | 62 | 0.25 | 5.2 |
| Me4/Em7 | 5 | 2 | 40 | 0.12 | 0.8 | Itpr1/Em3 | 16 | 9 | 56 | 0.21 | 5.2 |
| Me1/Em2 | 9 | 2 | 22 | 0.07 | 0.8 | Itpr1/Em4 | 15 | 13 | 87 | 0.34 | 7.6 |
| Me1/Em3 | 10 | 6 | 60 | 0.22 | 3.2 | Itpr1/Em5 | 20 | 11 | 55 | 0.2 | 5.6 |
| Me1/Em5 | 10 | 4 | 40 | 0.16 | 2.4 | Itpr1/Em6 | 19 | 10 | 53 | 0.18 | 5.2 |
| Me1/Em10 | 6 | 0 | 0 | 0 | 0 | Itpr1/Em7 | 12 | 7 | 58 | 0.21 | 3.6 |
| Me1/Em11 | 5 | 2 | 40 | 0.19 | 1.6 | Itpr1/Em8 | 15 | 6 | 40 | 0.17 | 4 |
| Me2/Em4 | 4 | 2 | 50 | 0.24 | 1.6 | Itpr1/Em9 | 18 | 10 | 56 | 0.21 | 5.6 |
| Me3/Em8 | 11 | 4 | 36 | 0.13 | 2.0 | Itpr1/Em10 | 16 | 11 | 69 | 0.28 | 6.8 |
| Me3/Em10 | 5 | 3 | 60 | 0.28 | 2.4 | Itpr1/Em11 | 19 | 9 | 47 | 0.17 | 4.8 |
| Me3/Em11 | 7 | 5 | 71 | 0.27 | 2.8 | Itpr2/Em1 | 17 | 13 | 76 | 0.3 | 7.6 |
| Me4/Em4 | 8 | 7 | 87 | 0.34 | 4.0 | Itpr2/Em2 | 20 | 14 | 70 | 0.26 | 7.6 |
| Me5/Em3 | 6 | 5 | 83 | 0.35 | 3.5 | Itpr2/Em3 | 28 | 23 | 82 | 0.34 | 15.2 |
| Me5/Em5 | 7 | 2 | 28 | 0.09 | 0.8 | Itpr2/Em4 | 23 | 13 | 57 | 0.13 | 4.4 |
| Me5/Em6 | 9 | 5 | 55 | 0.21 | 2.8 | Itpr2/Em5 | 23 | 18 | 78 | 0.29 | 9.6 |
| Me5/Em10 | 7 | 5 | 71 | 0.29 | 3.2 | Itpr2/Em6 | 17 | 4 | 24 | 0.1 | 2.8 |
| Me5/Em11 | 6 | 0 | 0 | 0 | 0 | Itpr2/Em7 | 11 | 4 | 36 | 0.16 | 2.8 |
| Me6/Em2 | 4 | 2 | 50 | 0.22 | 1.3 | Itpr2/Em8 | 16 | 9 | 56 | 0.21 | 4.8 |
| Me6/Em3 | 4 | 3 | 75 | 0.36 | 2.4 | Itpr2/Em9 | 14 | 7 | 50 | 0.16 | 2.8 |
| Me6/Em4 | 4 | 0 | 0 | 0 | 0 | Itpr2/Em10 | 17 | 7 | 41 | 0.16 | 4.4 |
| Me6/Em6 | 9 | 5 | 55 | 0.17 | 2.0 | Itpr2/Em11 | 18 | 11 | 61 | 0.23 | 6 |
| Me6/Em7 | 10 | 6 | 60 | 0.20 | 2.8 | Itpr3/Em1 | 17 | 13 | 76 | 0.33 | 9.2 |
| Me7/Em1 | 7 | 2 | 28 | 0.14 | 2.0 | Itpr3/Em2 | 16 | 9 | 56 | 0.23 | 5.6 |
| Me7/Em3 | 6 | 3 | 50 | 0.18 | 1.5 | Itpr3/Em3 | 18 | 18 | 100 | 0.4 | 10.8 |
| Me7/Em8 | 4 | 3 | 75 | 0.32 | 2.0 | Itpr3/Em4 | 15 | 13 | 87 | 0.32 | 6.8 |
| Me7/Em10 | 5 | 4 | 80 | 0.28 | 2.0 | Itpr3/Em5 | 22 | 21 | 95 | 0.4 | 14 |
| Me8/Em1 | 5 | 0 | 0 | 0 | 0 | Itpr3/Em6 | 22 | 20 | 91 | 0.38 | 12 |
| Me8/Em3 | 6 | 5 | 83 | 0.29 | 2.4 | Itpr3/Em7 | 15 | 15 | 100 | 0.39 | 8.8 |
| Me8/Em4 | 10 | 6 | 60 | 0.20 | 2.8 | Itpr3/Em8 | 18 | 17 | 94 | 0.4 | 11.6 |
| Me9/Em8 | 8 | 1 | 12 | 0.04 | 0.4 | Itpr3/Em9 | 17 | 16 | 94 | 0.38 | 10 |
| Me9/Em9 | 8 | 4 | 50 | 0.20 | 2.4 | Itpr3/Em10 | 15 | 15 | 100 | 0.37 | 8 |
| Me10/Em1 | 10 | 7 | 70 | 0.27 | 4.0 | Itpr3/Em11 | 27 | 20 | 74 | 0.3 | 12.8 |
| Me10/Em7 | 10 | 7 | 70 | 0.25 | 3.6 | Itpr4/Em1 | 14 | 14 | 100 | 0.46 | 10.8 |
| Me10/Em8 | 4 | 0 | 0 | 0 | 0 | Itpr4/Em2 | 16 | 9 | 56 | 0.26 | 6.8 |
| Me10/Em10 | 15 | 6 | 40 | 0.16 | 3.6 | Itpr4/Em3 | 20 | 19 | 95 | 0.35 | 8.8 |
| Me11/Em8 | 9 | 4 | 44 | 0.19 | 2.8 | Itpr4/Em8 | 20 | 11 | 55 | 0.22 | 6.8 |
| Me11/Em10 | 11 | 8 | 72 | 0.27 | 4.4 | Itpr4/Em9 | 23 | 15 | 65 | 0.24 | 8 |
| Me11/Em11 | 4 | 2 | 50 | 0.20 | 1.2 | Itpr4/Em10 | 18 | 15 | 83 | 0.36 | 10.4 |
| Me14/Em2 | 9 | 1 | 11 | 0.05 | 1.0 | Itpr4/Em11 | 20 | 11 | 55 | 0.21 | 6.4 |
| Me14/Em4 | 5 | 2 | 40 | 0.12 | 0.8 | Itpr5/Em1 | 20 | 16 | 80 | 0.33 | 10.4 |
| Me14/Em8 | 8 | 1 | 12 | 0.04 | 0.4 | Itpr5/Em2 | 18 | 8 | 44 | 0.16 | 4.4 |
| Me14/Em10 | 3 | 0 | 0 | 0 | 0 | Itpr5/Em3 | 21 | 7 | 33 | 0.12 | 4 |
| Itpr5/Em4 | 20 | 12 | 60 | 0.24 | 7.2 | ||||||
| Itpr5/Em5 | 18 | 17 | 94 | 0.33 | 7.6 | ||||||
| Itpr5/Em6 | 19 | 11 | 58 | 0.23 | 6.8 | ||||||
| Itpr5/Em7 | 19 | 10 | 53 | 0.2 | 5.6 | ||||||
| Itpr5/Em8 | 17 | 12 | 71 | 0.29 | 7.6 | ||||||
| Itpr5/Em9 | 23 | 23 | 100 | 0.41 | 14.4 | ||||||
| Itpr5/Em10 | 22 | 20 | 91 | 0.37 | 12 | ||||||
| Itpr5/Em11 | 16 | 16 | 100 | 0.28 | 8.8 | ||||||
| Total | 312 | 143 | 931 | 649 | |||||||
| Promedio | 7.2 | 3.3 | 44.2 | 0.17 | 1.92 | 18.3 | 12.7 | 69 | 0.27 | 7.5 |
Para los marcadores SRAP, el número total de bandas por combinación de iniciadores fue de 3 a 15, con un promedio de 7.2 y un total de 312; de éstos, el número de bandas polimórficas fue de 0 a 8, con un promedio de 3.3 y un total de 143. El porcentaje de polimorfismo varió desde 0 hasta 87.5 %, con un promedio de 44.2 %. El contenido de información polimórfica varió de 0 a 0.36, mientras que el poder de resolución fue desde 0 hasta 4.4.
Por su parte, los marcadores ITAP generaron de 11 a 28 bandas por par de iniciadores combinados, con un total de 931 bandas. Las bandas polimórficas fueron de 4 a 23, con un total de 649. Lo anterior permitió detectar porcentajes de polimorfismo de 24 a 100 %, con un promedio de 69 %, mayor al detectado por los marcadores SRAP evaluados (44.2 %), en tanto que los valores de contenido de información polimórfica oscilaron entre 0.1 y 0.46, mientras que el poder de resolución de los marcadores ITAP fue de 2.8 a 15.2. Este tipo de marcadores fue empleado por Xiong et al. (2013) para analizar variedades de plátano (Musa sp.), accesiones de ojo de dragón (Dimocarpus longan Lour) y cacahuate cultivado (Arachis hypogaea), y detectaron porcentajes de polimorfismo de 32, 42 y 53 %, respectivamente. Recientemente, este marcador fue utilizado para el estudio de variación somaclonal en plantas micropropagadas de Musa acuminata × Musa balbisiana cv. Manzano (AAB) y se detectó 13.7 % de polimorfismo (López-Gómez et al., 2017).
El genotipo más distante genéticamente fue PMCT 58, con similitudes de 0.62 a 0.65 con SRAP y de 0.48 a 0.55 con ITAP, con respecto a los genotipos Carmelo, Lagarto, CATIE R1 y CATIE R6, mientras que los más cercanos fueron los genotipos CATIE R1 y CATIE R6, con una similitud genética de 0.96 y 0.73 con SRAP e ITAP, respectivamente; en tanto que, el genotipo de cacao Criollo representado por Lagarto con Carmelo (Trinitario) mostraron una similitud de 0.82 con SRAP y 0.57 con ITAP (Cuadro 2). Lo anterior puede atribuirse a que los genotipos del CATIE son híbridos provenientes de la cruza entre UF-273 × CATIE1000 para CATIE R1 y UF-273 × PA-169 para CATIE R6.
Cuadro 2 Matriz del coeficiente de similitud (debajo de la diagonal) disimilitud (encima de la diagonal) de Jaccard entre genotipos de cacao revelados con marcadores SRAP/ITAP.
| PMCT 58 | Lagarto | Carmelo | CATIE R6 | CATIE R1 | |
|---|---|---|---|---|---|
| PMCT 58 | 0.35/0.45 | 0.38/0.48 | 0.38/0.52 | 0.37/0.49 | |
| Lagarto | 0.65/0.55 | 0.18/0.43 | 0.24/0.51 | 0.23/0.48 | |
| Carmelo | 0.62/0.52 | 0.82/0.57 | 0.12/0.31 | 0.12/0.28 | |
| CATIE R6 | 0.62/0.48 | 0.76/0.49 | 0.88/0.69 | 0.04/0.27 | |
| CATIE R1 | 0.63/0.51 | 0.77/0.52 | 0.88/0.72 | 0.96/0.73 |
En la Figura 1A se muestra el patrón electroforético generado al utilizar la combinación de iniciadores Me8/Em4 de SRAP e Itpr5/Em1 de ITAP, en el que se observan distintas bandas polimórficas. En la Figura 1B se puede observar la relación genética existente entre los genotipos de cacao evaluados, con el uso de ambos tipos de marcadores. Los marcadores SRAP e ITAP son adecuados para la caracterización de genotipos de cacao, ya que permiten distinguir entre genotipos Criollos (Lagarto), Trinitarios (Carmelo) y Forasteros (PMCT 58, CATIE R1 y CATIE R6). La similitud observada entre los genotipos Lagarto y Carmelo puede atribuirse a que el genotipo Carmelo, aun cuando por su morfología se considera un cacao tipo Trinitario, también se le ha ubicado como del tipo Criollo, debido a las características de la semilla (Rangel-Fajardo et al., 2012).

Figura 1 A) Patrón electroforético de la combinación de iniciadores Me8/Em4 del marcador SRAP (izquierda) e Itpr5/Em1 de ITAP (derecha) en genotipos de cacao. Las flechas indican presencia de una banda polimórfica de 600 pb con la combinación Me8/Em4 de SRAP y de 900 pb con la combinación Itpr5/Em1 de ITAP. Carril 1, marcador de peso molecular de 100 a 3000 pb y B) Dendrograma obtenido del análisis de conglomerados con el procedimiento UPGMA, con el coeficiente de Jaccard entre genotipos de cacao con 43 combinaciones de iniciadores de SRAP y 55 de ITAP. Los números en cada agrupamiento indican la significancia mediante Bootstrap con 1000 repeticiones.
En el Cuadro 3 se presentan las secuencias de las combinaciones de iniciadores SRAP e ITAP que mostraron mayor capacidad para la detección de polimorfismo entre genotipos de cacao. El porcentaje de detección de polimorfismo de las combinaciones seleccionadas fue desde 50 hasta 87.5 %. Dentro de estas combinaciones de iniciadores se encuentra Me1/Em7, la cual generó 12 bandas, y de éstas seis fueron polimórficas. El porcentaje de polimorfismo que esta combinación presentó fue de 50 %, un PIC de 0.22 y un RP de 4.4, los más altos observados en este estudio. Esta combinación también ha sido sugerida por López-Gómez et al. (2017) para detectar polimorfismo entre plantas de plátano propagadas in vitro. Por su parte, Muniswamy et al. (2017) reportaron esta misma combinación por su capacidad para detectar polimorfismo en plántulas micropropagadas de Coffea canephora. Estos mismos autores reportaron la combinación Me3/Em11, la cual en el presente estudio generó siete bandas, cinco de ellas fueron polimórficas, con 71.43 % de polimorfismo, 0.27 de PIC y 2.8 de RP (Cuadro 1).
Cuadro 3 Pares de iniciadores SRAP e ITAP seleccionados para la caracterización molecular de cacao.
| Combinación SRAP | Secuencia sentido | Secuencia antisentido |
|---|---|---|
| Me1/Em7 | 5’-TGAGTCCAAACCGGATA-3’ | 5’- GACTGCGTACGAATTATG-3’ |
| Me4/Em4 | 5′-TGAGTCCAAACCGGACC-3′ | 5′-GACTGCGTACGAATTTGA-3’ |
| Me5/Em3 | 5′-TGAGTCCAAACCGGAAG-3′ | 5’-GACTGCGTACGAATTGAC-3’ |
| Me5/Em10 | 5′-TGAGTCCAAACCGGAAG-3′ | 5’-GACTGCGTACGAATTTAG-3’ |
| Me6/Em7 | 5’-TGAGTCCAAACCGGTAG-3’ | 5’- GACTGCGTACGAATTATG-3’ |
| Me8/Em4 | 5’-TGAGTCCAAACCGGTGT-3’ | 5′-GACTGCGTACGAATTTGA-3’ |
| Me10/Em1 | 5’-TGAGTCCAAACCGGTAC-3’ | 5′-GACTGCGTACGAATTAAT-3′ |
| Me10/Em7 | 5’-TGAGTCCAAACCGGTAC-3’ | 5’- GACTGCGTACGAATTATG-3’ |
| Me3/Em11 | 5′-TGAGTCCAAACCGGAAT-3′ | 5′-GACTGCGTACGAATTTCC-3′ |
| Me6/Em3 | 5’-TGAGTCCAAACCGGTAG-3’ | 5’-GACTGCGTACGAATTGAC-3’ |
| Combinación ITAP | Secuencia sentido | Secuencia antisentido |
| ITPR2/Em10 | 5´-GACTGCGTACCTGCATGC-3’ | 5’-GACTGCGTACGAATTTAG-3’ |
| ITPR3/Em3 | 5´-GACTGCGTACCTGCAGAC-3’ | 5’-GACTGCGTACGAATTGAC-3’ |
| ITPR3/Em5 | 5´-GACTGCGTACCTGCAGAC-3’ | 5′-GACTGCGTACGAATTAAC-3′ |
| ITPR3/Em6 | 5´-GACTGCGTACCTGCAGAC-3’ | 5’-GACTGCGTACGAATTGCA -3’ |
| ITPR3/Em7 | 5´-GACTGCGTACCTGCAGAC-3’ | 5’- GACTGCGTACGAATTATG-3’ |
| ITPR3/Em8 | 5´-GACTGCGTACCTGCAGAC-3’ | 5’-GACTGCGTACGAATTAGC -3’ |
| ITPR3/Em9 | 5´-GACTGCGTACCTGCAGAC-3’ | 5′-GACTGCGTACGAATTACG-3′ |
| ITPR3/Em10 | 5´-GACTGCGTACCTGCAGAC-3’ | 5’-GACTGCGTACGAATTTAG-3’ |
| ITPR4/Em1 | 5´-GACTGCGTACCTGCAATG-3’ | 5′-GACTGCGTACGAATTAAT-3′ |
| ITPR4/Em3 | 5´-GACTGCGTACCTGCAATG-3’ | 5’-GACTGCGTACGAATTGAC-3’ |
| ITPR5/Em9 | 5´-GACTGCGTACCTGCAGCT-3’ | 5′-GACTGCGTACGAATTACG-3′ |
Aplicación de los iniciadores SRAP e ITAP seleccionados en el análisis de especies relacionadas con el género Theobroma
En el Cuadro 4 se presentan los resultados de la caracterización molecular de genotipos de cacao Criollo, Forastero, Trinitario, especies del género Theobroma (T. bicolor, T. angustifolium y T. mammosum) y Herrania sp., con marcadores SRAP e ITAP. Los datos de polimorfismo, contenido de información polimórfica y poder de resolución fueron similares al comparar los dos tipos de marcadores. En la Figura 2 se observa la capacidad de los marcadores seleccionados para detectar polimorfismo entre tipos genéticos de T. cacao y especies relacionadas al género Theobroma.
Cuadro 4 Resumen de resultados obtenidos al utilizar iniciadores SRAP e ITAP altamente polimórficos para comparar especies de Theobroma y Herrania.
| SRAP | ITAP | |
| Número de pares de iniciadores evaluados | 10 | 11 |
| Número de pares de iniciadores polimórficos | 10 | 11 |
| Número de pares de iniciadores monomórficos | 0 | 0 |
| Número de pares de iniciadores que no amplificaron | 0 | 0 |
| Polimorfismo (%) | 71.43 - 100 | 65.22 - 100 |
| Contenido de información polimórfica (PIC) | 0.25 - 0.40 | 0.23 - 0.35 |
| Poder de resolución del iniciador (RP) | 5.8 - 12.4 | 7.6 - 12.4 |
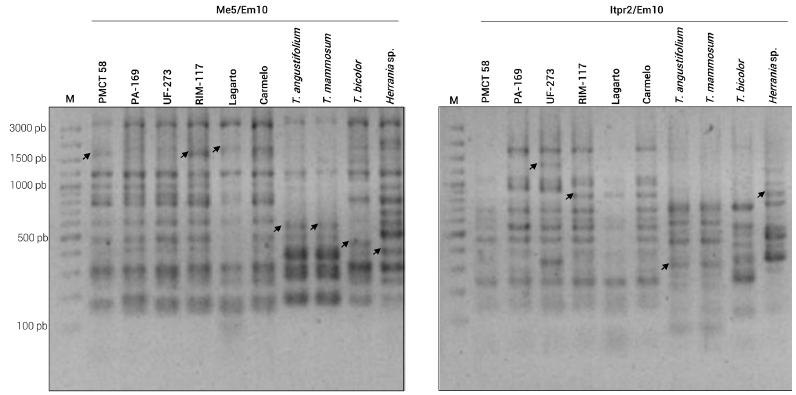
Figura 2 Patrón electroforético de la combinación de los iniciadores Me5/Em10 del marcador SRAP (izquierda) e Itpr2/Em10 de ITAP (derecha). Las flechas indican presencia de bandas polimórficas al analizar tipos genéticos de T. cacao y especies relacionadas al género. Carril 1, marcador de peso molecular de 100 a 3000 pb.
Ambos tipos de marcadores agruparon a T. angustifolium, T. bicolor, T. mammosum y Herrania sp., y los separaron claramente de los tipos genéticos de T. cacao (Figura 3). Los marcadores SRAP seleccionados distinguen claramente a los genotipos de T. cacao por su origen genético (Forastero, Trinitario y Criollo); sin embargo, aparece una inconsistencia, al mostrar mayor similitud entre los genotipos de T. cacao con Herrania sp. con respecto a las otras especies del género Theobroma (Figura 3ª). Lo anterior puede atribuirse a la naturaleza de los alelos generados por los marcadores SRAP (relacionados a exones y ORF’s). Esta misma discrepancia fue observada por Figueira et al. (1994), quienes no obtuvieron una clara distinción entre especies de Herrania y Theobroma con base en el polimorfismo de ADN ribosomal (rDNA).
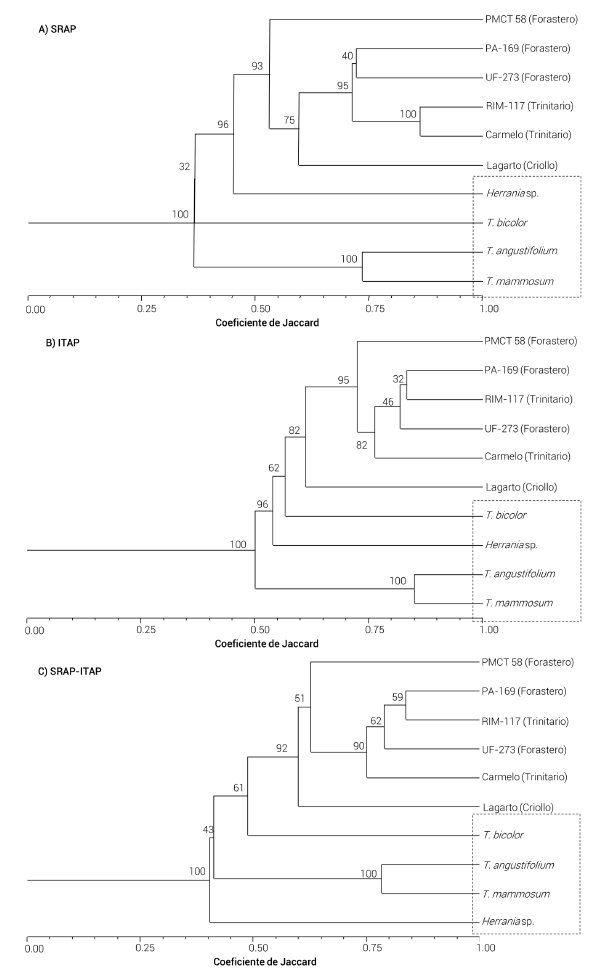
Figura 3 Dendrograma de similitud genética obtenido del análisis de conglomerados con el procedimiento UPGMA, con el coeficiente de Jaccard de especies del género Theobroma y Herrania sp, con el uso de marcadores a) SRAP, b) ITAP y c) la combinación de ambos marcadores SRAP-ITAP. Los números en cada agrupamiento indican la significancia al realizar un Bootstrap de 1000 repeticiones.
Para el caso de los marcadores ITAP seleccionados, la distribución no es muy clara, ya que muestra mayor similitud entre los genotipos RIM-117 y UF-273, lo cual no es consistente con su origen genético y geográfico (Ricaño-Rodríguez et al., 2018); esta agrupación podría deberse a que el tipo genético Trinitario se considera intermedio entre los tipos genéticos Criollo y Forastero (Figueira et al., 1994). El marcador ITAP ubicó a T. bicolor con mayor similitud con respecto a los genotipos de T. cacao L (Figura 3B). Otro aspecto a considerar en el comportamiento de los marcadores utilizados es que el polimorfismo observado se debe únicamente a las variaciones que hay en las regiones que amplifican las combinaciones de iniciadores y no es posible detectar posibles cambios a nivel de secuencias de alelos del mismo peso molecular (Li et al., 2013).
En la Figura 3C se observa el dendrograma generado al combinar los perfiles electroforéticos producto de la combinación de iniciadores Me1/Em7, Me6/Em3 y Me6/Em7 de SRAP y la combinación Itpr3/Em10 e Itpr4/Em3 de ITAP, los cuales muestran mejor capacidad para distinguir entre tipos genéticos de T. cacao y especies relacionadas al género, incluso separan claramente a Herrania sp., por lo que se consideran como adecuados para futuros estudios de caracterización molecular del cacao. Lo anterior confirma lo sugerido por Azofeifa-Delgado (2006), quien atribuye mayor confiabilidad al uso simultaneo de dos tipos de marcadores moleculares en estudios de diversidad.
CONCLUSIONES
Se logró seleccionar las mejores combinaciones de iniciadores de las técnicas SRAP e ITAP para la determinación de la variabilidad genética de los genotipos de Theobroma cacao, lo que permitió confirmar la distancia genética entre estos genotipos con base en su origen genético y geográfico. Los marcadores SRAP constituyeron la mejor técnica por su capacidad de distinguir entre tipos genéticos de T. cacao, mientras que las mejores combinaciones de iniciadores para distinguir tanto entre tipos genéticos de cacao como especies del género Theobroma fueron Me1/Em7, Me6/Em3 y Me6/Em7 para SRAP, así como Itpr3/Em10 e Itpr4/Em3 para ITAP.











 text new page (beta)
text new page (beta)


