Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista fitotecnia mexicana
Print version ISSN 0187-7380
Rev. fitotec. mex vol.34 n.4 Chapingo Oct./Dec. 2011
Artículos científicos
Actividad antioxidante de alcaloides de Erythrina americana Miller
Antioxidant activity of Erythrina americana Miller Alkaloids
Emmanuel Ibarra Estrada1*, Maribel Pacheco Sánchez2, Rosario García Mateos3, Rubén San Miguel Chávez4, Gustavo Ramírez Valverde5 y R. Marcos Soto Hernández4
1 Postgrado de Recursos Genéticos y Productividad-Fisiología Vegetal, Colegio de Postgraduados-Campus Montecillo. km. 36.5 Carr. México-Texcoco. 56280, Montecillo, Texcoco, Edo. de México. Tel: 01 (595) 95-20200 ext. 1361.*Autor para correspondencia (bayor_8@hotmail.com)
2 Área de Biología, Preparatoria Agrícola, Universidad Autonóma Chapingo. km. 38.5 Carr. México-Texcoco. 56230, Chapingo, Texcoco, Edo. de México.
3 Área de Química, Preparatoria Agrícola, Universidad Autonóma Chapingo. km. 38.5 Carr. México-Texcoco. 56230, Chapingo, Texcoco, Edo. de México.
4 Programa de Botánica, Colegio de Postgraduados-Campus Montecillo. km. 36.5 Carr. México-Texcoco. 56280, Montecillo, Texcoco, Edo. de México. Tel: 01 (595) 95-20200 ext. 1361.
5 Programa de Estadística, Colegio de Postgraduados-Campus Montecillo. km. 36.5 Carr. México-Texcoco. 56280, Montecillo, Texcoco, Edo. de México. Tel: 01 (595) 95-20200 ext. 1361.
Recibido: 28 de Septiembre del 2010.
Aceptado: 10 de Noviembre del 2011.
Resumen
Los alcaloides son compuestos químicos que poseen propiedades farmacológicas a concentraciones bajas. En este estudio se evaluó la actividad antioxidante en fracciones de alcaloides libres hexánicos, libres metanólicos, liberados metanólicos y de erisodina, obtenidas de semillas de Erythrina americana Miller, mediante el método del radical estable 2,2-difenil-1-picrilhidrazilo (DPPH); dicha reacción se midió por espectroscopía UV-Visible. La fracción de alcaloides liberados presentó mayor actividad antioxidante (0.1593 mg mL-1 ± 0.0305), aunque las tres fracciones crudas inhibieron más de 50 % de la concentración del DPPH. Se aisló erisodina pura a partir de la fracción de alcaloides liberados por medio de cromatografía en columna con los eluyentes diclorometano:metanol en distintas polaridades; dicho alcaloide se identificó a través de cromatografía en capa fina y RMN-1H. Erisodina causó una fuerte inhibición sobre el DPPH, comparable a la del ácido ascórbico (CI50 = 0.0212 mg mL-1 ± 0.008 y CI50 = 0.0068 mg mL-1 ± 0.0008, respectivamente). Erisodina a 0.5 mg mL-1 inhibió hasta 94 % del DPPH.
Palabras clave: Erythrina americana, antirradical, erisodina, alcaloides, radical libre.
Abstract
Alkaloids are chemical compounds with pharmacologic properties at low concentrations. In this study, the antioxidant activity of free alkaloids fractions in hexane and methanol, liberated in methanol and in erysodine, obtained from seeds of Erythrina americana Miller, was evaluated using the stable radical 2,2-diphenyl-1-picrylhydrazyl (DPPH) method; the reaction was measured by UV-Visible spectroscopy. The liberated alkaloid fraction showed the highest antioxidant activity (0.1593 mg mL-1± 0.0305), though all three crude fractions inhibited more than 50 % of the DPPH concentration. Pure erysodine was isolated from the fraction of liberated alkaloids by column chromatography, using dichloromethane:methanol at different polarities; this alkaloid was identified by thin-layer chromatography and 1H-NMR. Erysodine showed a strong DPPH inhibition which is comparable to the ascorbic acid inhibition (CI50 = 0.0212 mg mL-1 ± 0.008 and CI50 = 0.0068 mg mL-1 ± 0.0007, respectively). Also, erysodine at 0.5 mg mL-1 inhibited up to 94% of DPPH.
Key words: Erythrina americana, antiradical, erysodine, alkaloids, free radical.
INTRODUCCIÓN
Erythrina americana, de la familia Leguminosae (Fabaceae), ha sido estudiada por su alto contenido de alcaloides en semillas con su actividad farmacológica (García et al., 2001). Esta especie contiene los alcaloides erisovina, erisodina, erisopina y α- y β-eritroidina (García et al., 1996), los cuales son bases terciarias, mientras que otros alcaloides con similar actividad farmacológica son sales cuaternarias (Soto y Jackson, 1994). Tienen como base al esqueleto eritrinano, una espiroamina tetracíclica que se encuentra en dos formas en la planta: libre o conjugada formando glucósidos (García y Soto, 2001). En estudios con ratones y ranas, la erisodina administrada por vía oral, subcutánea, intraperitoneal e intralifántica presentó toxicidad en diferentes concentraciones (Garín et al., 2001). Erisodina y la dihidro-β-eritroidina actuaron como antagonistas de los receptores nicotínicos α4β2 y α7 presentes en el hipocampo dorsal de ratas, y afectaron la consolidación de la memoria de corto plazo (Garín et al., 2009).
En la búsqueda de compuestos naturales con actividad antioxidante se han encontrado diversos compuestos fenólicos, ácido ascórbico y compuestos nitrogenados como péptidos, aminoácidos, aminas y alcaloides (Valentao et al., 2002). Los antioxidantes son sustancias sintéticas o naturales que se añaden a productos para prevenir o retardar el deterioro causado por acción del oxígeno del aire (Huang et al., 2005). Los radicales libres inducen daño oxidativo a biomoléculas (lípidos, proteínas y ácidos nucleicos) y causan arterioesclerosis, envejecimiento, cáncer y otras enfermedades en humanos (Soler et al., 2000; Bafna y Mishra, 2005). Estudios recientes sugieren la existencia de seis especies reactivas de oxígeno (ROS) que provocan daño oxidativo al cuerpo humano: anion superóxido (O2 –°), peróxido de hidrógeno (H2O2), radicales peróxilo (ROO°), radical hidroxilo (HO°), oxígeno (O2) y peroxinitrito (ONOO–) (Huang et al., 2005).
Un método sencillo, fácil y rápido de llevar a cabo, desarrollado por Brand-Williams et al. (1995) para determinar actividad antioxidante de alimentos y compuestos secundarios, utiliza al radical estable 2,2-difenil-1-picril-hidrazilo (DPPH). En interacción con DPPH, los antioxidantes transfieren electrones o átomos de hidrógeno a este compuesto y así neutralizan su propiedad de radical libre (Naik et al., 2003). La característica de la reacción es un efecto decolorante sobre el DPPH de azul-violeta a amarillo (Brand-Williams et al., 1995). Una inhibición de por lo menos 50 % de la concentración de DPPH representa una buena actividad antioxidante. El objetivo principal de este estudio fue evaluar la actividad antioxidante de fracciones crudas de alcaloides y de erisodina, y su comparación con ácido ascórbico.
MATERIALES Y MÉTODOS
Material vegetal
Se trabajó con 388 g de E. americana Miller recolectada en los jardines de la Facultad de Química de la Universidad Nacional Autónoma de México, en octubre de 2008.
Preparación de los extractos crudos de alcaloides
Se siguieron los métodos descritos por Games et al. (1974) que a continuación se detallan:
Alcaloides libres. Las semillas trituradas mecánicamente (388 g) se desengrasaron con hexano por 48 h, en un soxhlet; el disolvente se evaporó al vacío y el extracto crudo hexánico se lavó con una solución de H2SO4 a 2 %. La separación de la grasa se llevó a cabo con lavados consecutivos de diclorometano (3 lavados de 100 mL cada uno). La fase acuosa se basificó con NaHCO3 hasta alcanzar un pH entre 8 y 9, seguida de una extracción con diclorometano (5 extracciones de 100 mL cada una). El extracto de diclorometano se secó con Na2SO4 anhidro y se evaporó a presión reducida para obtener la fracción de alcaloides libres del extracto hexánico. Las semillas se secaron a temperatura ambiente y se extrajeron con metanol en un soxhlet durante 72 h, y el disolvente se evaporó a sequedad. El extracto crudo se disolvió en una solución de H2SO4 1 M; después se hicieron lavados con diclorometano (5 lavados de 100 mL cada uno). El disolvente libre de humedad se evaporó para obtener la fracción de alcaloides libres.
Alcaloides liberados. El remanente de la fase acuosa se acidificó a pH 2 con ácido clorhídrico concentrado. La mezcla se llevó a reflujo durante 3 h a una temperatura entre 60 y 70 °C. La mezcla fría se alcalinizó con NaHCO3 hasta obtener pH 8 y se extrajo con diclorometano (5 extracciones de 100 mL cada una); el disolvente se secó con Na2SO4 anhidro y posteriormente se evaporó, para obtener la fracción de alcaloides liberados.
Purificación de alcaloides. De la fracción de alcaloides liberados se obtuvo el alcaloide erisodina mediante fraccionamiento por cromatografía preparativa en columna, con sílica gel (gel de sílice G 60 Merck) como fase estacionaria; los eluyentes fueron diclorometano:metanol en diferentes proporciones, desde 100:0 % a 80:20 % (v:v). Se obtuvieron fracciones de 5 mL cada una y se analizaron por cromatografía en capa fina, y se combinaron las que resultaron cromatográicamente similares. Después se realizó otra columna preparativa para la separación de los isómeros erisovina y erisodina, con el uso de los eluyentes cloroformo:metanol desde 100:0 % hasta 95:5 %.
Análisis por RMN-1H. La resonancia magnética nuclear es un método espectral basado en las propiedades magnéticas de los núcleos y, en su aplicación más común, en las propiedades del núcleo de hidrógeno. El compuesto obtenido de la cromatografía en columna se analizó por RMN-1H. Los espectros se determinaron en un espectrofotómetro Brucker-360® de 360 MHz (Bruker Daltonic GmbH Bremen Alemania), con DMSO (dimetilsulfóxido) como disolvente y TMS (tetrametilsilano) como referencia interna. Los desplazamientos químicos se expresan en unidades delta (δ).
Determinación de actividad antioxidante. La actividad antioxidante se evaluó mediante el método del radical libre DPPH, como lo describen Liu et al. (2009) y Kubola y Siriamornpun (2008). Dicho radical tiene un electrón no apareado (libre) y presenta un color azul-violeta que cambia a amarillo pálido en presencia de una sustancia antioxidante; esta reacción se midió en un espectrofotómetro marca Pye Unicam® SP 8-100 a 517 nm. Se preparó una solución metanólica de DPPH 0.1 mM. La absorbancia inicial del DPPH en metanol se midió a 517 nm, y no se registraron cambios durante el ensayo con las muestras. Se construyó una curva patrón a partir de la medición de la absorbancia del radical DPPH a diferentes concentraciones DPPH (0.1, 0.08, 0.06, 0.04, 0.02, 0.01 y 0 mM). Después, una alícuota de 1 mL de cada tratamiento (en diferentes concentraciones utilizadas) se agregó a 3 mL de solución metanólica de DPPH. La reacción se midió a 517 nm después de una incubación por 30 min a 30 °C en oscuridad. A partir de la ecuación de la curva se determinó la concentración a la cual se redujo el DPPH. Las mediciones se llevaron a cabo por triplicado. El porcentaje de DPPH inhibido (% DPPH) se calculó con la ecuación:
% DPPH inhibido = (A control - A muestra ) x 100/Acontrol
donde A control es la absorbancia del control, y A muestra es la absorbancia de la muestra. Los valores de CI50 se calcularon a partir de gráficos del porcentaje de inhibición y las concentraciones de los tratamientos. El CI50 denota la concentración de un compuesto para inhibir la concentración del valor inicial del DPPH a 50 %, a una absorbancia de 517 nm.
Diseño experimental
Se utilizó un diseño completamente al azar con cinco tratamientos a diferentes concentraciones: fracción de alcaloides libres hexánicos, fracción de alcaloides libres metanólicos, fracción de alcaloides liberados, erisodina y ácido ascórbico (testigo positivo). Se utilizaron las concentraciones 0.5, 0.1 y 0.05 mg mL-1 para las fracciones crudas; 0.5, 0.4, 0.3, 0.2, 0.1 y 0.05 mg mL-1 para erisodina; y 0.001, 0.005. 0.0075 y 0.01 mg mL-1 para ácido ascórbico. Las evaluaciones se hicieron por triplicado.
Para determinar diferencias entre tratamientos se hizo un análisis de varianza con el paquete SAS para Windows 9.0, previa transformación a rangos (Conover y Iman, 1981) para el cumplimiento de los supuestos, así como la comparación de medias REGWQ (Ryan-Einot-Gabriel-Welsh).
RESULTADOS Y DISCUSIÓN
Estudio fitoquímico
Se obtuvieron 57.2 g de extracto crudo hexánico y 102.4 g de extracto crudo metanólico. En el Cuadro 1 se presenta la cantidad de fracciones crudas obtenidas a partir de los extractos crudos de semillas de E. americana.
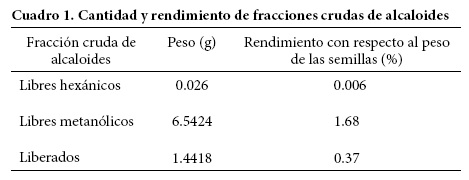
Para E. americana, Sotelo et al. (1993) reportaron 0.13 % de fracción de alcaloides liberados y 0.4 % de alcaloides libres. En el presente estudio se encontró un rendimiento superior con respecto a la cantidad de muestra utilizada. Garín et al. (2000) reportaron un rendimiento de 0.224 % de fracción de alcaloides liberados de semillas de E. americana, valor que corresponde con el obtenido en este estudio. La fracción de alcaloides liberados se purificó en una columna cromatográfica, y se obtuvieron 34.9 mg de un compuesto con aspecto de polvo café y amorfo con un punto de fusión de 204-206 °C, correspondiente a la erisodina (Amer, 1991). Se hizo un segundo análisis cromatográfico a 34.9 mg del compuesto obtenido en el primer análisis, para separar la erisodina de su isómero erisovina, y así lograr una mejor purificación. En el Cuadro 2 se presentan los desplazamientos químicos de los protones de erisodina en RMN-1H.

Actividad antioxidante
En el Cuadro 3 se presentan las concentraciones inhibitorias 50 (CI50) de fracciones crudas de alcaloides, de erisodina y del ácido ascórbico.
Erisodina provocó produjo una alta inhibición sobre DPPH, con una CI50 de 0.0211 mg mL-1, comparable con la del ácido ascórbico (0.0068 mg mL-1). Ambos compuestos mostraron potente actividad inhibitoria sobre el radical estable DPPH. La CI50 de la erisodina en este estudio es más efectiva que la obtenida para este mismo compuesto pero extraído de E. lysistemon, en el cual erisodina tuvo una CI50 de 150 (μg mL-1 después de 30 min de reacción, y de 90 (μg mL-1 después de 4 h. Así mismo, (+)-11 α-hidroxierisodina dio una CI50 de 200 μg mL-1 a los 30 min de reacción, y de 170 μg mL-1 a las 4 h, sobre DPPH 0.5 mM (Juma y Majinda, 2004). La concentración de DPPH utilizada podría explicar la diferencia entre concentraciones inhibitorias. El alcaloide melosmina de Rollinia pittieri presentó una CI50 de 3.037 ± 0.18 μg mL-1 (Montoya et al., 2004), valor superior al obtenido con erisodina, que a su vez es superior a O-metil-moschatolina de la misma especie y que no mostró efecto significativo sobre DPPH. La melosmina tiene dos grupos hidroxilos, que pueden ser responsables de la donación de átomos de hidrógeno necesarios para la actividad antioxidante, mientras que erisodina presenta un grupo hidroxilo en su estructura; la ausencia de estos grupos en O-metil-moschatolina podría explicar su pobre actividad.
Entre fracciones crudas, la de alcaloides liberados presentó la mejor concentración para inhibir al radical DPPH (0.1593 mg mL-1) y es significativamente igual a la que presentó la fracción de alcaloides libres hexánicos (0.1791 mg mL-1). La fracción de alcaloides libres metanólicos presentó una CI50 de 0.7243 mg mL-1, que es menos efectiva para inhibir al menos en 50 % a la concentración original del DPPH.
En E. latissima, Chacha et al. (2005) estudiaron las propiedades antioxidantes de l avonoides de madera del tallo de esta especie, un pterocarpano (135 μig mL-1), una chalcona (160 μg mL-1) y una flavanona (380 μg mL-1), las cuales presentaron menor actividad antirradical que erisodina.
Entre los porcentajes de inhibición de las fracciones crudas y el ácido ascórbico se aprecia que los alcaloides libres hexánicos y liberados presentan altos porcentajes de inhibición sobre el radical DPPH; sin embargo, las concentraciones de las fracciones crudas son mayores que las utilizadas con ácido ascórbico (Cuadro 3). Con las tres fracciones crudas evaluadas se logró una inhibición de por lo menos 50 % sobre el radical estable, aunque su potencial es diferente; esto evidencía que las fracciones crudas tienen propiedades antioxidantes, debido quizá a un efecto sinérgico entre los alcaloides presentes, pero su efecto es inferior al del ácido ascórbico. Similar al efecto de las fracciones crudas de alcaloides de E. americana, los extractos de diferentes especies como el extracto de oleorresina de hojas del árbol del curry (Murraya koenigii Spreng.) (Rao et al. , 2007) y la fracción alcaloidal del extracto metanólico de raíces de Cissampelos pareria Linn. (Bafna y Mishra, 2010), presentaron más de 50 % de inhibición sobre el DPPH.
En el Cuadro 3 se aprecia que erisodina en la mínima concentración evaluada, logró inhibir más de 50 % del DPPH. En concentraciones mayores alcanzó porcentajes de inhibición muy altos; con 0.5 mg mL-1 inhibió hasta 94.23 % ± 1.4 de la concentración de DPPH, comparable con el alcaloide pterodina de tipo oxindol aislado de uña de gato ( Uncaria tomentosa), el cual presentó una inhibición de 98.26 % con una concentración de 250 μg mL-1 (Paniagua et al., 2009); erisodina a esta misma concentración inhibe alrededor de 90 % del radical DPPH.
A una concentración de 100 μg mL-1 los alcaloides 6-acetonildihidroqueleritrina, queleritrina y dihidroqueleritrina, aislados del extracto de metanol de la corteza de Bocconia arborea, presentaron un porcentaje de barrido sobre DPPH de 84.3, 80.2 y 77.5 % respectivamente (Pérez et al., 2003) valores similares a los presentados por erisodina a esa concentración con 77.19 %. Este último valor es ligeramente superior al que presentó el alcaloide norditerpeno cochlearenina obtenido de raíces de Delphinium linearilobum, que tuvo un efecto inhibitorio de 75.52 % sobre el radical DPPH a una concentración de 100 μg, ligeramente inferior al presentado por erisodina a la misma concentración (77.19 % ± 3.9) (Kolak et al., 2006); el alcaloide koenigina extraído de hojas del árbol del curry inhibió 91.6 % a 50 μg g-1 (Rao et al., 2007). Estos alcaloides con efecto inhibitorio sobre DPPH contienen grupos hidroxilo, al igual que la erisodina; esto parece indicar que la actividad secuestradora sobre el radical se debe a la habilidad para donar átomos de hidrógeno. Los resultados de este estudio sugieren que la eficiente habilidad de erisodina para atrapar al radical DPPH podría relacionarse con la capacidad para inhibir daños al ADN, como se demostró para el alcaloide pterodina (Paniagua et al., 2009).
CONCLUSIONES
Las fracciones crudas de alcaloides de E. americana tienen potencial antioxidante con diversos niveles de poder inhibitorio sobre el DPPH, donde destaca la fracción de alcaloides liberados con la mayor actividad antioxidante. El alcaloide diénico erisodina tiene un potencial antioxidante similar al del ácido ascórbico. El método DPPH es sencillo y rápido para evaluar la actividad antioxidante de compuestos bioactivos, principalmente con los que contienen grupos -OH, tal como erisodina. Este estudio contribuye al conocimiento de la actividad antioxidante de los alcaloides del tipo eritrinano, en particular del alcaloide erisodina.
BIBLIOGRAFÍA
Amer M E (1991) The tetracyclic Erythrina alkaloids. J. Nat. Prod. 54:329-363. [ Links ]
Bafna A R, S H Mishra (2005) Actividad antioxidante in vitro del extracto de metanol de los rizomas de Curculigo orchioides Gaertn. Ars Pharm. 46:125-38. [ Links ]
Bafna A R, S H Mishra (2010) Antioxidant and immunomodulatory activity of the alcaloidal fraction of Cissampelos pareira Linn. Sci. Pharm. 78:21-31. [ Links ]
Brand-Williams W, M E Cuvelier, C Berset (1995) Use of a free radical method to evaluate antioxidant activity. Lebensm Wiss. Technol. 28:25-30. [ Links ]
Chacha M G, Bojase M, R R T Majinda (2005) Antimicrobial and radical scavenging flavonoids from the stem wood of Erythrina latissima. Phytochemistry 66:99-104. [ Links ]
Conover W J, R L Iman (1981) Rank transformations as a bridge between parametric and nonparametric statistics. The Amer. Stat. 35:124-129. [ Links ]
Games D E, A H Jackson, N A Khan, O S Millington (1974) Alkaloids of some African, Asian, Polynesian and Australian species of Erythrina. Lloydia 37:581-588. [ Links ]
García M R, M Soto H (2001) Alcaloides como una alternativa en la obtención de principios activos. Prod. Nat. Persp. Biotecnol. 6:1-9. [ Links ]
García M R, B Lucas, M Zendejas, M Soto H, M Martínez, A Sotelo (1996) Variation of total nitrogen, non-protein nitrogen content, and types of alkaloids at different stages of development in Erythrina americana seeds. J. Agric. Food Chem. 44:2987-2991. [ Links ]
García M R, M Soto H, H Vibrans (2001) Erythrina americana Miller ("Colorín"; Fabaceae), a versatile resource from Mexico: a review. Econ. Bot. 55:391-400. [ Links ]
Garín A M E, J E Ramírez L, M Soto H, G Valencia del T, M Martínez V (2000) Efect of crude extracts of Erythrina americana Mill. on aggressive behavior in rats. J. Ethnopharm. 69: 189-196. [ Links ]
Garín A M E, G Valencia del T, S G Sánchez H, M Soto H, J García A (2001) Alcaloides de Erythrina herbacea. Prod. Nat. Persp. Biotecnol. 6:10-19. [ Links ]
Garín A M E, S López V, C L Martínez V, G Valencia del T, M Soto H, R A Prado A (2009) Erisodina y receptores nicotínicos α4β2 del hipocampo dorsal en la consolidación de la memoria. Rev. Latinoam. Quím. 37:206-217. [ Links ]
Huang D, B Ou, R L Prior (2005) The chemistry behind antioxidant capacity assays. J. Agric. Food Chem. 53:1841-1856. [ Links ]
Juma B F, R R T Majinda (2004) Erythraline alkaloids from the lowers and pods of Erythrina lysistemon and their DPPH radical scavenging properties. Phytochemistry 65:1397-1404. [ Links ]
Kolak U, M Öztürk, F Özgökçe, A Ulubelen (2006) Norditerpene alkaloids from Delphinium linearilobum and antioxidant activity. Phytochemistry 67:2170-2175. [ Links ]
Kubola J, S Siriamornpun (2008) Phenolic contents and antioxidant activities of bitter gourd (Momordica charantia L.) leaf, stem and fruit fraction extracts in vitro. Food Chem. 110:881-890. [ Links ]
Liu L, Y Sun, T Laura, X Liang, H Ye, X Zeng (2009) Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C. J. Tseng. Food Chem. 112:35-41. [ Links ]
Montoya P G L, E J Osorio D, N S Jiménez U, G J Arango A (2004) Actividad captadora de radicales libres de alcaloides de Rollinia pittieri (Annonaceae) por el método del DPPH. Rev. Fac. Quím. Farm. Univ. Antioquía 11:51-57. [ Links ]
Naik G H, K I Priyadarsini, J G Satav, M M Banavalikar, D P Sohoni, M K Biyani, H Mohan (2003) Comparative antioxidant activity of individual herbal components used in Ayurvedic medicine. Phytochemistry 63:97-104. [ Links ]
Paniagua P R, E Madrigal B, D Molina J, S Reyes C, I Álvarez G, L Sánchez C, J Pérez G (2009) Antigenotoxic, antioxidant and lymphocyte induction efects produced by pterodine. Basic Clinical Pharmacol. Toxicol. 104:222-227. [ Links ]
Pérez R M, R Vargas, F J Martínez, E V García, B Hernández (2003) Actividad antioxidante de los alcaloides de Bocconia arbórea. Estudio sobre seis métodos de análisis. Ars Pharm. 44:5-21. [ Links ]
Rao L J M, K Ramalaksmi, B B Borse, B Raghavan (2007) Antioxidant and radical-scavenging carbazole alkaloids from the oleoresin of curry leaf (Murraya koenigii Spreng.). Food Chem. 100:742-747. [ Links ]
Soler R C, J C Espín, H J Wichers (2000) An easy and fast test to compare total free radical scavenger capacity of foodstuffs. Phytochem. Anal. 11:330-338. [ Links ]
Sotelo A, M Soto, B Lucas, F Giral (1993) Comparative studies of the alkaloidal composition of two Mexican species and nutritive value of the detoxified seeds. J. Agric. Food Chem. 41:2340-2343. [ Links ]
Soto H M, A H Jackson (1994) Erythrina alkaloids: isolation and characterization of alkaloids from seven Erythrina species. Planta Med. 60:175-177. [ Links ]
Valentao P, E Fernández, F Carvalho, P B Andrade, R M Seabra, M L Bastos (2002) Antioxidative properties of cardoon (Cynara cardunculus L.) infusión against superoxide radical, hydroxyl radical, and hypochlorous acid. J. Agric. Food Chem. 50:4989-4993. [ Links ]














