Introducción
Históricamente los esfuerzos de restauración ecológica, en la mayoría de los ecosistemas, se han centrado en el hábitat haciendo énfasis en el componente vegetal; mientras que ha habido un rezago en la inclusión de la fauna silvestre que interactúa y hace uso de esa vegetación (McAlpine et al., 2016; Cross et al., 2019, 2020). En el caso de las poblaciones animales, la reintroducción de individuos, la recolonización de zonas ancestralmente ocupadas por una especie y la recuperación de poblaciones han sido pobremente estudiadas desde la visión de la restauración de ecosistemas (Westwood et al., 2014). Esto ha dejado de lado el conocimiento y valor de las funciones ecológicas que cumplen esas especies de animales en los hábitats que ocupan, tales como el flujo de energía y su consecuente influencia sobre otros componentes de los ecosistemas (Lotze et al., 2011).
Como parte de los avances en la atención de estos vacíos del conocimiento, la restauración de poblaciones de animales se ha propuesto como un proceso de varias etapas a partir de las cuales se construyen esquemas conceptuales en los que se define cuándo una población o especie puede considerarse como recuperada (Block et al., 2001; Westwood et al., 2014; Akçakaya et al., 2018). Esto tiene implicaciones relevantes para los procesos de restauración y ha abierto un área de oportunidad para el análisis epistemológico de la restauración ecológica como el punto de encuentro en el que distintas ramas de la ecología y otras múltiples disciplinas convergen para la atención de un problema que demanda aproximaciones plurales y sin fronteras para una solución integral. Así, se resalta la necesidad de realizar acciones de restauración desde un planteamiento que considere los procesos y funciones al interior del ecosistema de interés y donde las interacciones entre la flora y la fauna son fundamentales, lo cual brinda mayor relevancia a la restauración de las poblaciones de fauna silvestre (Westwood et al., 2014; Moreno-Mateos et al., 2020).
Las interacciones ecosistémicas que ocurren en hábitats críticos; es decir, aquellos donde se desarrollan, reproducen y encuentran refugio las especies de interés para la conservación (DOF, 2021), son particularmente relevantes ya que ocurren en momentos clave de sus ciclos de vida. En estos hábitats se espera que una población tenga una interacción proporcional a su abundancia, que influye en las comunidades de su entorno y que, en ocasiones, puede provocar una presión negativa sobre la integridad y la viabilidad del ecosistema (Murdoch et al., 2007). Por ello, conocer la viabilidad y condición poblacional de especies de fauna silvestre, particularmente de aquellas en alguna categoría de amenaza o riesgo de extinción, y que son clave para el funcionamiento de los ecosistemas, es necesario para lograr una aproximación integral en los procesos de restauración (Moreno-Mateos et al., 2020). En este sentido, el estudio de atributos ecológicos y demográficos de las poblaciones de tortuga verde (Chelonia mydas Linnaeus, 1758), bajo análisis en este trabajo, contribuye al diagnóstico de la integridad ecológica, resiliencia y vulnerabilidad de los ecosistemas de los que hace parte, lo cual permite desarrollar enfoques adaptativos de manejo y restauración de forma integral, así como un monitoreo sistemático de la especie a largo plazo (Hodgson et al., 2015; Oliver et al., 2015).
Algunas especies, por ser altamente sensibles a alteraciones ambientales naturales o de origen humano, son consideradas como centinela o sombrilla (Wabnitz et al., 2010), mientras que las que modifican la estructura física de su hábitat son conocidas como ingenieras (Jones et al., 1997, 2010; Hastings et al., 2007). Chelonia mydas se considera centinela, ingeniera y sombrilla, por el efecto positivo que tienen sobre otras especies las acciones para su conservación (Wabnitz et al., 2010; Gredzenz et al., 2014; Hays et al., 2018). Identificar la función de las especies en los ecosistemas es de gran importancia en términos de manejo y restauración; especialmente el de aquellas que se encuentran en peligro de extinción (Caro y O’Doherty, 1998; Hunter Jr. et al., 2016; Hazen et al., 2019), pues su estudio adquiere relevancia en la estrategia para su conservación (Hughes et al., 2005; Hammerschlag et al., 2019).
La tortuga verde es un macroherbívoro marino en peligro de extinción que, por décadas y a nivel mundial, ha sido objeto de importantes esfuerzos de conservación y recuperación exitosos en términos del crecimiento de sus poblaciones, lo que evidencia su gran capacidad de resiliencia y recuperación en diferentes regiones (Balazs y Chaloupka, 2004; Broderick et al., 2006; Chaloupka et al., 2008; Fuentes et al., 2013; Delgado Trejo, 2016; Piacenza et al., 2016; Mazaris et al., 2017). Esta especie tiene una distribución pantropical; más de 95% de su tiempo de vida habita ecosistemas marinos, primordialmente praderas de pastos marinos debido a su hábito herbívoro en etapa adulta (para más detalles biológicos básicos consultar Hirth, 1997), y las hembras reproductoras utilizan playas arenosas para depositar sus nidadas. Por las interacciones en las que participan, influyen sobre la condición, resiliencia y vulnerabilidad de esos ecosistemas donde además de establecerse, promueven su viabilidad ecológica y procesos de sucesión de comunidades, entre otras funciones (Johnson et al., 2017, 2019).
Dado el uso que Chelonia mydas hace de playas arenosas para depositar sus huevos, sus hembras contribuyen al flujo de energía entre ecosistemas marinos y terrestres al aportar materia orgánica a las playas donde anidan cada año, lo cual impacta directamente a las comunidades que habitan las dunas costeras (Bouchard y Bjorndal, 2000; Hannan et al., 2007). En este sentido, se ha documentado que algunas comunidades vegetales de duna asimilan nutrientes como el fósforo y nitrógeno, derivados de los residuos de las nidadas en esas playas (Vander Zanden et al., 2012), por lo que se evidencia que estos quelonios contribuyen a la conectividad entre los ecosistemas de playa y los marinos costeros (Madden et al., 2008). Esta interacción ocurre siempre que las nidadas permanezcan durante todo el período de incubación en el sitio donde fueron originalmente depositadas. Sin embargo, una de las estrategias para la protección de tortugas marinas implica la reubicación de sus nidadas a corrales de protección para asegurar la conclusión de su desarrollo de forma exitosa (Mortimer, 1999).
Las playas de anidación en México se han protegido con esta última estrategia, incluso aplicándola a la totalidad de las nidadas registradas, como fue el caso del litoral sur de Campeche (Guzmán, 2021). Sin embargo, con la entrada en vigor de la Norma Oficial Mexicana NOM-162-SEMARNAT-2012 (DOF, 2013), que establece las especificaciones para la protección, recuperación y manejo de las poblaciones de tortuga marina en su hábitat de anidación, se obligó a priorizar la protección de nidadas en los sitios donde fueron depositadas originalmente (in situ) y con ello, la materia orgánica aportada por las nidadas volvió a mantenerse en los segmentos de playa de anidación original. Se espera que el incremento de las nidadas in situ de tortuga verde enriquezcan el suelo con materia orgánica lo que, a su vez, puede favorecer el crecimiento de las plantas de duna y mejorar su condición ecológica, establecida por el verdor de la vegetación presente en las playas de anidación (Vander Zanden et al., 2012).
En este contexto, una forma indirecta de evaluar atributos estructurales de la vegetación de duna es por medio de herramientas de percepción remota satelital. De esta manera, se obtienen valores de índices de vegetación que implican cálculos aritméticos con datos de la reflectancia de las comunidades vegetales en distintos rangos del espectro electromagnético y así se obtiene, entre muchas opciones, un índice del verdor de las comunidades estudiadas (Yacobi, 2012; Zarco-Tejeda et al., 2018). Este índice es un reflejo de la condición de cobertura y densidad de la comunidad, características que dependen de las circunstancias particulares de cada sitio, como clima, nutrientes y perturbaciones, entre otras condiciones (Forey et al., 2008; Gilbert et al., 2008). Con el fin de contar con datos históricos de los cambios en las comunidades vegetales de duna en las zonas de anidación, para las cuales no existen datos sistemáticos derivados de mediciones en campo, los índices calculados a partir de acervos históricos de imágenes satelitales se convierten en una alternativa viable para estudiar cambios en estos ecosistemas.
La alteración de estos ecosistemas, particularmente las playas de anidación en México, se debe al desarrollo urbano, a la presencia de infraestructura turística y erosión costera, así como a la eutrofización y destrucción mecánica de praderas de pastos marinos, de los cuales dependen esos quelonios en sus distintos estadios de vida (SEMARNAT, 2018). La degradación de sus hábitats críticos puede ser disminuida, revertida o paliada a través de distintas estrategias de conservación, restauración y manejo, que también se definen en el Programa de Acción para la Conservación de la Especie (PACE) Chelonia mydas (SEMARNAT, 2018). En este sentido, en México desde la década de los años cincuenta se han realizado proyectos de conservación y monitoreo de poblaciones de tortuga marina en sus playas de anidación (Márquez y Farías, 2000). Desafortunadamente, en este país la cantidad de publicaciones disponibles no refleja el número de proyectos de conservación que se han llevado a cabo, e incluso puede representar una barrera para la toma de decisiones e implementación de acciones de conservación (Uribe Martínez et al., 2019).
A escala mundial hay un gran interés por restaurar las poblaciones de tortuga marina en tamaños y condiciones que permitan el desarrollo de sus funciones ecológicas, lo cual se espera que también promueva la recuperación de los ecosistemas que habitan (Bjorndal y Bolten, 2003). En este sentido diversas iniciativas de conservación y restauración, implementadas a esta escala, han sido exitosas en la recuperación de las poblaciones de Chelonia mydas (Chaloupka et al., 2008; Zavaleta-Lizárraga et al., 2013; Mazaris et al., 2017), lo cual ha sido evidente solo después de tres décadas de trabajos de protección y monitoreo de sus poblaciones (Balazs y Chaloupka, 2004; Piacenza et al., 2016). El monitoreo de indicadores poblacionales y reproductivos incluye el censo de nidadas depositadas en playa y el número de hembras que las depositan anualmente, el de crías emergidas de los nidos y aquellas que ingresan al mar, el de anidaciones por hembra al año y tamaño de la nidada depositada por hembra, entre otros (Miller, 2000; NRC, 2010; Guzmán Hernández et al., 2015). Estos indicadores son críticos para la recuperación de poblaciones de especies en peligro de extinción.
Estos indicadores se calculan a partir de datos colectados en las playas de anidación de C. mydas, entre las cuales se reconoce un subgrupo clasificado como Playas Índice, en las cuales existen más de diez años de datos colectados de forma ininterrumpida, aunado a que cada año el personal técnico que realiza los trabajos de monitoreo en las playas recibe capacitación profesionalizante, y se producen reportes de acceso libre (CIT, 2013, 2014; Ceriani et al., 2019). Estas playas son estratégicas para el monitoreo de la dinámica poblacional y de conservación de las tortugas marinas.
Esta recuperación de Chelonia mydas difiere por regiones, lo que dificulta la reclasificación del estado de riesgo de esta especie a nivel mundial (Wallace et al., 2010). Como una medida para solucionar este conflicto, Wallace et al. (2010) definieron Unidades de Manejo Regional para atender, de forma segmentada, las necesidades de las poblaciones de tortugas marinas en distintas regiones del mundo tomando en cuenta las características demográficas y ecológicas de sus poblaciones particulares. Una de esas unidades es la del Atlántico Noroeste que incluye a los países del Gran Caribe, entre los que se encuentran México y Cuba, cuyas poblaciones de C. mydas se encuentran conectadas a nivel paisajístico y molecular (Ruíz-Urquiola et al., 2010; Uribe-Martínez et al., 2021).
Tanto México como Cuba cuentan con antecedentes sobre tendencias de anidación de la tortuga verde (Méndez Matos, 2010; Azanza Ricardo et al., 2013; Bravo-Gamboa, 2013; Tzeek Tuz et al., 2019; Méndez Matos et al., 2019). Sin embargo, no existen un análisis y documentación del proceso de recuperación de las poblaciones de C. mydas a escala regional. Dada la conectividad entre hábitats marinos y costeros de las poblaciones de esta especie entre México y Cuba, este trabajo aborda de forma integral el análisis de las playas de anidación en ambos países considerando poblaciones de C. mydas en ambos países. Para ello, el presente estudio tuvo como objetivos: (i) describir los patrones temporales del conjunto de valores histórico de los indicadores demográficos y reproductivos de tortuga verde en 16 Playas Índice del Golfo de México y Mar Caribe; (ii) evaluar el patrón de reclutamiento y crecimiento de la población anidante, en Campeche, México; (iii) comparar los valores de un índice de reflectancia de la vegetación de duna antes y después de la implementación de una Norma Oficial Mexicana y entre zonas con densidad de anidación distinta en una Playa Índice mexicana de anidación de tortuga verde donde se registra un incremento del número de anidaciones de esta especie, y (iv) comparar la cantidad de materia orgánica estimada de nidadas de tortuga verde en playas antes y después de la implementación de la Norma Oficial Mexicana NOM-162-SEMARNAT-2012.
Materiales y Métodos
Área de estudio
Para este análisis se consideraron las playas que se encuentran en la Unidad de Manejo Regional del Atlántico Noroeste (Wallace et al., 2010) (Fig. 1). Se trata de 16 Playas Índice de anidación localizadas en el Golfo de México y Cuba. Estas, 11 de México y 5 de Cuba, suman más de 200 km de litoral arenoso en los que ocurre la anidación de Chelonia mydas y representan el ámbito geográfico en donde anida esta tortuga verde en la zona del Canal de Yucatán, norte de Quintana Roo y la península de Guanahacabibes, al extremo oeste de Cuba. La especie anida en esta región de principios de mayo a octubre, e incluso hasta noviembre de cada año.
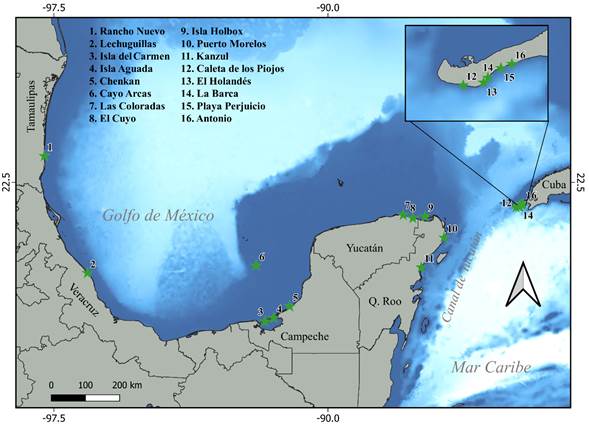
Figura 1: Ámbito geográfico de la distribución de 16 playas de anidación de tortuga verde (Chelonia mydas, Linnaeus 1758) (representadas con estrellas de color verde) en el Golfo de México y Mar Caribe. Las tonalidades de color azul denotan la batimetría de la región, con los tonos más claros representando las mayores profundidades.
En este contexto, si bien el análisis florístico de la vegetación en el área de estudio no se consideró en los objetivos de este análisis, es importante señalar que la vegetación presente en dunas costeras es un componente que impacta directamente en el proceso de anidación de las tortugas (Kamel y Mrosovski, 2006; Kelly et al., 2017). Para fines de una descripción de las características generales climáticas y de las comunidades vegetales en las 16 playas de anidación, a continuación, se exponen de forma breve algunas de las características generales climáticas y de las comunidades vegetales presentes en las 16 playas de anidación. Se describen enseguida, agrupadas de acuerdo con su región.
1) Oeste y suroeste del Golfo de México (Tamaulipas y Veracruz, México)
La costa tamaulipeca aloja la playa de anidación de Rancho Nuevo (Fig. 1, playa 1). Se caracteriza por un clima semiárido subhúmedo, en su mayoría está formada por una línea de playas bajas arenosas con una larga barrera frontal donde dominan comunidades vegetales de herbáceas con matorrales, o bien matorrales con árboles bajos y algunas cactáceas. Algunas de las especies representativas son Ipomoea pes-caprae (L.) R. Br., Jouvea pilosa (J. Presl) Scribn., Uniola paniculata L., Opuntia spp., Acacia spp., Rhizophora mangle L., Conocarpus erectus L., Avicennia germinans (L.) L. y Laguncularia racemosa (L.) Gaertn.
Por otro lado, la playa Lechuguillas (Fig. 1, playa 2), en el litoral central de Veracruz se ubica en la parte sur de la provincia fisiográfica “Llanura Costera del Golfo de México Norte”. La vegetación es la propia de duna costera, típica de la región, constituida por especies introducidas y de barrera, como la Casuarina equisetifolia (Fosberg) y Cocus nucifera (L.), y por otras endémicas de matorral costero como Conocarpus erectus, Chrysobalanus icaco L., Coccoloba uvifera (L.) L. y Opuntia dillenii (Ker Gawl.) Haw. También están presentes plantas de hábito rastrero como Ipomoea pes-capreae (L.) R. Br., I. imperati (Vahl) Griseb., Sesuvium portulacastrum (L.) L., Crotalaria incana L. y Cyperus articulatus L., entre otras.
Las comunidades vegetales de duna costera en la zona norte de Veracruz han sido menos estudiadas que las del centro y sur (Jiménez-Orocio et al., 2015); sin embargo, reportes como el de Reyes-Ortiz et al. (2017) dan cuenta de la alta diversidad de especies y endemismos en esta zona de interés para este estudio, para la que reportan una dominancia del estrato herbáceo, seguido por el arbustivo y arbóreo. Estos últimos autores coinciden con el reporte de I. pres-caprae como una de las especies más importantes, seguida por Randia laetevirens Standl., Ipomoea imperati, Eupatorium odoratum L., Croton punctatus Jacq. y Canavalia maritima Thouars.
2) Península de Yucatán (Campeche y Yucatán, México)
En Campeche se estudiaron cuatro playas de anidación (Fig. 1, playas 3-6) en las cuales se encuentran dunas frontales y planicies de dunas, la mayoría impactadas por diversas actividades humanas como el crecimiento urbano, la fragmentación del hábitat por la construcción y mantenimiento de la carretera federal del Golfo (número 180) y procesos de erosión costera, además de estar bajo amenaza de desaparecer por el incremento del nivel del mar asociado al cambio climático (López Rosas et al., 2014). Se definen dos tipos de comunidad vegetal en este litoral: en la línea de marea se distribuyen especies pioneras, principalmente hierbas, y tierra adentro vegetación de matorral (Espejel, 1984; Guadarrama et al., 2014). La vegetación pionera, cerca de la línea de marea, está dominada por especies de hábitos rastreros y herbáceos, incluyendo algunas arbustivas con alta tolerancia a condiciones de temperatura y salinidad extrema (Espejel, 1984), y en la de matorral, donde ya hay un sustrato fijo, existen elementos de vegetación más conspicua y de mayor altura.
Para los análisis en este estudio se consideró la playa Isla Aguada, Campeche. Esta se localiza al suroeste del estado, con un régimen climático caracterizado por cuatro temporadas climáticas: secas (marzo-abril), de transición (mayo), lluvias (junio-octubre) y nortes (noviembre-febrero) (Guerra-Santos y Kahl, 2018). Se caracteriza por un clima cálido-húmedo con lluvias en verano, con precipitaciones entre 150 y 180 mm, siendo septiembre cuando ocurre la mayor precipitación; la temperatura media anual está alrededor de los 26.75 °C siendo mayo el mes más caluroso (Rebolledo-Vieyra, 2010; López Rosas et al., 2014). El sistema de dunas de Isla Aguada incluye al menos 30 especies vegetales, entre las que destacan por su abundancia S. portulacastrum, I. pes-caprae, Canavalia rosea (Sw.) DC. y Ambrosia hispida Pursh, Hymenocallis littoralis (Jacq.) Salisb. (Noguera-Savelli, 2022).
En el caso de Yucatán (Fig. 1, playas 7 y 8), las comunidades de vegetación de duna son similares a las de la Cuenca del Caribe (Moreno-Casasola y Espejel, 1986), y son consideradas ricas en términos del número de especies (271 especies vasculares) con 7% de especies endémicas, lo que le confiere a este estado el segundo lugar en cuanto a la diversidad de endemismos en las dunas (Durán-García et al., 2010). En la estructura de su vegetación se reconocen dos zonas distintivas que responden al medio físico y biótico, y que concuerdan con la descripción general (Moreno-Casasola y Espejel, 1986; Espejel, 1992) para comunidades de pioneras y matorrales. La primera se caracteriza por especies que se establecen sobre sedimento arenoso móvil con hábito postrado principalmente, con Sesuvium portulacastrum, Ipomoea pes-caprae, Cakile lanceolata (Willd.) O.E. Schulz, Euphorbia buxifolia Lam., Canavalia rosea, Suriana maritima L. y Tournefortia gnaphalodes (L.) R. Br. ex Roem. & Schult. La segunda se distingue por una comunidad que se establece sobre sedimento arenoso fijo y con mayor cantidad de materia orgánica que la del no consolidado. Algunas de las especies presentes en esta zona son Coccoloba uvifera, Metopium brownei (Jacq.) Urb. y Agave angustifolia Haw.
3) Caribe mexicano (Quintana Roo, México)
En esta región se encuentran tres de las playas de anidación estudiadas (Fig. 1, playas 9-11), en donde la flora terrestre tiene gran similitud con la provincia de la costa del Golfo de México (Rzedowski, 1978). Para la zona de anidación en el centro y sur del estado se han reportado más de 30 especies de flora de los estratos arbóreo, arbustivo y herbáceo (Gayosso-Soto, 2015). Las especies dominantes de estas comunidades fueron Thrinax radiata Lodd. ex Schult. & Schult. f., Tournefortia gnaphalodes, Suriana maritima, Ambrosia hispida, Panicum amarum (Hitchc. & Chase) P. Palmer y Ernodea littoralis Sw.
4) Costa occidental de Cuba (Península de Guanahacabibes, Cuba)
El complejo de vegetación de costa arenosa es la formación vegetal típica de las playas de anidación de tortugas marinas en el occidente del archipiélago cubano (Fig. 1, playas 12-16) (Ferro et al., 2014). Tiene como característica fundamental que en su composición florística predominan especies rastreras y herbáceas (Capote y Berazaín, 1984); sin embargo, sobresalen por su abundancia y cobertura los arbustos Tournefortia gnaphalodes y Suriana maritima (Ferro et al., 2014). Otras especies observadas con frecuencia en el área de estudio fueron Cyperus planifolius Rich., Chamaesyce sp., Flaveria linearis Lag. e Ipomoea pes-caprae, de acuerdo con Cabrera-Guerra et al. (2019). Estos últimos, encontraron una relación positiva entre la presencia de vegetación y el éxito de emergencia de las tortugas marinas, en particular, en presencia de S. maritima.
Monitoreo de playas de anidación
El monitoreo biológico aplicado en las playas estudiadas para el seguimiento de las poblaciones de tortuga marina cumple con los estándares de datos mínimos establecidos en los protocolos establecidos a nivel internacional (SWOT, 2011). Estos se categorizaron en el nivel 1 protocolo B, en el cual el monitoreo de la anidación se realiza tres veces o más por semana durante toda la temporada de anidación (SWOT, 2011). Además, en México se cumplió con la Norma Oficial Mexicana NOM-162-SEMARNAT-2012 (DOF, 2013), y para Cuba se siguió el Protocolo del Programa Nacional de tortugas marinas (Moncada Gavilán et al., 2013). En este sentido, el acervo de datos de anidación en estas playas, conforme con los protocolos estandarizados de esfuerzo de muestreo en tiempo y espacio, satisface la definición de Playas Índice.
Los datos analizados en este estudio derivaron del trabajo de monitoreo biológico realizado de 1990 a 2020, en 16 playas de la Unidad de Manejo Regional del Atlántico Noroeste (Wallace et al., 2010) (Fig. 1), durante patrullajes nocturnos, en los que se utilizaron cuatrimotos, aunque en playas cortas (5 km) los recorridos se realizaron a pie. El monitoreo se realizó desde el inicio de la temporada de anidación (mayo) hasta el final de la temporada, entre los meses de octubre y noviembre. Se trabajó en la playa, en jornadas de trabajo de aproximadamente 12 horas (entre 20:00 y 08:00) y en un rango de entre 25 y 28 noches al mes. En playas mayores a 5 km los recorridos se hicieron generalmente dos veces por noche, mientras que en las menores a 5 km hasta cuatro veces o más por noche.
El 25% de las playas analizadas cuenta con una serie de tiempo que inicia en 1990 (31 años), seguido de otro 25% de playas cuyos primeros registros provienen de 1991 y 1994 (27-29 años), 37.5% de las playas tienen registros desde 2000 (22 años) y tan solo 12.5% tienen un registro histórico desde 2007 (14 años). Todos los programas de conservación y monitoreo en estas playas están activos y vigentes. La diferencia en el número de años de registro de datos de las playas incluidas en este estudio, se debe a la antigüedad en la implementación de los distintos programas, y solo se consideraron los años en los que se aplicaron métodos de monitoreo y esfuerzo homologados. Estas mismas diferencias hicieron necesario el análisis de tendencias a distintos niveles.
Recolecta de datos de anidación en playa
Durante el monitoreo en las playas se registró el número de las nidadas, coordenadas geográficas, fecha, hora de observación de la nidada y posición sobre el perfil de playa, y cuando se encontró a la hembra anidando se tomaron sus datos morfométricos; es decir, las medidas de longitud y anchura curvas del caparazón (van Dam, 1999). El período de incubación de Chelonia mydas es de 45-60 días (Delgado-Trejo, 2016; Méndez Matos et al., 2019), después de esta etapa, y una vez que las crías exitosas emergen del nido, quedan remanentes de la nidada que son clave para el cálculo de índices de éxito de incubación y reproductivos de tortuga marina (Miller, 2000). Para los primeros se contaron el número de crías eclosionadas vivas y muertas, el de crías eclosionando vivas y muertas; los huevos sin desarrollo embrionario aparente y aquellos con desarrollo embrionario y cascarones; para el cálculo del índice reproductivo se contabilizó el número de huevos depositados por nidada.
Respecto a la disponibilidad pública de estos datos, no existe un repositorio en el que se encuentren todos, existen iniciativas en México e internacional para crear estos repositorios (p. ej., Kot et al., 2022) y en donde se pueden encontrar datos de algunas de estas playas. En México, los datos básicos de número de nidadas y crías liberadas pueden ser accedidos a través de una solicitud de información a la Dirección General de Vida Silvestre de la SEMARNAT.
Análisis de la recuperación poblacional de Chelonia mydas
Los protocolos de monitoreo de anidación son comparables entre las 16 Playas Índice estudiadas; sin embargo, no todas tuvieron los datos mínimos necesarios para el cálculo de indicadores demográficos (p. ej., número de hembras anidantes, número de nidadas y de crías emergidas (censadas o estimadas), por lo que el análisis de recuperación poblacional se estructuró en tres niveles de detalle que se describen a continuación.
Primer nivel
El primer nivel se realizó a partir del conjunto de datos recabados de la abundancia de nidadas en cada playa en el período 1990-2020. Con ellos se calculó la tasa instantánea de incremento en el período (Ec. 1), la tasa instantánea de incremento (Ec. 2) y el porcentaje de cambio anual en la población (Ec. 3).
Tasa instantánea de incremento en el período 1990-2020:
donde k es el valor de la función en el periodo 0, e es el número de Euler, b es el valor de la pendiente de un modelo de función exponencial y representa la tasa de crecimiento en el período x.
Tasa instantánea de incremento (λ):
donde
Porcentaje de cambio anual en la población:
donde
Dado el patrón general del número de nidadas a lo largo del período de estudio en estas playas, se consideró que se asemejaba a una distribución de crecimiento exponencial y se calculó su ecuación para los siguientes análisis. Con el fin de evaluar el grado de ajuste de los datos a una distribución potencial, así como su significancia estadística, los datos del número de nidadas fueron transformados a logaritmo natural y se comparó con un modelo lineal utilizando una prueba de Pearson (alfa=5%) (NRC, 2010; Guzmán Hernández et al., 2015). Este análisis se realizó con el programa Infostat v. 2020 (DiRienzo et al., 2020).
Asimismo, con el fin de responder si el número de anidaciones de la tortuga verde en años de alta actividad cambiaron en las playas cuyo ajuste a un crecimiento exponencial fue significativo (prueba Pearson, alfa=5%), se compararon los valores del número de nidadas en los años altos en el período 1994-2004 (1994, 1996, 1998, 2000, 2002) y 2010-2020 (2012, 2013, 2015, 2017, 2019), los cuales se distinguen como períodos con magnitudes de anidación similares. Se evaluó la homocedasticidad de los datos (prueba F para igualdad de varianzas), los cuales no cumplieron el supuesto (p>0.05) por lo que se aplicó una prueba no paramétrica para dos muestras (Wilcoxon Mann-Whitney, alfa=5%).
Finalmente, con el fin de conocer el orden de magnitud del cambio en el número de anidaciones promedio en años de alta actividad antes y después del año 2010, para cada una de las playas mencionadas se dividió el número promedio de nidadas en el período después de 2010 entre el número de nidadas en el período previo. Se reporta el valor promedio y su desviación estándar para fines de conocer el orden de la magnitud de incremento de las anidaciones máximas de esta especie.
Segundo nivel
El segundo nivel consistió en cuantificar el número de crías (contadas y estimadas) que se asume que ingresaron al mar durante el período evaluado. Estas crías representan el porcentaje de un conjunto de ellas que, con el paso de los años, estará reclutándose al estadio de vida juvenil de la población, con la expectativa de que algunas se recluten como individuos adultos reproductores después de décadas. El número de crías que se reporta anualmente para las playas de anidación deriva de tres condiciones. La primera es el conteo directo de crías emergidas de los nidos, principalmente cuando las nidadas fueron protegidas al interior de corrales de incubación (zonas cercadas con mallas metálicas que evitan algún riesgo de pérdida por depredación o inundación). Las crías emergidas de estos nidos son contadas y liberadas al mar por el personal a cargo del monitoreo, posteriormente los remanentes de la nidada son clasificados y cuantificados de acuerdo con la Norma Oficial Mexicana NOM-162-SEMARNAT-2012 (DOF, 2013). La segunda condición es cuando las nidadas permanecen in situ, y al emerger las crías se incorporan directamente al mar, sin intervención humana. Entre 24 y 48 horas después de la emergencia de las crías, los remanentes de la totalidad de las nidadas se clasifican y cuantifican, y a partir del total de cascarones se estima el número de crías emergidas, que se asumen como un indicador del reclutamiento a la población general (Miller, 2000). La tercera condición se da cuando se reporta el número de crías emergidas de las nidadas in situ según las especificaciones marcadas en la Norma Oficial Mexicana NOM-162-SEMARNAT-2012 (DOF, 2013). En este manejo solo se revisan los remanentes de una fracción de las nidadas registradas utilizando el número de cascarones como indicador del total de crías emergidas y reclutadas, y se resta el número de crías muertas dentro y fuera del nido para obtener el número de crías liberadas. El total se estima con base en el valor promedio del número de huevos por nidada (fecundidad), el éxito de emergencia de las crías calculado para cada año en cada playa, y el número de nidadas exitosamente protegidas en la playa. El éxito de emergencia de las crías se calcula con la Ecuación 4:
donde el número de cascarones se refiere al remanente del cascarón cuando la cría eclosionó del huevo y emergió del nido; el número total de huevos de la nidada se compone por la suma de todas las categorías de residuales: cascarones, crías eclosionando vivas, crías eclosionando muertas, huevos sin desarrollo embrionario aparente y huevos con desarrollo embrionario aparente (Miller, 2000).
Si se alcanza una muestra mayor o cercana a 25% del total de los nidos registrados por año, la extrapolación al resto de los nidos sin revisión se considera como un buen parámetro de estimación (Chim Vera, 2009). Con estas técnicas se compiló el número de crías de tortuga verde emergidas anualmente para el período 1990-2020 y se asumió como indicador de las crías reclutadas al mar. A partir de esta información se construyó una serie de tiempo de la producción a largo plazo del número de crías que potencialmente se reclutaron a la población de individuos juveniles de la especie en esta región.
Tercer nivel
El tercer nivel de análisis tuvo como objetivo evaluar la relación entre la abundancia de la porción reproductiva de la población (parentela), en este caso representada por el número de hembras anidantes, y la abundancia de la porción no reproductiva (progenie), que en este estudio fue el número de crías liberadas al mar que fueron engendradas por esas hembras. Esta es una aproximación numérica útil para describir de forma directa el proceso de restauración de una población silvestre y considera el flujo convencional de crías a adultos, con una alta mortalidad de las primeras en sus fases tempranas (Heppell, 1998), así como el número promedio de crías por hembra por temporada como un indicador de la tasa de reclutamiento a la población general (Richardson et al., 1999). Este tipo de enfoque ha sido aplicado al estudio de la tortuga lora (Lepidochelys kempii Garman, 1880) en el Golfo de México (Gallaway et al., 2016) y de la tortuga carey (Eretmochelys imbricata Linnaeus, 1766) en Cuba (Doi et al., 1992).
Para identificar las etapas de restauración de la población de tortuga verde, se aplicó un análisis de conglomerados (K-medias; Tabachnick y Fidell, 2019). En él, se consideraron los datos de abundancia de crías y hembras de las playas de anidación Isla del Carmen, Isla Aguada, Chenkan y Cayo Arcas en el estado de Campeche, como el criterio de agrupamiento, y los años asociados a las crías y hembras como los objetos a ser agrupados. Los datos de abundancia se transformaron a escala logarítmica para facilitar la apreciación visual de los grupos formados. Estos análisis se realizaron utilizando el programa R (R Core Team, 2020).
Interacción con otros elementos del ecosistema
Con la entrada en vigor de la Norma Oficial Mexicana NOM-162-SEMARNAT-2010 (DOF, 2013), cambió el paradigma de conservación relacionado con el monitoreo y manejo de las nidadas de tortuga verde (C. mydas) durante el periodo de estudio (1990-2020) (Cuevas et al., 2013; Guzmán-H. y García-A., 2016). Eso favoreció el incremento del aporte de materia orgánica del mar a las playas, al privilegiar el mantenimiento de las nidadas en los sitios donde originalmente fueron depositadas. En este contexto, se plantearon dos hipótesis: 1) que la cantidad de materia orgánica depositada en las playas por las tortugas marinas en forma de sus nidadas se incrementó significativamente a partir de 2013 cuando la norma entró en vigor y 2) que en las zonas de playa con mayor densidad de nidadas, las comunidades vegetales de duna costera tienen un índice de verdor más alto que en las zonas de baja densidad de anidación. La adopción de un índice de verdor asume que este refleja atributos estructurales y de condición de estas comunidades.
Para abordar estas hipótesis se plantearon dos evaluaciones: (i) el cálculo de la materia orgánica que aportan las tortugas, derivado de datos obtenidos en campo de los remanentes de las nidadas registradas, y (ii) el cambio del verdor de la vegetación de duna presente en los sitios de anidación con el uso de imágenes satelitales de alta resolución espacial. Para la primera parte se calculó el aporte anual de materia orgánica con el que contribuyen las tortugas en la Playa Índice Isla Aguada, Campeche, de 2005 a 2020, tomando como base una adaptación de la metodología de Bouchard y Bjorndal (2000). Esta playa fue seleccionada debido a la disponibilidad de los datos necesarios para el cálculo de las aportaciones de materia orgánica, incluyendo su monitoreo sistemático y regular tanto en espacio como en el tiempo.
La estimación de la materia orgánica se obtuvo a partir de analizar, para cada año, el número de huevos incubados in situ y en corrales. Se utilizó el porcentaje de emergencia (proporción de crías que emergieron del nido, respecto al total de huevos) para estimar el total de crías producidas anualmente y a partir de esto se estimó el número promedio de crías que podrían esperarse de esos huevos (huevos multiplicado por el éxito de emergencia). A continuación, se obtuvo el número de kilogramos que representaron los huevos y las crías, considerando pesos promedio de 37 g y 21.56 g, respectivamente (Guzmán-Hernández, datos no publicados). Finalmente, a los kilogramos de huevos se les restó el peso de las crías, obteniendo así un indicador de la masa de materia orgánica que se queda disponible en la playa en forma de remanentes. Se realizó una prueba de homocedasticidad a los dos conjuntos de datos (prueba F para igualdad de varianzas), pero no se cumplió este supuesto (p<0.05), por lo que para evaluar la significancia de las diferencias entre los períodos se realizó una prueba no paramétrica para dos muestras (Wilcoxon Mann-Whitney, alfa=5%). Estos análisis se realizaron con el programa Infostat v. 2020 (DiRienzo et al., 2020).
Para la segunda parte, en la que se estimó el cambio del verdor de la vegetación adyacente a los sitios de anidación, se utilizó un diseño experimental en el que se compararon áreas con distinta condición de la vegetación de duna y de densidad de anidaciones de tortuga verde. Se eligieron tres segmentos de la Playa Índice de Isla Aguada, con densidades de nidadas baja (
Con base en el análisis de imágenes satelitales (Sentinel-2) (ESA, 2015) y fotografías tomadas en los sitios, se definió que dos de estos segmentos presentaban vegetación arbustiva similar en términos de la abundancia y hábitos de crecimiento de los individuos presentes, los cuales se describen como zonas de matorral en ambiente estable de acuerdo con la literatura disponible para estas comunidades vegetales (Fig. 2A, B) (Espejel, 1984; Guadarrama et al., 2014; Noguera-Savelli et al., 2019). El tercer segmento se caracterizó por la presencia dominante de vegetación pionera cercana a la línea de costa (Fig. 2C). De acuerdo con el inventario de uso de suelo y vegetación, serie VII (INEGI, 2021), estas zonas se describen como vegetación secundaria arbustiva de selva mediana subperennifolia y vegetación secundaria arbórea de selva mediana subperennifolia. A su vez, de acuerdo con Rzedowski (1990) estas zonas albergan vegetación del tipo bosque tropical subcaducifolio, bosque tropical perennifolio y vegetación acuática y subacuática.

Figura 2: Diseño para la cuantificación del verdor de la vegetación con el índice ‘Soil Adjusted Vegetation Index’ (SAVI), como indicador del vigor de la vegetación de duna aledaña a zonas de alta (A), media (C) y baja (B) densidad anidación de (Chelonia mydas Linnaeus, 1758) en la Playa Índice de Isla Aguada, Campeche, México y playa secundaria de Isla del Carmen, Campeche, México.
El análisis detallado de la estructura y riqueza de las comunidades vegetales de duna en cada uno de los segmentos evaluados queda fuera del objetivo de este trabajo, pues en este se analizaron datos indirectos de la condición (índices de vegetación a partir de percepción remota) de dichas comunidades vegetales, con el propósito de evaluar diferencias en las condiciones de la vegetación en la playa de anidación que justifiquen un estudio detallado de la relación entre anidaciones de tortugas marinas y dichas comunidades.
El análisis del cambio de verdor se hizo mediante la evaluación de imágenes satelitales, considerando las propiedades de absorbancia y reflectancia de la luz por las clorofilas a (pico de absorción entre 430 y 660 nm) y c (pico de absorción en λ=445 nm), que se utilizan para evaluar la intensidad del verdor de la vegetación a partir de índices de vegetación que cubren estos rangos espectrales (Yacobi, 2012; Zarco-Tejeda et al., 2018). En este marco, el segmento del espectro electromagnético conocido como ‘red-edge’ (>700 nm) ha sido ampliamente reconocido para el estudio de la vegetación verde y, en términos de imágenes satelitales gratuitas, el canal de infrarrojo cercano (λ=865 nm) permite la evaluación espectral del verdor de la vegetación.
En este análisis se procesaron 182 imágenes del sensor Landsat 7 ETM v. 2.0 (USGS, 2019) con una resolución espacial de 30 m por pixel y una resolución temporal (tiempo entre dos imágenes consecutivas para la misma zona) de 16 días, de las cuales 70 pertenecen al período 2007-2011 y 112 al período 2015-2019 (antes y después del aumento en las anidaciones protegidas en los sitios donde fueron originalmente depositadas en respuesta al cambio de la estrategia de manejo de las nidadas por la publicación de la NOM-162-SEMARNAT-2012). Para cada imagen satelital se calculó el índice de vegetación ajustado por suelo SAVI (Soil Adjusted Vegetation Index, por sus siglas en inglés; Huete, 1988) (Ec. 5), el cual se reconoce como indicador directo del verdor de la vegetación e indirecto de su condición general. Este índice se define como:
donde Infrarrojo Cercano se refiere a la banda cinco (λ=865 nm) y Rojo a la banda cuatro (λ=655 nm) del sensor Landsat 7 ETM v. 2.0 (USGS, 2019), mientras que L es un factor de corrección por brillo del suelo desnudo, que para este caso se le asignó un valor de 0.5.
Este índice del verdor de la vegetación (el cual va de 0 -nula presencia de vegetación- a 1 -vegetación en su máxima condición de verdor) ha sido utilizado para evaluar cambios en la condición y estructura del dosel de la vegetación (Malingreau, 1989; Valderrama-Landeros et al., 2018; Marzialetti et al., 2019; Rivera-Monroy et al., 2020). Los análisis se realizaron con el programa QGIS v. 3.10 (QGIS, 2022). Con estos datos se construyó una matriz de datos en la que además de los valores de verdor, se incluyó la categorización por zona de playa (densidad de anidación baja, media y alta) y el año.
Se evaluaron las potenciales diferencias entre los valores de verdor (SAVI) de la vegetación, primero entre los tres segmentos definidos, y posteriormente entre los períodos antes y después de la entrada en vigor de la norma. En ninguno de los casos los datos cumplieron la condición de homocedasticidad (p<0.05, prueba F para igualdad de varianzas) realizada en el programa Infostat v. 2020 (DiRienzo et al., 2020), por lo que tuvieron que aplicarse pruebas estadísticas no paramétricas. En la primera evaluación se realizó una prueba no paramétrica (Kruskal-Wallis, alfa=5%). Para la segunda, se realizó una prueba no paramétrica pareada (Wilcoxon Mann-Whitney, alfa=5%) utilizando el programa Infostat v. 2020 (DiRienzo et al., 2020).
Para fines de una interpretación natural y directa de los resultados estadísticos, se decidió no transformar los datos procurándoles su ajuste de homocedasticidad para aplicar una prueba de hipótesis paramétrica, sobre todo considerando la existencia de una amplia gama robusta de pruebas no paramétricas para el análisis de conjuntos de datos como los nuestros.
Resultados
El número de anidaciones registrado anualmente para las poblaciones de tortuga verde del litoral mexicano en el Atlántico y de la península de Guanahacabibes en Cuba, se incrementó a partir de 2013. Desde entonces, el patrón bienal de mayores anidaciones en la región y el orden de magnitud de la actividad cambiaron a una dinámica distinta a la conocida hasta entonces, la cual se explica en los apartados.
Tendencias de restauración poblacional
En general, los tres niveles de análisis de los indicadores demográficos fueron consistentes para todas las playas evaluadas en este estudio. El número de anidaciones en el período evaluado mostró patrones consistentes entre las 16 playas donde se tienen registros al menos desde la década de 1990. La mayoría de las series muestran dos incrementos sincrónicos en el número de anidaciones, separados por entre 12 y 14 años (Fig. 3B-F). Desde el inicio del período reportado en 2005, la anidación de tortuga verde presentó un patrón bienal, en el que los años pares se caracterizaron por una alta actividad de anidación, y en los impares por una baja actividad. Entre 2005 y 2009, en prácticamente toda el área de estudio, este patrón se modificó, y a partir de 2010 el patrón bienal cambió a años impares con la mayor actividad de anidación y los pares con baja anidación. Así mismo, el número de anidaciones anuales aumentó casi un orden de magnitud (Fig. 3). Prácticamente en todas las playas evaluadas los valores mínimos de anidación registrados a partir de 2011 son similares a los valores máximos de anidación en 2005 (Fig. 3).
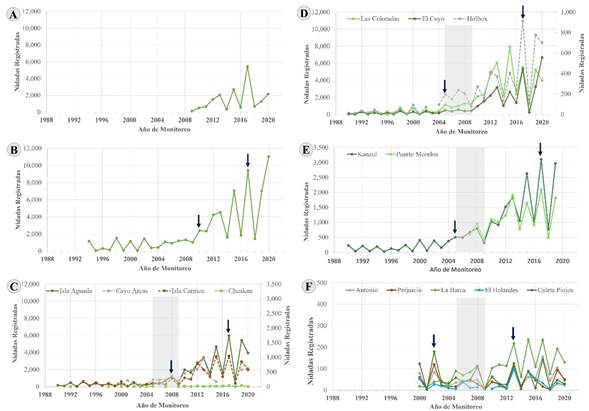
Figura 3: Serie de tiempo de las anidaciones registradas de tortuga verde (Chelonia mydas Linnaeus, 1758) en las distintas playas por regiones al interior del área de estudio en Tamaulipas (A), Veracruz (B), Campeche (C), norte de la península de Yucatán (D), Quintana Roo (E), y la península de Guanahacabibes, Cuba (F). Los datos de las líneas punteadas están relacionados con los ejes secundarios (ubicados en el costado derecho) de las gráficas que también corresponden al número de nidadas registradas. Las flechas azules señalan incrementos sincrónicos en el número de anidaciones. La sombra gris resalta el periodo en que el patrón bienal se modificó.
El ajuste del modelo exponencial (Prueba de Pearson) fue estadísticamente significativo p<0.05) para 50% (n=8) de las playas de anidación evaluadas (Cuadro 1). La tasa continua de incremento (λ) en el período estudiado fue similar entre todas las playas, con rangos de valores mínimos muy similares entre ellas, pero con valores máximos de anidación que se clasificaron en cuatro categorías: playas con menos de 500 anidaciones en todo el período (n=6), entre 500 y 1000 (n=2), entre 1000 y 5000 (n=3) y con más de 5000 (n=5) (Cuadro 1).
Cuadro 1: Parámetros de tendencias poblacionales para Chelonia mydas Linnaeus, 1758, definidos a partir del número de nidadas registradas en las playas evaluadas. Los parámetros se calcularon a partir del ajuste de un modelo exponencial a la serie de tiempo del número de nidadas por playa, así como con base en el ajuste de un modelo lineal al logaritmo natural (Ln) del número de nidadas para cada playa. Los valores p del ajuste del modelo lineal con texto en negritas representan aquellos casos en los que el ajuste del modelo fue estadísticamente significativo (alfa=5%).
| Nombre de la playa | Tasa continua de incremento en el período (λ) | Rango del número de anidaciones (Min.-Max.) | Tasa instantánea de incremento en el período (r) | Porcentaje de cambio anual | Grado de ajuste de modelo lineal (Ln nidadas) | Valor p del ajuste del modelo (Ln nidadas) | Período de evaluación (años) |
|---|---|---|---|---|---|---|---|
| Rancho Nuevo, Tamaulipas, México | 1.1611 | 146-5459 | 0.1494 | 16.11 | 0.215 | 0.0731 | 2009-2020 |
| Lechuguillas, Veracruz, México | 1.1487 | 61-11,044 | 0.1386 | 14.87 | 0.655 | <0.0001 | 1994-2020 |
| Isla del Carmen, Campeche, México | 1.1221 | 8-1050 | 0.1152 | 12.21 | 0.458 | <0.0001 | 1993-2020 |
| Isla Aguada, Campeche, México | 1.1364 | 38-5974 | 0.1279 | 13.64 | 0.659 | <0.0001 | 1990-2020 |
| Chenkan, Campeche, México | 1.0422 | 1-42 | 0.0413 | 4.22 | 0.032 | 0.2243 | 1998-2020 |
| Cayo Arcas, Campeche, México | 1.1093 | 64-956 | 0.1037 | 10.93 | 0.349 | 0.0121 | 2001-2015 |
| Las Coloradas, Yucatán, México | 1.1553 | 27-7935 | 0.1444 | 15.53 | 0.678 | <0.0001 | 1990-2020 |
| El Cuyo, Yucatán, México | 1.1532 | 31-6679 | 0.1425 | 15.32 | 0.674 | <0.0001 | 1990-2020 |
| Isla Holbox, Quintana Roo, México | 1.1651 | 1-915 | 0.1528 | 16.51 | 0.559 | <0.0001 | 1991-2020 |
| Puerto Morelos, Quintana Roo, México | 1.0444 | 422-2100 | 0.0434 | 4.44 | 0.002 | 0.3358 | 2008-2019 |
| Kanzul, Quintana Roo, México | 1.1393 | 25-3105 | 0.1304 | 13.93 | 0.706 | <0.0001 | 1990-2019 |
| Antonio, Cuba | 1.0437 | 3-155 | 0.0428 | 4.37 | 0.033 | 0.2108 | 2000-2020 |
| La Barca, Cuba | 1.1114 | 6-235 | 0.1056 | 11.14 | 0.407 | 0.0011 | 2000-2020 |
| Caleta de los Piojos, Cuba | 1.0222 | 4-179 | 0.022 | 2.22 | -0.035 | 0.5804 | 2000-2020 |
| El Holandés, Cuba | 1.0285 | 2-96 | 0.0281 | 2.85 | -0.028 | 0.4996 | 2000-2020 |
| Playa Perjuicio, Cuba | 0.994 | 2-120 | -0.006 | 0.6 | -0.051 | 0.8771 | 2000-2020 |
A su vez, para aquellas playas en las que el ajuste al modelo exponencial del número de anidaciones de tortuga verde fue estadísticamente significativo, el porcentaje de cambio anual promedio (en este caso de incremento por ser valores positivos) del número de nidadas fue de 14.14% (±1.79 D.E.) (Cuadro 1). Por otro lado, para 37.5% de las playas (seis) se registró un porcentaje de incremento anual menor a 5%, y el patrón de su número de anidaciones no se ajustó de forma significativa al modelo de distribución exponencial (prueba Pearson, p>0.05). A excepción de la playa La Barca, Cuba, el resto de las playas con un ajuste estadísticamente significativo al modelo exponencial (Cuadro 1) registró valores de las medianas de anidaciones estadísticamente distintos antes y después de 2010 (Cuadro 2), lo que representa un incremento promedio de 8.52 veces (±2.64 D.E.) el número de anidaciones en años altos después de 2010, respecto a los años anteriores a este mismo año.
Cuadro 2: Actividad de anidación (número de nidadas) de Chelonia mydas Linnaeus, 1758, en sus playas de anidación antes y después del incremento claro del número de nidadas en 2010 registrado en todas las playas evaluadas. Las playas incluidas son aquellas para las que el modelo de crecimiento ajustado fue estadísticamente significativo (Cuadro 1). Se incluye el valor de grados de libertad (g. l.) de cada playa, los valores de la prueba no paramétrica Wilcoxon Mann-Whitney (alfa=5%) y su valor p de significancia.
| Playa | Mediana de anidaciones antes 2010 (g. l.) | Mediana de anidaciones después 2010 (g. l.) | Estadístico W | Valor p |
| El Cuyo, Yucatán, México | 330.00 (5) | 3220.50 (4) | 30.00 | 0.0159 |
| Isla Holbox, Quintana Roo, México | 67.50 (4) | 415.00 (5) | 10.00 | 0.0159 |
| Isla Aguada, Campeche, México | 378.00 (5) | 4703.00 (5) | 15.00 | 0.0079 |
| Isla del Carmen, Campeche, México | 147.00 (5) | 861.00 (5) | 15.00 | 0.0079 |
| Kanzul, Quintana Roo, México | 244.00 (5) | 2628.00 (5) | 15.00 | 0.0079 |
| Las Coloradas, Yucatán, México | 535.00 (5) | 5528.00 (5) | 15.00 | 0.0079 |
| Lechuguillas, Veracruz, México | 1168.00 (5) | 7038.00 (5) | 15.00 | 0.0079 |
Las poblaciones anidantes de tortuga verde en las playas de Rancho Nuevo, Las Coloradas, El Cuyo y Holbox (Fig. 1; playas 1, 7, 8 y 9, respectivamente) mostraron los niveles de recuperación (tasa de instantánea de incremento) más altos (Cuadro 1); mientras que igual en crecimiento, pero con menores tasas, se encuentran las playas Lechuguillas (2), Kanzul (11), Isla Aguada (4), Isla del Carmen (3), Cayo Arcas (6) y La Barca (14, en Cuba) (Fig. 1; Cuadro 1). En las playas restantes se observaron condiciones estables o un incremento incipiente (Cuadro 1).
Producción de crías, reclutas de nuevas generaciones
A partir del número estimado de crías emergidas y liberadas en las playas de anidación, se observó un incremento de por lo menos un orden de magnitud en todas las playas estudiadas en el Golfo de México y Mar Caribe (excepto en Rancho Nuevo, Tamaulipas; Figs. 3, 4). Por ejemplo, en Campeche (en cuatro playas) el número de crías pasó de 5000 en 2001 a 995,000 en 2017; y en La Barca, Cuba (el sitio con la menor abundancia), de 1200 crías en 2001 a 12,500 en 2020. Un segundo rasgo observado en las series de tiempo del número de crías registrado fue la sincronía en su variación interanual entre playas de anidación, independientemente de la abundancia de nidadas y la distancia geográfica entre ellas, lo cual fue consistente con el comportamiento temporal y espacial de las anidaciones de la especie en el área de estudio (Fig. 4). Esto se reflejó en la consistencia de los años pares, previos al 2010, como los años con mayor cantidad de crías liberadas en todas las playas, y en los años impares después de 2010.
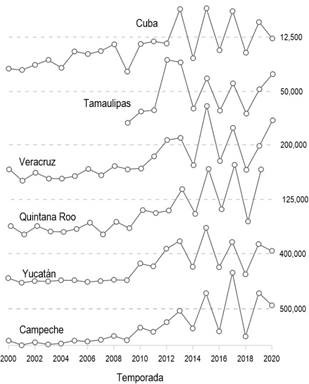
Figura 4: Series de tiempo del número de crías reclutadas de tortuga verde (Chelonia mydas Linnaeus, 1758) en diferentes sitios de anidación en el Golfo de México y Mar Caribe. La línea punteada en cada panel es un nivel de referencia de la magnitud de la abundancia en cada sitio. Nótense los cambios sincrónicos en el número de crías a lo largo de todas las series, independientemente de la distancia entre sitios y de la abundancia en cada uno.
Relación parentela-progenie
El análisis de conglomerados aplicado a los datos de abundancia de hembras anidantes y crías de tortuga verde en Campeche (1984-2020) mostró la existencia de tres grupos estadísticamente distinguibles que sugieren un incremento regional en el número de ambos segmentos poblacionales. Estos tres grupos describen la historia de la recuperación de las poblaciones de C. mydas con la primera etapa de contención de la disminución de las poblaciones de hembras, que duró hasta el período entre los años 2000 y 2004, para pasar a una etapa de reajuste en 2005-2009, y llegar a la etapa actual de crecimiento exponencial desde 2010 (Fig. 5A). Los grupos de datos indican la existencia de al menos dos incrementos simultáneos y cualitativos en el número de crías y hembras en los últimos 40 años. El primer incremento drástico ocurrió entre 1999 y 2000, mientras que el segundo se registró entre 2007 y 2008 (Fig. 5B).
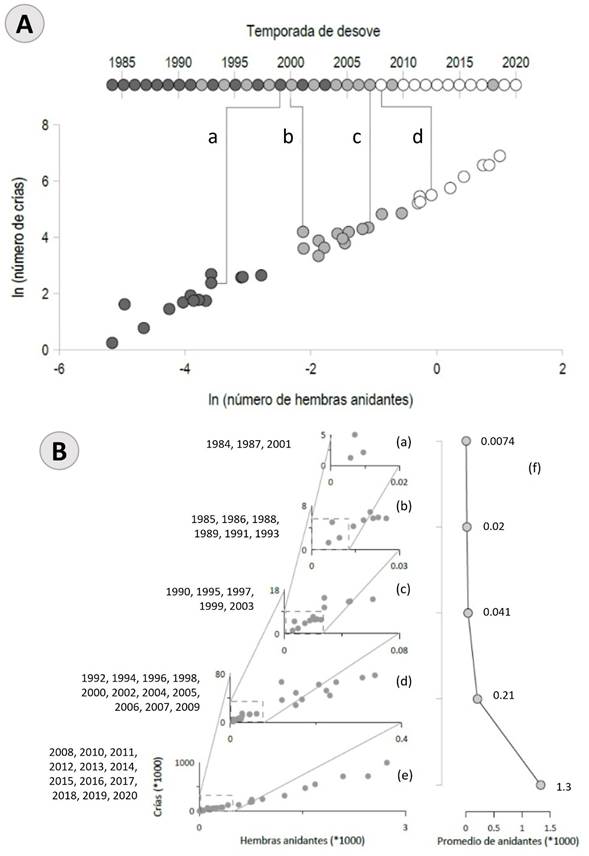
Figura 5: A. Diagrama de dispersión (logaritmo) del número de crías en función del logaritmo del número de hembras de la población de tortuga verde (Chelonia mydas Linnaeus, 1758) del estado de Campeche, México, para el período 1984-2020. Cada círculo es un par de datos de hembras-crías, y los tonos de gris representan tres grupos estadísticamente distinguibles (alfa=5%). En la parte superior, cada año corresponde con un punto en el diagrama de dispersión. Las líneas a y b (1999-2000), c y d (2007-2008) representan los cuatro grupos derivados del análisis de conglomerados e indican las diferencias más grandes entre los años consecutivos. B. Relación entre hembras anidantes y crías de C. mydas en su proceso de incremento poblacional en Campeche, México. Los recuadros de línea punteada en las gráficas b-e muestran los límites de los ejes x, y de la gráfica del período anterior, a los cuales se les une con una línea. El cambio en el tamaño de la población anidante entre gráficas consecutivas se determinó visualmente. El panel f muestra el número promedio de hembras anidantes de los puntos que están fuera del recuadro de cada gráfica (a-e). Tanto el número de hembras como de crías que aparecen en las gráficas se debe multiplicar por 1000 para obtener la magnitud de los datos originales.
En las series de tiempo de la relación parentela-progenie, se observaron años aislados en los que se incrementó la abundancia de hembras y crías, lo cual es reflejo del patrón bienal de variación (Figs. 3, 5). Se reconocen tres periodos en la abundancia histórica de crías y las hembras anidantes. El primero, desde el inicio de la serie de tiempo y hasta 2003 (de una a decenas de miles de crías; Fig. 5Ba-c). El segundo fue la fase de cambio entre 2004 y 2009, en el que la magnitud de la abundancia de crías y hembras fue equiparable a los años de alta anidación de las décadas anteriores (centenas de miles de crías; Fig. 5Bd); y el tercero fue un período en el que se registraron entre cien mil a casi un millón de crías (Fig. 5Be). La abundancia de hembras anidantes pasó de 500 en 2008, a casi 1500 en 2020 (Fig. 5Bf).
Interacción con otros elementos del ecosistema
Junto con la entrada en vigor de la Norma Oficial Mexicana NOM-162-SEMARNAT-2012 (DOF, 2013), se incrementó la cantidad de materia orgánica, estimada de kilogramos, aportada por las tortugas marinas con sus nidadas en la playa de Isla Aguada, Campeche, México (W=40.00, g. l.=8, p=0.0019; Fig. 6). La mediana de la cantidad de materia orgánica de las nidadas que se trasladaban a corrales de protección antes de la entrada en vigor de esa norma fue de 1215 kg; el material orgánico se concentraba en zonas de la playa asociadas a los corrales. Después de la entrada en vigor de la norma, se estimó una mediana de 6300 kg de materia orgánica distribuida en varios kilómetros de playa, que coincidió con el incremento en la magnitud de la anidación de la especie. La diferencia entre estos dos períodos fue estadísticamente significativa (W=40, n=8, p<0.05).
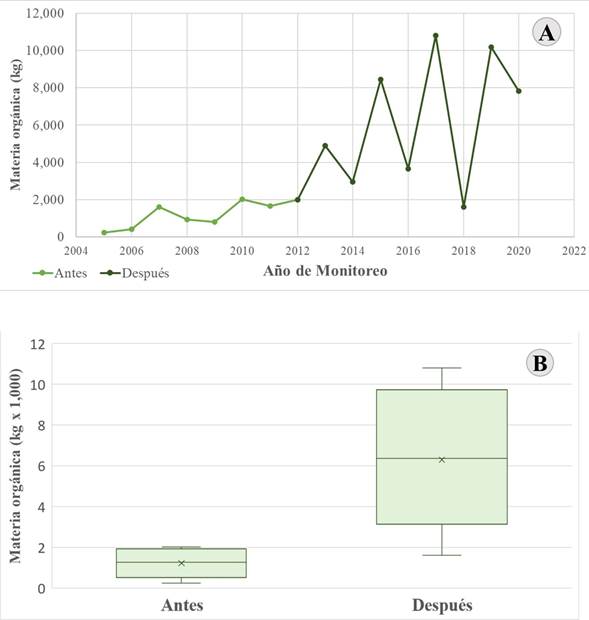
Figura 6: A. Dinámica temporal de la aportación estimada de materia orgánica por Chelonia mydas Linnaeus, 1758, a la playa de Isla Aguada, Campeche, México. B. Comparación entre períodos antes y después del cambio de estrategia de manejo de nidadas en esta playa en 2013. Las líneas verticales (bigotes) representan el valor mínimo (inferior) y el máximo (superior), el borde inferior, la línea media y el borde superior de la caja representan el 1er, 2o (mediana) y 3er cuartil, y el asterisco representa la media aritmética.
Finalmente, el análisis del verdor de la vegetación (SAVI) indicó que la zona con vegetación arbustiva y con baja y alta anidación de tortuga verde, fue significativamente mayor en la zona de vegetación pionera y anidación media para el período 2007-2019 (H=580.66, N>250, p<0.001). No se encontraron diferencias significativas en el verdor de la vegetación entre las zonas arbustivas con alta y baja densidad de anidación (Cuadro 3). Por otro lado, se encontraron diferencias significativas entre las medianas de las tres zonas con distinta densidad de anidación para antes (2007-2011; mediana=0.49) y después (2015-2019; mediana=0.54) de la implementación de la norma oficial (Cuadro 3). Junto con el incremento regional de la anidación de la especie (Cuadro 2), en la zona de la vegetación arbustiva, tanto con densidades altas y bajas de nidadas de C. mydas, la diferencia en el verdor de la vegetación entre los períodos previo y posterior a la implementación de la Norma Oficial Mexicana NOM-162-SEMARNAT-2012 fue estadísticamente significativa (mediana antes=0.50; mediana después=0.53, p<0.05) (Fig. 7).
Cuadro 3: Valores calculados del verdor (índice SAVI) de las comunidades vegetales de duna costera en tres segmentos de la playa de anidación de tortuga verde (Chelonia mydas Linnaeus, 1758) en Isla Aguada e Isla del Carmen, Campeche. Se compararon los valores SAVI antes (2007-2011) y después (2015-2019) de la implementación de la Norma Oficial Mexicana NOM-162-SEMARNAT-2012 (DOF, 2013). Se incluyen estadísticos de tendencia central y dispersión para ambos períodos en cada uno de los segmentos de playas evaluados. Se incluyen los valores de la desviación estándar (D. E.) de cada factor por playa, los valores de la prueba no paramétrica Wilcoxon MannWhitney (W) (alfa=5%) y su valor p de significancia (valores en negritas).
| Condición de la playa de anidación | Factor | N | Promedio | D. E. | Mediana | W | Valor p |
|---|---|---|---|---|---|---|---|
| Arbustiva con alta anidación | Antes | 144 | 0.50 | 0.09 | 0.49 | 21,295.00 | <0.0005 |
| Después | 194 | 0.52 | 0.14 | 0.54 | |||
| Arbustiva con baja anidación | Antes | 101 | 0.49 | 0.11 | 0.50 | 11,547.00 | <0.0247 |
| Después | 152 | 0.52 | 0.11 | 0.53 | |||
| Pionera con anidación media | Antes | 141 | 0.20 | 0.07 | 0.18 | 21,273.00 | <0.0417 |
| Después | 184 | 0.21 | 0.08 | 0.21 |
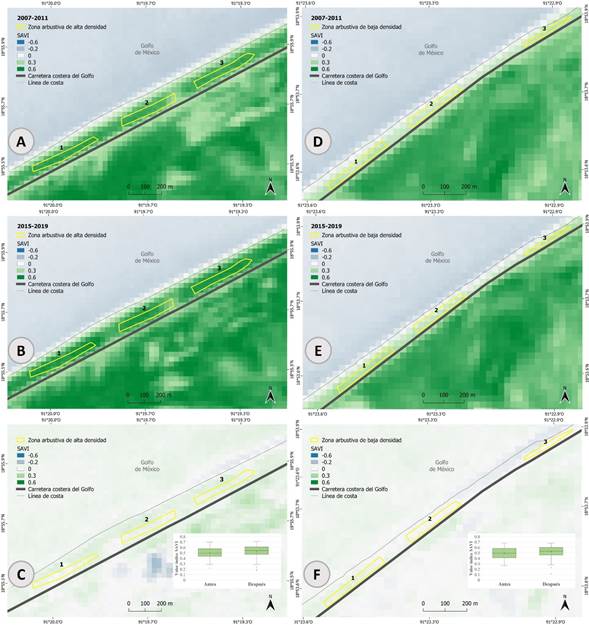
Figura 7: Valores de tendencia central (mediana) del índice de vegetación ajustado por suelo (Soil Adjusted Vegetation Index, SAVI) para las zonas de vegetación arbustiva estable con alta (A) y baja (D) anidación en el período antes del cambio de estrategia de manejo de nidadas y el incremento exponencial de las mismas, así como en para el período posterior en las mismas zonas (B y E, respectivamente). En la imagen se presenta la diferencia de los valores del índice SAVI en el segundo período menos el primero en la zona de alta (C) y baja (F) anidación, para las cuales las diferencias fueron estadísticamente significativas en los períodos de antes (2005-2011) y después (2015-2019) del cambio de tipo de manejo de las nidadas (Cuadro 2). Para fines de macrolocalización de las zonas de anidación referirse a la figura 2. Se presentan gráficas de cajas y bigotes con el promedio del índice de vegetación ajustado por suelo (cruz central), los cuartiles representados por el rectángulo y los valores mínimo y máximo representados por las barras de error (E y F).
Discusión
Restauración de poblaciones de Chelonia mydas
Este es el primer estudio regional de largo plazo de las tendencias poblacionales de tortuga verde en el Atlántico mexicano y Cuba, en el que se documentan y describen los cambios de indicadores demográficos a lo largo de varias décadas, y que su tendencia positiva se asume como un reflejo de la recuperación de las poblaciones de esta especie.
Los datos de abundancia de tortuga verde en Campeche fueron los más robustos en términos metodológicos y constituyen las series de tiempo más largas e ininterrumpidas (1984-2020). Con base en la similitud de las tendencias poblacionales observadas entre las 16 playas de anidación aquí evaluadas, se asume que las series de tiempo de la anidación de la tortuga verde en este estado son representativas de los patrones demográficos generales que ocurren en otras playas del sur del Golfo de México, e incluso del noroeste del Caribe.
El análisis de los datos en distintos niveles provee una historia detallada del proceso de restauración de las poblaciones de tortuga verde a nivel regional, a la vez que documenta el cambio de estado de los indicadores demográficos para la especie. En los últimos ocho años se observa una estabilidad en la abundancia de hembras y crías, y se describe un patrón de variación bienal que es característico de Chelonia mydas. Inherentemente, este patrón se relaciona con el aumento exponencial en la abundancia de crías, gracias a los esfuerzos tempranos de conservación y protección.
El estado de recuperación de las poblaciones de tortuga verde, que se documenta en este estudio, coincide con la eficacia de los proyectos de conservación de tortuga marina reportada a nivel mundial (Mazaris et al., 2017), los cuales evidencian la resiliencia de estas especies (Ocaña et al., 2012; Gallaway et al., 2016; Ceriani et al., 2019). Una de las primeras poblaciones de tortuga verde para la que se reportó la recuperación de sus poblaciones fue la del archipiélago de Hawái en los Estados Unidos de América (Balazs y Chaloupka, 2004; Chaloupka et al., 2008; Piacenza et al., 2016). Chaloupka et al. (2008) reportaron una tasa de crecimiento anual de 13.9% (Florida, EUA) hasta 2005, similar a la calculada hasta 2019 para varias de las playas aquí estudiadas. Para la población de Hawái, se mostró que después de tres décadas de esfuerzos de conservación se podían observar condiciones demográficas claras de la recuperación poblacional, llegando al punto de argumentar el cambio de estatus de protección en su acta de especies en riesgo (ESA, por sus siglas en inglés) (USF, 1973). Una situación similar es la de Isla Ascensión, en el Atlántico Sur, donde se reportó un incremento de 285% en la abundancia de tortuga verde, tomando como referencia la década de 1970 (Broderick et al., 2006); aquí también se propuso la revisión del estatus de conservación. Estos casos de referencia muestran la relevancia de los esfuerzos de conservación y monitoreo a largo plazo, para el seguimiento de la recuperación de las especies de interés, y en este marco es necesaria la actualización de estrategias con base en la recuperación de las poblaciones.
En la actualización 2015, en los Estados Unidos de América, del acta de especies en peligro para la región del Atlántico Norte (ESA, por sus siglas en inglés), se postuló clasificar las poblaciones de C. mydas de esta región como amenazadas y dependientes de acciones de protección y conservación, pero ya no catalogarlas en peligro de extinción (Department of the Interior, 2015; Seminoff et al., 2015). En México, los documentos rectores para la recuperación de las poblaciones de las especies de fauna son los Programas de Acción para la Conservación (PACE) (Gibert Isern y Monroy Ojeda, 2015). En el caso de la tortuga verde (SEMARNAT, 2018), se requiere de una actualización para incorporar indicadores cuantitativos que permitan evaluar de forma directa la condición de las poblaciones, en términos de su abundancia y estabilidad ecológica, para identificar cuándo la especie se ha recuperado y cuándo es necesario implementar acciones de restauración para la tortuga y su hábitat. En el caso de Cuba, los indicadores que se utilizan para evaluar la recuperación de la especie se centran en mantener una tendencia positiva en el total de anidación anual y reducir las tasas de mortalidad de hembras anidantes causadas por la captura ilegal (Azanza Ricardo et al., 2018). Estos indicadores se evalúan principalmente en áreas de anidación prioritarias donde los esfuerzos de conservación han permitido alcanzar una tendencia positiva a partir de 2010, y en donde al mismo tiempo se ha reducido en más de 10% el número de hembras depredadas. Sin embargo, se reconoce que existen áreas donde se requiere intensificar estas acciones, ya que el total de nidos está disminuyendo y la captura ilegal no ha disminuido lo suficiente.
Algunas explicaciones propuestas sobre la recuperación exponencial de distintas poblaciones de esta especie son que, dada su condición históricamente mermada que provocó una baja densidad de individuos adultos reproductores, las hembras se reproducen con mayor frecuencia que en poblaciones más densas (Chaloupka et al., 2008). De igual forma, Gallegos Fernández et al. (2021) sugieren que esta especie es más resiliente que otras en la región, como la tortuga carey (Eretmochelys imbricata), debido a que tiene una mayor producción de crías por hembra anidante al año y una menor exposición a amenazas como la pesca incidental. En este contexto de crecimiento poblacional, se infiere que las condiciones ambientales y de protección constante han configurado un escenario adecuado para la recuperación de las poblaciones de tortuga verde, Chelonia mydas.
Considerando la edad de la primera anidación de la tortuga verde, estimada en más de 30 años, en el Caribe (Meylan et al., 2011), se deduce que los primeros indicios de incremento del número de hembras anidantes se observarían en la década del 2000, dado que en México y Cuba los primeros esfuerzos formales de protección se implementaron a inicios de la década de 1970. Esta condición no se observó de forma clara en ninguna de las playas de este estudio (Fig. 3).
El mayor hito en la conservación en el caso cubano ocurrió en 2008 con el cese de la captura legal, por lo que los resultados de esta medida de conservación se vieron reflejados en el incremento de hembras anidantes cerca de las áreas de pesca tradicional (Moncada Gavilán et al., 2014). No obstante, dado que la pesca ilegal e incidental persiste como amenaza para esta especie (Caderno y Moncada Gavilán, 2019), tal vez tomará más tiempo reconocer el impacto de los esfuerzos de conservación en las playas de anidación.
En México, los esfuerzos de conservación y protección más robustos ocurrieron a partir de 1990, cuando entró en vigor la veda total sobre las tortugas marinas (DOF, 1990). Por ello, los primeros indicios de recuperación de hembras adultas reclutadas en la población debieron ocurrir apenas en 2020, pero este no fue el caso. Por otro lado, Méndez Matos (2010) y Guzmán Hernández et al. (2015) sugieren una edad de primera anidación de 18 años para esta especie, y Herrera et al. (2008) reportan hembras anidantes de C. mydas en Quintana Roo, México, de entre 15 y 16 años. Estas estimaciones llevarían a los primeros indicios de hembras reproductoras reclutadas entre los años 2005 y 2008, período en el cual se registró el inicio del incremento de anidaciones y reajuste de los niveles de anidación de la especie en la región (Fig. 3). Esto indicaría que, para las poblaciones del área de estudio de esta investigación, su edad de primera anidación es similar a las de Quintana Roo, lo cual sugiere que pueden ser subpoblaciones con rasgos ecológicos y de comportamiento muy similares.
Interacción al interior del ecosistema
El presente estudio reporta por primera vez para la región de la península de Yucatán la cuantificación del aporte de materia orgánica proveniente de las nidadas de tortuga marina al ecosistema de dunas costeras, lo que representa un avance para vincular de forma directa datos derivados del monitoreo biológico de largo plazo con una métrica de la relevancia de la especie para el funcionamiento ecosistémico (Bouchard y Bjorndal, 2000). Esto ya ha sido documentado en otras regiones, en términos de cambios en la estructura e integridad de la vegetación de duna en playas de anidación, asociado con la asimilación de nitrógeno proveniente de los remanentes de las nidadas de tortugas marinas (Madden et al., 2008; Vander Zanden et al., 2012). El enriquecimiento del sustrato por acción directa de las tortugas marinas puede ser fundamental para superar la limitación de nutrientes que existe en algunas zonas de dunas costeras y que impide la colonización y regeneración natural de la vegetación nativa típica del ecosistema. En este sentido, la sucesión ecológica promovida indirectamente por el abono orgánico de las tortugas podría promover el crecimiento vegetal y con ello brindar mayor estabilidad a la duna costera en zonas de alta densidad de anidación, lo que podría disminuir el impacto de los procesos de erosión (Sigren et al., 2014; Feagin et al., 2019). Los efectos de la fertilización son acumulativos, pues al estar los nutrientes disponibles para las comunidades vegetales, se favorece el buen estado de conservación de la vegetación costera en las áreas de anidación.
Respecto a la interacción entre la abundancia de anidaciones y la composición de las comunidades vegetales de las tres zonas evaluadas con distintas densidades de anidación se observó que, aunque la estructura de esta vegetación no era muy compleja ni de gran porte, visualmente se aprecian diferencias en la cobertura y altura de las especies. Estas diferencias pudieron afectar la selección de los sitios por parte de las hembras anidantes. Estas suelen preferir lugares con vegetación poco densa, para favorecer las condiciones que tendrán las crías al momento de eclosionar, pero suficientemente cubiertos para evitar la depredación de los nidos y sitios con temperatura regular (brindada por la cobertura vegetal presente). En la Figura 8 se presentan algunas de las especies identificadas más representativas de cada zona de anidación.

Figura 8: Vista de la cobertura de vegetación de duna presente en zonas con alta, media y baja densidad de anidación de tortuga verde (Chelonia mydas Linnaeus, 1758) en la playa de Isla Aguada, Campeche, México. Zona alta: Ipomoea pes-caprae (L.) R.Br., Ambrosia hispida Torr., Heliotropium curassavicum L. Zona media: Sesuvium portuclacastrum (L.) L., Scaevola plumieri (L.) Vahl, Canavalia rosea (Sw.) DC. Zona baja: Panicum amarum (Hitchc. & Chase) P. Palmer, Coccoloba uvifera L., Tournefortia gnaphalodes (L.) R. Br. ex Roem. & Schult. Créditos de las fotografías: Eduardo Cuevas.
En términos de composición de especies, las zonas de alta, media y baja densidad de anidación, en este estudio, no fueron del todo diferentes. Si bien en dos de ellas las especies de hábito arbustivo eran más conspicuas, en todas las zonas hubo presencia de herbáceas, hábito más frecuente de encontrar en las plantas asociadas a los sitios de anidación. Fue común la presencia de I. pes-caprae, A. hispida, T. gnaphalodes, C. uvifera y Scaevola plumieri (L.) Vahl, en al menos dos de las zonas evaluadas. Todas ellas están reportadas como elementos frecuentes en las dunas costeras del estado de Campeche (Guadarrama et al., 2014; López Rosas et al., 2014; Noguera-Savelli, 2022). Estas generan una diversidad de micrositios con posibilidades de influir en la densidad de nidadas en la región; por lo tanto, además de saber cómo se caracteriza la comunidad vegetal de estas zonas, es importante determinar la condición ecológica, lo que podría inferirse a partir de los índices espectrales de vegetación.
En este sentido, una de las contribuciones del presente estudio es el reporte de las diferencias en el verdor de la vegetación entre los períodos 2007-2011 y 2015-2019 de la implementación de la norma oficial y del crecimiento exponencial de las poblaciones, es información relevante para orientar los esfuerzos de recuperación de la especie en términos de su hábitat. El conocimiento de esta función ecológica de las tortugas marinas, a través de una métrica cuantitativa (toneladas de materia orgánica), se sugiere sea un criterio en el caso de tener que manejar los remanentes de las nidadas en las playas, manteniendo el aporte que representan y su importancia para el ecosistema de playa.
Por otro lado también es importante señalar, a manera de conclusión sobre una de las interacciones conocidas entre las tortugas anidantes y las comunidades vegetales, que la vegetación pionera es alterada en zonas de muy alta actividad de anidación por la acción mecánica que realizan las hembras al construir su nido, pues cuando preparan el área remueven la vegetación provocando cambios que podrían considerarse un disturbio intermedio, promoviendo la renovación de las comunidades vegetales por sustitución de especies e individuos, principalmente de herbáceas y rastreras, que son las que son afectadas más severamente por la acción mecánica de las tortugas (Shea et al., 2004; Patrício et al., 2006). La anidación tiene incluso el potencial de cambiar el perfil de playa (Péron et al., 2013), pero también libera espacio para la colonización por parte de nuevos individuos, promoviendo la regeneración natural y los procesos de sucesión vegetal.
En este contexto de interacciones entre los componentes ecosistémicos, si bien en este estudio no se incluyó el análisis numérico de factores ambientales que pudieran influir sobre el verdor de la vegetación de duna, como la precipitación, temperatura (Valderrama-Landeros et al., 2018; Rivera-Monroy et al., 2020; Ovando-Hidalgo et al., 2020), y el impacto de eventos meteorológicos (p. ej., “nortes” en la costa Atlántica de México) (Goldenberg et al., 2001), se recomienda que en estudios subsecuentes se incluya el análisis de una serie de tiempo conformada por la totalidad de imágenes satelitales disponibles de los sensores Landsat 7 ETM v. 2.0 y 8 OLI (USGS, 2019) para los períodos evaluados junto con datos atmosféricos del mismo período, ya que representaría de forma más completa la variabilidad estacional de la vegetación en la región.
La vegetación en el medio marino está representada por praderas de pastos, cuya relevancia para la salud de los océanos y servicios ecosistémicos es conocida (Duarte et al., 2005; O’Brien et al., 2018); debido a que las tortugas verdes adultas se alimentan de ellos, documentar esa interacción resulta fundamental. La tortuga verde tiene un papel determinante en el estado de conservación de las praderas de pastos marinos: mitigan los efectos de la eutrofización mediante el ramoneo constante de sus hojas, pues al estimular la producción de las nuevas, previene activamente su envejecimiento, lo que las torna menos nutritivas y con mayores niveles de epifitismo (Bjorndal, 1980); aumentan la exportación de nutrientes y, de manera indirecta, fomentan la producción de biomasa subterránea (Christianen et al., 2012, 2021). Se considera que el declive de las poblaciones de tortugas marinas ocurrido en el siglo XIX puede ser uno de los factores en la condición multifactorial que causó la crisis de los pastizales marinos ocurrida en el siglo XX; además, se ha probado el impacto positivo de esta especie en la productividad de dichas praderas (Orth et al., 2006; Atwood et al., 2015; Johnson et al., 2017).
El Golfo de México y Caribe Occidental albergan importantes zonas de alimentación para la tortuga verde (Méndez et al., 2013; Azanza Ricardo et al., 2018; Russet Rodríguez et al., 2020; Uribe-Martínez et al., 2021). En tales zonas se espera un aumento en la densidad de individuos, producto de la recuperación de las poblaciones de la especie y, en consecuencia, también el incremento de la intensidad de la interacción entre tortugas y pastos marinos. Los resultados del presente estudio subrayan la necesidad de definir indicadores que permitan evaluar y monitorear el flujo de materia entre ecosistemas, facilitado por especies marinas clave. Este tema es aún de mayor relevancia por la condición de vulnerabilidad de la línea de costa que se está experimentado en muchos lugares, particularmente en Campeche, producto de la erosión costera (Bolongaro Crevenna Recaséns et al., 2010; Cuevas et al., 2018; Canul Turriza et al., 2018).
¿Un nuevo paradigma para especies de fauna en recuperación?
En el litoral mexicano, los programas de conservación y recuperación de especies implementados por los tres órdenes de gobierno, instituciones de investigación, organizaciones de la sociedad civil, agrupaciones comunitarias (p. ej., asambleas ejidales, grupos de voluntarios) e industria privada se han enfocado en detener la disminución de las poblaciones de interés, y el deterioro de los hábitats críticos que esas poblaciones ocupan. Estos han utilizado como indicadores de efectividad tanto el número de individuos rescatados, o que no perecieron por las distintas amenazas que enfrentan, como el número de nidadas protegidas. Esta estrategia fue necesaria para detonar la recuperación de algunas especies; sin embargo, en el caso de la tortuga marina, cinco décadas después de su implementación se refuerza la necesidad de considerar estrategias adicionales que mantengan las tendencias de recuperación para las poblaciones de tortuga marina en la región de estudio. Para ello, se requiere especificar y estandarizar los indicadores de la recuperación de las especies y los cambios a nivel ecosistémico asociados con su recuperación, así como identificar e implementar nuevas estrategias de manejo que integren diversos elementos y componentes de los ecosistemas.
En este sentido, Akçakaya et al. (2018), de la Unión Internacional para la Conservación de la Naturaleza (UICN), plantearon el diseño de una Lista Verde en la que se estudia el proceso de recuperación de especies, como una evolución y siguiente paso a la Lista Roja. Este marco conceptual remarca la importancia de evaluar las funciones ecológicas de las especies como uno de los criterios para su valoración, el seguimiento del estatus y recuperación de sus poblaciones, y de integrar métricas como el legado de la conservación. Para el caso analizado en este trabajo, por ejemplo, determinar la proporción de los individuos efectivamente reclutados a las poblaciones silvestres, que son producto directo de las acciones de conservación en las playas, continuará siendo uno de los indicadores cuya evaluación sistemática en el largo plazo es estratégica para el monitoreo de la recuperación de sus poblaciones.
Asimismo, el potencial de recuperación, que se asocia con la resiliencia de las poblaciones, es un concepto que requiere de un análisis detallado y de la definición de un conjunto de indicadores que sean prácticos, operativos y que se postulen como alternativa para la medición de este concepto poblacional. La diversidad de los servicios ecosistémicos asociados con cualquiera que sea la especie de interés, así como la magnitud del impacto negativo que sufre por distintas amenazas, y que alteran la dinámica de sus servicios ecosistémicos (p. ej., materia orgánica aportada), son propuestas de indicadores que nos permitirán monitorear fielmente el estatus de su recuperación, y que junto con los indicadores demográficos usuales (p. ej., cantidad de hembras anidantes, período remigratorio de las hembras, relación entre el número de machos y de hembras reproductores), se tendrá una visión más completa de la condición de las poblaciones, en este caso particular, de las poblaciones de tortugas marinas. La información aquí presentada sobre el proceso de recuperación de la tortuga verde en la región, junto con los indicadores de su función ecológica, es información estratégica y se espera que contribuya a definir nuevas prácticas de manejo y restauración del equilibrio ecosistémico marino, incluyendo indicadores cuantitativos de interacciones ecosistémicas.
En este sentido, Westwood et al. (2014) reconocen cinco etapas en el proceso de recuperación de una especie: (1) diagnosis, (2) tratamiento, (3) estabilización, (4) rehabilitación y (5) estado recuperado. Las evidencias mostradas en este trabajo sugieren que las poblaciones de tortuga verde en la región se encuentran entre las etapas tres y cuatro. Estas etapas van de un proceso de estabilización de su tendencia poblacional (según el número de anidaciones y la relación parentela-progenie) por un período de diez años o tres generaciones, a una tendencia marcada de incremento poblacional por al menos diez años o tres generaciones. La validación de la cuarta etapa requiere de datos que muestren un período de evaluación a largo plazo (tal vez entre 25 y 30 años) del crecimiento poblacional. Esto demanda el mantenimiento de las acciones, con robustez técnica y científica, que han llevado a los resultados cuantificables, efectivos y eficientes que han permitido evaluaciones cuantitativas sólidas como las realizadas en este estudio. De esta manera se asegura el impacto positivo que ha brindado la inversión histórica de numerosos recursos para la recuperación de estas especies que representa el legado de la conservación (Akçakaya et al., 2018), y también sustenta la planificación de estrategias de adaptación a las nuevas condiciones demográficas y ecosistémicas que supone esta recuperación.
Con esta reflexión se busca ampliar la visión de uno de los paradigmas más antiguos en la conservación marina en México: el monitoreo biológico en playas de anidación de tortugas marinas que por décadas se ha enfocado a proteger a los individuos en la playa (Guzmán, 2021). También, a considerar acciones innovadoras para adaptarse a las nuevas condiciones de recuperación de las especies (p. ej., protocolos para conteos rápidos y diseño muestral en zonas de alta abundancia de nidos) y a evaluar la intensidad de las interacciones entre flora y fauna que influye en el crecimiento de sus poblaciones (p. ej., aportación de materia orgánica y procesos de denso-dependencia).
Con este análisis se propone el tránsito de una aproximación de la mera actividad de protección y monitoreo de los individuos, asumido como conservación, hacia una visión que incluya la evaluación del crecimiento poblacional, pero que cuantifique indicadores del número de individuos que se reclutan a sus poblaciones y sus interacciones ecosistémicas durante el proceso de la recuperación de las poblaciones. Esta visión está alineada con la aproximación impulsada por la UICN en su Lista Verde (Akçakaya et al., 2018). Se pretende que este nuevo paradigma primero sea implementado en Playas Índice, donde las condiciones técnicas y de monitoreo estén plenamente controladas, para eventualmente evolucionar a escala nacional. Con esta visión se espera construir modelos de manejo y restauración ecosistémica integrales que contemple a las tortugas marinas como parte del ecosistema y no solo como esfuerzos de recuperación focales y centrados en la especie.
Asimismo, se resalta la innovación de este estudio que enfatiza la oportunidad de enlazar estudios faunísticos y florísticos en un contexto de recuperación de una especie en peligro de extinción y analiza las implicaciones ecosistémicas para la restauración de funciones ecológicas en el ecosistema de dunas costeras. Al respecto, la falta de una visión ecosistémica más amplia en México se ha evidenciado a través de las pocas acciones específicas de restauración ecológica que se han planificado e implementado a partir de los Programas de Acción para la Conservación de Especies en México (Gómez-Ruíz et al., 2020). Desde la óptica de la recuperación de las poblaciones de especies marinas prioritarias para la conservación, como lo son algunas especies de tortuga marina (Chelonia mydas, Lepidochelys kempii, Lepidochelys olivacea Eschscholtz, 1829), se abre un campo de oportunidad único e innovador en el ámbito de la restauración ecológica como especialidad transdiciplinaria para trabajar de forma integral los casos de recuperación de especies de fauna. Esto permitirá medir interacciones entre flora y fauna, cuantificar servicios ecosistémicos y evaluar los cambios de la restauración de las poblaciones de fauna asociados a los distintos ecosistemas; conocimiento que en última instancia se espera incida sobre la planeación, la implementación y la evaluación de las políticas públicas en los planes nacionales de recuperación.











 text new page (beta)
text new page (beta)



