Introducción
Los bosques de coníferas en México contienen grupos de entidades biológicas de relevancia evolutiva y alto potencial de uso (Delgado y Piñero, 2008). Están representados mayormente por especies del género Pinus L., género que incluye más de 50% de los taxa existentes a nivel mundial, con 52 especies, dos subespecies, 14 variedades y cuatro formas (Perry, 1991), de los cuales 22 son endémicos (Gernandt y Pérez-de la Rosa, 2014). Por lo anterior, México es considerado como su segundo centro de diversificación en el mundo (Farjon y Styles, 1997; Ledig, 1997; Gernandt y Pérez-de la Rosa, 2014).
Las especies de Pinus se distribuyen en condiciones ambientales contrastantes, en altitudes cercanas al nivel del mar (Pinus caribaea Morelet var. hondurensis (Sénécl.) W.H. Barret ( Golfari) o superiores a los 4000 m (Pinus hartwegii Lindl.) (Farjon y Styles, 1997). Muchas de sus especies habitan en un ambiente de clima templado (Pinus montezumae Lamb. y Pinus pseudostrobus Lindl.), otras viven en lugares semidesérticos, como casi todos los piñoneros (Pinus johannis M.F. Robert, Pinus cembroides Zucc.) o en un ambiente más tropical como Pinus chiapensis (Martínez) Andresen o P. caribaea var. hondurensis (Piñero, 2004).
Los usos de los integrantes de Pinus también son muy variados, se utilizan como plantas ornamentales, para la producción de madera, resinas y productos derivados y en servicios ecosistémicos como captura de carbono, recarga de mantos acuíferos y regulación del clima. Las semillas de muchas de las especies son usadas como comestibles y otras, para la producción de plantas con fines de reforestación y restauración (Eguiluz, 1978; CONAFOR, 2005). Dos de las especies que más se han utilizado con este fin son Pinus pseudostrobus y P. montezumae, quienes ocupan el primero y segundo lugar, respectivamente, en cuanto a la producción de plantas en vivero para actividades de restauración y reforestación de los bosques templados en México, principalmente en la zona centro del país (Michoacán, Puebla, Estado de México, Hidalgo, Morelos y Tlaxcala) y en el sureste, en los estados de Chiapas y Oaxaca (PRONARE, 2000; CONAFOR, 2005; SEMARNAT, 2009). Así mismo, son dos de las especies más utilizadas para el desarrollo de plantaciones forestales comerciales debido a su capacidad de crecimiento rápido y calidad maderable (Eguiluz, 1978; Clausen et al., 1994; CONAFOR, 2005).
Ambas especies presentan distribución amplia, pero es más continua en las poblaciones de P. pseudostrobus, que en las de P. montezumae (Perry, 1991; Farjon y Styles, 1997). Las dos especies contienen poblaciones alopátricas y simpátricas; en la Faja Volcánica Transmexicana, y en menor proporción en la Sierra Madre del Sur y Sierra de Chiapas, habitan la mayoría de las poblaciones simpátricas (Perry, 1991; Styles, 1993; Delgado et al., 2007). Pinus pseudostrobus también se ha reportado en la parte sur de la Sierra Madre Occidental, y P. montezumae en la porción centro-sur de la Sierra Madre Oriental (Perry, 1991; Farjon y Styles, 1997). intervalo altitudinal en donde se distribuyen ambas especies también es similar, P. pseudostrobus entre 1600 y 3200 m y P. montezumae entre 1150 y 3500 m (Perry, 1991). Por lo tanto, se tiene un escenario o patrón geográfico conformado por bosques puros y de coexistencia (mezclados) (Perry, 1991; Farjon y Styles, 1997).
Pinus pseudostrobus y P. montezumae pertenecen a la subsección Ponderosae, y aunque son dos entidades filogenética y taxonómicamente distintas (Gernandt et al., 2005), tienen gran capacidad de hibridizar, lo cual ha sido documentado con base en caracteres morfológicos, anatómicos y moleculares (Martínez, 1948; Mirov, 1967; Perry, 1991; Delgado et al., 2007). Las características mencionadas hacen de estas especies un modelo interesante que podría aportar información sobre la hipótesis de conservadurismo del nicho, la cual plantea que los linajes o especies cercanamente relacionadas tienden a mantener u ocupar nichos ecológicos ancestrales similares (Harvey y Pagel, 1991; Peterson et al., 1999, Petitpierre et al., 2012; Pyron et al., 2015). Es decir, nichos ambientalmente estables a través del tiempo, donde sus especies se adaptan más lentamente a los cambios ambientales en comparación a especies con una divergencia reciente, y por tanto tienen un mayor riesgo a la extinción (Petitpierre et al., 2012).
Pinus montezumae y P. pseudostrobus no están consideradas en riesgo o en peligro de extinción; sin embargo, en la actualidad se ha observado una disminución de sus poblaciones, debido fundamentalmente a su sobrexplotación, donde varias de las poblaciones (Michoacán, Estado de México, Puebla y Chiapas) que habían sido reportadas por algunos autores (Madrigal, 1986; Perry, 1991; Farjon y Styles, 1997) ya no existen, mientras que otras poblaciones están conformadas por fragmentos o parches de bosques aislados (Delgado et al., 2015). Lo anterior, aunado al calentamiento global, podría alterar su hábitat natural, con tamaños poblacionales cada vez más pequeños y con efectos negativos en muchos de sus procesos adaptativos, fisiológicos y/o reproductivos. Por ejemplo, podría disminuir la producción de semillas viables e incrementar los niveles de endogamia y acelerar la extinción de poblaciones locales (Delgado y Piñero, 2008; Delgado et al., 2015). Por lo tanto, el conocimiento del nicho ecológico de las especies es clave para discernir los patrones ambientales y geográficos de su distribución; información previa que es necesaria para poder conservar y utilizar los recursos genéticos de un ecosistema de manera sustentable (Hernández-Ruíz et al., 2016).
Las herramientas para producir modelos de nicho ecológico de las especies (MNE) se han usado para entender cómo éste puede o no cambiar (contraerse, expandirse o persistir) en un espacio ambiental y geográfico (Warrent et al., 2010; Peterson, 2011, Broennimann et al., 2012). Sin embargo, han sido poco usadas para conocer y predecir la distribución de especies de pinos en México, tanto en el periodo presente (Aguirre y Duivenvoorden, 2010; Leal-Nares et al., 2012; Ávila-Coria et al., 2014; Aguirre-Gutiérrez et al., 2014; García-Aranda et al., 2018), como en escenarios pasados (Moreno-Letelier et al., 2013) o futuros (Sáenz-Romero et al., 2010, 2015; Pérez-Miranda et al., 2013; Cruz-Cárdenas et al., 2016). Además, no existe ningún estudio que incorpore estas herramientas para la predicción y selección de áreas productoras de semillas, conocimiento central para el planteamiento de esquemas de manejo y conservación de este grupo de especies.
Las áreas productoras de semillas funcionan como reservorios de material biológico y como fuente de materia prima para la obtención de plantas destinadas a las actividades de restauración, reforestación y mejoramiento genético (CONAFOR 2005). Los criterios para su selección han surgido a partir de tratamientos silvícolas, basados fundamentalmente en la selección de árboles que presentan características dasométricas sobresalientes (p. ej. alturas y diámetros dominantes, cobertura de copa, fustes rectos y/o edad productiva) (Niembro, 1985; Zobel y Talbert, 1988; Niensteadt et al., 1990). Además, se ha propuesto el establecimiento de áreas semilleras con base en la zonificación ambiental de rodales naturales donde se analizan variables geográficas (latitud, longitud y altitud) y ecológicas (clima, suelo, topografía, pendiente entre otras) relacionadas con la distribución de las especies (Sáenz-Romero y Clausen, 1991; Sáenz-Romero et al., 2006; CONAFOR, 2012; Castellanos-Acuña et al., 2018).
En este estudio se analizaron datos geográficos y ambientales (climáticos, edáficos y topográficos) para probar la hipótesis de que el nicho ecológico de P. montezumae es similar y equivalente al de P. pseudostrobus. Los objetivos específicos fueron i) modelar el nicho ecológico de P. montezumae y P. pseudostrobus en México, ii) evaluar y comparar la similaridad y equivalencia de la idoneidad del nicho entre las áreas de distribución de las dos especies, y iii) proponer zonas geográficas potenciales para la delimitación de áreas productoras de semillas y de conservación representativas de cada especie.
Materiales y Métodos
Área de estudio
El área de estudio considera parte de las provincias fisiográficas: Sierra Madre Oriental, Faja Volcánica Transmexicana, Mesa del Centro, Cordillera Centroamericana, Sierra Madre del Sur y Sierra de Chiapas (INEGI, 2001) (Fig. 1).
Obtención de datos
Se usaron tres tipos de registro de presencia de especies: 1) base de datos Global Biodiversity Information Facility (GBIF, 2016), 2) Herbario Nacional MEXU (UNAM, 2016) y 3) datos georreferenciados en campo. De las dos primeras fuentes se obtuvieron 351 registros para P. montezumae (1934-2015) y 411 para P. pseudostrobus (1966-2014); mientras que de los datos georreferenciados en campo se obtuvieron 30 y 41 registros para cada especie, respectivamente (2013-2014). En total se contó con 381 registros para P. montezumae y 452 para P. pseudostrobus. Los datos fueron depurados dejando un solo registro por celda (1 km2) con el uso del programa NicheToolBox de la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Osorio-Olvera et al., 2016).
Variables predictoras
La construcción de los modelos de nicho ecológico (MNE) se hizo con 19 variables bioclimáticas descargadas de la plataforma de la Unidad de Información para las Ciencias Atmosféricas y Ambientales (UNIATMOS-UNAM) (Fernández-Eguiarte et al., 2011), las cuales representan el comportamiento climático promedio en México para los años 1902-2011, a una resolución espacial de 1 km2. Para descartar aquellas variables redundantes (coeficiente de correlación (0.85), se hizo un análisis de correlación de Pearson entre cada uno de los valores puntuales de las 19 capas bioclimáticas con el uso del programa R (R Core Team, 2016). Esto ayudó a evitar el efecto de multicolinearidad y maximizar la contribución de las variables a los modelos (Peterson y Nakazawa, 2008; Ortego et al., 2014; Monterubio-Rico et al., 2016), seleccionando 10 de las 19 variables bioclimáticas (Cuadro 1). También se incluyeron las variables pendiente (%), orientación (°), altitud (m) y suelo (tipo). Las tres primeras variables fueron obtenidas a partir de un Modelo Digital de Elevación del Instituto Nacional de Estadística, Geografía e Informática (INEGI, 2016), y el suelo de las capas disponibles por la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO, 1995). En total se analizaron 14 variables ambientales (Cuadro 1).
Cuadro 1: Variables ambientales utilizadas en la creación de los modelos de nicho ecológico para Pinus montezumae Lamb. y P. pseudostrobus Lindl. (correlaciones<0.85).
| Código | Descripción de variables (unidades en paréntesis) | Especie |
| Bio1 | Temperatura promedio anual (°C) | Ambas |
| Bio2 | Oscilación diurna de la temperatura (°C) | Ambas |
| Bio3 | Isotermalidad (°C) | Ambas |
| Bio4 | Estacionalidad de la temperatura (desviación estándar *100) (°C) | P. pseudostrobus Lindl. |
| Bio7 | Oscilación anual de la temperatura (°C) | P. montezumae Lamb. |
| Bio12 | Precipitación anual (mm) | Ambas |
| Bio14 | Precipitación del periodo más seco (mm) | P. pseudostrobus Lindl. |
| Bio15 | Estacionalidad de la precipitación (Coeficiente de variación) | Ambas |
| Bio18 | Precipitación del trimestre más cálido (mm) | Ambas |
| Bio19 | Precipitación del trimestre más frío (mm) | P. montezumae Lamb. |
| Pnd | Pendiente (°) | Ambas |
| Alt | Altitud (m) | Ambas |
| Or | Orientación (%) | Ambas |
| Sue | Suelo (tipo) | Ambas |
Delimitación del área M
El área accesible M de cada especie se ha descrito como el espacio donde una especie está o se asume que podría estar dado el conocimiento biológico que se tiene de ella y de su capacidad de dispersión por no existir barreras ambientales que pudieran limitar su establecimiento (Soberón y Peterson, 2005; Martínez-Méndez et al., 2016). Para delimitarla se usaron las Subprovincias Fisiográficas de México (INEGI, 2001), eligiendo aquellas que coincidían con la ubicación de los registros seleccionados, así como las contiguas a ellas, donde podrían estar presentes las especies (Martínez-Meyer, 2005; Martínez-Méndez et al., 2016). A partir de la delimitación del área M, se recortaron las capas ambientales para cada especie en formato ASCII con el uso del programa ArcGis ver 10.3® (ESRI, 2014).
Generación de modelos de nicho ecológico
La modelación del nicho ecológico se hizo con el programa MaxEnt versión 3.3.3 (Phillips et al., 2006), el cual está fundamentado bajo el principio de máxima entropía. El algoritmo calcula la probabilidad de áreas idóneas para la distribución de las especies a partir de datos de presencia, no requiere datos de ausencia y genera buenas predicciones, aun cuando las muestras son pequeñas (Phillips et al., 2006; Pearson et al., 2007). Se supone que el ambiente en los puntos de observación de una especie representa la gama ambiental del organismo, de tal forma, que las 78variables ambientales se utilizan como sistema de calibración para proponer un modelo de la probabilidad de presencia. Acorde con esta relación (sitios conocidos y su ambiente), el algoritmo explora e identifica sitios (celdas) a partir de los puntos de presencia de las especies hacia otras áreas donde se desconoce su presencia o ausencia (Lindermayer et al., 1996).
En principio, con el uso de los registros de ambas especies se probaron tres modelos para ver cual se ajustaba mejor a la distribución de cada una, considerando diferentes reglas de aplicación umbral: 1) máxima prueba de sensibilidad más (plus) especificidad, 2) igual prueba de sensibilidad y especificidad, y 3) sin aplicación de regla de umbral (determinado en el programa por omisión).
Se usó 75% de los datos de presencia para el entrenamiento y 25% de los datos para su validación con 1000 iteraciones de remuestreo con remplazo (Bootstrap) y el límite de convergencia se fijó en 0.00001 (valor por omisión) (Phillips et al., 2006). Se desactivaron las opciones Extrapolate y Do clamping con el fin de evitar extrapolaciones artificiales en los valores extremos de las variables ecológicas (Elith et al., 2011).
Para los tres modelos se obtuvo una salida de tipo logística, que sugiere un índice de idoneidad de 0 a 1. Valores bajos indican que las condiciones no son idóneas para la presencia de la especie, mientras que valores superiores a 0.5 indican que las condiciones son adecuadas para la especie (Coitiño et al., 2013).
Validación de los modelos
Los modelos fueron evaluados con pruebas de precisión. Se analizó el área bajo la curva (AUC, por sus siglas en inglés) que se obtiene directamente de la técnica Receiver Operating Characteristic (ROC estándar). Los valores del AUC entre 0.7 y 0.9 se consideran como buenos, y los modelos con valores por arriba de 0.9 se consideran excelentes (Peterson, 2011). La significancia estadística de predicción se realizó mediante los 11 test binomiales de omisión generados, los cuales deben ser significativos con un valor de confiabilidad de 99% (Romo et al., 2013).
Debido a que la validación de los modelos por medio de ROC estándar ha sido cuestionada al no considerar las ausencias y al darle el mismo peso a los errores de omisión y de comisión (Lobo et al., 2007; Peterson et al., 2008), los modelos también fueron analizados con la prueba de ROC parcial, con el uso del programa Tool for Partial-ROC (Barve, 2008). Esta técnica se desarrolló para contrarrestar las diferencias o error de la curva AUC (Peterson et al., 2008).
Se hicieron corridas para cada uno de los tres modelos iniciales, usando 50% de evaluación independiente de los datos de presencia, con 1000 réplicas de remuestreo Bootstrap, y fijando un error de omisión de 5%. El mejor modelo se seleccionó con base al valor más alto de AUC; valores mayores a 1 indican que las predicciones se deben a la modelación y no al azar (Peterson et al., 2008; Garza-López et al., 2016). Además, se hizo una prueba estadística de Z, la cual sirvió para determinar si los modelos eran estadísticamente válidos (Martínez-Méndez et al., 2016). Las proyecciones de los modelos fueron visualizadas con el programa ArcGIS 10.3® (ESRI, 2014).
Traslape de nichos entre las especies
Para evaluar y comparar la idoneidad del nicho (variables ambientales) entre las áreas geográficas de distribución de las dos especies, se hizo un análisis de traslape de nicho, usando los índices D (equivalencia de nicho) e I (similaridad de nicho), implementados en el programa ENMTools versión 1.4 (Warrent et al., 2008, 2010). Ambos índices toman valores entre 0 (no traslape) y 1 (traslape total, sugiriendo modelos idénticos). También se hizo un análisis de similaridad del nicho con 100 pseudoreplicas para generar un modelo de distribución nula y probar la hipótesis de que los modelos de nicho ecológico generados con MaxEnt (empíricos) son similares a los esperados, bajo el supuesto de que las especies presentan un espacio ambiental similar (traslape) (Warrent et al., 2008). La hipótesis se rechaza si los valores observados de D o I son significativamente menores que los valores esperados (Warrent et al., 2010). El soporte estadístico se realizó con una prueba de Z de dos vías para cada parámetro antes mencionado, con una probabilidad α de 0.05.
Áreas productoras de semillas y de conservación
La selección de áreas productoras de semillas y de conservación se basó en la evaluación de la calidad de estación de los rodales (Huang et al., 1992). Ésta refleja la capacidad productiva de los sitios a través de la altura dominante de los árboles y de la relación alométrica que proponen Huang et al.(1992), Lappi (1997) y Lei y Parresol (2001), con un incremento proporcional entre la altura y el diámetro normal del arbolado, por lo cual los sitios con árboles que presenten valores altos de estas variables tendrán teóricamente un mayor rendimiento. Para ese análisis se usaron los datos ambientales que definieron la distribución de cada especie y los dasométricos de altura y diámetro normal en formato raster obtenidos del Inventario Nacional Forestal y de Suelos (INFyS) de la Comisión Nacional Forestal (CONAFOR, 2016).
Se usó el área M de la modelación de las especies para delimitar las capas raster del INFyS, sobre las cuales se usaron las coordenadas geográficas de los registros de las dos especies y se extrajeron los valores puntuales de altura y diámetro máximos de cada árbol. Esto es, cada uno de los puntos georeferenciados tiene un valor de pixel en el área M del raster, el cual equivale a un dato de diámetro en centímetros y altura máxima en metros para cada individuo. A partir de esta información se clasificaron los valores en cinco categorías para identificar zonas de diferente calidad de estación o sitio; calidad muy baja, media, alta y muy alta para cada especie. Finalmente, para corroborar los resultados de los mejores sitios, se hicieron análisis de regresión lineal simple entre los valores totales del diámetro normal y altura máxima para cada árbol por especie (obtenidos como se mencionó anteriormente); se espera que las zonas de mayor calidad de sitio presenten árboles con los valores más altos de diámetro normal y altura. Los análisis se obtuvieron con el uso del programa Statgraphics Centurion versión 15.2.06 (StatPoint Inc., 2007).
Resultados
Modelos de nicho ecológico
La compilación de los registros finales para la modelación, después del proceso de depuración, fue mayor para P. pseudostrobus con 109 registros, mientras que en P. montezumae quedaron 85. En total, para la delimitación del área M se usaron 43 subprovincias fisiográficas, 21 de ellas contienen los registros de las especies (Apéndice). Para P. pseudostrobus los registros se distribuyen en un número mayor de subprovincias fisiográficas (19) que en P. montezumae (15). Trece subprovincias son similares para las dos especies, dos están presentes solo en P. montezumae y seis solo en P. pseudostrobus (Apéndice).
Los 11 test binomiales de omisión usados para la validación de la prueba de ROC estándar de los tres modelos (máxima prueba de sensibilidad más (plus) especificidad, igual prueba de sensibilidad y especificidad, y sin aplicación de regla de umbral) fueron significativos para ambas especies (p<0.01). Los modelos presentaron valores de AUC similares y superiores a 0.9, lo que indica que el desempeño fue excelente en ambos casos. Los valores del AUC para P. montezumae fueron 0.978-0.986 para los datos de entrenamiento y 0.836-0.938 para los de validación. Para P. pseudostrobus los valores del AUC fueron 0.966-0.976 para los datos de entrenamiento y 0.897-0.934 para la validación. La prueba de Z corrobora estos resultados, siendo los tres modelos estadísticamente significativos (p<0.01). Sin embargo, cuando se aplicó la prueba de ROC parcial, el modelo 1 (Máxima prueba de sensibilidad más (plus) especificidad) fue el que presentó el mejor ajuste para P. montezumae con un valor de AUC de 0.986 para el entrenamiento, 0.938 para la validación, y uno de ROC parcial de 1.312 (valores mayores a 1, son catalogados como buenos). Para P. pseudostrobus el modelo 2 (igual prueba de sensibilidad y especificidad) presentó los valores más altos del AUC, 0.970 y 0.934 para el entrenamiento y validación respectivamente, y uno de ROC parcial de 1.381. Lo anterior indica que para ambas especies los modelos son estadísticamente mejores que el azar (Cuadro 2).
Cuadro 2: Pruebas de Receiver Operating Characteristic (ROC) parcial y de Z para tres modelos de nicho ecológico obtenidas para los datos históricos de Pinus montezumae Lamb. y P. pseudostrobus Lindl.
| Especie | Modelo | Valores de ROC parcial |
Desviación estándar |
Prueba Z Valor p |
| Pinus montezumae Lamb. | -Máxima prueba de sensibilidad más (plus) especificidad | 1.312 | ±0.198 | <0.01 |
| -Igual prueba de sensibilidad y especificidad | 1.159 | ±0.124 | <0.01 | |
| -Sin aplicación de una regla de umbral | 1.182 | ±0.140 | <0.01 | |
| Pinus pseudostrobus Lindl. | -Máxima prueba de sensibilidad más (plus) especificidad | 1.1 | ±0.040 | <0.01 |
| -Igual prueba de sensibilidad y especificidad | 1.381 | ±0.186 | <0.01 | |
| -Sin aplicación de una regla de umbral | 1.369 | ±0.196 | <0.01 |
La modelación de nicho ecológico indica que las dos especies presentan zonas muy similares de alta idoneidad (colores cálidos, Fig. 2), generalmente distribuidas en la Faja Volcánica Transmexicana y en la Sierra Madre del Sur, con diferencias solo en la zona norte dentro de la Sierra Madre Oriental para P. montezumae (Fig. 2 A). La mayor contribución a los modelos para P. pseudostrobus fueron las variables Bio1 (temperatura promedio anual: 41.3%), Sue (Suelo: 18.3%) y Bio12 (precipitación total anual: 14.3%). En contraste, para P. montezumae, las variables que tuvieron la mayor contribución al modelo fueron Sue (Suelo: 31.1%), Dem (altitud: 29%) y Bio1 (temperatura media anual: 20.5%), ambos modelos presentan en común las variables Sue y Bio1, aunque en diferentes proporciones (Cuadro 3).
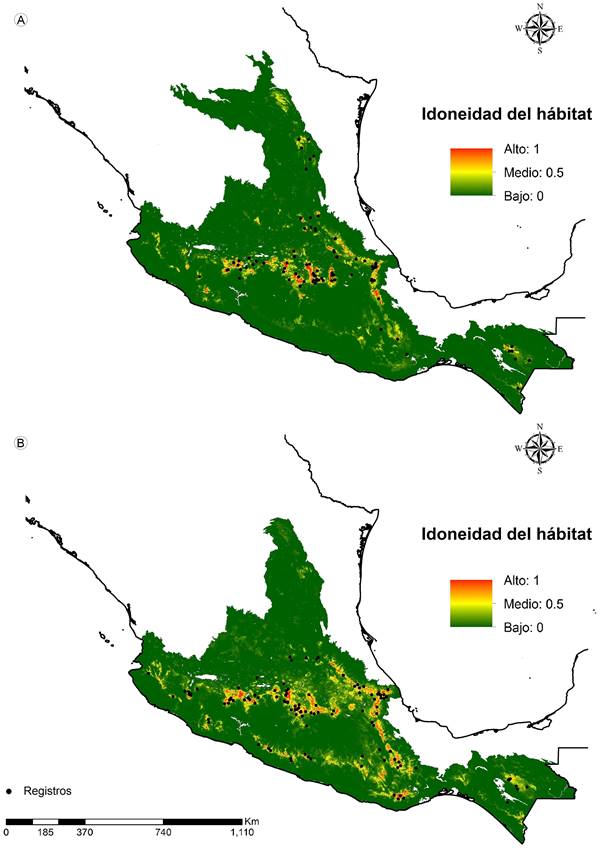
Figura 2: Proyección geográfica de la modelación potencial de nicho ecológico para Pinus montezumae Lamb. (A) y P. pseudostrobus Lindl. (B) respectivamente.
Cuadro 3: Variables de contribución a los modelos históricos y actuales generados para P. montezumae Lamb. y P. pseudostrobus Lindl., en México.
| Especie | Variable | Porcentaje de contribución (%) |
| Pinus montezumae Lamb. | Sue | 31.1 |
| Dem | 29 | |
| Bio1 | 20.5 | |
| Bio12 | 10 | |
| Bio2 | 7.4 | |
| Bio7 | 1.4 | |
| Pen | 0.2 | |
| Bio15 | 0.2 | |
| Bio3 | 0.1 | |
| Asp | 0.1 | |
| Bio19 | 0 | |
| Bio18 | 0 | |
| Pinus pseudostrobus Lindl. | Bio1 | 41.3 |
| Sue | 18.3 | |
| Bio12 | 14.3 | |
| Dem | 9.9 | |
| Bio4 | 6.1 | |
| Pen | 4.8 | |
| Bio2 | 2.1 | |
| Bio18 | 0.9 | |
| Asp | 0.9 | |
| Bio14 | 0.7 | |
| Bio15 | 0.5 | |
| Bio3 | 0.2 |
Traslape de nichos entre las especies
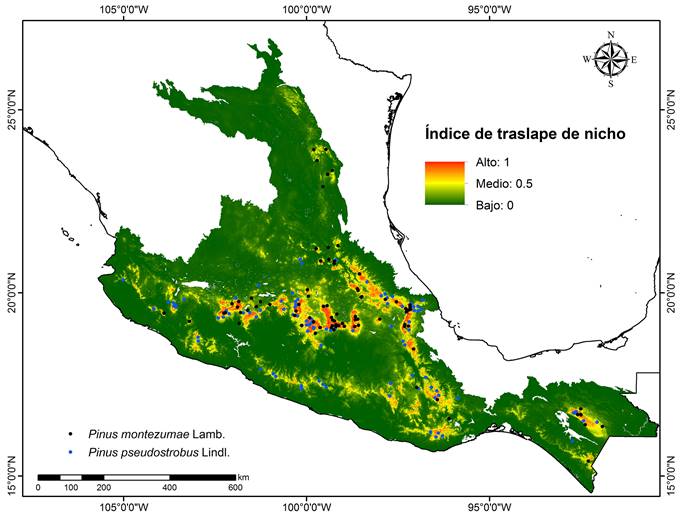
El análisis de traslape de nicho muestra que el valor observado de equivalencia (D=0.430) fue menor al valor de similaridad (I=0.610), lo que sugiere que las especies tienen un nicho similar (espacio ambiental) pero que este no es equivalente o idéntico en su totalidad. Los resultados del modelo de distribución nula generado con 100 pseudoréplicas, fueron de 1 para ambas métricas y significativos con relación a los valores observados (p<0.001), por lo que la hipótesis de identidad del nicho se rechaza, apoyando la no existencia de un traslape total del nicho ecológico de estas dos especies (Fig. 3).
Áreas productoras de semillas y de conservación
La zona con los valores máximos de altura (>30 m) se encuentran en la Faja Volcánica Transmexicana, subprovincias fisiográficas Lagos y Volcanes de Anáhuac, Volcanes de Colima, Neovolcánica Tarasca y Mil Cumbres, para ambas especies, seguida de la Sierra Madre del Sur (21-30 m), y en las subprovincias Cordillera Costera del Sur, Sierras Orientales y Altos de Chiapas para P. pseudostrobus (Fig. 4). Los valores máximos de diámetro se presentan en la zona sur (Sierra de Chiapas) y en la Faja Volcánica Transmexicana (>80 cm) para las dos especies. Los valores más bajos de altura y diámetro se presentan hacia la Sierra Madre Oriental (subprovincia de Carso Huasteco y Gran Sierra Plegada) para P. montezumae y en una porción de la Faja Volcánica Transmexicana, hacia Veracruz y Puebla para P. pseudostrobus (subprovincias de Chiconquiaco y Sierra del Sur de Puebla). Por lo tanto, la zona con la mejor calidad de sitio se encuentra dentro de la Faja Volcánica Transmexicana para las dos especies, junto con la Sierra Madre del Sur para P. pseudostrobus, alcanzando la zona sur de su distribución en Oaxaca y Chiapas.

Figura 4: Calidad de sitio, modelado con datos dasométricos de altura y diámetro normal para Pinus montezumae Lamb. (A y B) y P. pseudostrobus Lindl. (C y D) en México.
Este comportamiento también se puede observar con los resultados de la correlación entre el diámetro normal y la altura de los árboles, que fueron significativas para cada especie (p=0.001; Figs. 5A, B). Los valores máximos de diámetro y altura se presentan generalmente en la Faja Volcánica Transmexicana para ambas especies, así como de P. pseudostrobus en la Sierra Madre del Sur y en la Sierra Madre Oriental para P. montezumae.
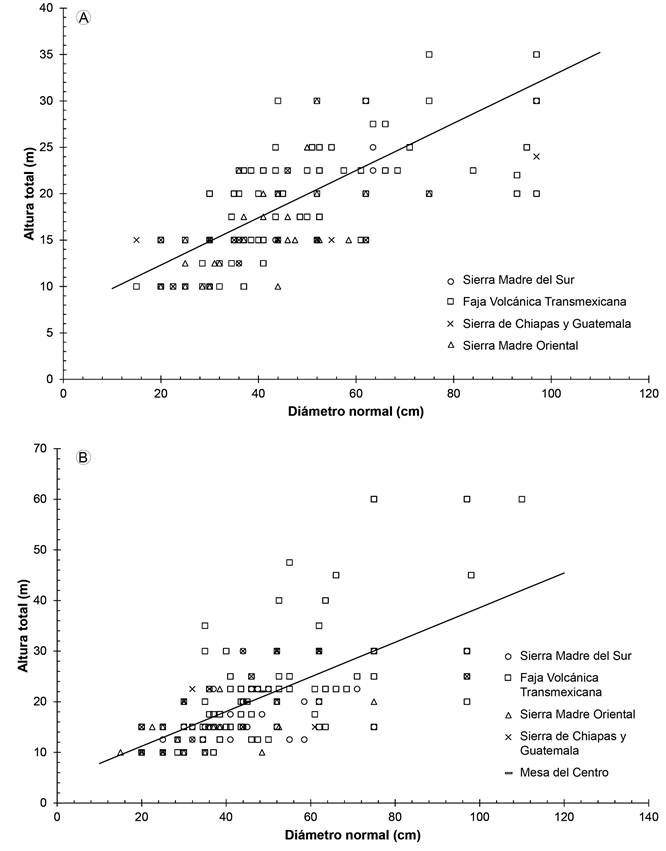
Figura 5: Asociación de variables dasométricas de los árboles distribuidos en diferentes provincias fisiográficas de México. A. relación entre el diámetro normal y altura para Pinus montezumae Lamb. (y=7.229+0.255x; r=0.794); B. relación entre el diámetro y altura para P. pseudostrobus Lindl. (y=4.372+0.342x; r=0.728).
Se observa una dispersión importante de los datos en ambas especies, sugiriendo una mayor heterogeneidad para P. pseudostrobus (Fig. 5B). No obstante, las correlaciones significativas nos permiten corroborar que la calidad de estación es un factor importante que influye en las características dasométricas de las especies.
Discusión
Modelación de nicho ecológico
Los modelos de nicho ecológico generados para las dos especies fueron robustos de acuerdo con las pruebas de ROC estándar y ROC parcial, y diferenciales solo al aplicar la prueba de ROC parcial. El modelo 2 (igual prueba de sensibilidad y especificidad) tuvo el mejor desempeño para P. montezumae (valor promedio de 1.312), mientras que para P. pseudostrobus lo fue el modelo 1 (máxima prueba de sensibilidad más (plus) especificidad) (valor promedio de 1.381). Esto indica que para ambas especies los modelos son estadísticamente mejores que una modelación al azar (valores>1) (Peterson et al., 2008; Garza-López et al., 2016). La generación de estos modelos, catalogados como buenos, también se debió a que se usaron registros de toda el área que ocupan las dos especies y de áreas contiguas a éstas para no excluir la posibilidad de su presencia en otras zonas no reportadas, delimitadas con el uso de las subprovincias fisiográficas de México que ubican de una manera más fina la distribución de las mismas (Martínez-Meyer, 2005); es decir, el área M de alta idoneidad o accesibilidad de las especies de acuerdo al modelo de BAM (Soberón y Peterson, 2005).
A partir de esta información la modelación de los datos demuestra que ambas especies ocupan un área geográfica similar dentro de la categoría de bosques templados y comparten registros en 13 de las 19 subprovincias incluidas en las provincias fisiográficas de la Faja Volcánica Transmexicana y Sierra Madre del Sur. Sin embargo, el nicho ecológico idóneo para P. montezumae se presenta a una mayor altitud (2000-3550 m) que P. pseudostrobus, con requerimiento de suelo tipo Andosol, donde ambas variables presentan porcentajes similares en su contribución al modelo. Pinus pseudostrobus requiere de temperaturas constantes durante el año (Bio1: 9-22.2 °C), suelos también de tipo Andosol y precipitaciones promedio durante todo el año (Bio12: 1162 mm), por lo que la temperatura es su principal factor limitante, mientras que para P. montezumae son el tipo de suelo y la altitud, lo cual sugiere que los nichos ecológicos de las dos especies no son completamente idénticos.
Aunque en la actualidad existen pocos estudios sobre modelación de nicho ecológico en especies de coníferas y muchos de ellos son realizados a nivel regional (Aguirre y Duivenvoorden, 2010; Sáenz-Romero et al., 2012; Ávila-Coria et al., 2014; Moreno-Letelier et al., 2013; Aguirre-Gutiérrez et al., 2014; Cruz-Cárdenas et al., 2016), los resultados pueden ser comparables con algunos de ellos, como el realizado para dos especies de Abies Mill. y 10 de Pinus distribuidos en el estado de Michoacán, donde las provincias de mayor distribución potencial fueron las mismas que en el presente estudio (Faja Volcánica Transmexicana y Sierra Madre del Sur) (Cruz-Cárdenas et al., 2016). Sin embargo, los autores no lograron separar las diferencias ambientales entre ellas, siendo las mismas condiciones ambientales idóneas para todas las especies; temperatura máxima del mes más cálido (Bio5), mínima del mes más frío (Bio6) y pH. Esto se debió probablemente a que no contemplaron establecer o limitar el area M de cada especie y/o no eliminar la autocorrelación entre las variables bioclimáticas.
Otro estudio sobresaliente es el realizado por Aguirre-Gutiérrez et al. (2014), para cinco especies de pinos de la subsección Cembra, conocido como grupo de pinos blancos, que son especies filogenéticamente cercanas con una distribución fragmentada a lo largo del territorio mexicano (Perry, 1991; Bruederle et al., 2001). Los autores indican que los centros de alta idoneidad se localizan en la Faja Volcánica Transmexicana y sobre las cadenas montañosas que conectan México con Guatemala (Sierra Madre del Sur y Sierras de Chiapas y Guatemala), logrando encontrar diferencias ambientales entre las especies (a excepción de P. ayacahuite C. Ehrenb. ex Schltdl. y P. strobiformis Engelm.), donde la altitud fue la variable que mas contribuyó a los modelos.
Ambos tipos de resultados concuerdan con el presente estudio, reforzando la idea de la existencia de dos centros de idoneidad ambiental para muchas de las especies del género Pinus distribuidas en México: la Faja Volcánica Transmexicana y la Sierra Madre del Sur.
Idoneidad y traslape de nicho
Al obtener, con los MNE, variables ambientales diferenciadas para ambas especies, un valor de equivalencia de nicho menor al de identidad (D=0.430; I=0.610) entre las dos especies y diferencias significativas entre los valores observados y teóricos de los índices D e I, se puede sugerir que las especies presentan un nicho ecológico similar pero que no es totalmente equivalente.
Este tipo de análisis ha sido poco documentado pero puede compararse con los resultados obtenidos para dos especies de la familia Asteraceae del género Dyscritothamnus B. L. Rob., donde ambos taxa ocupan ambientes similares, pero presentan un valor medio de equivalencia (D=0.563) (Suárez-Mota et al., 2015).
Asimismo, es comparable con el estudio realizado en cinco especies de pinos de la subsección Strobi (pinos blancos), donde dos de ellas, Pinus ayacahuite y P. strobus var. chiapensis Martínez, distribuidos en la Sierra Madre del Sur, presentan 55% de traslape del nicho, sugiriendo que sus nichos son similares pero no idénticos (Aguirre-Gutiérrez et al., 2014).
En general, para las especies mencionadas se sustenta la hipótesis de conservadurismo de nicho, pero dados los valores de equivalencia intermedios que se obtuvieron, las especies podrían estar iniciando procesos de diversificación del mismo.
En nuestro estudio, el nicho ecológico es similar pero no es totalmente equivalente (p<0.001) por lo que no se sustenta la hipótesis. Peterson (2011) menciona que el conservadurismo del nicho se ha verificado más en grupos de especies con un origen o divergencia reciente; domina en tiempos cortos o medios del inicio de la especiación que en periodos largos del proceso debido fundamentalmente a que en el principio del proceso de especiación las condiciones ambientales son más similares. Para probar este supuesto, es importante contar con información molecular o registro fósil que permita conocer los tiempos de divergencia de las especies (Peterson et al., 1999; Peterson y Nyári, 2007). Afortunadamente, para las especies de este trabajo se cuenta con ambos tipos de información, pues se han reportado conos fosilizados del Terciario que podrían ser de los ancestros de las dos especies, correspondientes al Oligoceno tardío (26-34 Ma) (Axelrod, 1986). A nivel molecular, en un estudio filogeográfico realizado con microsatélites de cloroplasto, Delgado et al. (2007) reportan un intervalo de 11-27 Ma de coexistencia, y un estudio filogenético, reconstruido con secuencias de cloroplasto y calibrado con el registro fósil, sugiere que la separación de la subsección Ponderosae (al cual pertenecen las especies de estudio) de la subsección Australes fue hace 11-16 Ma (Hernández-León et al., 2013), por lo que el inicio de la especiación entre las especies de estudio probablemente sea más ancestral que los tiempos reportados con la información molecular mencionada, apoyando los resultados de no equivalencia del nicho (D) obtenidos, y los argumentos de Peterson (2011) sobre el conservadurismo del nicho, dificilmente verificable en especies de origen ancestral.
Asi mismo, las especies, al presentar una tendencia similar de no total equivalencia, podría indicarnos que las, o alguna de las dos especies están iniciando procesos de diversificación del nicho. Para las especies de estudio se han determinado eventos de introgresión tanto con datos morfológicos como moleculares (Martínez, 1948; Perry, 1991; Delgado et al., 2007), y aunque en el presente estudio se lograron obtener valores diferenciados de D e I observados y teóricos entre las especies, los valores obtenidos con el modelo teórico (1 para D e I) fueron altos, por lo que se considera que este proceso de introgresión podría haber influido parcialmente en los resultados.
A este respecto, los estudios moleculares indican que la zona de mayor introgresión se presenta en la Faja Volcánica Transmexicana, con una mayor tasa de introgresión de P. montezumae hacia las poblaciones de P. pseudostrobus (Delgado et al., 2007). Por lo que esta especie podría ser la que está diversificando su nicho por el efecto de la introgresión unidireccional, lo cual podría verse reflejado en el valor diferencial de equitatividad (D) que se obtuvo.
Una hipótesis alternativa a la divergencia reciente e incompleta del nicho sería que en el pasado estas especies pudieron ser alopátricas y que los cambios ambientales recientes pudieron producir un contacto secundario que aumentó la proporción de áreas simpátricas. Presentes principalmente en la Faja Volcánica Transmexicana, la cual se ha reportado como una zona de contacto entre las especies de pino de la Sierra Madre Oriental y Occidental, así como de otras especies arbóreas características de los bosques templados (Eguiluz, 1985; Delgado et al., 2007; Moreno-Letelier et al., 2013, Martínez-Méndez et al., 2016). Además se ha sugerido la migración de especies de esta zona hacia otras zonas montañosas de México y Centroamérica (Styles 1993; Farjon y Styles, 1997), con ciclos de aislamiento y contacto secundario de poblaciones y especies, no solo del género Pinus, sino de otras coníferas como Abies, Pseudotsuga Carrière y Picea A. Dietr. (Gugger et al., 2011; Martínez-Méndez et al., 2016), favoreciendo los procesos de hibridación, radiación adaptativa y especiación (Styles, 1993).
Áreas productoras de semillas y de conservación
Los resultados obtenidos con la modelación de nicho ecológico y de la calidad de estación permiten proponer dos posibles zonas para el desarrollo de áreas productoras de semillas y de protección relacionadas con la conservación in situ de estas especies.
La primera zona está ubicada en la Faja Volcánica Transmexicana, dentro de las subprovincias Lagos y Volcanes de Anáhuac, Mil Cumbres, y Neovolcánica Tarasca para ambas especies, y la segunda en la porción norte de la Sierra Madre del Sur, dentro de las subprovincias Cordillera Costera del Sur y Sierras Orientales y en la subprovincia Altos de Chiapas, para P. pseudostrobus. Estas zonas representan los nichos idóneos para ambas especies y contienen los individuos con las características dasométricas deseables para la producción de semillas (máximos valores de diámetro y altura).
Aguirre y Duivenvoorden (2010), en su trabajo sobre la modelación potencial de 56 especies de Pinus en México, mencionan que una de las zonas más importantes para establecer nuevas áreas de protección de este taxon es la Sierra Madre del Sur, en donde muchas de las especies existen y donde son escasas las áreas con alguna categoría de protección (reservas o parques naturales). Por otro lado la Faja Volcánica Transmexicana se ha reportado como zona idónea para la distribución de varias especies de pinos distribuidas en Michoacán, entre ellas las dos especies de estudio (Cruz-Cárdenas et al., 2016). También para Abies religiosa (Kunth) Schltdl. & Cham., A. hickelii Flous & Gaussen y A. flinckii Rushforth (Martínez-Méndez et al., 2016), y para la conservación de la mariposa monarca, con base en la modelación del nicho climático contemporáneo y futuro de los bosques de A. religiosa asociados (Sáenz-Romero et al., 2012). En el mismo sentido se han propuesto estas dos zonas biogeográficas (Faja Volcánica Transmexicana y Sierra Madre del Sur) como nichos idóneos del grupo de pinos de la subsección Strobi (cinco especies y una variedad) que son filogenéticamente cercanas, pero que presentan nichos no equivalentes (Aguirre-Gutiérrez et al., 2014).
Por lo anterior, podemos considerar estas dos zonas biogeográficas como centros de diversidad y como áreas prioritarias para la conservación de especies de pinos y de otras coníferas con una distribución similar, como las del género Abies.
Aunque las especies de estudio no se encuentran dentro de alguna categoría de riesgo, las altas tasas de deforestación y el cambio de uso de suelo han ocasionado la fragmentación del hábitat de ambas especies de manera drástica, disminuyendo el tamaño y la conectividad de las poblaciones con una clara tendencia a la extinción de poblaciones locales (Delgado et al., 2015), no solo de éstas, sino de sus variedades y formas (P. montezumae var. lindleyi Loudon, P. montezumae f. macrocarpa Martínez, P. pseudostrobus f. protuberans Martínez, P. pseudostrobus f. megacarpa Look), o de otras especies de pino asociadas (P. leiophylla Schttdl. ( Cham., P. douglasiana Martínez, P. devoniana Lind., P. herrerae Martínez y P. lawsonii Roezl, entre otras). Para su permanencia se requiere de la aplicación de estrategias puntuales de manejo e inmediata protección, como la declaración de Reservas Naturales o Parques Naturales, dentro de las subprovincias biogeográficas obtenidas con los MNE.
A pesar de que el presente estudio no se enfoca en el análisis del efecto del cambio climático sobre la subsistencia de estas especies de pino, se puede emplear como base para compensar los cambios climáticos, tal como lo proponen Castellanos-Acuña et al. (2018) quienes realizaron una zonificación de semillas de árboles forestales para México, basada en variables climáticas extremas, comparando condiciones actuales y proyecciones de cambio climático. Este tipo de aproximación puede ser un complemento al presente trabajo; las zonas de recolecta de semillas y de conservación de mayor idoneidad del nicho que se proponen, pueden funcionar como ensayos piloto para transferir planta hacia hábitats que en la actualidad son de mayor altitud (P. montezumae) o de mayor humedad (P. pseudostrobus), pero que en un futuro podrían ser las zonas de amortiguamiento y permitir la subsistencia de estas especies. Es decir, los resultados de este estudio pueden funcionar como base en actividades de migración asistida con fines de conservación y/o restauración de los bosques con estas especies, como lo indican Sáenz-Romero et al. (2009), la Secretaría del Convenio sobre la Diversidad Biológica (CBD, 2009) y Castellanos-Acuña et al. (2018) en sus estudios sobre migración de especies y cambio climático.
Conclusiones
El estudio aporta información relevante en dos aspectos centrales; (i) los modelos de nicho ecológico generados fueron diferentes para cada especie, sustendados con diferentes pruebas de precisión estadistica (ROC estandar, ROC parcial y de Z), que dieron una mayor certidumbre y robustez a los modelos, y (ii) se obtienen diferencias en la equivalencia e idoneidad del nicho con condiciones ambientales diferenciadas para cada especie, a pesar de que geográficamente presentan una distribución muy similar (la altitud para P. montezumae y humedad constante para P. pseudostrobus), lo cual no sustenta la idea de conservadurismo del nicho ecologico de las especies. Además, los resultados permiten contar con información particular de cada especie para proponer áreas con mayor calidad para conformar zonas productoras de semillas y para la protección in situ de su acervo genético. No obstante, se recomienda complementar la información en sitios con bosques puros de cada especie, como podrían ser dentro de la Sierra Madre Oriental para P. montezumae, y la porción sur de la Sierra Madre Occidental y Sierra Madre del Sur para P. pseudostrobus, con la finalidad de definir más nichos idóneos y diferenciales para cada especie.
Esta información puede ser considerada por parte de los dueños de los bosques y de las instituciones encargadas de salvaguardar y manejar los recursos forestales de México, para que de una manera sistematizada se logren implementar programas de manejo y conservación sostenible para estas especies de pino tan características de los bosques templados de México.











 text new page (beta)
text new page (beta)