Introducción
La Selva Baja Caducifolia de la costa de Oaxaca (SBC Oax) ubicada al sur de la República Mexicana, ha sido constantemente intervenida por actividad antropógena como el continuo cambio de uso de la tierra hacia la agricultura, ganadería, actividades turísticas y urbanización (Mass et al., 2010). Aún con el disturbio, este ecosistema aloja alta diversidad biológica de especies arbóreas (Salas-Morales, Saynes y Schibli, 2003), y cuenta con alto potencial ecológico y social (cultural, económico, alimenticio y de vivienda) para la población local y aledaña. En la SBC Oax destaca Amphipterigyum adstringens (Schltdl.) Standl. “cuachalalate”, una especie arbórea con importancia económica y cultural por ser relevante en la herbolaria mexicana debido a que la corteza posee propiedades químicas importantes para curar una variedad de enfermedades (Osorio-García, Macías, Tornero, Loera y Garza, 2018).
La mayoría de las investigaciones del cuachalalate están enfocadas hacia las propiedades fitoquímicas de la corteza y su acción en la salud humana (Castillo-Juárez, García, Velázquez, Soto y Martínez, 2013; Rodríguez-Canales et al., 2016), así como en los diferentes canales de comercialización y aprovechamiento (Solares-Arenas, Mata, Vargas, Soto y Rodriguez 2006; Beltrán-Rodríguez et al., 2021).
La alta demanda de este recurso obliga a generar conocimiento sobre la ecología de la especie, para contribuir al uso adecuado y sustentable. Entre la problemática para la sustentabilidad de A. adstringens de la Mixteca Poblana destacan factores como: la baja capacidad de los individuos para producir estructuras reproductivas, la lentitud de crecimiento, la escasez de la especie, la alta mortalidad de plantas jóvenes y adultas y, el bajo potencial de recuperación después del aprovechamiento (Martínez-Pérez, López, Gil y Cuevas, 2012). Por tales motivos, estos autores mencionaron como imperante necesidad, utilizar al cuachalalate como especie para reforestación con el fin de evitar que desaparezca de su hábitat. Rehabilitar áreas con especies forestales de uso múltiple como el cuachalalate, aseguraría un buen aprovechamiento de ese recurso forestal y garantizaría la disponibilidad de servicios ambientales regionales, los cuales mantendrían la economía local.
Continuar con esas intenciones requiere contar con el conocimiento claro del tipo de ecosistema en que habita el cuachalalate, el estado de conservación del suelo, así como los atributos estructurales de la asociación vegetal (frecuencia, densidad y dominancia), tipo de distribución de los individuos en el espacio (aleatoria, agrupada o regular) y, definir rasgos de la historia de vida como el potencial de regeneración y desarrollo de los individuos, forma y cobertura de copa, fenología, biología de la semilla, entre otras características (Díaz-Triana, 2007; Vargas-Rios, 2011). En términos prácticos, el desconocimiento biológico genera mala gestión del aprovechamiento de la especie, lo que influye negativamente en el mantenimiento de las poblaciones.
Por la falta de información para el caso del A. adstringens de la SBC Oax, resultaría interesante identificar la estructura poblacional en diversos sitios y verificar cuáles son los cambios fenológicos de los árboles, con el fin de que dicho conocimiento sea utilizado para futuros planes de manejo.
Contar con información fenológica a nivel local contribuye al aprovechamiento forestal adecuado; a nivel ecosistémico y global, la fenología permite identificar los cambios sucedidos en la cubierta vegetal e inclusive, determinar los efectos derivados del cambio climático (Hudson y Keatley, 2010). En las especies de clima cálido la variabilidad de eventos fenológicos se atribuye a la estacionalidad de la precipitación (Baker, Affum-Baffoe, Burslem y Swaine, 2002), la temperatura (Urrego y Del Valle, 2001), la radiación solar (Wright y Van Schaick, 1994) y la latitud o la altitud (Van Schaick, Terborgh y Wright, 1993).
En cualquier ambiente donde haya cuachalalate, las características del suelo y su calidad hidrológica contribuyen para el crecimiento y desarrollo de las plantas hasta conformar grandes poblaciones. En las selvas caducifolias de Michoacán (Méndez-Toribio, Martínez, Cortés, Rendón y Ibarra, 2014), Morelos (Beltrán-Rodríguez et al., 2018) y de la costa de Oaxaca (Luis-Reyna, Ortega y Ochoa, 2017), la presencia del cuachalalate estuvo asociada con los tipos de suelo feozem háplico, regosol éutrico y litosol. Ortega-Baranda, Sánchez, Sánchez, Luis y Ruvalcaba (2020) coinciden con esa información y agregan que los suelos están degradados, con pobre acumulación de materia orgánica y son vulnerables a procesos de remoción de partículas minerales durante la lluvia, también son de poca capacidad de almacenamiento hídrico (Sánchez-Bernal et al., 2013).
Los objetivos fueron: obtener la estructura poblacional de A. adstringens en distintos sitios con base en tres estados de crecimiento (independientemente del sexo), crecidos en suelo degradado, a la vez, conocer su patrón de dispersión y distinguir el tiempo en que se expresan las fases fenológicas de árboles masculinos y femeninos, así como caracterizar el suelo donde habita la especie, con base en las características físicas y químicas del Litosol degradado de San Pedro Mixtepec, Oaxaca. Las hipótesis asumen que la estructura poblacional y patrón de dispersión difieren entre unidades de muestreo y, que hay sincronía entre sexos para expresar las etapas fenológicas. Por otro lado, se asume que las características físicas y químicas del suelo revelarán el estado de deterioro del suelo.
Consideramos que analizar sitios con suelos degradados en Oaxaca, conlleva a desarrollar información para programas de conservación, rehabilitación y de plantaciones forestales, lo cual resulta de alto valor ecológico.
Materiales y Métodos
Área de estudio
La investigación se realizó en el área protegida de la Universidad del Mar, bajo condiciones naturales, sin aprovechamiento ni prácticas de manejo. Esta área natural comprende 16.7 ha, y está ubicada en el municipio San Pedro Mixtepec, región costa de Oaxaca, entre los 70 a 160 m de altitud. Los suelos de San Pedro Mixtepec en la región costa de Oaxaca son poco profundos y de escaso desarrollo, conformados por los horizontes A y B resultado de la intemperización de rocas metamórficas cálcico-magnésicas (Sánchez-Bernal et al., 2013) de la formación geológica Xolapa, de edad Paleozoica (De Cserna, 1965). El relieve de bajo-lomeríos fue resultado de los levantamientos de la corteza terrestre emergida del mar, ocurridos durante el Pli-pleistoceno (López-Ramos, 2018). Los tipos edáficos dominantes son Litosol y Regosol Eútrico.
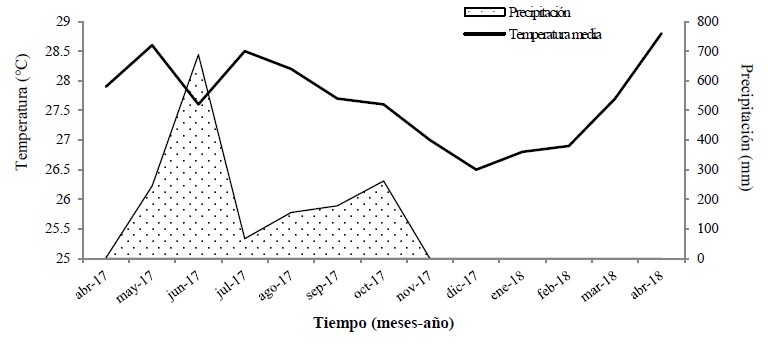
El clima es cálido subhúmedo con lluvias en verano de mayo a octubre (Trejo, 2004). La Figura 1 muestra la precipitación y temperatura de los años 2017 y 2018.
Comunidad vegetal
A. adstringens es especie ubicua en los hábitats de selva seca y bosque espinoso (Méndez-Toribio, Meave, Zermeño e Ibarra, 2016). La SBC Oax es secundaria de acuerdo con Luis-Reyna et al. (2017) y Ortega-Baranda et al. (2020), el área cuenta con 18 familias botánicas, 34 géneros y 37 especies arbóreas, donde el cuachalalate se ubica entre las primeras cinco especies más importantes. Las especies coexistentes con cuachalalate son: Ceiba parvifolia Rose, Cochlospermum vitifolium (Willd) Spreng, Dalbergia congestiflora Pittier, Heliocarpus donnell-smithii Rose, Acacia farnesiana Wall., Comocladia engleriana Loes, Tabebuia chrysantha (Jacq.) Nicholson, Guapira macrocarpa (Miranda) Miranda, Bunchosia sp.
Breve descripción de Amphipterygium adstringens
El “cuachalalate” es una especie arbórea nativa, perteneciente a la familia Anacardiaceae (Wannan, 2006), se distribuye en la vertiente del Pacífico principalmente desde Sinaloa a Chiapas (Solares y Gálvez, 2002), adentrándose por la cuenca del Balsas a los estados de Morelos y Puebla. Beltrán-Rodríguez, Manzo, Maldonado, Martínez y Blancas (2017), expresaron que es una especie endémica del bosque tropical caducifolio (o SBC), altamente comercializada, caracterizada como especie en riesgo y de alta vulnerabilidad. De acuerdo con Cuevas-Figueroa (2005), los individuos varían en altura, entre 4.0 y 8.5 m y de ± 40 cm de diámetro normal (DN). La especie es dioica, tiene flores masculinas y femeninas (Guízar y Sánchez 1991), Otra vía de crecimiento poblacional del cuachalalate es por policaulescencia (Lebrija-Trejos, Pérez, Meave, Poorter y Bongers, 2011).
Unidades de muestreo y datos dasométricos
Las Unidades de muestreo (UM) fueron establecidas considerando el área explorada dentro de la SBC Oax por Luis-Reyna et al. (2017) y Ortega-Baranda et al. (2020). En esta zona y previo muestreo determinaron que A. adstringens es la segunda especie de mayor índice de valor de importancia y forestal.
Se trabajó en cuatro UM de 1000 m2. El trazado de cada UM se realizó con una brújula marca AOFAR, modelo AF-M2 y longímetro marca TRUPER, modelo TFC50; cada UM fue dividida en 10 subunidades de 100 m2 (Villavicencio y Valdez, 2003).
Como variables abióticas se registraron la exposición (N, S, E, O), altitud (m) y pendiente (porcentaje) de cada UM, de modo que por cada UM se tuvieron los siguientes datos: UM1 (S - N, 124 m de altitud, 31%), UM2 (E - O, 147 m de altitud, 36%), UM3 (S - N, 144 m de altitud, 30%) y UM4 (N - S, 156 m de altitud, 29%). Entre cada UM hubo 100 metros de distanciamiento.
El muestreo en cuachalalate fue dirigido. Se censaron todos los individuos de cuachalalate categorizándolos en tres etapas de crecimiento (brinzal, latizal, fustal) diferenciadas por tamaño [con base en diámetro normal - DN (cm) y altura -H- (m)], como lo determinó Ortega-Baranda, Valdez, García y Rodríguez (2017): brinzales (Br, < 1.5 m hasta > 0.3 m de altura), latizales (Lt, < 2.5 cm de DN con > 1.5 m de altura) y fustales (Ft, > 2.5 cm DN, medido a 1.3 metro del suelo). Las variables dasométricas consideradas y los instrumentos utilizados para cada individuo fueron: altura total (H) (clinómetro, marca SUUNTO PM-5, Tandem), DN y cobertura de copa (flexómetro, marca TRUPER modelo TFC50).
Estructura vertical, horizontal y dispersión de la población de cuachalalate
Tanto para la estructura vertical y la horizontal de las poblaciones de cuachalalate se construyeron histogramas de frecuencia por tamaños de altura y diámetro. Las categorías diamétricas (cat.) de cuachalalate se ordenaron (a excepción del primer intervalo) por incrementos en altura de 5 cm (< 2.5 cm, cat.5 = 2.5-7.5, cat.10 = 7.6-12.5, cat.15 = 12.6-17.5, cat.20 = 17.6-22.5, cat.25 = 22.6-27.5, cat.30 = 27.6-32.5).
La distribución espacial de la especie se esquematizó con coordenadas cartesianas de acuerdo con Zarco-Espinoza, Valdéz, Angeles y Castillo (2010), y se cuantificó con el Índice de Morisita:
Donde: I δ = índice de distribución espacial, q = número de cuadros, n i = número de individuos en el i-ésimo cuadro, N = Número total de individuos en todos los q cuadros (Morisita, 1959; Caldato, Vera y Mac Donagh, 2003).
Jerarquía de las etapas de desarrollo
Se obtuvo la dominancia, frecuencia y densidad por brinzales, latizales y fustales, para calcular el IVI (Curtis y McIntosh, 1951; Moreno-Guerrero, Ortega, Sánchez y Nieto, 2020) y con ello jerarquizar las etapas de desarrollo de cuachalalate, aplicándose la sumatoria de abundancia, dominancia y frecuencia relativas. La mayor importancia se define en orden descendente. Para el caso del uso de datos conforme al formulario base, en lugar de “especies” se listaron cada una de las tres etapas de desarrollo y, para el concepto “todas las especies” se aplicó el valor correspondiente a las tres etapas de desarrollo.
Fases fenológicas del cuachalalate
Se identificaron y etiquetaron en las cuatro UM todos los fustales femeninos y masculinos. La observación de los eventos fenológicos se realizó con binoculares marca Bushnell, modelo 134211.
Los eventos fenológicos registrados fueron foliación, floración femenina y masculina, fructificación y defoliación. El periodo de registro fue mensual, de abril 2017 - abril 2018. Para los meses de agosto y septiembre de 2017 se frecuentaron las visitas de observación por semana debido al corto tiempo de duración de la floración.
La ocurrencia de las fases fenológicas se hizo con base en la metodología usada por García y Di Stefano (2005), Pineda-Herrera, Valdez y Pérez (2016). Para el registro de cada etapa fenológica (defoliación, foliación, floración, fructificación), se asignaron valores porcentuales estimados visualmente, de representación en la copa arbórea. La escala de calificación utilizada consistió en cinco niveles: 0 = ausencia total del evento, 1 = 1% - 25%, 2 = 26% - 50%, 3 = 51% - 75% y 4 = 76% - 100%. Con la información recabada se elaboró el fenograma para la especie.
En algunos casos se corroboró el sexo de los fustales carentes de flor por el color de albura, considerando que Solares y Gálvez (2002), determinaron que el sexo (en caso de ausencia de flores) se identifica por el color de la albura (color blanco = femenino; color rojo = masculino). Se realizó un pequeño corte a la corteza de 2.0 × 2.0 cm (4.0 cm2), con una navaja esterilizada a la altura del DN, posteriormente se observó y se registró el color de la albura de cada individuo muestreado. Finalmente se colocó nuevamente la corteza y se adhirió al fuste con cinta adhesiva.
Análisis de suelo
En campo se observó un relieve accidentado y una geoquímica uniforme del terreno, estableciendo cuatro monolitos (uno por UM), cada monolito de suelo se estableció como punto centrado a la UM. Se realizaron las colectas de muestras de suelo con dimensiones de 0.30 m de diámetro, por largo en espesores de 0.10 m hasta 0.40 m (Palmer, 1979), se realizó una colecta de 2 kg de suelo por espesor. Cada monolito se obtuvo con la ayuda de una pala curva marca TRUPER. Cada muestra de suelo fue colocada en bolsa de plástico cerrada e identificada según el espesor; las muestras fueron procesadas en el Laboratorio de aguas y suelos de Tecnología de la Madera de la Universidad del Mar, Campus Puerto Escondido. Estas tuvieron un proceso de secado y tamizado, de las cuales se preparó una pasta de saturación con 250 g de suelo con agua destilada. Con el hidrómetro de Bouyoucos se determinó la textura, aplicando 25 mL de hidróxido de sodio al 1 N en una batidora Hamilton Beach® durante 10 min para realizar la dispersión, posteriormente en una probeta de 1 L se depositó la mezcla de agua y sedimentos, posteriormente se realizó la interpretación con el triángulo de texturas (Soil Survey Staff, 2014). El color fue determinado con las tablas de Münsell (Münsell Color, 2009).
El porcentaje de espacio poroso fue calculado con la ecuación:
donde: ϱa= densidad aparente; ϱr= densidad real; fueron determinadas por el método de Pignómetro hídrico y de la Paraf ina respectivamente y en lo que respecta a los análisis químicos se consideró la metodología de Soil Survey Staff (2014). Se obtuvieron pastas de saturación con las cuales se determinó: pH y Conductividad eléctrica (CE), mediante un multiparámetro Hanna Instruments® modelo HI98129. En el caso de los sólidos totales disueltos (STD) en mg L-1 se usó el método de calcinación en mufla a 600 °C. Los Cationes Ca2+, Mg2+ y aniones CO3 2-, HCO3 - y Cl-, fueron por el método titrimétrico; SO4 2- por turbidimetría (espectofotómetro Perkin Elmer); Na+ y K+ por flamometría (Flamómetro IL-653).
Resultados y Discusión
Estructura vertical, horizontal y dispersión de la población
Cada UM presentó una estructura vertical de dos estratos: inferior (2.0 a 9.5 m) y superior (10.0 a 16.0 m). La altura promedio del cuachalalate para fustales fue de 2.10 ± 6.5 m, para latizales de 0.65 ± 2.60 m y para brinzales de 0.35 ± 0.70 m (Figura 2a). En lo que corresponde a la estructura horizontal la mayoría de los individuos de brinzales y latizales en las cuatro UM estuvieron en la categoría (cat.) < 2.5 cm, con un diámetro promedio de ±1.85 cm y en fustales en la cat. 5 y 10 (Figura 2b). Las cuatro UM conforman semejante estructura poblacional vertical y horizontal, como previamente lo documentaron Guizar y Sánchez (1991), con H hasta 12 m y DN de 40 cm; Pennington y Sarukhán (2005) con H, hasta 8.0 m y DN, hasta 40 cm; Rzedowski (2006) H = 4.0 a 6 .0 m. Solo en la UM4 hubo cuatro individuos que presentaron alturas mayores, entre 12 a 16 m, con categoría diamétrica de 20, 25 y 30 cm. La UM4 tiene árboles más grandes por estar conservada desde hace 34 años (Luis-Reyna et al., 2017), mientras que las otras UM son de conservación más reciente, de 18 años. Además, la zona donde se ubica la UM4 fue utilizada con anterioridad a su conservación como área de cultivo, la ventaja de tener árboles de mayores dimensiones en esta UM se debe a que los agricultores los auspiciaron para que les proporcionaran sombra. Dryflor et al. (2016) han argumentado que la variación en la estructura vegetal de las selvas bajas caducifolias se vincula con factores ambientales y de manejo.
De acuerdo con el índice de Morisita (I S ) la dispersión poblacional generó valores > 1, tanto en fustales, latizales y brinzales en las cuatro UM. Estos valores demuestran que los individuos de cuachalalate presentan distribución espacial agregada (Figura 3), al igual que otras arbóreas tropicales y subtropicales (Martínez y Álvarez, 1995). El patrón de distribución agregado ocurre por variadas causas como la distribución heterogénea de los recursos, la interacción con otras especies (Mandujano, Montaña, Méndez y Golubov, 1998), la baja dispersión de semillas y el efecto nodriza requerido en la etapa de crecimiento de brinzales y latizales, cuyo fin es amortiguar las consecuencias del déficit hídrico (Beltrán-Rodríguez et al., 2022). La policaulescencia mencionada por Lebrija-Trejos, et al. (2011), también contribuye a la distribución agregada de las poblaciones.
Jerarquía de las etapas de desarrollo
El IVI reflejó el nivel de ocupación del área de estudio por cada etapa de desarrollo. Los fustales presentaron 950 individuos por ha-1 (79%) con una alta dominancia relativa, explicada como resultado de la proporción de terreno ocupado por la proyección perpendicular de las partes aéreas de los individuos de la clase de tamaño considerada (Matteucci y Colma, 2002), en seguida los brinzales con 118 individuos ha-1 (11%) y latizales con 70 individuos ha-1 (9%) (Cuadro 1). Para la clase brinzal, la dominancia relativa es baja ya que el área basal de cada individuo es pequeña (Ortega-Baranda et al., 2017), aunque en términos generales el IVI estimado fue mayor en brinzales, debido a los altos valores obtenidos por densidad y frecuencia relativa, que en parte son fomentados por la policaulescencia.
Cuadro 1: Índice de Valor de Importancia por etapas de desarrollo del cuachalalate, en una selva baja caducifolia asentada sobre suelos de litosol degradado.
Table 1: Importance Value Index by stages of development of cuachalalate in a low deciduous forest on degraded lithosol soils.
| Etapas de desarrollo | Dominancia absoluta | Dominancia relativa | Densidad absoluta | Densidad relativa | Frecuencia absoluta | Frecuencia relativa | IVI |
| Fustal | 5.264 | 99.545 | 0.095 | 83.516 | 0.975 | 54.929 | 237.99 |
| Brinzal | 0.003 | 0.069 | 0.011 | 10.329 | 0.425 | 23.943 | 34.342 |
| Latizal | 0.020 | 0.384 | 0.007 | 6.153 | 0.375 | 21.126 | 27.665 |
Fases fenológicas
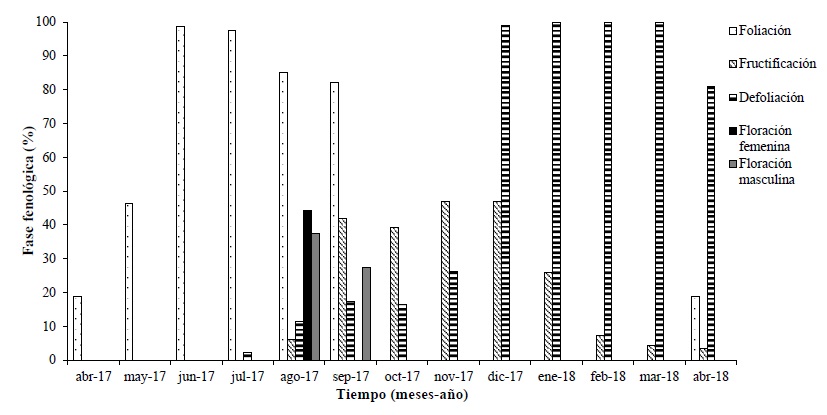
Se identificaron los individuos femeninos y masculinos directamente por la presencia de floración y color de la albura. La floración masculina registró dos periodos: la primera se dio entre la segunda y la cuarta semana del mes de agosto del 2017 y la segunda, entre la tercera semana de septiembre del mismo año; aproximadamente el 28% de la copa de los individuos masculinos se observó con floración en estos periodos. La floración femenina sólo presentó un periodo que inició una semana después de la floración masculina (tercera y cuarta semana del mes de agosto del 2017), en el 45% del total de la copa (Figura 4). Con base en la Figura 1 se determina que para el área de estudio, el período de foliación coincide con el pico de precipitación (600 mm) y temperatura más cálida (28.5 °C). Al término del crecimiento de la cobertura foliar surge la floración, climáticamente se mantiene la misma temperatura, aunque el proceso coincide con la reducción de la precipitación (hasta los 100 mm), tiempo de canícula. La fructificación se logra con el segundo pulso de precipitación (300 mm) y temperatura algo menor (27.5 °C). La dispersión de estos frutos ocurre durante la época invernal e inicio de primavera, de noviembre a abril, con menor temperatura (27 °C) y nula precipitación (0 milimetros).
De acuerdo con la literatura, se presentan diferencias en los periodos fenológicos para el cuachalalate en selvas bajas caducifolias de México, esto se debe a los periodos de temperaturas máximas y de precipitación que difieren en cada área de estudio. En el estado de Morelos, Monroy y Colín (1997) refirieron que la floración se observa en los meses de mayo a agosto, Solares y Gálvez (2002) señalaron marzo a junio y Pennington y Sarukhán (2005) mencionaron que de mayo a julio. En el estado de Jalisco Cuevas-Figueroa (2005) observó floración de junio a agosto (Cuadro 2) y para esta investigación, en la SBC Oaxaca, la floración ocurre de un mes a otro, de agosto a septiembre; también se ven diferencias en otros datos como que la floración empieza en abril a diferencia de Morelos que se indica inicia en junio, la defoliación ocurre en un período de tiempo amplio, de julio del año n a abril del año n+1, y la fructificación ocurre de agosto del año n a abril del año n+1.
Cuadro 2: Periodos fenológicos para el cuachalalate en diferentes selvas bajas caducifolias de México.
Table 2: Phenological periods for cuachalalate in different low deciduous forests of Mexico.
| Localidad | Foliación | Defoliación | Floración | Fructificación | Referencia |
| Morelos | mayo-agosto | Junio-febrero | Monroy y Colín (1997) | ||
| Morelos | marzo-junio | Marzo-mayo | Solares y Gálvez (2002) | ||
| Morelos | noviembre-mayo | mayo-julio | Pennington y Sarukhán (2005) | ||
| Morelos | junio-septiembre | mayo-octubre | Solares-Arenas, Mata, Vargas, Soto y Rodriguez (2006) | ||
| Jalisco | junio-agosto | agosto-enero | Cuevas-Figueroa (2005) |
La fase de fructificación perduró nueve meses (de la época lluviosa en agosto del 2017 a la época seca, abril del 2018), los frutos maduros se observaron en los meses de septiembre (finales de la época lluviosa a diciembre (época seca) del mismo año, la abscisión de éstos fue a partir de noviembre, en la época seca del 2017 (el 47% de los frutos eran maduros), algunos se hallaban abajo del dosel de la planta madre y en áreas cercanas, sin haber liberado la semilla, y hasta abril (época seca del año 2018) algunos frutos aún permanecían adheridos al árbol. La mayor foliación (proporcionalidad de hojas en la copa entre un 85 - 90%) en los individuos arbóreos se presentó en los meses de junio a septiembre (época lluviosa) del 2017. La defoliación fue mayor en la época de estiaje durante los meses de diciembre 2017 a abril del 2018, entre un 80 y 99% (Figura 4).
Las fenofases para el cuachalalate estuvieron relacionadas con el factor clima; los porcentajes de floración y fructificación fueron bajos, la producción de flores de ambos sexos se sincronizó en agosto y septiembre (época lluviosa), la época de estiaje con altas temperaturas influyó en la floración y fructificación. La abscición foliar y la nueva foliación estuvieron relacionadas respectivamente, con la ausencia y presencia de la precipitación. Los periodos de floración y fructificación en muchos casos están influenciados por la temperatura que controla la tasa de desarrollo de muchos organismos que requieren la acumulación de cierta cantidad de calor para pasar de un estadio a otro en su ciclo de vida (Plana-Bach, 2000). Vochysia guatemalensis Donn. Smith y Licania arborea Seem, ejemplifican el efecto de la temperatura máxima con la floración femenina, tanto en el estado de Oaxaca (Pineda-Herrera, Valdez y López, 2012) como en el de Chiapas (Ríos-García, Orantes, Verdugo, Sánchez y Farrera, 2017).
Se ha registrado que, en el hemisferio norte, las laderas con orientación sur presentan una mayor radiación solar en comparación con las laderas con orientación norte (López-Gómez, Zedillo, Anaya, González y Cano, 2012). En esta investigación el porcentaje de floración masculina y femenina para A. adstringens fue mayor en UM con una pendiente de exposición sur (más cálido) y mucho menor en una exposición norte (más fresco). Campanello, Gatti, Montti, Villagra y Goldstein (2011), mencionan que la sombra reduce notablemente la floración en plantas tropicales.
Caracterización del suelo
Con el levantamiento de la corteza terrestre emergida del mar (López-Ramos, 2018) hubo oxidación de minerales como el hierro, lo que le da al suelo su coloración característica. El color del suelo rojo cafesáceo (Cuadro 3) indica que se trata de oxisoles o suelos ferralíticos con un subhorizonte característico kraznon de concresiones de óxido de fierro (Fe2 O3) y aluminio (Al2O3) (Palacios y Gama, 1994).
Table 3: Characteristics of texture and color of lithosol soils in low deciduous forest.
| Espesor de suelo | arena | limo | arcilla | Condición Textural | Color en seco | Intensidad del color |
| cm | - - - - - - - - - % - - - - - - - - - - - | |||||
| (0-10] | 87 | 7 | 4 | Franco arenoso | 2.5YR 3/4 | Rojo cafesáceo |
| (10.20] | 68 | 23 | 5 | Franco arenoso | 2.5 YR 3/4 | Rojo cafesáceo |
| (20-30| | 78 | 19 | 3 | Franco arenoso | 2.5 YR 3/4 | Rojo cafesáceo |
| (30-40] | 76 | 20 | 4 | Franco arenoso | 2.5YR 3/4 | Rojo Cafesáceo |
En el área de estudio, el horizonte A presentó un subhorizonte Oa con acumulación de residuos de materia orgánica fresca con descomposición rápida debido a factores ambientales como la radiación solar, la temperatura y la humedad, así como por la actividad microbiana del suelo, lo que originó una pobre acumulación de materia orgánica (Ortega-Baranda et al., 2020). Debajo de la incipiente capa húmica se localizó el sub-horizonte Oi, en el que se observó un espesor intergrado de materia orgánica en descomposición y materia mineral. Las partículas que predominaron fueron las arenas en más de un 80% en los primeros 10 cm de espesor, seguidas de limos y arcillas (Cuadro 3). Por su parte el horizonte B con profundidad aproximada de 1 m, presentó arcillas caolinitas y óxidos e hidróxidos de hierro y aluminio que se acumularon en su parte media. El horizonte C se conformó por silicatos primarios intemperizados y la roca madre.
La condición textural es franco arenoso; el predominio de arenas sobre limos tiene relación con un espacio poroso de 45% (Cuadro 3), que induce una adecuada infiltración hídrica en condiciones de lluvia de poca intensidad.
La textura franco arenosa al contener aproximadamente 80% de arena, permite que la porosidad favorezca la presencia de micro y macrobiota que, con condición favorable de humedad, disminuye evaporación por presencia de cobertura vegetal, y ésta a la vez aumenta el contenido de materia orgánica en el suelo, consiguiendo con este proceso la conservación del agua (UCM, 2022). Lo contrario ocurre cuando llueve con intensidad, ya que el espacio poroso se satura y la roca metamórfica que subyace a menos de 1.5 m de profundidad, impide la adecuada conductividad hidráulica y buena infiltración. La impermeabilidad y la pendiente mayor a 20% son la causa de que la capa superior del suelo en sus primeros 20 cm se erosione por acción del agua de escurrimiento de las zonas de lomerío.
Otra característica de estos suelos es que son hidrófobos por su poca capacidad de almacenamiento de agua. La probabilidad de que un suelo se vuelva repelente al agua depende de la presencia de material hidrófobo y de la textura del suelo, de acuerdo con Hunt y Gilkes referidos por ICL Specialty Fertilizers (2019), quienes argumentan que los suelos arenosos de textura gruesa que contienen menos del 5% de arcillas como los mostrados en el Cuadro 3, tienen una alta probabilidad de volverse repelentes al agua.
Las sustancias hidrófobas contenidas en el suelo están constituidas por moléculas orgánicas repelentes al agua, las que son producto de la materia orgánica, la descomposición vegetal y la actividad metabólica de los microorganismos. En suelos forestales, la hidrofobia también depende de otros factores como el tipo de bosque y la composición de especies, la edad del bosque, la estación del año y la combustión incompleta de materia orgánica cuando hay incendios (Ángeles-Cervantes y López-Mata, 2009). En época de estiaje, el déficit hídrico de origen climático se suma a la baja retención de agua del suelo y la hidrofobia por las moléculas presentes. Estas restricciones edáficas son afrontadas por las especies vegetales de la selva baja, a través de la abscisión de sus hojas, lo que induce a la defoliación de los individuos vegetales.
El pH de los suelos es ligeramente ácido propio de suelos que presentan lixiviación de cationes básicos Ca2+, Mg2+, Na+ y K+ en época de lluvias, lo que se confirma con los datos de composición química del suelo. La CE de los extractos de las pastas de saturación son bajas, en promedio 0.55 dS m-1, lo que indica que no presentan problemas de salinidad (Cuadro 4). Un ligero incremento de salinidad se presenta en el espesor 0-10 cm, esto es natural debido al ascenso de sales y evaporación de aguas del subsuelo por capilaridad, en algunos casos alcanza un nivel de 1 dS m-1, por lo que no hay riesgo de que las plantas sean afectadas por salinidad. En el Cuadro 4 se observa una estrecha relación entre los bajos valores de STD y el potencial osmótico de -0.01 MPa, lo que indica la pobre presencia de iones en solución. Dicha relación es característica en suelos tropicales (Richards, 1974), lo que justifica el resultado obtenido en la región estudiada.
Cuadro 4: pH, CE, Sólidos Totales Disueltos (STD) y Potencial osmótico (Ψπ) de la solución de suelo litosol degradado en selva baja caducifolia.
Table 4: pH, CE, Total dissolved solids (STD) and Osmotic Potential (Ψπ) of the degraded lithosol soil solution in low deciduous forest.
| Espesor de suelo | pH | CE | STD | Ψπ | Parámetros estadísticos | |
| cm | dS m-1 | mg L-1 | MPa | CE | STD | |
| (0-10] | 6.88 | 1.15 | 736 | -0.041 | M = 0.53 σ= 0.41 C.V. = 0.77 | M = 340.5 ∑=265.31 C. V. 0.77 |
| (10-20] | 7.67 | 0.39 | 249 | -0.014 | ||
| (20-30] | 6.44 | 0.31 | 198 | -0.011 | ||
| (30-40] | 6.30 | 0.28 | 179 | -0.010 | ||
La composición iónica de los suelos presenta el siguiente orden (Cuadro 5): Ca2+ en la superficie y mayor profundidad > Mg2+ en los espesores intermedios > Na+ > K+ y HCO3 - > SO4 2- > Cl- lo que guarda relación con la migración de iones en solución (Szabolcs, 19941).
Con estos elementos se determina que estos suelos son litosoles de piedemonte, donde ocurren procesos incipientes de acumulación, los que con el tiempo transitarán hacia regosoles éutricos (Sánchez-Bernal et al., 2019); esta transición edáfica aunada a las condiciones de clima favorece el desarrollo de la selva baja caducifolia donde crece A. adstringens.
Cuadro 5: Composición química de extractos de saturación de suelo litosol degradado en selva baja caducifolia.
Table 5: Chemical composition of saturation extracts of degraded lithosol soil in low deciduous forest.
| Espesor de suelo | Cationes | Total | Aniones | Total | ||||||
| cm | - - - - - -mEq 100 g-1 de suelo- - - - - - | - - - - - -mEq 100 g-1 de suelo- - - - - - | ||||||||
| Ca2+ | Mg2+ | Na+ | K+ | CO32- | HCO3- | Cl- | SO42- | |||
| (0-10] | 0.0021 | 0.0003 | 0.0002 | 0.0002 | 0.0028 | 0.0000 | 0.0002 | 0.0000 | 0.0003 | 0.0005 |
| (10-20] | 0.0004 | 0.0012 | 0.0001 | 0.0001 | 0.0018 | 0.0000 | 0.0002 | 0.0001 | 0.0002 | 0.0005 |
| (20-30] | 0.0004 | 0.0013 | 0.0001 | 0.0001 | 0.0019 | 0.0000 | 0.0002 | 0.0001 | 0.0002 | 0.0005 |
| (30-40] | 0.0014 | 0.0011 | 0.0002 | 0.0001 | 0.0028 | 0.0000 | 0.0002 | 0.0001 | 0.0002 | 0.0005 |
Conclusiones
Las poblaciones de cuachalalate diferenciadas en fustales, latizales y brinzales presentaron distribución agregada, con una estratificaron en dos niveles de altura. La estructura vertical y horizontal de las poblaciones analizadas en distintas unidades de muestreo situadas sobre litosol degradado fue similar. Los fustales presentaron la mayor dominancia relativa, seguida de brinzales con altos valores de densidad y frecuencia relativa. En el caso de los brinzales la policaulescencia contribuyó a elevar la densidad, debido a que la mayoría de los individuos fueron originados como renuevo de la planta madre. La poca densidad de latizales probablemente es causada por la calidad hidrófoba del suelo debido a su composición arenosa con menos del 5% de arcilla y baja retención, lo que propicia déficit de agua para las plantas que están en crecimiento.
Las fenofases para el cuachalalate estuvieron relacionadas con temperatura y precipitación. Los porcentajes de floración y fructificación fueron bajos. La floración ocurrió durante la época lluviosa, la fructificación durante la época lluviosa a la seca del siguiente año, la foliación de la época seca a la lluviosa del mismo año, la defoliación de la época lluviosa a la seca del siguiente año.
La física y química del suelo refleja cambios que evolucionan a la transición litosol-regosol, este dato resalta como futuro beneficio para el mantenimiento de la selva baja caducifolia y las especies que ahí cohabitan, como el cuachalalate.
Contribución de los Autores
Conceptualización, metodología, curación de contenido, escritura; preparación del borrador original: V.O.B. Curación de datos, análisis formal de datos, investigación: D.L. de la C.S. Análisis crítico, discusión y escritura del artículo, así como edición de la versión final: A.R.M. Curación de datos, análisis formal de datos: E.I.S.B.











 text new page (beta)
text new page (beta)