Introducción
Ecuador ocupa el cuarto lugar entre los países productores de cacao fino del mundo (Loor-Solórzano et al., 2019). En América Latina, es el mayor productor y exportador de cacao fino de aroma. Para preservar la calidad del producto se necesita el establecimiento de cacaotales con plántulas aptas obtenidas mediante un proceso que garantice una mayor producción (Peña-López, 2019). En la práctica, se prefiere la propagación vegetativa a partir de esquejes, ya que no produce cambios en la información genética del nuevo individuo respecto a la planta madre (Borges-García, Reyes, Zayas y Destrade, 2015). Sin embargo, el crecimiento de las plántulas es lento y la regeneración es baja (alrededor de 25-40%), por lo que se requiere de sustancias estimuladoras del enraizamiento (Cajamarca-Marín, Quevedo y García, 2017).
En el mercado hay varias hormonas promotoras del crecimiento vegetal, como el ácido beta indol butírico, ácido naftalenacético, ácido giberélico, entre otros, que se usan para estimular la formación de raíces y la regeneración de plantas a partir de esquejes de cacao. Estas inducen la división celular, incrementan el contenido de clorofila a través de la diferenciación de cloroplastos, aumenta la actividad fotosintética, participa en la pérdida de dominancia apical y retrasa la senescencia (Cárdenas-Hernández, Álvarez, Barragán y Rivera, 2010; Santander-Coronel, 20181). Sin embargo, el alto costo de estos productos hormonales ha motivado la búsqueda de alternativas (Cordero-Rivera, Montalván y Flores, 2014).
El uso de bioestimulantes provenientes de la pared celular vegetal, tales como los oligopectatos, son una alternativa para estimular la formación de raíces en esquejes y favorecer el crecimiento de las plantas (Guarnizo, Oliveros, Murillo y Bermúdez, 2020). Los oligopectatos u oligogalacturónidos constituyen cadenas de 2 a 20 unidades de ácido galacturónico, unidas por enlaces α (1.4) que se obtienen mediante hidrólisis de la pectina presente en la pared celular vegetal (Singh et al., 2020). Comercialmente pueden obtenerse de los albedos de frutas cítricas, una mezcla de oligopectatos que poseen entre 9 y 16 unidades de ácido galacturónico (Mederos y Hormaza, 2008). La aplicación de oligopectatos en esquejes de guayaba aumentó el porcentaje de raíces en las plantas (Ramírez, Cruz y Franchialfaro, 2003). De igual forma, el tratamiento de fragmentos nodulares de yuca (Manihot esculenta C.) con 10 mg L-1 de oligopectatos, aumentó el enraizamiento respecto al control (Suárez y Hernández, 2015). El uso de este producto también estimuló el enraizamiento y crecimiento vegetal de plantas ornamentales como violeta (Viola odorata L.) y palma areca (Dipsis lutescens H. Wendl.) (Cabrera et al., 2012). El objetivo de este trabajo es la optimización de las dosis de oligogalacturónidos en la propagación vegetativa de dos clones de cacao (Theobroma cacao L.) bajo condiciones controladas en vivero.
Materiales y Métodos
Campo experimental
La investigación fue desarrollada en el vivero de la Finca Experimental “La María” de la Universidad Técnica Estatal de Quevedo (UTEQ), provincia de Los Ríos, Ecuador, geográficamente ubicada a 1° 5’ 33” S y 79° 30’ 7.7” O y altitud de 73 m. La zona ecológica posee una temperatura media de 24.8 ºC, precipitación anual de 2252.2 mm, humedad relativa media de 84% y heliofanía de 894 horas luz-1 año-1.
Genotipos y material vegetal
Se utilizó material vegetal de los clones CCN-51 y EET-801, dos genotipos que ostentan un aroma y calidad característicos, además, son altamente productivos. Los esquejes fueron seleccionados de plantas clonales sanas, del jardín clonal de cacao de la Facultad de Ciencias Agropecuarias de la UTEQ. Se tomaron esquejes lignificados del tercio superior de la planta madre, con cuatro hojas, que mostraban coloración parda en un lado y verde por el otro. Las hojas fueron reducidas a un tercio. Los esquejes se desinfectaron con hipoclorito de sodio (1%), durante cinco minutos y lavaron con agua destilada. Después, los esquejes fueron trasladados a una casa de cultivo, tapado de una lámina de plástico, desde la propia finca.
Diseño experimental y tratamientos
En el experimento se utilizó un Diseño Completamente al Azar (DCA) con arreglo factorial A × B. El factor A constituyeron los clones (2) y el factor B, los enraizantes: el control o testigo absoluto, donde solo se usó agua destilada desionizada (0 mg L-1 de producto enraizante); las dosis 10, 50 y 100 mg L-1 de oligogalacturónidos y un enraizante químico en dosis de 200 miligramos por litro.
Cada tratamiento estuvo conformado de 10 esquejes con tres repeticiones, para cada clon de cacao. Los tratamientos se aplicaron por inmersión de la base del esqueje, durante 15 minutos. Posteriormente, se sembraron los esquejes en bolsas de polietileno de 5 × 8 pulgadas (12.7 x 20.32 cm), de color negro, perforadas, conteniendo un sustrato con 75% de su volumen de materia orgánica (cachaza descompuesta) y 25% de suelo franco arcilloso, tipo inceptisol, con pH 5.7. Estas bolsas se transfirieron a condiciones de vivero organizadas en hileras de 10 bolsas de largo por cinco de ancho, formando tres bloques por clon, con separación de 1 m, para facilitar las mediciones de las variables experimentales. El sustrato se humedeció semanalmente en su totalidad con agua destilada, usando un nebulizador.
Variables evaluadas
A los 60 días después del establecimiento de los esquejes (DDE), se evaluó: el índice de plantas regeneradas (IPR) como la relación entre esquejes enraizados y sembrados. A los 90 DDE se registraron las siguientes variables: número de hojas (NH), número de raíces en los esquejes (NR), fracción radical (FR), biomasa fresca de hojas (BFH), biomasa seca de hojas (BSH), biomasa fresca de raíces (BFR), biomasa seca de raíces (BSR) y biomasa seca del tallo (BST). Para la medición del peso de la biomasa se usó una balanza analítica de precisión (OHAUS Adventurer, modelo H-5276) ± 0.01 miligramos.
Análisis estadístico
Se realizaron las pruebas de normalidad de Kolmogorov-Smirnov (KS) y la de Levene para probar la homogeneidad de las varianzas (Flores y Flores, 2021). Se realizó el análisis de varianza y para la comparación de medias se utilizó el criterio de Newman-Keuls, a un nivel de confianza de 95%. Se realizó el análisis de correlaciones lineales y el análisis de regresión considerando variable dependiente al índice de plantas regeneradas y como variables independientes a los clones y a los cinco tratamientos. Para la confiabilidad de la matriz de datos se usó la prueba alfa de Cronbach, la prueba KMO (Kaiser-Meyer-Olkin) para relacionar los coeficientes de correlación y la prueba de esfericidad de Bartlett para medir la aplicabilidad del análisis de múltiples variables.
Resultados y Discusión
La dosis de 100 mg L-1 de oligogalacturónidos mostró los mayores efectos significativos en las variables NH, NR, FR, BFR, BSR e IPR, seguido de la dosis de 50 mg L-1. El efecto del enraizante químico en dosis de 200 mg L-1 tiende a ser parecido a la dosis de 100 mg L-1 de oligogalacturónidos, excepto en las variables IPR y BSR. El testigo sin aplicación de hormonas mostró menores magnitudes en todas las variables biológicas (Cuadro 1).
Cuadro 1: Efecto de los oligogalacturónidos sobre el promedio de las variables de crecimiento vegetativo de las plántulas de cacao en vivero.
Table 1: Oligogalacturonide effect on the average vegetative growth variables of cocoa seedlings in the nursery.
| Variables | Dosis | Media | Error estándar | Precisión |
| mg L-1 | % | |||
| Número de hojas (NH) | ||||
| 0 | 13 d | 0.88 | 93.39 | |
| 10 | 17 c | 0.52 | 96.96 | |
| 50 | 21 b | 0.49 | 97.61 | |
| 100 | 23 a | 0.58 | 97.49 | |
| Enraizante químico (200 mg L-1) | 18 c | 0.52 | 97.13 | |
| Media | 18 | |||
| Número de ramas (NR) | ||||
| 0 | 9 d | 0.26 | 97.13 | |
| 10 | 11 c | 0.45 | 95.93 | |
| 50 | 13 b | 0.31 | 97.61 | |
| 100 | 15 a | 0.31 | 97.97 | |
| Enraizante químico (200 mg L-1) | 12 bc | 0.21 | 98.19 | |
| Media | 12 | |||
| Fracción radical (FR) | ||||
| 0 | 9 d | 0.22 | 97.37 | |
| 10 | 12 c | 0.17 | 98.63 | |
| 50 | 14 b | 0.43 | 96.83 | |
| 100 | 15 a | 0.31 | 97.97 | |
| Enraizante químico (200 mg L-1) | 12 c | 0.21 | 98.19 | |
| Media | 12 | |||
| Biomasa fresca de raíces (BFR) | ||||
| 0 | 3.2 d | 0.14 | 95.58 | |
| 10 | 5.3 bc | 0.17 | 96.73 | |
| 50 | 6.0 ab | 0.19 | 96.92 | |
| 100 | 6.6 a | 0.11 | 98.32 | |
| Enraizante químico (200 mg L-1) | 4.8 c | 0.32 | 93.22 | |
| Media | 5.2 | |||
| Biomasa seca de raíces (BSR) | ||||
| 0 | 0.62 e | 0.02 | 96.83 | |
| 10 | 0.70 d | 0.03 | 95.91 | |
| 50 | 0.91 b | 0.01 | 99.25 | |
| 100 | 1.20 a | 0.02 | 98.14 | |
| Enraizante químico (200 mg L-1) | 0.75 c | 0.02 | 97.74 | |
| Media | 0.83 | |||
| Índice de plantas regeneradas (IPR) | ||||
| 0 | 8.8 e | 1.66 | 81.19 | |
| 10 | 30.3 c | 1.02 | 96.63 | |
| 50 | 42.0 b | 1.13 | 97.32 | |
| 100 | 51.7 a | 0.95 | 98.15 | |
| Enraizante químico (200 mg L-1) | 22.3 d | 1.69 | 92.45 | |
| Media | 31.0 | |||
Letras distintas en la misma columna indican diferencias significativas, según la prueba de Newman-Keuls (P ≤ 0.05). NH = número de hojas; NR = número de raíces; FR = fracción radical; BFR = biomasa fresca de la raíz; BSR = biomasa seca de la raíz; IPR = índice de plantas regeneradas.
Different letters in the same column indicate significant differences, according to the Newman-Keuls test (P ≤ 0.05). NH = number of leaves; NR = number of roots; FR = root fraction; BFR = fresh biomass of the root; BSR = dry biomass of the root; IPR = index of regenerated plants.
El índice de plantas regeneradas (IPR), del 25 al 40% referida por Cajamarca-Marín et al. (2017), fue superada por los tratamientos con dosis de 50 mg L-1 y 100 mg L-1, donde se alcanzaron promedios de 50% y 53.3% para los clones CCN-51 y EETP 801, respectivamente. A nivel de vivero, la variable número de hojas (NH) expresa de manera objetiva el crecimiento vegetativo (Cuadro 1). Los estadísticos Media, error estándar, variación relativa o proporción del error y la precisión, denotan información técnica para hacer inferencias con alta confiabilidad.
El efecto hormonal del oligogalacturónido estimula el desarrollo de las raíces de las plantas (Falcón-Rodriguez, Costales, González y Nápoles, 2015) y en el crecimiento de los cultivos está relacionado con el incremento de la disponibilidad y la absorción de nutrientes y el proceso de fotosíntesis mediante la acumulación de metabolitos y el aumento de pigmentos foliares (Reyes-Pérez, Ramos, Llerena, Ramírez y Falcón, 2021; Rodríguez, Martínez y Cruz, 2021; Reyes-Pérez et al., 2022). Los mecanismos de acción del oligogalacturónido no están totalmente dilucidados, pero la aplicación de este compuesto puede sustituir parcialmente el uso de hormonas vegetales en la propagación vegetativa comercial de cultivos como ornamentales, plátanos y bananos, aunque depende de la concentración aplicada (Izquierdo, Núñez, González, Proenza y Cabrera, 2009; Borges-García et al., 2015).
Estos resultados refuerzan la hipótesis de que los enraizantes, además de tener efectos estimulantes en el prendimiento de los esquejes, promueven el crecimiento vegetal como efecto directo de la concentración utilizada. Falcón-Rodríguez et al. (2015) y Lara-Acosta, Costales, Nápoles y Falcón (2019) demostraron que la aplicación de oligogalacturónidos a fragmentos de tejidos y esquejes de distintos cultivos, estimula el enraizamiento y acelera el crecimiento vegetal, por lo que se ha considerado como un bioestimulante.
En la Figura 1, se expone la distribución empírica de los tratamientos, destacándose que la dosis de 100 mg L-1 permite obtener los valores más altos en el índice de plantas regeneradas (IPR) y la dosis de 10 mg L-1 tiende a ser similar al tratamiento con el enraizante químico. El testigo (sin oligogalacturónidos) presenta el valor más bajo de IPR.
En el resumen de los análisis de varianza (Cuadro 2), se distingue que los coeficientes de variación (%), fluctúan de 4.72 a 10.55% lo que equivale a un adecuado control de los errores experimentales. En los tratamientos, se observaron diferencias significativas en todas las variables experimentales (P < 0.05), sin embargo, para los clones el comportamiento fue diferenciado, no evidenciándose diferencias estadísticas en las variables: NR, FR, BFR, BSR, BFH e IPR.
Table 2: Mean squares of the growth variables of cocoa seedlings in the nursery.
| Fuentes de variación | Grados de libertad | Cuadrados medios | ||||||||
| NH | NR | FR | BFR | BSR | BFH | BSH | BST | IPR | ||
| Clones | 1 | 38.53* | 1.20ns | 1.20ns | 0.51ns | 0.0023* | 5.72* | 2.13* | 0.05* | 7.50ns |
| Tratamientos | 4 | 81.13* | 31.22* | 36.70* | 10.00* | 0.3100* | 44.78* | 7.58* | 0.13* | 1672.5* |
| Error experimental | 24 | 0.76 | 0.57 | 0.45 | 0.23 | 0.0025 | 1.34 | 0.25 | 0.0011 | 10.72 |
| Total | 29 | |||||||||
| Coeficiente de variación | ---- | 4.72 | 6.35 | 5.50 | 9.26 | 5.93 | 6.77 | 6.73 | 5.17 | 10.55 |
NH = número de hojas; NR = número de raíces; FR = fracción radical; BFR = biomasa fresca de la raíz; BSR = biomasa seca de la raíz; BFH = biomasa fresca de la hoja; BSH = biomasa seca de la hoja; BST = biomasa seca del tallo; IPR = índice de plantas regeneradas.
NH = number of leaves; NR = number of roots; FR = root fraction; BFR = fresh biomass of the root; BSR = dry biomass of the root; BFH = fresh biomass of the leaf; DSH = dry biomass of the leaf; DST = dry stem biomass; IPR = index of regenerated plants.
En la Figura 2, se puede observar el comportamiento de los tratamientos y los rangos, según el criterio de Keuls, donde, el testigo absoluto sin enraizante, tiene un reducido índice de plantas regeneradas.
El clon CCN-51 comparado con el clon EET 801 tiende a mostrar mayor número de hojas (P < 0.01), fracción radical (P < 0.05), biomasa seca de la hoja (P > 0.01) y biomasa seca del tallo (P > 0.01). En las otras variables biológicas, los dos clones en estudio resultaron estadísticamente iguales (Cuadro 3).
Table 3: Test t for the clones CCN-51 and EET 801 in the biological variables of cocoa seedling growth in the nursery.
| Variables biológicas | |||||||||
| Medias | NH | NR | FR | BFR | BSR | BFH | BSH | BST | IPR |
| CCN-51 | 20 a | 12 a | 12.4 a | 5.3 a | 0.84 a | 17.6 a | 7.7 a | 0.7 a | 31.5 a |
| EET 801 | 17 b | 12 a | 12.0 b | 5.1 a | 0.83 a | 16.7 a | 7.1 b | 0.6 b | 30.5 a |
| Diferencia | 2.3 | 0.40 | 0.40 | 0.26 | 0.01 | 0.87 | 0.53 | 0.08 | 1.00 |
| p de t | 0.00004 | 0.1643 | 0.0281 | 0.2040 | 0.4690 | 0.0758 | 0.008 | 0.001 | 0.485 |
| Significación estadística | ** | ns | * | ns | ns | ns | ** | ** | ns |
NH = número de hojas; NR = número de raíces; FR = fracción radical; BFR = biomasa fresca de la raíz; BSR = biomasa seca de la raíz; BFH = biomasa fresca de la hoja; BSH = biomasa seca de la hoja; BST = biomasa seca del tallo; IPR= índice de plantas regeneradas.
NH = number of leaves; NR = number of roots; FR = root fraction; BFR = fresh biomass of the root; BSR = dry biomass of the root; BFH = fresh biomass of the leaf; DSH = dry biomass of the leaf; DST = dry stem biomass; IPR= index of regenerated plants
El análisis de correlaciones lineales, momento-producto de Pearson, permitió determinar que IPR tiene una correlación positiva y significativa con niveles de confianza mayores que 95%, con todas las variables biológicas en estudio (Cuadro 4). La biomasa seca del tallo (BST) no se correlaciona estadísticamente con BSR, BFH, ni BSH. No se evidencia correlación significativa entre BSR con BFR. Los valores críticos de r, para grados de libertad = 4 y α = 0.05 y α = 0.01, fueron: r0.05 = 0.811 y r0.01 = 0.917, respectivamente.
Table 4: Linear correlation analysis among the biological growth variables of cocoa seedling in the nursery.
| NH | NR | FR | BFR | BSR | BFH | BSH | BST | IPR | |
| NH | 1.000 | ||||||||
| NR | 0.891* | 1.000 | |||||||
| FR | 0.905* | 0.902* | 1.000 | ||||||
| BFR | 0.848* | 0.815* | 0.871* | 1.000 | |||||
| BSR | 0.842* | 0.916* | 0.846* | 0.754ns | 1.000 | ||||
| BFH | 0.897* | 0.823* | 0.876* | 0.807* | 0.821* | 1.000 | |||
| BSH | 0.898* | 0.903* | 0.834* | 0.838* | 0.831* | 0.855* | 1.000 | ||
| BST | 0.817* | 0.806* | 0.835* | 0.838* | 0.759ns | 0.790ns | 0.796ns | 1.000 | |
| IPR | 0.899* | 0.869* | 0.925** | 0.919** | 0.852* | 0.889* | 0.854* | 0.829* | 1.000 |
NH = número de hojas; NR = número de raíces; FR = fracción radical; BFR = biomasa fresca de la raíz; BSR = biomasa seca de la raíz; BFH = biomasa fresca de la hoja; BSH = biomasa seca de la hoja; BST = biomasa seca del tallo; IPR= índice de plantas regeneradas. * correlación significativa con 95% de confianza, ** correlación significativa con 99% de confianza, ns = no hay correlación.
NH = number of leaves; NR = number of roots; FR = root fraction; BFR = fresh biomass of the root; BSR = dry biomass of the root; BFH = fresh biomass of the leaf; DSH = dry biomass of the leaf; DST = dry stem biomass; IPR= índex of regenerated plants. * significant correlation with 95% confidence, ** significant correlation with 99% confidence, ns = no correlation.
Estos resultados tienen implicaciones prácticas en la producción de cacao, pues las plántulas al tener mayor biomasa seca radicular podrían tener un crecimiento más rápido y por tanto un menor tiempo de aclimatización para convertirse en plantas vigorosas. En ese sentido, Izquierdo et al. (2009) dan a conocer un comportamiento similar en plantas in vitro de plátanos tratadas con oligogalacturónidos debido a que se acortó el ciclo de climatización, respecto al testigo.
Los análisis estadísticos realizados respecto a la biomasa fresca de las hojas indican que la concentración de oligogalacturónidos a 100 mg L-1 fue el mejor tratamiento en los dos clones de cacao. La mayor biomasa fresca de la hoja fue obtenida con la aplicación de oligogalacturónidos a 100 mg L-1 lo que demuestra la respuesta positiva de este indicador al aumento de la concentración del producto. Ramos-Hernández et al. (2013) sostienen que las estacas de guayaba tratadas con oligogalacturónidos aumentan la proliferación de raíces y esto mejora el potencial hídrico y beneficia la plasticidad y elasticidad de las hojas y raíces.
Los resultados de estimulación del crecimiento vegetal mediante la aplicación de oligogalacturónidos se debe a la composición de oligómeros activos que estimulan la secreción de endopoligalacturonasas endógenas, las cuales, aumentan la hidrólisis de las sustancias pécticas que funcionan como material de unión de la celulosa, hemicelulosa y otros componentes de la célula vegetal provocando un mayor crecimiento de la misma (Sabater, Blanco, Montilla y Corzo, 2021). Las oligosacarinas se han propuesto como una nueva jerarquía de hormonas en las plantas, cuya acción precede la síntesis y acumulación de las conocidas hormonas tradicionales (Falcón-Rodríguez et al., 2015; Reyes-Pérez et al., 2021). Los resultados encontrados en este trabajo pudieran tener una aplicación práctica inmediata para el cultivo del cacao en los dos clones estudiados, así como en otros cultivos (Cabrera et al., 2012).
El coeficiente de determinación fue 87%, por lo que se afirma: la aplicación de oligogalacturónidos influye positivamente en el índice de plantas regeneradas, en los dos clones probados en vivero, siendo el modelo cuadrático que mejore representa el fenómeno biológico. Sin la aplicación del producto, el IPR promedio fue 14.5% y la dosis máxima calculada a partir de la primera derivada, para tener la mejor respuesta de IPR es:
Por lo tanto, la dosis de oligogalacturónidos que posibilita obtener el máximo IPR es 85 mg L-1
Según Ramos-Hernández et al. (2013), en el enraizamiento de esquejes de guayaba enana Roja cubana, hubo una mejor respuesta en enraizamiento con la dosis de 20 mg L-1. Esta diferencia en la dosis puede explicarse porque se trata de especies distintas.
El índice de plantas regeneradas que puede predecirse a partir del análisis de regresión polinomial de grado 2, donde se determinó que aplicando 85 mg L-1 del bioestimulante se logra el 49.1% de IPR, con un coeficiente de determinación del 87% (Figura 3).
Realizando el análisis de regresión lineal múltiple para generar un modelo en el que el valor de la variable dependiente o respuesta (Y) se determina a partir de un conjunto de variables independientes llamadas predictores, sean X1, X2, X3… (Amat, 2016). Para este análisis se usó la modelación lineal automatizada del software SPSS v22 (IBM SPSS Statistics, 2013). En la preparación de los datos no se detectaron valores atípicos. El modelo matemático: Y = f(X1, X2), se tradujo en IPR= f(BFR,BFH). Estas variables predictoras tuvieron una importancia en el modelo que equivale a 59 y 33%, respectivamente.
El modelo multivariado para predecir IPR es el siguiente:
Dónde: IPR= Índice de plantas regeneradas, BFR= Biomasa fresca de las raíces, BFH= Biomasa fresca de las hojas.
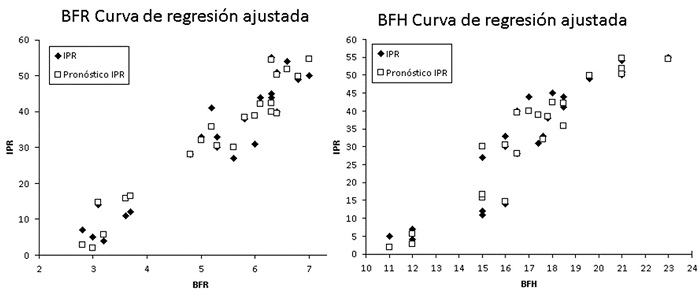
La curva de regresión ajustada del modelo IPR (Figura 4) indica la lata probabilidad de predecir el IPR en base a la biomasa fresca de las raíces (BFR) y biomasa fresca de las hojas (BFH), con un coeficiente de determinación, R2 ajustado= 0.959 y un coeficiente alfa de Cronbach, α = 0.964, para datos tipificados, que permite tener una alta confiabilidad en el modelo. Los oligogalacturónidos además de tener efectos significativos sobre el crecimiento vegetativo de las plántulas de cacao, se utilizan como protectores de las plantas ante el estrés salino, como en el cultivo del arroz (Pérez-Domínguez et al., 2021).
Conclusiones
Las dosis de 50 mg L-1 y 100 mg L-1 en los clones de cacao EET 801 y CCN-51 mostraron los mayores efectos sobre las variables biológicas. NH, FR, BSH y BST. El clon CCN-51 comparado con EET 801 mostro mayores promedios de NH, FR, BSH y BST (P < 0.05). Los clones CCN-51 y EET 80 resultaron estadísticamente iguales en NR, BFR, BSR, BFH e IPR. El IPR tiene una correlación positiva y significativa con todas las variables biológicas evaluadas. La biomasa seca del tallo (BST) no se correlaciona estadísticamente con BSR, BFH ni BSH. El más alto índice de plantas regeneradas se obtuvo con la dosis de 85 mg L-1 para lograr un IPR potencial de 49.1%. El índice de plantas regeneradas (IPR) puede predecirse con un coeficiente de determinación del 96%. Por lo tanto, la aplicación de oligogalacturónidos es una opción para la propagación vegetativa de cacao en condiciones de vivero.
Contribución de los Autores
Investigación, conceptualización, validación, administración del proyecto, adquisición de fondo: J.J.R.P. Escritura: revisión y edición: J.A.T.R. Investigación, metodología: L.T.L.R. Escritura: preparación del borrador original, escritura: revisión y edición: L.G.H.M. Curación de datos, análisis de datos: J.J.R.P. Escritura, revisión, análisis formal: J.A.T.R.











 text new page (beta)
text new page (beta)