Introducción
El cultivo de jitomate tiene un papel importante en el sector agrícola de México. Aporta 4.5% del valor de la producción agrícola y en el año 2021, se cultivaron 48 042 ha de jitomate, de las cuales, 32.8% se produjeron bajo agricultura protegida, aportando 66.5% del volumen de producción; con un rendimiento promedio nacional de 140.26 Mg ha-1, superando 4.05 veces el rendimiento obtenido bajo condiciones de cielo abierto (SIAP, 2021).
En la actualidad, la producción agrícola se sustenta en el empleo de una alta cantidad de insumos externos, siendo los principales los fertilizantes químicos (McArthur y McCord, 2017; Ritchie, Roser y Rosado, 2017) y el cultivo del jitomate no escapa a esta situación. En México, la producción de jitomate bajo condiciones protegidas emplea cantidades importantes de fertilizantes, de acuerdo a FIRA (2018), en el estado de Guanajuato representan el 16.65% de los costos variables de producción del cultivo, repercutiendo en la rentabilidad y en los ingresos de los productores. Por lo anterior, es necesario la búsqueda de alternativas sustentables que impacten ecológica y económicamente la producción de jitomate a través de la reducción parcial o total de los fertilizantes químicos. De acuerdo a Fukami, Cerezini y Hungria (2018), Kamal, Kumar, Rajkumar y Raghav (2018), Velasco, Castellanos, Acevedo, Aarland y Rodríguez (2020) y Kumar, Diksha, Sindhu y Kumar (2022) con el uso de los inoculantes microbianos se puede reducir el deterioro ambiental ocasionado por la fertilización química y se logra disminuir los costos de producción sin afectar el rendimiento de los cultivos.
Algunos estudios han mostrado que la inoculación con microorganismos benéficos es una alternativa viable para sustituir total o parcialmente la fertilización química nitrogenada y fosfórica (Fernández-Delgado, Hernández y Salgado, 2021; Hernández-Valladares et al., 2021).
Los hongos micorrízicos arbusculares (HMA) promueven la nutrición mineral de los cultivos, principalmente incrementan la absorción de fósforo (Jiang et al., 2017; Kumar, Maurya, y Raghuwanshi, 2021; Bennett y Groten, 2022), disminuyen la absorción de metales pesados (Pb, Cd, Hg y As) (Esmaeel et al., 2018; Morar, Iantovics y Gligor, 2018; Riaz et al., 2021), incrementan la tolerancia a enfermedades (Trinidad-Cruz, Quiñones, Rincón, López y Hernández, 2017; Schirawski y Perlin, 2018; Quiñones-Aguilar, Hernández, López y Rincón, 2019) y condiciones de estrés a sequía, heladas y salinidad (Baum, El-Tohamy y Gruda, 2015; Schirawski y Perlin, 2018).
En tanto que Azospirillum sp. produce fitohormonas que promueven el crecimiento de las raíces de los cultivos (Abdel-Latef, Abu-Alhmad, Kordrostami, Abo-Baker y Zakir, 2020; Kumar et al., 2021). Por lo anterior, el presente trabajo se realizó con la finalidad de evaluar la respuesta de dos cultivares de jitomate a la inoculación de Azospirillum sp., hongos micorrízicos arbusculares (HMA) y diferentes concentraciones de solución nutritiva bajo un sistema hidropónico en invernadero.
Materiales y Métodos
Se estableció un ensayo con el cultivo de jitomate en condiciones de invernadero bajo un diseño factorial 4*4*2 con arreglo en bloques al azar con cinco repeticiones, y una densidad de 3.5 plantas m-2, en la Unidad Académica Huejotzingo, del Campus Puebla del Colegio de Postgraduados ubicada en 19.161944 N y -98.406389 O a una altura de 2260 m de altitud.
Los factores de estudio evaluados fueron; concentración de solución nutritiva, inoculación e híbridos. El desarrollo del cultivo se dividió en cuatro etapas fenológica, en cada una de las cuales se aplicó una solución nutritiva (Cuadro 1).
Cuadro 1: Solución nutritiva empleada en el cultivo hidropónico de tomate en las diferentes etapas fenológicas.
Table 1: Nutritive solution used in hydroponic tomato at different phenological stages.
| DDT | pH | CE | N | P | K+ | Ca++ | Mg++ | S | Fe | Mn | Cu | Zn | B |
| 0 a 20 | 5.5 | 1.5 | 126 | 23 | 205 | 135 | 36 | 84 | 3 | 0.5 | 0.1 | 0.1 | 0.1 |
| 21 a 40 | 5.5 | 1.8 | 151 | 28 | 246 | 162 | 43 | 101 | 3 | 0.5 | 0.1 | 0.1 | 0.1 |
| 41 a 60 | 5.5 | 2.1 | 176 | 33 | 287 | 189 | 50 | 118 | 3 | 0.5 | 0.1 | 0.1 | 0.1 |
| > 60 | 5.5 | 2.4 | 202 | 37 | 328 | 216 | 58 | 134 | 3 | 0.5 | 0.1 | 0.1 | 0.1 |
DDT = días después del trasplante; pH = potencial de hidrogeno; CE = conductividad eléctrica; N = nitrógeno; P = fosforo; K+ = ion potasio; Mg++ = ion magnesio; S = azufre; Fe = hierro; Mn = manganeso; Cu = cobre; Zn = zinc; B = boro. Los valores de nutrimentos están expresados en mg L-1.
DDT = days after transplantation; pH = potential of hydrogen; CE = electrical conductivity; N = nitrogen; P = phosphorus; K+ = potassium ion; Mg++ = magnesium ion; S = sulfur; Fe = iron; Mn = manganese; Cu = copper; Zn = zinc; B = boron. Nutrient values are expressed in mg L-1.
El diseño se realizó tomando en cuenta el análisis del agua de riego que presentaba las siguientes características; pH 7.21, CE 1.02 mScm-1, suma de aniones 10.26 meq L-1, suma de cationes10.19 meq L-1, realizando un balance de cationes y aniones considerando las relaciones iónicas de Steiner (19841). Las soluciones del Cuadro 1 empleadas en cada etapa fenológica se consideraron al 100% de concentración. Los niveles de la solución nutritiva que fueron evaluadas fueron 100, 75, 50 y 25%. Para obtener cada uno de los niveles de la solución nutritiva se partió de la concentración al 100% y ésta se diluyó con la cantidad de agua necesaria para llegar a la concentración requerida. Las fuentes de fertilización empleadas fueron; fosfato monoácido de amonio, nitrato de potasio, sulfato de potasio, nitrato de calcio y sulfato de magnesio.
Para el factor inoculación se emplearon los productos comerciales; Biofertibuap de la Benemérita Universidad Autónoma de Puebla y Glumix de Biokrone. La primera está constituido por la bacteria fijadora de nitrógeno del género Azospirillum, en tanto que Glumix está constituida por 8% de calcio, 0.05% de hierro y 0.15% equivalente a 20 000 esporas viables kg-1 de HMA de las especies Rhizoglomus fasciculatum, Septoglomus constrictum, Sieverdingia tortuosa, Funneliformis geosporum y R. intraradices. Los niveles del factor inoculación fueron; sin inoculantes (testigo), Azospirillum (Azo), HMA y Azospirillum más HMA (AzHMA). Se realizaron tres inoculaciones; una al momento del trasplante, los dos restantes a 15 y 30 días después del trasplante. En las tres inoculaciones, se emplearon soluciones que contenían aproximadamente 5000 ufc mL-1 de Azospirillum y 80 esporas mL-1 de HMA. Al momento del trasplante a las plantas que les correspondía el tratamiento de inoculación se sumergieron en la solución respectiva por 5 minutos, con el sustrato que contenía en la charola, en tanto que a los 15 y 30 días después de trasplante a los tratamientos que les correspondía inoculación se les aplicó cinco mL de la solución con inoculantes que correspondía a cada tratamiento.
Para el factor tipo de jitomate de crecimiento indeterminado se utilizaron los híbridos Ramses y Cid. El cultivo se estableció en macetas con capacidad de 16 L en sistema hidropónico abierto, usando arenilla de tezontle rojo (2 mm de diámetro), colocando una planta por maceta. Se aplicaron tres riegos por día con la solución nutritiva que correspondía a cada tratamiento. De 0 a 40 días después del trasplante (DDT) en cada riego se aplicaron 60 mL por maceta, entre los 41 a 60 DDT se aplicaron 120 mL por maceta y riego y después de los 60 días se aplicaron 200 mL por maceta y riego.
El ensayo se condujo hasta el quinto racimo, tomando las siguientes variables; rendimiento kg m-2 (REN) número de frutos (NFRU), peso promedio de frutos en g (PPROF), firmeza en kg m-2 (FIR), solidos solubles totales en °Brix (SST), diámetro longitudinal en mm (DLONG), y diámetro ecuatorial en mm (DECU). Para el análisis, primeramente, se comprobó el supuesto de distribución normal y homogeneidad de varianza de los datos mediante las pruebas de Kolmogorov-Smirnov y Bartlet, posteriormente se les realizó un análisis de varianza y comparación de medias de Tukey al 5% con el paquete SAS System Versión 9 (SAS Institute, 2002).
Resultados y Discusión
Factor: solución nutritiva
El factor porcentaje de solución nutritiva (PSOLN) presentó efecto altamente significativo (P < 0.0001) para el rendimiento (REN), número de frutos (NFRU), peso promedio de frutos (PPROF), firmeza (FIR), SST, diámetro longitudinal (DLONG) y diámetro ecuatorial (DECU).
Las plantas con la concentración al 50% de la solución nutritiva presentó el mayor rendimiento de fruto por metro cuadrado (11.83 kg), seguido del 100% (11.75 kg), 75% (11.41 kg) y 25% (7.27 kg). Presentándose diferencias significativas (P < 0.05) solamente entre la concentración al 25% con el resto de los tratamientos (Cuadro 2). Los resultados muestran que es probable que los híbridos empleados en el estudio satisfagan sus requerimientos nutricionales con el 50% de concentración de la solución. Al respecto Cosme et al. (2017) evaluaron diferentes concentraciones de una solución estándar base (100%) para el cultivo de melón, reportando que la concentración a 47% produjo el mayor peso promedio de frutos. Adesemoye, Torbert y Kloepper (2009), empleando la solución Hoagland a concentraciones al 100, 80, 75, 70 y 50% encontraron que el crecimiento y rendimiento de jitomate no se afecta reduciendo la concentración de la solución base hasta en un 75%. Por otro lado, Lazcano-Bello et al. (2021), al evaluar la solución de Steiner al 100 y 50% en calidad de plántula de jitomate no encontraron diferencias.
Cuadro 2: Efecto de la concentración de la solución nutritiva sobre rendimiento y variables de calidad de fruto de jitomate.
Table 2: Effect of the concentration of the nutritive solution on yield and quality variables of the tomato fruit.
| Solución nutritiva | NFRU | PPROF | FIR | DLONG | DECU | SST | REN |
| g | kg m-2 | - - - - - - mm - - - - - | ºBrix | kg m-2 | |||
| 100 | 40.75 (6.1) a | 93.3 (9.1) a | 3.21 (0.2) a | 67.65 (3.6) a | 54.10 (3.2) a | 4.42 (0.4) a | 11.74 (1.6) a |
| 75 | 41.38 (5.8) a | 92.29 (8.8) a | 3.14 (0.2) ab | 66.53 (2.5) a | 52.26 (3.0) b | 4.34 (0.4) a | 11.40 (1.6) a |
| 50 | 39.68 (5.8) a | 97.96 (14.8) a | 3.07 (0.2) b | 66.78 (3.2) a | 52.78 (3.0) ab | 4.10 (0.3) b | 11.82 (2.1) a |
| 25 | 30.83 (6.9) b | 80.01 (10.7) b | 2.85 (0.3) c | 63.78 (3.5) b | 50.39 (2.8)c | 3.78 (0.2) c | 7.72 (1.6) b |
| CV | 14.72 | 11.48 | 5.57 | 4.552 | 5.061 | 6.405 | 14.599 |
| DSH | 3.27 | 6.075 | 0.0994 | 1.76 | 1.54 | 0.1551 | 0.908 |
Dónde: NFRU = número de frutos promedio por planta; PPROF = peso promedio de frutos; FIR = firmeza de fruto; DLONG = diámetro longitudinal de fruto; DECU = diámetro ecuatorial de fruto; SST = solidos solubles totales; REN = rendimiento; CV = coeficiente de variación; DSH = diferencia mínima armónica. Letras distintas en la misma columna indican diferencias significativas, según prueba de Tukey (P ≤ 0.05). Los valores entre paréntesis indican la desviación estándar de las medias.
Where: NFRU = average number of fruits per plant; PPROF = average fruit weight; FIR = fruit firmness; DLONG = longitudinal diameter of fruit; DECU= equatorial diameter of fruit; TSS = total soluble solids; REN = yield; CV= coefficient of variation; DSH = minimum harmonic difference. Different letters in the same column indicate significant differences according to Tukey's test (P ≤ 0.05). Values in parentheses indicate the standard deviation of means.
Las variables NFRU, PPROF, DLONG y DECU no presentaron diferencias estadísticas significativas (P < 0.05) entre los niveles de concentración de 100, 75 y 50%; sin embargo, estos tres niveles muestran diferencias estadísticas significativas con la concentración de 25%. En cuanto a las variables FIR y SST se encontraron diferencias estadísticas significativas (P < 0.05) entre la concentración de 50% con las de 100 y 75%, encontrando que a mayor concentración se produce mayor FIR y SST (Cuadro 2). Los resultados indican que la dosis de fertilización puede reducirse al 50%, sin ser afectado el rendimiento y la calidad de frutos.
Es de señalar que, en muchas zonas productoras de jitomate bajo invernadero en México, se utiliza la solución nutritiva Steiner al 100%, por lo que los resultados encontrados en el presente estudio muestran que se excede en el uso de fertilizantes químicos. Se encontró que estos se pueden reducir hasta en un 50%, sin afectar el rendimiento y calidad de la producción. Además, se disminuye el impacto que tienen los agroquímicos sobre el ambiente, y se repercute de manera importante sobre los costos de producción, generando de esta manera mayores ingresos a los productores.
Factor: inoculación de microorganismos benéficos
El factor inoculación presentó efecto altamente significativo para SST (P < 0.0001) y FIR (P < 0.0001), en tanto que fue significativo para REN (P < 0.0.0476) y DECU (P < 0.0165). En SST, la inoculación con Azospirillum (Azo) incremento la SST y es estadísticamente diferente a los valores presentados con HMA, la coinoculación Azospirillum-HMA (AzHMA) y testigo (Figura 1). Para el caso de la firmeza (FIR), los tratamientos que mostraron los valores más altos fueron; HMA (3.1375 kg m-2), AzHMA (3.0975 kg m-2) y Azo (3.0825 kg m-2) no mostrando diferencias estadísticas entre ellas; y el tratamiento que mostró menor firmeza en frutos fue el tratamiento testigo (2.85 kg m-2) (Figura 2).
Figura 1: Efecto de la inoculación sobre SST de frutos en jitomate. HMA = hongo micorrízicos arbusculares; SST = solidos solubles totales. Letras distintas entre barras indican diferencias significativas en SST de fruto entre tratamientos de inoculación, según prueba de Tukey (P ≤ 0.05); Los datos son presentados como medias ± desviación estándar (SD).
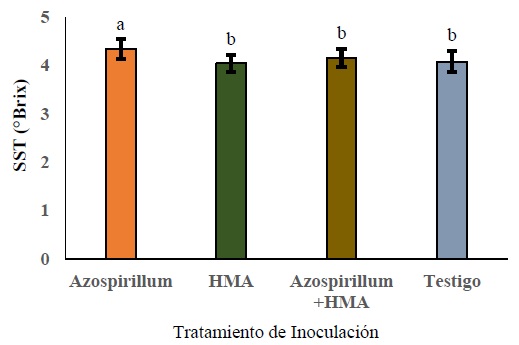
Figure 1: Effect of inoculation on TSS of tomato fruits. AMF= arbuscular mycorrhizal fungus; TSS= total soluble solids. Different letters between bars indicate significant differences in fruit TSS among inoculation treatments, according to Tukey's test (P ≤ 0.05); Data are presented as means ± standard deviation (SD).
Figura 2 Efecto de la inoculación sobre firmeza de frutos en jitomate. Donde: FIR = firmeza, HMA = hongos micorrízicos arbusculares. Letras distintas entre barras indican diferencias significativas en firmeza de fruto entre tratamientos de inoculación, según prueba de Tukey (P ≤ 0.05); Los datos son presentados como medias ± desviación estándar (SD).
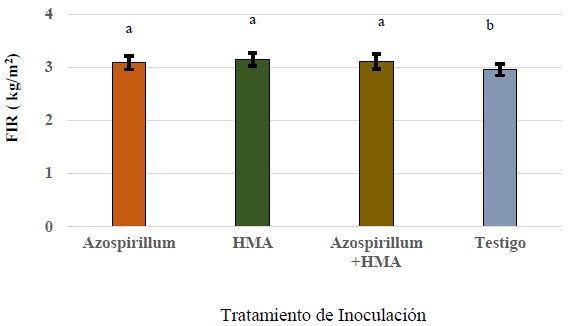
Figure 2: Effect of inoculation on tomato fruit firmness. Where: FIR = firmness, AMF = arbuscular mycorrhizal fungi. Different letters between bars indicate significant differences in fruit firmness among inoculation treatments, according to Tukey's test (P ≤ 0.05); Data are presented as means ± standard deviation (SD).
De acuerdo a Gianinazzi et al. (2010) y González-Rodríguez et al., 2018) la inoculación con rizobacterias promotores del crecimiento vegetal (RPCV) y HMA incrementa la absorción de nutrientes esenciales, por lo que hay un aumento en la actividad fotosintética, elevándose la producción de azucares simples y almidón, con lo que se mantiene la turgencia y disminuye la pérdida de agua trayendo como consecuencia el incremento del peso de fruto.
Por otra parte, Rochange (2010) señala que los RPCV y HMA provoca una mayor absorción de nutrimentos, intensificando el metabolismo de la planta hospedante, lo que incide sobre enzimas que participan en la degradación de carbohidratos de la pared celular, pudiendo producir azucares simples que incrementa la concentración de solidos solubles en los frutos. En relación a la firmeza de frutos, Mena-Violante, Cruz, Paredes, Gómez y Olalde (2009) señalan que las plantas inoculadas con RPCV y HMA pueden reducir el deterioro de los frutos, disminuyendo la actividad de la enzima poligalacturonasa en la pared celular, la cual, actúa en el ablandamiento del fruto.
El tratamiento de inoculación que dio mayor diámetro ecuatorial (DECU) a los frutos de jitomate fue el de Azo (53.0206 mm) seguido de HMA (52.77 mm) y AzHMA (52.52 mm) y los frutos que presentaron menor DECU fueron los del tratamiento testigo (51.23 mm) siendo diferente estadísticamente con los frutos del tratamiento con Azo (Figura 3). Los RPCV y HMA promueven el crecimiento de las plantas, rendimiento y tamaño de frutos al incrementar la absorción de nutrimentos (Abraham-Juárez et al., 2018). En tanto, Nzanza, Marais y Soundy (2012), señalan que las RPCV inciden sobre el crecimiento de los frutos activando las enzimas involucradas en la expansión de los frutos.
Figura 3: Efecto de la inoculación sobre diámetro ecuatorial de frutos de jitomate. Donde: DECU = diámetro ecuatorial de fruto; HMA = hongo micorrízico arbuscular. Letras distintas entre barras indican diferencias significativas en diámetro ecuatorial de fruto entre tratamientos de inoculación, según prueba de Tukey (P ≤ 0.05); Los datos son presentados como medias ± desviación estándar (SD).

Figure 3: Effect of inoculation on equatorial diameter of tomato fruits. Where: DECU = equatorial diameter of fruit; AMF = arbuscular mycorrhizal fungus. Different letters between bars indicate significant differences in fruit equatorial diameter among inoculation treatments, according to Tukey's test (P ≤ 0.05); Data are presented as means ± standard deviation (SD).
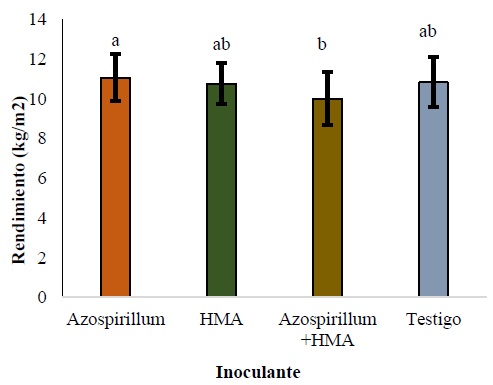
El mayor rendimiento de fruto se obtuvo con el tratamiento Azo (11.0785 kg m-2), superando al testigo con 2.2%, HMA con 2.8% y AzHMH con 10.57% presentándose diferencias solamente entre Azo y AzHMA (Figura 4). Estos resultados coinciden a los reportados por Esquivel-Cote, Tsuzuki, Ramírez y Huante (2017), quienes encontraron un incremento de 16% en rendimiento de jitomate con la inoculación de 105 NMP células g-1 de raiz con Azospirillum con respecto al tratamiento no inoculado. En tanto, Alvarado, Diaz y Peña del Rio (2014) reportan rendimientos de jitomate superiores al 30% con Rhizophagus intraradices inoculada con > 40 esporas g-1 respecto al obtenido con el tratamiento sin inocular. Khan, Bano, Ali y Babar (2020), señalan que la aplicación de RPCV y HMA incrementa los rendimientos por la produccion de auxinas, citoquininas, giberelinas, riboflavina y vitaminas (tiamina, niacina y ácido pantoténico).
Figura 4: Efecto de la inoculación sobre rendimiento de jitomate. Donde: HMA = hongo micorrízico arbuscular. Letras distintas entre barras indican diferencias significativas en rendimiento de fruto entre tratamientos de inoculación, según prueba de Tukey (P ≤ 0.05); Los datos son presentados como medias ± desviación estándar (SD).
Contrario a lo encontrado en el presente estudio, diversos trabajos han reportado efectos positivos de la coinoculación de Azo y HMA en diferentes cultivos, reducción de dosis de fertilización, incremento de altura de planta, largo y ancho de hoja bandera y diametro de tallo, peso de grano con una presencia de 198 UFC mL-1 en maíz (Zulueta-Rodríguez, Gómez, Alemán, Núñez y Lara, 2020), longitud y diametro de tallo, peso seco de hoja en Morus alba inoculado con 350 a 400 esporas de hongos micorrízicos por planta y 125 mL de inoculo de Azospirillum brasilense a concentracion de 109 a 1010 CFU mL-1 (Becquer, Puentes, Cabrera, Hernández y Sánchez, 2021).
Interacción solución nutritiva por inoculación
La interacción solución nutritiva por inoculación fue altamente significativa para PPROMF (P < 0.0074) y significativa para firmeza (P < 0.0117).
Los tratamientos que presentaron mayor PPROMF fueron 50% de solución nutritiva sin inoculantes, inoculada con Azo y AzHMA, presentando únicamente diferencias estadísticas significativas con los niveles bajos de solución nutritiva (25%) combinada con los cuatro tratamientos de inoculación (Cuadro 3). Los tratamientos de concentración de solución nutritiva más bajo (25%) con los cuatro tratamientos de inoculación fueron los que presentaron los niveles más bajos de PPROMF. Al respecto Terry-Alfonso, Leyva y Hernández (2005), encontraron que con la inoculación con Azospirillum y 120 kg de N ha-1, produjo frutos de jitomate con peso promedio superior en 7.4% al testigo, ahorrando con este tratamiento 30 kg de N ha-1. Los tratamientos que presentaron mayor firmeza en frutos fueron 100% de solución nutritiva inoculada con HMA y AzHMA, 75% de solución nutritiva inoculada con Azo, presentando al igual que para el caso de PPROMF diferencias estadísticas significativas principalmente con los tratamientos bajos en solución nutritiva con los cuatro niveles de inoculantes (Cuadro 3).
Cuadro 3: Efecto de porcentaje de solución nutritiva e inoculación sobre firmeza y peso promedio de frutos de jitomate.
Table 3: Effect of the percentage of nutrient solution and inoculation on firmness and average weight of tomato fruits.
| PSOLN | Tratamiento | PPROF | FIR |
| g | kg m-2 | ||
| 25 | Azo | 85.65 (12.2) bcde | 2.88 (0.37) de |
| 25 | AzHMA | 75.30 (10.4) e | 2.75 (0.14) e |
| 25 | HMA | 79.91 (10.4) cde | 3.04 (0.27) bcd |
| 25 | T | 79.18 (8.2) de | 2.73 (0.12) e |
| 50 | Az | 101.56 (9.8) ab | 3.09 (0.19) abcd |
| 50 | AzHMA | 95.73 (7.6) abc | 3.19 (0.20) abc |
| 50 | HMA | 86.42 (12.8) bcde | 3.08 (0.28) abcd |
| 50 | T | 108.12 (18.7) | 2.93 (0.18) |
| 75 | Az | 92.69 (10.5) | 3.21 (0.12) |
| 75 | AzHMA | 92.01 (7.4) | 3.16 (0.24) |
| 75 | HMA | 94.5 (7.6) | 3.12 (0.15) |
| 75 | T | 89.96 (10.3) | 3.06 (0.15) |
| 100 | Az | 91.88 (10.0) | 3.15 (0.11) |
| 100 | AzHMA | 93.03 (9.0) | 3.29 (0.17) |
| 100 | HMA | 94.4 (8.6) | 3.31 (0.19) |
| 100 | T | 93.89 (9.8) | 3.08 (0.22) |
Dónde: PSOLN = porcentaje de solución nutritiva, PPROF = peso promedio de frutos, FIR = firmeza, Azo = Azospirillum, HMA = hongo micorrízicos arbusculares; AzHMA= Coinoculación Azospirillum-HMA, T = testigo. Medias con la misma letra en las columnas son iguales estadísticamente (ANOVA), prueba de Tukey (P ≤ 0.05). Los valores entre paréntesis indican la desviación estándar de los datos.
Where: PSOLN = percentage of nutrient solution, PPROF = average fruit weight, FIR = firmness, Azo = Azospirillum, AMF = arbuscular mycorrhizal fungus; AzHMA = Azospirillum-AMF coinoculation, T = control. Means with the same letter in the columns are statistically equal (ANOVA), Tukey's test (P ≤ 0.05). Values in parentheses indicate the standard deviation of the data.
Diversos estudios han reportado efectos positivos de la interacción niveles de fertilización e inoculación sobre el rendimiento en jitomate; Terry-Alfonso, Ruiz y Carrillo (2018), evaluando HMA a dosis de 20 esporas g-1 y la fórmula de fertilización química 150-75-100 al 50 y 100%, encontraron que el tratamiento testigo fue superado con 76.5 y 79.3% en el número de frutos y peso promedio de éstos con los tratamientos de 50% de fertilización química con HMA y 100% de fertilización química respectivamente. Adesemoye et al. (2009), reportaron que en el cultivo de jitomate la fertilización puede reducirse al 75% de la dosis recomendada con la coinoculación con rizobacterias y HMA. En tanto que Ziane, Hamza y Meddad (2021), evaluando la fórmula 10-40-10 a una dosis de 100 kg ha-1 aplicando 0, 50 y 100% y 200 Propágalos de HMA por planta más una fertilización base de 150 kg ha-1 de nitrato de amonio y 50 kg ha-1 de sulfato de potasio, reportan incremento del rendimiento de 8.7% con el tratamiento de inoculación independientemente del tratamiento de fertilización. Premshekhar y Rajashree (2009), reportaron que en el cultivo de jitomate la altura de planta, número de frutos por planta, y rendimiento fueron mayores con la inoculación con Azospirillum, 75, 100 y 100% de la dosis recomendada de nitrógeno, fósforo y potasio, respectivamente.
Factor: hibrido
El factor hibrido (HIB) presentó efecto altamente significativo para las variables firmeza (P < 0.0001), DLONG (P < 0.0001) y DECU (P < 0.0001). Se encontró que el hibrido Cid supera a Ramses con 0.12 kg m-2, 1.74 mm y 1.75 mm en firmeza, DLONG y DECU, respectivamente (Cuadro 4).
Cuadro 4: Efecto del hibrido de jitomate sobre firmeza, diámetro longitudinal (DLONG) y diámetro ecuatorial (DECU).
Table 4: Effect of tomato hybrid on firmness, longitudinal diameter (DLONG) and equatorial diameter (DECU).
| Hibrido | FIR | DLONG | DECU |
| kg m-2 | - - - - - - - - mm - - - - - - - - | ||
| Cid | 3.13 (0.22) a | 67.35 (3.13) a | 53.26 (3.15) a |
| Ramses | 3.01 (0.27) b | 65.61 (3.56) b | 51.51 (3.14) b |
Dónde: FIR = firmeza, DLONG = diámetro longitudinal, DECU = diámetro ecuatorial. Medias con la misma letra en las columnas son iguales estadísticamente (ANOVA), prueba de Tukey (P ≤ 0.05). Los valores entre paréntesis indican la desviación estándar de los datos.
Where: FIR = firmness, DLONG = longitudinal diameter, DECU = equatorial diameter. Means with the same letter in the columns are statistically equal (ANOVA), Tukey's test (P ≤ 0.05). Values in parentheses indicate the standard deviation of the data.
Al respecto Monge-Pérez (2014) reporta diferencias significativas en firmeza en catorce variedades de jitomate de crecimiento indeterminado bajo condiciones de invernadero, encontrando una gran variación, con valores que van desde 20.8 a 47.4 N. A su vez este autor señala que el genotipo es una variable que define en gran medida la firmeza de frutos. Por otro lado, Urrieta-Velázquez et al. (2012) al evaluar tres variedades de jitomate costilla encontraron efecto altamente significativo en diámetro longitudinal, diámetro ecuatorial y firmeza atribuida a las diferencias genéticas intrínsecas de cada variedad.
Factor: interacción solución nutritiva por hibrido
La interacción PSOLN*HIB presentó efecto altamente significativo para SST (P < 0.0059) y número de frutos (P < 0.0042). Los SST en general muestran que existe una correlación positiva entre esta variable y la concentración de solución nutritiva en ambas variedades, es decir, a medida que se incrementa la nutrición del cultivo se incrementa la concentración de solutos (Cuadro 5). En relación al NFRU, la concentración de 75% de solución nutritiva mostró los mayores valores en ambas variedades. Sin embargo, estos valores no son diferentes estadísticamente a los mostrados con las concentraciones de 100 y 50%. Urrieta-Velázquez et al. (2012), encontró diferencias significativas entre variedades y concentración de la solución nutritiva, y señala que las diferencias entre variedades se deben principalmente al número de frutos por racimo.
Cuadro 5: Efecto de la interacción concentración de solución nutritiva e hibrido sobre SST y número de frutos en el cultivo de jitomate.
Table 5: Effect of nutrient solution concentration and hybrid interaction on SST and number of fruits in tomato.
| PSOLN | Hibrido | SST | NFRU | ||
| 100 | Ramses | 4.515 (0.48) a | 39.8 (5.96) a | ||
| 75 | Cid | 4.355 (0.40) ab | 42.0 (7.18) a | ||
| 100 | Cid | 4.325 (0.21) ab | 41.7 (6.32) a | ||
| 75 | Ramses | 4.315 (0.39) ab | 40.7 (4.09) a | ||
| 50 | Cid | 4.215 (0.21) bc | 39.4 (5.92) ab | ||
| 50 | Ramses | 3.98 (0.26) cd | 39.95 (5.74) a | ||
| 25 | Ramses | 3.79 (0.26) d | 34.05 (4.22) b | ||
| 25 | Cid | 3.765 (0.21) d | 27.6 (7.71) c | ||
Dónde: PSOLN = porcentaje de solución nutritiva, SST = solidos solubles totales, NFRU= número de frutos promedio por planta. Medias con la misma letra en las columnas son iguales estadísticamente (ANOVA), prueba de Tukey (P ≤ 0.05). Los valores entre paréntesis indican la desviación estándar de los datos.
Where: PSOLN = percentage of nutrient solution, TSS = total soluble solids, NFRU = average number of fruits per plant. Means with the same letter in the columns are statistically equal (ANOVA), Tukey's test (P ≤ 0.05). Values in parentheses indicate the standard deviation of the data.
Factor: interacción inoculación por hibrido
La interacción INOC*HIB solo presentó efecto altamente significativo para la variable SST (P < 0.0001). En el Cuadro 6 se puede observar que el tratamiento de inoculación con Azo e hibrido Ramses presentó los valores más elevados de SST, siguiéndole el tratamiento con AzHMA y Cid, no presentándose diferencias estadísticas significativas entre estos tratamientos. De acuerdo a Castro, Herschkovitz, Okon y Jurkevitch (2007), hay una respuesta diferencial de las variedades a la inoculación. Por otro lado, Feldmann (2008), señala que hay una gran variabilidad de la respuesta entre variedades de tomate a la inoculación con HMA, por lo que sugiere que se realicen estudios a largo plazo sobre la respuesta de variedades de jitomate a la inoculación.
Table 6: Effect of inoculation and hybrid interaction on SST in tomato.
| Tratamiento | Hibrido | SST |
| Azo | Ramses | 4.5 (0.48) a |
| AzHMA | Cid | 4.275 (0.40) ab |
| Azo | Cid | 4.19 (0.27) bc |
| T | Cid | 4.15 (0.37) bc |
| HMA | Ramses | 4.045 (0.37) bc |
| HMA | Cid | 4.045 (0.35) bc |
| AzHMA | Ramses | 4.04 (0.32) bc |
| T | Ramses | 4.015 (0.46) c |
Dónde: Azo = Azospirillum; HMA = hongo micorrizícos arbusculares; AzHMA = coinoculación Azospirillum-HMA, T = testigo, SST = solidos solubles totales. Medias con la misma letra en las columnas son iguales estadísticamente (ANOVA), prueba de Tukey (P ≤ 0.05). Los valores entre paréntesis indican la desviación estándar de los datos.
Where: Azo = Azospirillum; AMF = arbuscular mycorrhizal fungus; AzAMF = Azospirillum-AMF coinoculation, T = control, TSS = total soluble solids. Means with the same letter in the columns are statistically equal (ANOVA), Tukey's test (P ≤ 0.05). Values in parentheses indicate the standard deviation of the data.
Factor: interacción solución nutritiva, inoculación e hibrido
La interacción PSOLN*INOC*HIB presentó efecto altamente significativo para firmeza (P < 0.0020), y significativo para SST (0.0176 y DECU (P < 0.0181). En el Cuadro 7 se puede observar que solo en dos tratamientos (50-AzHMA y 100 AZ) el hibrido Ramses supera en firmeza a Cid, mientras que para SST Ramses supera a cid en 43.75% de los tratamientos, mientras que en DECU en el tratamiento con 25% de solución nutritiva Cid es superada por Ramses. En ninguno de los casos se presenta una tendencia clara en la respuesta del hibrido a la concentración de la solución nutritiva e inoculante.
Cuadro 7: Efecto de la interacción; porcentaje de solución nutritiva, inoculación e hibrido sobre la firmeza, solidos solubles totales y diámetro ecuatorial de frutos de jitomate.
Table 7: Effect of the interaction; percentage of nutrient solution, inoculation and hybrid on firmness, total soluble solids and equatorial diameter of tomato fruits.
| PSOLN | Tratamiento | HIB | FIR | SST | DECU |
| kg m-2 | °Brix | mm | |||
| 25 | Azo | Cid | 3.2 (0.10) abc | 3.9 (0.11) defghij | 52.18 (1.23) abcd |
| Ramses | 2.56 (0.06) g | 4.06 (0.13) bcdefg | 49.658 (1.77) bcd | ||
| AzHMA | Cid | 2.78 (0.02) defg | 3.86 (0.09) defghij | 52.296 (0.36) abcd | |
| Ramses | 2.72 (0.10) egf | 3.78 (0.09) fghij | 48.977 (0.92) dc| | ||
| HMA | Cid | 3.06 (0.07) abcdef | 3.6 (0.08) ij | 49.818 (1.60) bcd | |
| Ramses | 3.02 (0.19) abcdef | 3.74 (0.10) ghij | 51.029 (0.92) bcd | ||
| T | Cid | 2.78 (0.07) defg | 3.7 (0.10) hij | 50.92 (1.52) bcd | |
| Ramses | 2.68 (0.04) gf | 3.58 (0.09) j | 48.261 (1.60) dc | ||
| 50 | Azo | Cid | 3.2 (0.09) abc | 4.36 (0.08) abcdfg | 55.951 (1.08) ab |
| Ramses | 2.98 (0.07) abcdef | 4.24 (0.09) bcdefghi | 52.92 (1.63) abcd | ||
| AzHMA | Cid | 3.14 (0.07) abcd| | 4.06 (0.12) bcdefghij | 55.256 (0.86) abcd | |
| Ramses | 3.24 (0.13) abc | 4.04 (0.06) cdefghij | 51.125 (1.60) bcd | ||
| HMA | Cid | 3.24 (0.14) abc | 4.26 (0.12) bcdefghi | 51.863 (1.93) abcd | |
| Ramses | 2.92 (0.08) bcdefg | 3.84 (0.12) efghij | 52.408 (0.70) abcd | ||
| T | Cid | 3.02 (0.08) abcdef | 4.18 (0.04) bcdefghij | 52.147 (1.36) abcd | |
| Ramses | 2.84 (0.08) cdefg | 3.8 (0.12) efghij | 50.6 (0.82) bcd | ||
| 75 | Azo | Cid | 3.24 (0.07) abc | 4.28 (0.15) bcdefgh | 54.045 (1.43) abcd |
| Ramses | 3.18 (0.05) abcd | 4.7 (0.21) ab | 50.704 (1.42) bcd | ||
| AzHMA | Cid | 3.18 (0.14) abcd | 4.68 (0.16) abc | 51.654 (0.77) abcd | |
| Ramses | 3.14 (0.12) abcd | 4.14 (0.15) bcdefghij | 54.446 (1.39) abcd | ||
| HMA | Cid | 3.12 (0.09) abcde | 4.04 (0.15) cdefghij | 53.614 (1.46) abcd | |
| Ramses | 3.12 (0.07) abcde | 4.16 (0.13) bcdefghij | 51.752 (0.62) abcd | ||
| T | Cid | 3.08 (0.08) abcdef | 4.42 (0.22) abcdef | 52.657 (1.18) abcd | |
| Ramses | 3.04 (0.08) abcdef | 4.26 (0.18) bcdefgh | 49.232 (0.69) cd | ||
| 100 | Azo | Cid | 3.1 (0.04) abcde | 4.22 (0.10) bcdefghij | 55.114 (1.47) abcd |
| Ramses | 3.2 (0.06) abc | 5 (0.18) a | 53.593 (2.37) abcd | ||
| AzHMA | Cid | 3.34 (0.06) a | 4.5 (0.09) abcd | 53.949 (1.99) abcd | |
| Ramses | 3.24 (0.11) abc | 4.2 (0.23) bcdefghi | 52.431 (0.92) abcd | ||
| HMA | Cid | 3.34 (0.09) a | 4.28 (0.11) bcdefgh | 58.084 (1.31) a | |
| Ramses | 3.28 (0.11) a | 4.44 (0.16) abcdef | 53.616 (1.28) abcd | ||
| T | Cid | 3.18 (0.12) abcd | 4.3 (0.09) bcdefgh | 52.655 (0.87) abcd | |
| Ramses | 2.98 (0.07) abcdef | 4.42 (0.23) abcdef | 53.365 (1.24) abcd |
Dónde: PSOLN = porcentaje de solución nutritiva, HIB = hibrido, FIR = firmeza, SST= solidos solubles totales, DECU = diámetro ecuatorial, PSLN*INOC*HIB = interacción porcentaje de solución nutritiva; por inoculación por hibrido, 25 = concentración de solución nutritiva al 25%, 50 = concentración de solución nutritiva al 50%, 75 = concentración de solución nutritiva al 75%, 100 = concentración de solución nutritiva al 100%, Azo = Azospirillum; AzHMA = coinoculación Azospirillum-hongos micorrízicos arbusculares, HMA = hongo micorrízicos arbusculares, T = testigo. Medias con la misma letra en las columnas son iguales estadísticamente (ANOVA), prueba de Tukey (P ≤ 0.05). Los valores entre paréntesis indican la desviación estándar de los datos.
Where: PSOLN= percentage of nutrient solution, HIB = hybrid, FIR = firmness, SST = total soluble solids, DECU = equatorial diameter, PSLN*INOC*HIB = interaction percentage of nutrient solution; by hybrid inoculation, 25 = 25% nutrient solution concentration, 50 = 50% nutrient solution concentration, 75 = 75% nutrient solution concentration, 100 = 100% nutrient solution concentration, Azo = Azospirillum; AzAMF= Azospirillum-arbuscular mycorrhizal fungus coinoculation, AMF = arbuscular mycorrhizal fungus, T = control. Means with the same letter in the columns are statistically equal (ANOVA), Tukey's test (P ≤ 0.05). The values in parentheses indicate the standard deviation of the data.
De manera general los resultados del presente estudio muestran que el factor inoculación al presentarse en interacción ya sea con porcentaje de solución nutritiva o variedad muestra efectos significativos o altamente significativos solo para parámetros de calidad de jitomate.
Conclusiones
Los resultados muestran que la fertilización en jitomate que actualmente se emplea en la región de Huejotzingo y Tecamachalco Puebla se puede reducir en 50% sin que se disminuya el rendimiento y calidad de frutos. La inoculación con Azospirillum y HMA ya sea solas o coinoculadas en los híbridos Cid y Ramses solo afectaron los parámetros de SST, firmeza, DECU.
La interacción porcentaje de solución nutritiva, inoculación y variedad solo presenta efecto significativo en parámetros SST, firmeza, DECU.











 text new page (beta)
text new page (beta)