Introducción
El Perú tiene una gran diversidad de productos agrícolas, con base en una amplia gama de climas y de diferentes características geográficas a lo largo del país, lo cual lleva a obtener productos consumidos no solo a nivel nacional e internacional, uno de éstos es el autóctono maíz morado (Zea mays L.), producto que se consume desde tiempos preincaicos, cuya raza primitiva se denomina “Kculli”, en Cajamarca, Ayacucho, Ancash, Lima y Arequipa, siendo su adaptación en la costa y en valles interandinos de la sierra hasta 3200 m de altitud (Ccaccya et al., 2019).
Dentro del maíz morado también se encuentran los polifenoles, entre estos los flavonoides, los más importantes son las antocianinas, glúcidos de las antocianidinas. La mazorca (olote y grano) está constituida en un 85% por grano y un 15% de olote. Este pigmento denominado antocianinas se encuentra en mayor cantidad en el olote que en el grano (Guillén-Sánchez et al., 2014).
El Perú dispone de seis razas principales del maíz morado (Cuzco, Canteño, Caraz, Arequipeño, Negro de Junín, Huancavelicano), además, cuenta con cinco variedades mejoradas (INIA-615 Negro Canaán, INIA-601, PM-581, PM-582 y UNC-46), del Instituto Nacional de Innovación Agraria (INIA), de la Universidad Nacional Agraria La Molina (UNALM) y de la Universidad Nacional de Cajamarca (UNC).
La antocianina es un pigmento natural muy utilizado en la industria textil, médica y farmacéutica (Somavat et al., 2016), cosmética y en la industria de los alimentos, principalmente en la preparación del postre típico la mazamorra morada y en la bebida típica nacional conocida como “chicha morada” (Pedraza et al., 2017; Somavat et al., 2016). Respecto a esta última industria, se destaca su uso no solo por sus características funcionales sino también por el color que otorga a los alimentos reemplazando a los colorantes sintéticos, cuyas cantidades y tipo de antocianina dependen de la técnica que se utilicen en su extracción.
Es importante señalar, que la antocianina es ampliamente utilizada en las diferentes industrias por su alto poder antioxidante en la salud humana, es decir, pueden inhibir a los radicales libres que dañan a las biomoléculas importantes como lípidos o proteínas oxidadas (Castañeda-Sánchez y Guerrero-Beltrán, 2015). Además, presentan propiedades como anticancerígeno, antitumorales y antiinflamatorio, mejora la circulación sanguínea y promueve la regeneración del tejido conectivo, colágeno, entre otros, siendo estos beneficios atribuidos a la capacidad antioxidante sobre todo a las antocianinas del maíz morado (Guillén-Sánchez et al., 2014; Lao et al., 2017; Lee et al., 2017; Yousuf et al., 2016). El objetivo de la presente revisión fue comprender el mecanismo de acción de las antocianinas en la salud humana, realizándose de la siguiente manera: primero se recopiló información con base principalmente en artículos científicos de los últimos siete años, en las bases de datos más importantes que existen en el mundo como Scopus, Web of Science, Biblioteca Virtual del Concejo Nacional de Ciencia, Tecnología e Innovación Tecnológica (CONCYTEC), PubMed y Google Scholar. Posteriormente, se analizaron y se describieron los resultados con base en dos partes fundamentales, en la primera parte se describen los diferentes métodos utilizados para la extracción y la cuantificación de las antocianinas encontradas en las diferentes razas y variedades mejoradas del maíz morado del Perú, y en la segunda parte, se detallaron los valores obtenidos de su actividad biológica más importante, la antioxidante, y finalmente otras actividades biológicas que presentan y sus análisis en diferentes sistemas biológicos.
Estructura de la antocianina
La antocianina es un pigmento hidrosoluble que se encuentra en las vacuolas de las células vegetales y es la que provoca el color rojo, púrpura a las hojas, flores y frutos (Khoo et al., 2017). Desde el punto de vista químico, la antocianina es una molécula polihidroxilada glicosilada o polimetoxi derivada de 2-fenilbenzopirilio, la cual usualmente contiene un peso molecular entre 400 a 1200 KDa (Bueno et al., 2012).
La antocianina pertenece al grupo de los flavonoides y son glucósidos de las antocianidinas, es decir, están constituidas por una molécula de antocianidina, que es la aglicona, a la que está unida un azúcar a través de un enlace β-glucosídico. La estructura básica contiene un núcleo de flavona que consta de dos anillos aromáticos: un benzopirilio (A) y un grupo fenólico (B), ambos unidos por una unidad de tres carbonos, tal como se muestra en la Figura 1.

Figura 1: Estructura química general de las antocianinas. Fuente: Chatham et al., 2019.
Figure 1: Chemical structure general of anthocyanins. Source: Chatham et al., 2019.
Las diferencias entre las antocianinas varían en el número y posición de los grupos hidroxilos, metoxilo, naturaleza y número de azúcares unidos a la molécula (Aguilera et al., 2011; Castañeda-Sánchez y Guerrero-Beltrán, 2015; Chatham et al., 2019), cuyas principales diferencias ocurren en la posición 3´ y 5´ del anillo B producen 6 antocianidinas descriptos por Chen et al. (2016) en el Cuadro 1, tras su análisis usando cromatografía líquida acoplada a espectrometría de masas (HPLC-DAD-ESI-MS/MS), encontró como fragmento principal a la cianidina‑3‑glucosido con un 45.8%, seguido de la cianidina-3-O-(6‑malonilglucosido) con un 40.1% de abundancia relativa.
Cuadro 1: Composición química de extracto de olote de maíz morado del Perú. Fuente: Chen et al., 2016.
Table 1: Chemical composition of purple corn cob extract from Peru. Source: Chen et al., 2016.
| Compuesto | Fragmento | |||
| Rf | [M]+ | (m/z) | AR | |
| % | ||||
| Cianidina-3-O-glucósido | 17.79 | 449 | 287 | 45.8 |
| Pelarginidina-3-O-glucósido | 19.84 | 433 | 271 | 3.3 |
| Peonidina-3-O-glucósido | 21.41 | 463 | 301 | 4.1 |
| Cianidina-3-O-(6-malonilglucosido) | 22.61 | 535 | 287 | 40.1 |
| Pelargonidina-3-O-(6-malonilglucósido) | 24.46 | 519 | 271 | 1.5 |
| Cianidina-3-O-(3,6-dimalonilglucósido) | 25.83 | 621 | 287 | 1.2 |
Rf = factor de retención; AR (%) = abundancia relativa en %; [M]+ = concentración del ion molecular; m/z = relación masa/carga.
Rf = retention factor; AR (%) = % relative abundance; [M]+ = concentration of the molecular ion; m/z = relationship mass/load.
Factores que determinan el color y la estabilidad de las antocianinas
La estabilidad de la antocianina depende del tipo de pigmento antociánicos, además de otros factores como: pH, luz, temperatura, enzimas, y otras moléculas como el oxígeno y el ácido ascórbico, los cuales tienen gran impacto en la estabilidad de las antocianinas (Turturica et al., 2015). Además, la estabilidad es afectada por el proceso tecnológico, extractivo y almacenamiento del maíz morado, los cuales disminuyen la estabilidad de la antocianina en una solución produciendo modificaciones indeseables en la estructura y color (Khoo et al., 2017).
El pH de la solución afecta el color de la antocianina, esto se debe a que la antocianina posee una naturaleza iónica (Turturica et al., 2015). En soluciones acuosas a valores menores de pH 2, el pigmento se encuentra en su forma más estable o de ion oxonio o catión flavilio (AH+) de color rojo intenso, es por eso que su extracción se hace en medio ácido. Conforme incrementa su pH da lugar a un equilibrio entre la pseudobase carbinol o hemiacetal (B) de color incoloro y la forma chalcona (C) de color amarillo. A un pH mayor a 7, se presenta en forma de quinoidales (A, A-1) de color azul a púrpura que se degradan rápidamente por la oxidación con el aire, tal como se muestra en la Figura 2 (Castañeda-Sánchez y Guerrero-Beltrán, 2015).
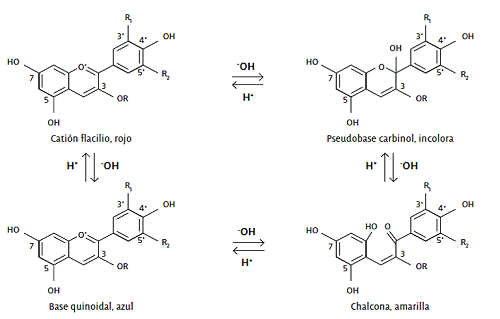
Figura 2: Estructura de las antocianinas a diferentes valores de pH. Fuente: Castañeda-Sánchez y Guerrero-Beltrán, 2015.
Figure 2: Structure of anthocyanins at different pH values. Source: Castañeda-Sánchez and Guerrero-Beltrán, 2015.
La temperatura es un factor que afecta la estabilidad de las antociáninas, y son menos estables con el incremento de la temperatura (Khoo et al., 2017). En el pH de 2 a 4, la degradación térmica de las antocianinas produce la hidrólisis de la molécula del azúcar y por ende la transformación de la antocianina resultante a una chalcona o α-dicetona. Cabe señalar, que la degradación térmica de las antocianinas ocurre a través de la ruptura del enlace glucosídico, dando como resultado la formación de la aglicona o chalconas y estructuras hidroxiladas de menor estabilidad que las metiladas, glicosiladas o acetiladas (Castañeda-Sánchez y Guerrero-Beltrán, 2015).
La luz es otro factor que afecta la estabilidad de las antocianinas, la cual es necesaria para su asimilación, por otro lado, tiene la desventaja de acelerar su degradación. Las antocianinas mantienen por más tiempo su color en la oscuridad. Las sustituciones que tenga la molécula influyen en su fotodegradación, siendo susceptibles, aquellas que en el C-5 sean sustituidas por un grupo hidroxilo, isoflavonas y auronas sulfonadas; sin embargo, la presencia de copigmentos y tecnologías de encapsulación disminuyen la fotodegradación (Castañeda-Sánchez y Guerrero-Beltrán, 2015).
Descripción de las razas y variedades del maíz morado en el Perú
Existen diferentes razas del maíz morado en el Perú, las cuales derivan de la raza ancestral denominada “Kculli”, que aún se cultiva en el Perú. Está línea es muy antigua aproximadamente de hace 4000 años atrás y sus restos arqueológicos con mazorcas típicas se han encontrado en Ica, Paracas, Nazca y otros lugares de la costa central (Quispe y Chura, 2018). En el Perú existen muchas razas y variedades mejoradas del maíz morado, las principales se describen a continuación.
Cuzco
Relacionado a la raza Cuzco gigante, esta tiene la característica de ser tardía, de granos grandes dispuestos en mazorcas con hileras bien definidas. Se cultiva en lugares diferentes de altitud intermedia en los departamentos de Cuzco y Apurímac (Quevedo, 2013).
Canteño
Raza con características similares a la raza Cuzco, aunque con menor tamaño, es más precoz y su cultivo se da en la Sierra del Perú, especialmente en las partes altas del valle del Chillón del Departamento de Lima entre 1800 a 2500 m de altitud (Manrique, 1997).
Caraz
Es una raza derivada de las razas Ancashino y Alazán. Tiene la característica de ser de precocidad intermedia, grano más chico que la raza Cusqueño y puede adaptarse también en la costa. Es una raza que presenta un rendimiento alto y cuyo olote es el más pigmentado (Manrique, 1997).
Arequipeño
Raza cultivada principalmente en el Departamento de Arequipa, cuya forma de mazorcas es similar a la raza Cuzco, pero más chica. El color del olote es menos intenso comparado con las demás razas (Manrique, 1997).
Negro de Junín
Es una raza precoz, cuyos granos son grandes, negros y dispuestos irregularmente en una mazorca corta y redonda. Se encuentra en la sierra del centro y sur en Ayacucho, Apurímac y Arequipa. Sus características morfológicas son parecidas a las de la raza Huancavelicano (Manrique, 1997).
Huancavelicano
Su cultivo de esta raza se da en la parte Sierra, Centro y Sur hasta Arequipa, desarrollándose en niveles altitudinales mucho mayores que las otras razas (Manrique, 1997).
UNC-47
Es una variedad mejorada denominada “Grone”, obtenida por UNC en Cajamarca. Es una variedad que produce después de 190 días de la siembra de color morado intenso, sus mejores épocas de siembra son en los meses de octubre y noviembre (Pedraza et al., 2017).
PM-581
Es una variedad mejorada por UNALM, la cual proviene del maíz Caraz. Se siembra en la costa central y en la sierra media, con una altitud de 1200 a 1400 m, además el tamaño de mazorcas es de 15 a 20 cm (Pinedo et al., 2017).
PM-582
Es otra variedad mejorada por la UNALM, adaptada a la sierra alta. Las plantas son de tamaño intermedio, mazorcas medianas y cuyo contenido de antocianinas y rendimiento son altos (Manrique, 1997).
INIA-615 negro Canaán
Esta variedad mejorada desarrollada por el INIA en la Estación Experimental Agraria (EEA) de Canaán en Ayacucho. Está variedad presenta como progenitores femeninos a las razas locales Negro Kculli y Morado y cuyos progenitores masculinos son una mezcla de las tres razas Negro, Kculli y Morado (Pinedo et al., 2017).
INIA-601
Esta variedad mejorada también fue desarrollada por el INIA en la EEA de Cajabamba en Cajamarca, se formó con 256 progenies, de las cuales 108 corresponden a la raza Caraz y 148 a la raza Negro de Parubamba, cuyo ámbito se da en la sierra norte (Pedraza et al., 2017).
Metodología de extracción de antocianinas en maíz morado del Perú
Las antocianinas son ampliamente extraídas con técnicas convencionales o clásicas como las extracciones sólido-líquido y maceración. Cabe señalar que nuestro enfoque es la extracción de las antocianinas del maíz morado provenientes de los diferentes cultivares nativos del Perú.
La extracción más empleada en el Perú es la de sólido-líquido, la cual usa solventes como el etanol, agua o mezclas de ellos y a veces acidulado en diferentes concentraciones, proporciones, temperaturas y tiempos de agitación constante. Las extracciones de las antocianinas son llevadas a cabo con solventes como etanol, metanol, agua, pudiendo ser acidulada con ácido cítrico al 1% o HCl 0.1 M. Se suele elegir al etanol por su toxicidad baja y por el uso en ensayos alimenticios o clínicos. Si la concentración del ácido es elevada puede causar la hidrolisis de los grupos acilo, especialmente en presencia de ácidos dicarboxílicos como en el ácido malónico, por lo que se sugiere utilizar ácidos débiles a bajas concentraciones.
El proceso de maceración consiste en la inmersión del material en un solvente, dentro de un recipiente durante 4 a 15 días, a temperatura ambiente dependiendo de la metodología usada (Azmir et al., 2013; Cristianini y Guillén, 2020). El material debe ser molido hasta llegar a partículas de tamaño pequeño, usualmente en el orden de los μm, con la finalidad de romper la pared celular del material y por ende sea fácil la liberación del compuesto bioactivo, obteniendo una mayor área de superficie de contacto, disminuyendo el tiempo de análisis, así como las probabilidades de oxidación del compuesto bioactivo (Cristianini y Guillén, 2020).
Cabe señalar, que través de los años se siguen utilizando estás técnicas, ya que tienen la ventaja del bajo costo en los materiales y reactivos, lo cual lo hace accesible a la gran cantidad de laboratorios de análisis químico, además los métodos no son tan complejos. Está sección, es importante ya que se da a conocer los diferentes métodos para su obtención y cuantificación de las antocianinas en el olote del maíz morado del Perú (Cuadros 2 y 3).
Table 2: Methods of extraction, quantification of anthocyanin and antioxidant activity.
| Distrito | Departamento | Razas de maíz | Método de extracción | Fenoles | Antocianina en el olote | Cianidina-3-glucósido | DPPH | Literatura citada |
| - - - - - - - mg g-1 - - - - - - - | % | |||||||
| Cañete | Lima | 1:100 (g ml-1 de etanol al 20%), pH 2, 30 min a 70 °C | 94.1 | 42.6 | 18.5 | Ccaccyaet al.(2019) | ||
| San Marcos | Cajamarca | ni | 75.4 | 34.1 | 10.3 | - | ||
| Abancay | Apurímac | 67.9 | 24.4 | 9.5 | ||||
| Lima | Lima | Muestra comercial | Macerar con 7 L de etanol al 60% kg-1 de muestra, 48 h | - | - | 15.4 | - | Pedreschi y Cisneros-Zevallos (2006) |
| Lima | Lima | ni | Macerar con 7:3 (etanol:agua), 4 días | 33.2 | - | - | 28.9 | Doroteoet al.(2013) |
| Joya | Arequipa | TC | 1:200 (g ml-1 de etanol a pH 2),60 min a 90 °C | 33.4 | 13.4 | - | 93.8 | Quispeet al.(2011) |
| PM-581 | 40.6 | 20.6 | 93.7 | |||||
| TJ | 36.2 | 14.8 | 92.9 | |||||
ni = no identificado. Fuente: Elaborada por el autor.
ni = not identified. Source: Prepared by the author.
Table 3: Methods of extraction and quantification of anthocyanin on the cob.
| Distrito Joya del Departamento de Arequipa | |||
| Raza de maíz | Método de extracción | Antocianina en el olote | Literatura citada |
| mg g-1 | |||
| TJ (Testigo Joya) | 2.5:200 (g mL-1 de agua a pH 2), 4 h a 60 °C | 30 | Gorritiet al.(2009) |
| 2.5:200 (g mL-1 de etanol 20% a pH 2), 4 h a 60 °C | 34.7 | ||
| 2.5:200 (g mL-1 de etanol 60% a pH 2), 4 h a 60 °C | 29.5 | ||
| 2.5:200 (g mL-1 de agua a pH 2), 4 h a 75 °C | 33 | ||
| 2.5:200 (g mL-1 de etanol 20% a pH 2), 4 h a 75 °C | 37.1 | ||
| 2.5:200 (g mL-1 de etanol 60% a pH 2), 4 h a 75 °C | 32.2 | ||
| 2.5:200 (g mL-1 de agua a pH 2), 4 h a 90 °C | 33.5 | ||
| 2.5:200 (g mL-1 de etanol 20% a pH 2), 4 h a 90 °C | 34 | ||
| 2.5:200 (g mL-1 de etanol 60% a pH 2), 4 h a 90 °C | 35.2 | ||
| 2.5:200 (g mL-1 de agua a pH 4), 4 h a 60 °C | 28.3 | ||
| 2.5:200 (g mL-1 de etanol 20% a pH 4), 4 h a 60 °C | 31.6 | ||
| 2.5:200 (g mL-1 de etanol 60% a pH 4), 4 h a 60 °C | 28.3 | ||
| 2.5:200 (g mL-1 de agua a pH 4), 4 h a 75 °C | 31.8 | ||
| 2.5:200 (g mL-1 de etanol 20% a pH 4), 4 h a 75 °C | 31 | ||
| 2.5: 200 (g mL-1 de etanol 60% a pH 4), 4 h a 75 °C | 30.9 | ||
| 2.5:200 (g mL-1 de agua a pH 4), 4 h a 90 °C | 23.4 | ||
| 2.5:200 (g mL-1 de etanol 20% a pH 4), 4 h a 90 °C | 48 | ||
| 2.5:200 (g mL-1 de etanol 60% a pH 4), 4 h a 90 °C | 46.5 | ||
Fuente: Elaborada por el autor.
Source: Prepared by the author.
Por otro lado, las tecnologías emergentes o las tecnologías no convencionales, han tenido un apogeo en el siglo XX, debido a que tiene como características preservar mejor el material sin dañar el aporte nutricional ni tampoco sus características organolépticas (Barba et al., 2015), además es automatizado; sin embargo, la desventaja principal de la tecnología es su elevado costo de producción y mantenimiento, lo cual hace en muchos casos que sea difícil su acceso (Cristianini y Guillén, 2020; Cuesta-Parra y Correa, 2018).
En el Cuadro 4 se muestran las investigaciones realizadas sobre las tecnologías emergentes más utilizadas como el ultrasonido, microondas, alta presión isostática y fluidos supercríticos, usándose a una escala piloto sobre el maíz morado a nivel mundial. Es preciso destacar, que hay muy pocos artículos que reportan el uso de estas tecnologías en Perú.
Cuadro 4: Comparación de la cantidad de cianidina-3-glucosido (C3G) en las diferentes técnicas no convencionales usadas en el proceso extractivo.
Table 4: Comparison of the amount of cyanidine-3-glucoside (C3G) in the different no-conventional techniques used in the extraction process.
| Técnica | Razas de maíz | Parámetros | C3G | Literatura citada |
| μg g-1 | ||||
| Ultrasonido | Ceratina | 1:20 (g mL-1 de etanol al 50%), 20 KHz, 30 min a 60 °C | 219.3 | Muangratet al.(2017) |
| Calentamiento Óhmico | LPSC901 | 1:20 (g mL-1 de agua), 5 min a 25 °C, 50 Hz, 100 V,4 cm | 3.1 | Piyapanrungrueanget al.(2016) |
| Microondas | ni | 1:20 (g/1.5 M HCl 95% y etanol 15:85 v/v), 10 min a25 °C, 400 W | 1.4 | Yang y Zhai (2010) |
| Fluido supercrítico | ni | Proporción solido: líquido no especificado. Fluido supercrítico de CO2 (1.7 g min-1, 90-100 min, 400 bars), después etanol (0.4 g min-1, 150-200 min) y agua(0.5 g min-1, 390-480 min) | 54.6 | Monroyet al.(2016) |
| Alta presión isostática | ni | 1:7,5 (g mL-1 de buffer fosfato a pH 3), 15 min a 25 °C, 200 Mpa | 1.4 | Itthisoponkulet al.(2018) |
ni = no identificado. Fuente: Elaborada por el autor.
ni = not identified. Source: Prepared by the author.
Actividad antioxidante de la antocianina en el maíz morado
La capacidad antioxidante se refiere a la habilidad que tiene la molécula de captar el electrón desapareado del orbital externo de los radicales libres, disminuyendo el estrés oxidativo, es decir, disminuyendo la cantidad de especies oxidantes como las especies reactivas de oxígeno (EROs) y las especies reactivas del nitrógeno (RNS). Las EROs son típicamente producidas en el citosol, mitocondrias, peroxisomas, retículo endoplasmático, membrana plasmática y lisosomas; mientras que el RNS es producido en el metabolismo de los aminoácidos (Meo et al., 2016). La producción de EROs y otros radicales libres es un proceso normal del metabolismo celular; sin embargo, la exposición a contaminantes ambientales, humo del tabaco y rayos X pueden generar un exceso de estos (Sánchez-Valle y Méndez-Sánchez, 2013).
Cabe señalar, que el incremento de las sustancias reactivas permite la oxidación de biomoléculas importantes en el organismo como las proteínas, lípidos, carbohidratos y ácido desoxirribonucleico (ADN), generando la oxidación degenerativa de un tejido vivo y da lugar a diferentes patologías como las enfermedades cardiovasculares, neurodegenerativas, mal del Parkinson, cáncer, tumores, entre otros (Sánchez-Valle y Méndez-Sánchez, 2013).
Actividad antioxidante in-vitro
Los extractos del maíz morado muestran resultados positivos tras ser evaluados mediante los diferentes ensayos químicos in-vitro, tales como DPPH (2,2-difenil-1-picrilhidrazilo), ABTS (Ácido 2,2´-azino-bis-(3-etilbenzotiazolin-6-sulfonico), APPH (2,2´-azo-bis-(2-amidinopropano), dihidrocloruro), ORAC (Oxigen radical absorbance capacity), FRAP (Ferric ion reducing antioxidan power), TEAC (Trolox equivalent antioxidant capacity), entre otros (Duangkhamchan y Siriamornpun, 2015; Ramos-Escudero et al., 2012b; Vayupharp y Laksanalamai, 2015).
El método más utilizado a través de los años es el DPPH, y su actividad de las antocianinas del maíz morado está directamente relacionada con la cantidad de compuestos bioactivos, es decir polifenoles, flavonoides, antocianinas, los cuales tienen un efecto en la metodología de extracción, raza o variedad mejorada y lugar de siembra de la parte agronómica (Khampas et al., 2015; Lao et al., 2017). Se ha encontrado que la actividad antioxidante de los extractos del maíz morado es superior a otras plantas como lo menciona Doroteo et al. (2013) quienes muestran que la actividad antioxidante de las antocianinas del maíz morado fue de 28.9 μg mL-1 expresado como una concentración media efectiva (EC50); mientras que para los extractos de las plantas ratania y uña de gato fue de 10.5 y 12.1 μg mL-1, respectivamente.
Existen varios reportes sobre la actividad antioxidante de maíz morado usado en los diferentes cultivares del Perú por la técnica DPPH, mostrados en el Cuadro 2. Por otro lado, se han realizado análisis con otras técnicas como TEAC, radical superóxido e hidroxilo de un extracto del maíz morado con la técnica de maceración usando una mezcla de etanol y agua en una relación 7:3 durante 4 días a temperatura ambiente, encontrando que la concentración efectiva media (EC50) de la actividad antioxidante fue de 0.18, ˃200 y 35 μg mL-1, respectivamente (Doroteo et al., 2013).
Actividad antioxidante en un sistema ex-vivo e in‑vivo
El efecto de los extractos del maíz morado se ha estudiado en un sistema celular como antioxidante en órganos de ratones con un tratamiento de H2O2 a un riñón, hígado o cerebro (Lao et al., 2017; Ramos-Escudero et al., 2012b). La presencia del compuesto malondialdehido (MDA) sirve como un indicador de una lesión oxidativa celular de la membrana celular después de aplicar el H2O2. Cuando los órganos mostraron niveles bajos de MDA y fueron tratados con extractos del maíz morado, los niveles de las enzimas antioxidantes superóxido dismutasa (SOD), catalasa y el peróxido total en el organismo incrementaron (Lao et al., 2017; Ramos-Escudero et al., 2012b). Estás enzimas tienen la capacidad de inhibir a las especies reactivas y prevenir el daño en la oxidación en las células. También en el estudio de Ramos-Escudero et al. (2012a) mencionan que hay compuestos funcionales del maíz morado que estimulan la secreción de enzimas antioxidantes que reducen el daño oxidativo causado por los radicales libres.
Zhang et al. (2014), mostraron que extractos del maíz morado tienen un efecto en el daño oxidativo en el hígado y riñón de ratas. En este trabajo, primero se les indujo un stress oxidativo con fluoruro, produciendo células inflamadas, MDA altos en el suero y tejidos hepáticos. Los niveles de las enzimas antioxidantes SOD y glutatión peroxidasa, usando los extractos del maíz morado, fueron significativamente más altas que del grupo en donde solo se utilizó fluoruro. Este resultado sugiere que los extractos del maíz morado dados en la dieta de las ratas pueden disminuir los daños oxidativos inducidos por el fluoruro, incrementando la capacidad antioxidante en el hígado y riñón de las ratas.
Actividades biológicas de las antocianinas del maíz morado
En la sección anterior, se ha descripto a las antocianinas provenientes del maíz morado como un poderoso antioxidante, pero también tiene una amplia actividad biológica como por ejemplo, tienen un efecto benéfico en la obesidad, reconociendo a los receptores que provocan la sobre nutrición, pudiendo activar los factores de transcripción como NF-κB, IRF-3 y AP-1 para la translocación en el núcleo y enlazarse a la región a promover los genes target (Lee et al., 2017), tal como se muestra en la Figura 3.
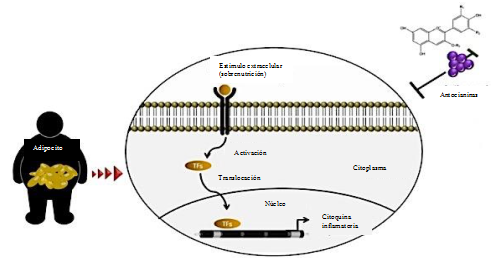
Figura 3: Efecto benéfico de las antocianinas en la obesidad. Fuente: Adaptado de Lee et al., 2017.
Figure 3: Beneficial effect of anthocyanins on obesity. Source: Adapted of Lee et al., 2017.
Las antocianinas han sido muy estudiadas por sus propiedades anticancerígenas, así como por sus propiedades angiogénesis. La angiogénesis es un proceso importante para el desarrollo del cáncer, ya que se puede dar la transición de un tumor de un estado benigno a uno maligno. Para prevenir el cáncer, la angiogénesis es un proceso que impide la formación de nuevos vasos sanguíneos que inhiben la presencia del oxígeno en las células tumorales (Khoo et al., 2017). Kang et al. (2013), han encontrado que extractos ricos en antocianinas del maíz morado tienen un efecto angiogénesis disminuyendo la expresión del tejido endotelial de un factor de crecimiento vascular endotelial (VEGF) en un sistema ex-vivo, el cual es uno de los más potentes agentes activantes.
Se ha encontrado que los extractos de las antocianinas también tienen propiedades anticancerígenas contra el esófago, colón, pulmón, próstata, piel (Khoo et al., 2017; Lao et al., 2017) y antimutágeno (Lao et al., 2017). Por ejemplo, en un extracto de las antocianinas del maíz morado como antimutágeno obtuvo un IC50 de 95.2 μg de ácido clorogénico plato-1 y que su efecto principal fue en el mecanismo de bloqueo S-9 (Pedreschi y Cisneros-Zevallos, 2006).
Los autores Long et al. (2013) han evaluado las propiedades anticancerígenas del cáncer de mama y próstata en un nivel in-vitro e in-vivo. Las ratas para el adenocarcinoma de la glándula prostática, tras consumir los extractos antociánicos, presentaron niveles bajos del adenocarcinoma y porcentajes altos de neoplasia intraepitelial en grado bajo
Se ha mostrado que las antocianinas también tienen otras características benéficas para la salud, por ejemplo, ayudan en la visión disminuyendo la opacidad del lente junto con niveles más bajos de malonaldehído y en el sistema cardiovascular se realizaron análisis con pollos que consumieron el maíz morado, los cuales mostraron significativamente menores pesos del corazón y grasas abdominales comparados con los pollos que comieron maíz amarillo (Amnueysit et al., 2010).
Conclusiones
La cantidad y tipo de antocianinas que provienen de los diversos cultivares de maíz morado en el Perú dependen del método de extracción que involucran factores como el solvente, la temperatura, el pH, el tiempo de agitación, la concentración del solvente y la relación masa-solvente usadas tanto en tecnologías clásicas como en emergentes. Se prefiere la tecnología clásica por el bajo costo de producción y mantenimiento, siendo las condiciones óptimas para el proceso de extracción de 1 g de muestra con 15 mL de agua en agitación constante durante 15 min a 90 ºC. Cabe señalar, que se podrían utilizar técnicas emergentes, conservando su aporte nutricional y sus características organolépticas, como ultrasonido, microondas, alta presión isostática y fluidos supercríticos.
- También se han descrito numerosos estudios de las antocianinas en un sistema in-vitro y en cultivos celulares en diferentes actividades biológicas, pudiendo prevenir diversas enfermedades incluyendo el cáncer al esófago, colón, pulmón, próstata, piel, tumor, diabetes, obesidad e inflamaciones. Estos compuestos mejoran la visión, el sistema cardiovascular, así como también tienen propiedades angiogénesis, entre otras, atribuidas a su alto poder antioxidante de las antocianinas del maíz morado.











 text new page (beta)
text new page (beta)



