Introducción
Existen diferentes tratamientos culturales aplicados durante el desarrollo de la planta, los cuales se busca que sean más naturales y biocompatibles debido a los riesgos ambientales y efectos adversos en el suelo, contexto en el que resalta la importancia de la agricultura orgánica, sustentable o sostenible, cuya tendencia continuará en los próximos años (Prasad et al., 2019). Dentro de los tratamientos incluidos en el esquema de la agricultura orgánica, sobresalen el estudio y la aplicación de bioestimulantes, incluyendo las rizobacterias promotoras del crecimiento en plantas, conocidas como PGPR por sus siglas en inglés, cuya finalidad es disminuir la aplicación de agroquímicos en los cultivos, además de ayudar a proporcionar nutrientes requeridos por las plantas (Sahu et al., 2018). Un bioestimulante consiste en diferentes compuestos o microorganismos que mejoran la eficiencia nutricional por parte de la planta a la que se le aplica, sin ser necesariamente un nutriente (du Jardin, 2015).
El género Azotobacter corresponde a bacterias del suelo con diferentes efectos positivos en las plantas, incluyendo: estimulación del crecimiento mediante la síntesis de fitorreguladores (auxinas, citoquininas y ácido giberélico) y la movilización de nutrientes en los suelos, la síntesis de compuestos fenólicos y mecanismos de defensa, control o inhibición de organismos fitopatogénicos, fijación de nitrógeno y solubilización de minerales del suelo. Asimismo, ayudan en la biorremediación y la degradación de compuestos xenobióticos de los suelos (Mrkovacki y Milic, 2001; Wani et al., 2013; Prasad et al., 2019). Además, dichos microorganismos producen polisacáridos extracelulares, favoreciendo el intercambio de gases y la capacidad hídrica de los suelos (De-Bashan et al., 2007). Es por ello que, desde su aislamiento hace más de 100 años, la aplicación y el estudio de los beneficios y efectos de Azotobacter chroococcum sigue siendo de sumo interés (Mrkovacki y Milic, 2001).
Otros compuestos con potencial aplicación dentro de la agricultura orgánica son las oligosacarinas, incluyendo derivados del quitosano (Pandey et al., 2018), cuya ventaja principal consiste en que no contaminan el ambiente (Larskaya y Gorshkova, 2015). Por lo anterior, es esperable que su uso aumente durante los próximos años, en virtud de que son una alternativa para eliminar el uso de agroquímicos (Cabrera et al., 2013; Pandey et al., 2018). Las oligosacarinas son compuestos naturales que forman parte de las paredes celulares de plantas y microorganismos como los hongos (Falcón-Rodríguez et al., 2015). Las aplicaciones actuales de las oligosacarinas en la agricultura incluyen la geminación, el crecimiento y el incremento de rendimiento de los cultivos, la acción antimicrobiana directa, la liberación lenta de fertilizantes, la mejora de la retención de agua del suelo; asimismo, promueven la actividad de defensa en las plantas ante la presencia de patógenos (Falcón-Rodríguez et al., 2015; Pandey et al., 2018). En Cuba, destacan algunos productos comerciales a base de oligosacarinas derivadas de pectina (Pectimorf®, 58-61% de ácido galacturónico) o derivadas del quitosano (Quitomax®), los cuales inducen efectos positivos en el desarrollo y rendimiento de diferentes cultivos (Falcón-Rodríguez et al., 2015).
Un número importante de estudios realizados en la agricultura orgánica se han centrado en el efecto que tienen en la planta y en el rendimiento de los cultivos (García-Sahagún et al., 2009). Sin embargo, la calidad de los productos poscosecha es de suma trascendencia, toda vez que es la cualidad que permite acceder a una mayor aceptación por parte del consumidor y generar menores pérdidas poscosecha. Es por ello que en años recientes se investigan de manera más intensa los efectos benéf icos para el fruto, su calidad y vida poscosecha (Hassan y Emam, 2015; Alarcón-Zayas et al., 2018a,b; Reyes-Pérez et al., 2018a,b). En este contexto, en estudios previos, el uso de reguladores de crecimiento y bioestimulantes incrementaron el rendimiento y mejoraron la calidad poscosecha de una variedad de productos (Ahmad et al., 2018), incluyendo las calabacitas (Cucurbita pepo) (Sarhan et al., 2011). Dicho cultivo es importante para México, toda vez que es uno de los diez principales países productores a nivel mundial (SIAP, 2017). Aun cuando los frutos de calabacita se cosechan y consumen sin madurar completamente, presentan un aporte significativo de nutrimentos (Sedano-Castro et al., 2011).
Por lo antes expuesto, el objetivo de la presente investigación fue evaluar tratamientos naturales aplicados durante el desarrollo de la planta y desde la semilla, los cuales consistieron en la aplicación de bacterias promotoras del crecimiento y oligosacarinas, para determinar su efecto en parámetros físicos, bioquímicos y de calidad de frutos de calabacita después de su cosecha.
Materiales y métodos
Material vegetal
Se desarrollaron plantas de calabacita (Cucurbita pepo L.) var. 'Grey Zucchini' a partir de semillas (Seminis®) con siembra directa en sistema de triángulo (tresbolillo), bajo condiciones de campo abierto y con acolchado plástico, en las instalaciones del campo experimental del Centro de Investigación en Química Aplicada (CIQA). La nutrición y riego se aplicaron mediante fertirrigación (160-64-360 NPK) con cinta de goteo (doble) con goteros cada 20 cm y con un gasto de 1.36 L h-1 a 10 psi.
Materiales y reactivos
La cepa de la bacteria Azotobacter chroococcum fue donada por el Laboratorio de Investigaciones y Diagnósticos Agropecuarios S.A. de C.V. (LIDAG S.A. de C.V.) de Monterrey, Nuevo León. Las oligosacarinas (Pectimorf® y Quitomax®) fueron donadas por el Instituto Nacional de Ciencias Agrícolas (INCA) de La Habana, Cuba (https://www.ecured.cu/Pectimorf y https://www.ecured.cu/Quitomax).
Los reactivos de grado analítico utilizados en este trabajo fueron adquiridos en la empresa Sigma-Aldrich (St. Louis MO, EUA).
Tratamientos
Se aplicaron los siguientes tratamientos: (1) control (sin bioestimulantes), (2) Azotobacter chroococcum (A. chroococcum) 1 × 107 unidades formadoras de colonias (UFC), (3) A. chroococcum + Pectimorf® 5 mg L-1, (4) A. chroococcum + Pectimorf® 10 mg L-1, (5) A. chroococcum + Pectimorf® 20 mg L-1, (6) A. chroococcum + Quitomax® 5 mg L-1, (7) A. chroococcum + Quitomax® 10 mg L-1 y (8) A. chroococcum + Quitomax® 20 mg L-1; dichas concentraciones se fundamentaron en las recomendaciones de productores y estudios preliminares (https://www.ecured.cu/Pectimorf y https://www.ecured.cu/Quitomax).
Se efectuaron tres aplicaciones de A. chroococcum, una directamente en la semilla (1 × 105 UFC) y dos aplicaciones alrededor del pie del tallo (1 × 107 UFC) a los 15 y 30 días después de la siembra (DDS), empleando un volumen de 30 mL por planta. Las oligosacarinas se aplicaron vía foliar por aspersión a los 28, 35, 42 y 49 DDS. Cada tratamiento contó con un total de 48 plantas donde cada unidad experimental consistió en parcelas de 4 m de largo con 16 plantas separadas cada 40 cm, dividido en bloques al azar por triplicado y contemplando bordos. Los frutos fueron cosechados en madurez de consumo (considerado verde) y divididos aleatoriamente en lotes, respetando la asignación de tratamientos.
Análisis en los frutos poscosecha
De cada tratamiento se seleccionaron frutos al azar considerando una unidad experimental por fruto, para un total de nueve repeticiones o frutos (n = 9) por tratamiento para la realización de los análisis en laboratorio.
Parámetros físicos
Color. Dicha prueba se realizó en el epicarpio o cáscara de cada una de las calabacitas (n = 9), tomando tres lecturas del mismo fruto en diferentes zonas del fruto al azar, empleando un colorímetro manual (Hunterlab miniscan, MSEZ-4500L, Hunter Associates Laboratory Inc., Reston, VA, EUA) con escala CIELab (L, a* y b*). Esta última fue empleada para la obtención de los valores de croma (C) y ángulo hue (°h) (McGuire, 1992).
Diámetro polar, ecuatorial y peso del fruto. Se evaluó la longitud y ancho de los frutos con un vernier (Stainless Hardened, 6 pulgadas, China). Además, fue considerado el peso de los frutos en g (balanza digital, BIOBASE, JF3204AT, Alemania).
Biomasa seca y porcentaje de humedad. En frutos independientes se registró el peso en fresco y se cortaron en cuatro partes para favorecer la deshidratación. Cada fruto se colocó dentro de bolsas de papel (previamente rotuladas) a una temperatura de 80 °C durante 72 h o hasta obtener un peso constante (Cardarelli et al., 2010). El tejido resultante se pesó (balanza digital Biobase, JF3204AT, Alemania) y los datos obtenidos fueron empleados para calcular el porcentaje de biomasa seca y humedad.
Firmeza. Se empleó un texturómetro (Texture Analyzer TA.XT Express, Stable Micro System Ltd., EUA) para perforar tres puntos equidistantes en la zona ecuatorial de los frutos (n = 9) a una velocidad de 4 mm s-1, a una distancia de 5 mm con una sonda de 2 mm de diámetro. Los resultados fueron expresados como la fuerza de compresión en Newtons (N) (Cortez-Vega et al., 2014).
Parámetros químicos, enzimáticos y antioxidantes
Potencial de hidrógeno (pH). El pH se obtuvo mediante un potenciómetro (Thermo Scientif ic, Orion Star A211, Waltham, MA, EUA) (Cardarelli et al., 2010).
Sólidos solubles totales (SST). Los SST se determinaron con un refractómetro manual (ERMA 0-32%) de acuerdo con los métodos de análisis oficiales internacionales (AOAC, 1990), empleando una gota de extracto de la pulpa; los resultados se expresaron como °Brix.
Acidez titulable (AT). Se maceraron 10 g de pulpa de cada una de las calabacitas empleadas (n = 9), se diluyeron en 50 mL de agua destilada y éste se tituló con NaOH 0.1 N (Sigma-Aldrich) mediante un titulador automático (Mettler Toledo, modelo DGi111-SC, International, Inc., Ohio, EUA) hasta que se alcanzó un pH de 8.2. La acidez fue reportada como mg de ácido cítrico 100 g-1 de peso fresco, basado en la norma NMX-FF-010-1982.
Vitamina C. Se pesaron 10 g de tejido de cada una de las calabacitas (n = 9), se maceraron, filtraron y aforaron a 50 mL con agua destilada de acuerdo con el método AOAC 967.21 (Horwitz, 2000). La muestra se tituló con el reactivo de Thielmann hasta la aparición de una coloración rosa, con un titulador automático (Mettler Toledo, modelo DGi111-SC, International, Inc., Ohio, EUA). Los resultados fueron expresados como mg de ácido ascórbico 100 g-1 de peso fresco.
Proteínas totales. El contenido de proteínas totales se determinó por el método de Bradford (1976) modificado para microplaca. La mezcla de reacción contuvo 25 μL de la muestra, 45 μL del colorante de Bradford (Sigma-Aldrich) y 155 μL de agua destilada. Se generó una curva patrón con albumina (R2 = 0.9783) para calcular el contenido de proteína y reportarla como g de proteína 100g-1 de peso fresco.
Actividad enzimática. Se utilizó 1 g de pulpa de calabacita (n = 9) y 50 mg de polivinilpirrolidona (PVP, Sigma-Aldrich), se homogeneizó con 9 mL de amortiguador de fosfatos (pH 6.8, 50 mM) en frío (en baño de hielo) y se centrifugó (Hermle Labnet Z 36K, Labnet International Inc., NJ, EUA) a 3000 × g a 4 °C durante 25 min (Soriano-Melgar et al., 2012). El extracto enzimático obtenido se empleó para la determinación de la actividad específ ica de las enzimas: superóxido dismutasa (SOD) (Suzuki, 2000), catalasa (Cat) (Aebi, 1984), peroxidasas totales (POX) (Kar y Mishra, 1976) y polifenol oxidasa (PPO) (Jiang y Fu, 1999) mediante técnicas espectrofotométricas. Todos los resultados fueron expresados como unidades de actividad (U) de las enzimas por g-1 de proteína.
Compuestos fenólicos. Se utilizó el reactivo de Folin-Ciocalteu (Sigma-Aldrich) mediante la técnica colorimétrica modif icada para microplaca (Soriano-Melgar et al., 2012) a una absorbancia de 750 nm (Epoch 1, BioTek, Winooski, VT). La mezcla de reacción consistió en 10 μL del extracto de cada una de las muestras, 15 μL de una mezcla del reactivo de Folin-Ciocalteu y agua desionizada (1:1), y 100 μL Na2CO2 al 2%. Se incubó durante un minuto y se agregó 100 μL de NaOH al 0.4%. Se generó una curva estándar con ácido gálico (Sigma-Aldrich) (R2 = 0.9914) y el contenido total de compuestos fenólicos se expresó en μg de ácido gálico g-1 de peso fresco.
Capacidad antioxidante total. Se realizó según el método modificado para microplaca descrito por Brand-Williams et al. (1995) empleando un radical libre comercial 2,2-difenil-2-picril-hidracil (DPPH, Sigma-Aldrich), cuya mezcla de reacción consistió en 50 μL de la muestra y 150 μL de DPPH (125 µM), dejándola reaccionar por 45 min. Se empleó una curva patrón de ácido gálico de 5-50 µM (R2 = 0.9985) y se registró el decremento de la absorbancia a 515 nm. Los resultados fueron expresados como mmol de ácido gálico g-1 de peso fresco.
Análisis estadístico. Los datos obtenidos se sometieron a análisis de varianza y comparación de medias por Tukey usando el programa estadístico NCSS 2007 (Hintze, 2006).
Resultados y discusión
Propiedades físicas de los frutos
Un parámetro de calidad que permite seleccionar o diferenciar un producto es la apariencia, la cual incluye al color. Los resultados de color obtenidos mediante la escala CIELab en frutos de calabacita (Cucurbita pepo L.) var. 'Grey Zucchini' no presentaron diferencias signif icativas en la luminosidad ni en la coordenada b* (P > 0.05), solo se presentaron cambios en a* (P ≤ 0.05, Cuadro 1). La coordenada a* permite identificar los colores dónde, valores negativos en a* indican un color verde y valores de a* positivos indicarían un color rojo. Al respecto, un color más verde se percibiría para los frutos obtenidos de las plantas control. Para analizar con mayor nitidez el color, se obtuvieron los resultados de croma (C, cromaticidad o saturación) y ángulo hue (°h, matiz). Los valores de C no mostraron diferencias significativas (P > 0.05), mientras que el principal cambio estuvo dado por el °h (P ≤ 0.05, Cuadro 1). Los resultados de la variación en °h nos estarían indicando también un color más verde en los frutos de las plantas no tratadas (control) y un matiz verde-amarillo para los frutos de las plantas tratadas durante su desarrollo con A. chroococcum + Quitomax 10 y 20 mg L-1.
Cuadro 1: Datos del color de la cáscara de calabacita (Cucurbita pepo L.) var. ‘Grey Zucchini’ tratada con bacterias promotoras de crecimiento y oligosacarinas.
Table 1: Color of squash fruit peel (Cucurbita pepo L.) var. ‘Grey Zucchini’ produced by plants treated with PGPR and oligosaccharins.
| Tratamientos | Color | ||||
| L | a* | b* | C | °h | |
| Control (no tratados) | 56.33 ± 1.33 a† | -8.01 ± 0.12 b | 32.10 ± 0.56 a | 33.09 ± 0.57 a | 104.02 ± 0.19 a |
| Azotobacter chroococcum | 58.99 ± 1.30 a | -7.26 ± 0.35 ab | 33.15 ± 0.47 a | 33.95 ± 0.44 a | 102.39 ± 0.65 abc |
| A. chroococcum + Pectimorf 5 mg L-1 | 56.77 ± 1.57 a | -7.74 ± 0.20 b | 33.29 ± 0.82 a | 34.18 ± 0.80 a | 103.15 ± 0.44 abc |
| A. chroococcum + Pectimorf 10 mg L-1 | 56.40 ± 0.92 a | -7.67 ± 0.21 ab | 32.70 ± 0.71 a | 33.59 ± 0.72 a | 103.21 ± 0.30 ab |
| A. chroococcum + Pectimorf 20 mg L-1 | 57.17 ± 1.13 a | -7.64 ± 0.29 ab | 32.84 ± 0.75 a | 33.72 ± 0.76 a | 103.11 ± 0.46 abc |
| A. chroococcum + Quitomax 5 mg L-1 | 57.71 ± 1.60 a | -7.78 ± 0.34 ab | 31.55 ± 0.71 a | 32.50 ± 0.75 a | 103.84 ± 0.44 ab |
| A. chroococcum + Quitomax 10 mg L-1 | 55.90 ± 1.54 a | -6.20 ± 0.66 a | 31.93 ± 0.77 a | 32.58 ± 0.63 a | 101.06 ± 1.24 bc |
| A. chroococcum + Quitomax 20 mg L-1 | 57.92 ± 1.75 a | -6.17 ± 0.39 a | 33.79 ± 0.62 a | 34.37 ± 0.60 a | 100.38 ± 0.69 c |
Los valores en las columnas indican el promedio ± error estándar, n = 9. † Letras diferentes en la misma columna indican diferencia significativa (P ≤ 0.05, Tukey) entre tratamientos.
Columns are the average (n = 9) ± SE. † Means with different letters in the same column are significantly differt (P ≤ 0.05, Tukey).
Otros autores también reportaron cambios en el color de los productos poscosecha por la aplicación de tratamientos con microorganismos con propiedades bioestimulantes, tal es el caso de Hassan y Emam (2015), quienes reportaron cambios en el color de las fresas por efecto de tratamientos con biofertilizantes, incluyendo A. chroococcum, en conjunto con tratamientos poscosecha.
En cuanto a tratamientos con oligosacarinas aplicados durante el desarrollo de las plantas, García-Sahagún et al. (2009) reportaron cambios en el color (luminosidad y °h) en frutos de tomate tratados con productos a base de oligosacáridos, incluyendo Enerplant® y Pectimorf®. De dichos productos, Enerplant® fue el que más modificó el color produciendo frutos más amarillos, blancos y brillantes, con un matiz rojo pálido. En los frutos de calabacita, el mayor cambio se observó con el compuesto Quitomax® a dosis altas, modificando el color y no en luminosidad, por lo que el efecto puede deberse al producto bioestimulante utilizado, a la variedad del fruto o modelo de estudio.
Los frutos de calabacita mostraron cambios en el diámetro polar o largo del fruto por efecto de los tratamientos, observando que los frutos cuyas plantas fueron tratadas con A. chroococcum y A. chroococcum + Quitomax 5 mg L-1 son más largos (P ≤ 0.05) en comparación con los frutos de las plantas no tratadas o tratadas con A. chroococcum + Pectimorf 5 mg L-1 (Cuadro 2). También se observaron cambios signif icativos (P ≤ 0.05) en el diámetro ecuatorial o ancho de los frutos, siendo más anchos los frutos cuyas plantas fueron tratadas con A. chroococcum + Quitomax 5 mg L-1 en comparación con el control (no tratados, Cuadro 2). Los frutos con mayor peso fueron los obtenidos con A. chroococcum + Quitomax 5 mg L‑1 en comparación con el control y con el tratamiento con A. chroococcum + Pectimorf 5 mg L-1 (P ≤ 0.05, Cuadro 2). El contenido de biomasa seca fue mayor con A. chroococcum + Quitomax 5 mg L-1 en comparación con el control (P ≤ 0.05). Por ende, los frutos con mayor porcentaje de humedad fueron los del grupo control (Cuadro 2). En cuanto a la firmeza, no se observaron diferencias signif icativas (P > 0.05, Cuadro 2).
Cuadro 2: Parámetros físicos de frutos de calabacita (Cucurbita pepo L.) var. ‘Grey Zucchini’ tratados con bacterias promotoras de crecimiento y oligosacarinas.
Table 2: Physical parameters of squash fruit (Cucurbita pepo L.) var. ‘Grey Zucchini’, produced by plants treated with PGPR and oligosaccharins.
| Tratamientos | Diámetro polar |
Diámetro ecuatorial |
Peso | Biomasa seca | Porcentaje de humedad |
Firmeza |
| - - - - - - - mm - - - - - - - | g | - - - - - - - % - - - - - - - | N | |||
| Control (no tratados) | 109.6 ± 3.1 b† | 35.7 ± 0.9 b | 87.6 ± 6.3 b | 3.95 ± 0.3 b | 96.05 ± 0.3 a | 3.68 ± 0.1 a |
| Azotobacter chroococcum | 122.9 ± 2.3 a | 39.8 ±1.1 ab | 106.1 ± 12.9 ab | 4.27 ± 0.3 ab | 95.72 ± 0.3 ab | 3.93 ± 0.2 a |
| A. chroococcum + Pectimorf 5 mg L-1 | 109.2 ± 1.8 b | 37.7 ± 0.5 ab | 96.5 ± 3.5 b | 4.56 ± 0.1 ab | 95.43 ± 0.1 ab | 3.71 ± 0.2 a |
| A. chroococcum + Pectimorf 10 mg L-1 | 121.4 ± 3.6 ab | 39.8 ±1.1 ab | 124.5 ± 11.2 ab | 4.55 ± 0.2 ab | 95.45 ± 0.2 ab | 4.17 ± 0.2 a |
| A. chroococcum + Pectimorf 20 mg L-1 | 118.5 ± 2.1 ab | 39.4 ±1.2 ab | 115.6 ± 7.9 ab | 4.44 ± 0.2 ab | 95.56 ± 0.2 ab | 3.69 ± 0.2 a |
| A. chroococcum + Quitomax 5 mg L-1 | 127.2 ± 3.5 a | 41.5 ±1.3 a | 137.8 ± 13.1 a | 4.48 ± 0.2 ab | 95.51 ± 0.2 ab | 3.77 ± 0.2 a |
| A. chroococcum + Quitomax 10 mg L-1 | 120.2 ± 2.8 ab | 37.9 ± 1.0 ab | 114.0 ± 6.8 ab | 5.31 ± 0.1 a | 94.68 ± 0.1 b | 3.94 ± 0.2 a |
| A. chroococcum + Quitomax 20 mg L-1 | 116.4 ± 2.0 ab | 39.1 ± 0.7 ab | 112.1 ± 5.1 ab | 4.96 ± 0.2 ab | 95.04 ± 0.2 ab | 4.12 ± 0.3 a |
Las columnas indican el promedio ± error estándar, n = 9. † Letras diferentes en la misma columna indican diferencia significativa (P ≤ 0.05, Tukey) entre tratamientos.
Columns are the average (n = 9) ± SE. † Means with different letters in the same column are significantly differt (P ≤ 0.05, Tukey).
Se ha reportado que Azotobacter promueve el crecimiento de los cultivos, incluyendo calabacita (Refai et al., 2010), lo cual puede aportar a la obtención de una mejor calidad y vida poscosecha de los productos (Wani et al., 2013). Al comparar los frutos de plantas no tratadas (grupo control) con los frutos cosechados de plantas con tratamientos, se observa un incremento de ~15.88% en el largo, ~16.25% en el ancho, ~57.31% en peso y ~34.43% en biomasa seca, por efecto de los diferentes tratamientos, principalmente con la combinación de A. chroococcum + Quitomax 5 mg L-1.
Otros autores han reportado modificaciones en los parámetros físicos de diferentes productos empleando tratamientos durante el desarrollo de las plantas o distintas etapas fenológicas. Alarcón-Zayas et al. (2018a) reportaron el incremento en el diámetro (anchura y longitud) de frutos de tomate los cuales recibieron tratamientos con ácidos húmicos en comparación con los frutos del grupo control (no tratados). Los autores indican que la mayor absorción de nutrimentos durante el desarrollo de las plantas es la responsable de una mejor calidad poscosecha en los frutos de tomate. De manera similar, Sarhan et al. (2011) reportaron un incremento en el diámetro de frutos de calabacita (Cucurbita pepo L.) por efecto de la aplicación de Azotobacter y residuos orgánicos de oveja (estiércol), por lo que los tratamientos con Azotobacter solos o combinados con residuos orgánicos, generaron efectos positivos en el crecimiento y rendimiento de las plantas de calabacita, lo que ayuda a la mejora de la calidad de los frutos.
Por su parte, Alarcón-Zayas et al. (2018b) observaron un incremento en el diámetro polar y ecuatorial de los bulbos de cebolla por la aplicación de oligosacáridos (Enerplant®). Reyes-Pérez et al. (2018 b) también observaron un incremento en el diámetro ecuatorial y polar, y biomasa fresca de frutos de tomate, por efecto de la aplicación del producto Quitomax®. Lo anterior apoya el hecho del aumento de tamaño de los frutos de calabacita principalmente con el tratamiento A. chroococcum + Quitomax 5 mg L‑1. Reyes-Pérez et al. (2018b) indican que el cambio en el tamaño de los frutos de tomate se debe a las propiedades estimulantes del Quitomax® y su efecto directo en las plantas.
Características Químicas de los Frutos
Se observó un mayor pH en frutos del grupo control en comparación con A. chroococcum, A. chroococcum + Pectimorf 20 mg L-1, A. chroococcum + Quitomax 5 mg L‑1 y A. chroococcum + Quitomax 10 mg L-1 (P ≤ 0.05, Cuadro 3). No se observaron cambios signif icativos en el contenido de SST (P > 0.05, Cuadro 3) y AT, cuyos valores estuvieron por debajo de 0.013 mg de ácido cítrico 100 g-1 de peso fresco. El contenido de vitamina C fue mayor en A. chroococcum + Quitomax 5 mg L-1 en comparación con A. chroococcum (P ≤ 0.05, Cuadro 3). El contenido de proteína fue mayor en A. chroococcum, A. chroococcum + Quitomax 10 y 20 mg L-1, siendo el grupo control el que tuvo un menor contenido de proteína (P ≤ 0.05, Cuadro 3). Haciendo una comparación entre los frutos del grupo control y los que recibieron tratamiento durante el desarrollo de las plantas, podemos observar que el pH disminuyó hasta un 9.72%, mientras que el contenido de vitamina C y proteínas incrementó hasta un 162.5 y 22.38%, respectivamente, por efecto de los diferentes tratamientos orgánicos recibidos (Cuadro 3).
Cuadro 3: Parámetros químicos de los frutos de calabacita (Cucurbita pepo L.) var. ‘Grey Zucchini’ tratados con bacterias promotoras de crecimiento y oligosacarinas.
Table 3: Chemical parameters of squash fruit (Cucurbita pepo L.) var. ‘Grey Zucchini’, produced by plants treated with PGPR and oligosaccharins.
| Tratamientos | pH | SST | Vitamina C | Proteína |
| °Brix | mg ácido ascórbico 100 mL-1 de jugo | g de proteína 100 g-1 PF | ||
| Control (no tratados) | 7.2 ± 0.1 a† | 3.9 ± 0.1 a | 1.23 ± 0.52 ab | 2.19 ± 0.04 c |
| Azotobacter chroococcum | 6.5 ± 0.01 b | 3.6 ± 0.1 a | 0.73 ± 0.03 b | 2.46 ± 0.06 ab |
| A. chroococcum + Pectimorf 5 mg L-1 | 6.6 ± 0.01 ab | 3.6 ± 0.1 a | 1.04 ± 0.39 ab | 2.38 ± 0.05 bc |
| A. chroococcum + Pectimorf 10 mg L-1 | 6.6 ± 0.02 ab | 3.5 ± 0.1 a | 2.57 ± 0.27 ab | 2.37 ± 0.08 bc |
| A. chroococcum + Pectimorf 20 mg L-1 | 6.5 ± 0.01 b | 3.6 ± 0.1 a | 1.94 ± 0.05 ab | 2.36 ± 0.06 bc |
| A. chroococcum + Quitomax 5 mg L-1 | 6.5 ± 0.02 b | 3.4 ± 0.1 a | 1.96 ± 0.28 ab | 2.35 ± 0.06 bc |
| A. chroococcum + Quitomax 10 mg L-1 | 6.5 ± 0.03 b | 3.4 ± 0.1 a | 3.23 ± 0.30 a | 2.66 ± 0.07 a |
| A. chroococcum + Quitomax 20 mg L-1 | 6.6 ± 0.04 ab | 3.6 ± 0.1 a | 1.63 ± 0.03 ab | 2.42 ± 0.05 abc |
Las columnas indican el promedio ± error estándar, n = 9. † Letras diferentes en la misma columna indican diferencia significativa (P ≤ 0.05, Tukey) entre tratamientos. SST= sólidos solubles totales; AT= acidez titulable; PF = peso fresco.
Columns are the average (n = 9) ± SE. † Means with different letters in the same column are significantly differt (P ≤ 0.05, Tukey). SST = total soluble solids; AT = titratable acidity; PF = fresh weight.
Las modificaciones de parámetros químicos por efecto de tratamientos aplicados durante el desarrollo de las plantas se han reportado por diferentes autores y en diferentes productos poscosecha. En este contexto, Sarhan et al. (2011) reportaron incremento en el contenido de SST del fruto por efecto de la aplicación de Azotobacter y residuos orgánicos de cabras (estiércol). González-Rodríguez et al. (2018) observaron un aumento en el contenido de SST y ácido ascórbico en los frutos de tomate producidos en invernadero, mediante la inoculación de PGPR. Hassan y Emam (2015) observaron un incruento en el contenido de SST y ácido ascórbico o vitamina C en frutos de fresa por efecto de la aplicación de biofertilizantes, incluyendo tratamientos con A. chroococcum.
González-Rodríguez et al. (2018) atribuyen que el cambio en el contenido bioquímico de los frutos después de la aplicación de los tratamientos en las plantas se debe a que las PGPR generan un aumento en la fotosíntesis y el contenido de clorofilas de las plantas, aumentando la captación de CO2 y mejorando la acumulación de azúcares en frutos. Mientras que Mrkovacki y Milic (2001) correlacionan el crecimiento de las plántulas con los efectos de los microorganismos, los cuales involucran la síntesis de fitorreguladores, la fijación de N2 y la mejor absorción de nutrimentos por la influencia de una mayor actividad de la fosfatasa alcalina en la raíz. Por lo que el uso de biofertilizantes podría incrementar la captación de diferentes microelementos, entre ellos el K. El K es importante para aumentar el vigor de la planta, incrementar el crecimiento, además de ser esencial para la hidrólisis de azúcares y la translocación de nutrimentos desde las hojas, participando en procesos como la síntesis de clorof ila, la actividad enzimática, la regulación del potencial osmótico, entre otros (Sedano-Castro et al., 2011).
Otros tratamientos han generado modificaciones en la calidad poscosecha de frutos, tal es el caso del reporte de Alarcón-Zayas et al. (2018a), quienes observaron cambios en el pH y SST de tomates después de cosechados y cuyo tratamiento consistió en la aplicación de ácidos húmicos durante el desarrollo de las plantas. Los autores mencionan que estos cambios pueden deberse al efecto bioestimulante y biofertilizante de estas sustancias orgánicas y su influencia en los parámetros fisiológicos de las plantas como el área foliar y la tasa fotosintética.
Los tratamientos con oligosacáridos durante el desarrollo de las plantas también generan cambios en la composición química de los frutos poscosecha. Alarcón-Zayas et al. (2018b), reportaron que el producto Enerplant® a base de oligosacarinas, incrementa el contenido de SST en bulbos de cebolla. García-Sahagún et al. (2009) reportaron cambios en la AT, los SST, el peso y la firmeza en frutos de tomate tratados con Enerplant® y Pectimorf®. Sin embargo, el estado de corte de tomate fue en rojo maduro, mientras que en el caso particular de calabacita se corta en un estado aún verde, a lo cual se atribuye que el contenido de AT y SST no muestre variación alguna en este trabajo. Los SST incluyen principalmente azúcares y el resto son ácidos orgánicos, pectinas y aminoácidos; cuya concentración varía según el estado de desarrollo de los frutos (Kader, 2002). Los azúcares incrementan durante la maduración mientras que los ácidos orgánicos disminuyen dentro del metabolismo celular durante la senescencia (Batista-Silva et al., 2018). Esto puede apoyar los valores tan bajos de AT observados en calabacita, la cual se cosecha en un estado inmaduro.
Reyes-Pérez et al. (2018b) reportaron un incremento en el contenido de proteínas en frutos de tomate por efecto de la aplicación de Quitomax®, lo cual apoya los cambios observados en calabacita por efecto del tratamiento A. chroococcum + Quitomax 10 mg L-1. Éste mayor contenido de proteínas se puede relacionar a una mayor calidad nutricional de los frutos de calabacita, al igual que lo expresan Reyes-Pérez et al. (2018b) en frutos de tomate.
Propiedades Antioxidantes de los Frutos
La actividad enzimática presentó diferencias significativas, observando una mayor actividad de SOD en los tratamientos con oligosacarinas, tanto Pectimorf® como Quitomax® (P ≤ 0.05, Figura 1A). La actividad de Cat fue mayor en A. chroococcum + Quitomax 20 mg L-1 y menor en el grupo control y en A. chroococcum + Pectimorf 10 mg L-1 (P ≤ 0.05, Figura 1B). La actividad de POX fue mayor en A. chroococcum + Quitomax 10 mg L-1 (P ≤ 0.05, Figura 1C). La actividad de PPO fue mayor en los frutos obtenidos con los tratamiento con A. chroococcum + Quitomax 10 y 20 mg L-1 (P ≤ 0.05, Figura 1D).
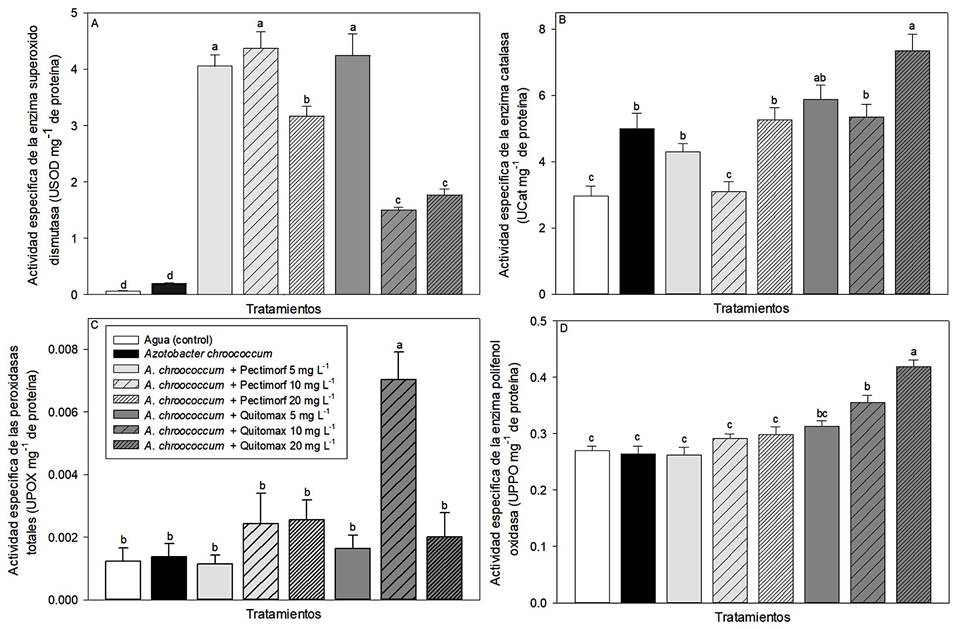
Figura 1: Actividad enzimática de A) superóxido dismutasa, B) catalasa, C) peroxidasas totales y D) polifenol oxidasa en pulpa de calabacita (Cucurbita pepo L.) var. ‘Grey Zucchini’ con tratamientos a base de bacterias promotoras de crecimiento (Azotobacter chroococcum) y oligosacarinas (productos Pectimorf® y Quitomax®).
En calabacita observamos un incremento en la actividad de SOD por acción de los tratamientos que incluyeron oligosacarinas (Pectimorf® y Quitomax®), lo cual sugiere que los frutos se encuentran en estrés oxidativo. A su vez, esto genera un incremento en la actividad de Cat y POX, para eliminar el H2O2 generado por SOD. Por si fuera poco, la mayor actividad de la enzima PPO indica también estrés oxidativo. Al respecto, es conocido que las oligosacarinas causan un incremento en el contenido de H2O2 (Côté y Hahn, 1994), además de la actividad de las enzimas POX y PPO (Cabrera et al., 2013), ya que causan la despolarización de la membrana y cambios en el flujo iónico, dando lugar al estrés oxidativo (Larskaya y Gorshkova, 2015).
Se observaron diferencias no signif icativas en el contenido de compuestos fenólicos totales (P > 0.05, Figura 2A). Sin embargo, se observa una disminución no significativa (P > 0.05) del contenido de compuestos fenólicos totales con el tratamiento A. chroococcum + Quitomax 5 mg L-1 (Figura 2A). Para la capacidad antioxidante total se observó una diminución en los frutos obtenidos de plantas tratadas con A. chroococcum + Quitomax 5 mg L-1 (P ≤ 0.05, Figura 2B), lo cual coincide con la disminución del contenido de compuestos fenólicos totales (Figura 2A), debido a que se ha reportado ampliamente que la capacidad antioxidante está altamente relacionada con el contenido de compuestos fenólicos.
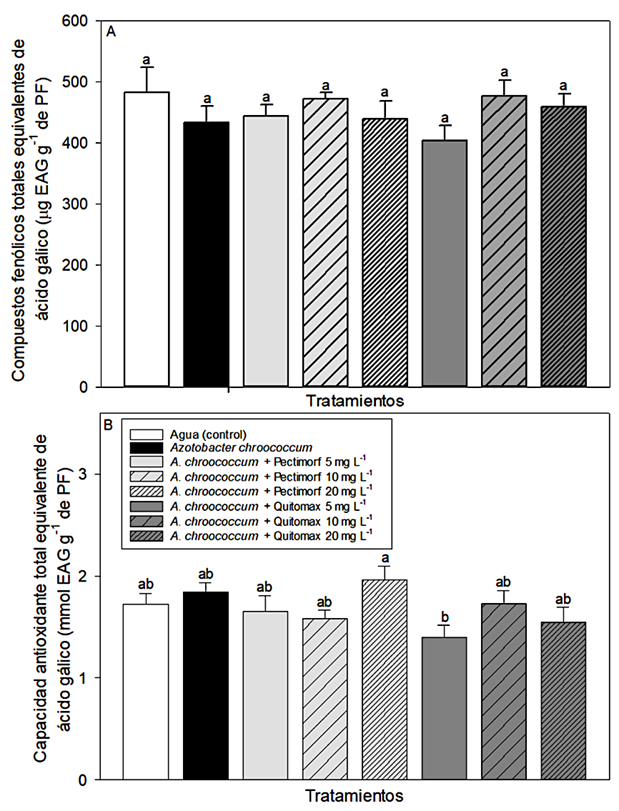
Figura 2: Contenido antioxidante: A) compuestos fenólicos totales (g EAG g-1 de peso fresco), B) capacidad antioxidante total (g EAG g-1 de peso fresco) en pulpa de calabacita (Cucurbita pepo L.) var. 'Grey Zucchini' con tratamientos con bacterias promotoras de crecimiento (Azotobacter chroococcum) y oligosacarinas (productos Pectimorf® y Quitomax®).
Figure 2: Antioxidant content: A) total phenolic compounds (G EAG g-1 fresh weight) and B) total antioxidant capacity (g EAG g-1 fresh weight) in fruit pulp from squash (Cucurbita pepo L.) var. 'Grey Zucchini', produced by plants treated with PGPR (Azotobacter chroococcum) and oligosaccharins (Pectimorf® and Quitomax®).).
Godoy del Pozo y Diosdado-Salces (2002) reportaron que el producto Pectimorf® estimuló la actividad de la enzima fenilalanina amonio liasa (PAL) en protoplastos de naranjo agrio (Citrus aurantium L.), lo que estaría indicando un estímulo en la síntesis de compuestos fenólicos. Sin embargo, los frutos de calabacitas tratados con PGPR (A. chroococcum) y oligosacarinas (Pectimorf® y Quitomax®) no mostraron cambios en el contenido de compuestos fenólicos en los frutos poscosecha. Por lo que el efecto en la actividad de la enzima puede estar dada sólo en la planta y no llegar el estímulo hasta el fruto.
Las oligosacarinas son moléculas que no penetran del todo en la célula, y se cree que su mecanismo de acción está relacionado directamente con la membrana y pared celular; sin embargo, se transportan a través del apoplasto, generando efectos en otros tejidos diferentes a aquellos donde se aplicaron o donde se sintetizaron (Larskaya y Gorshkova, 2015). A su vez, se ha reportado que algunos tipos de oligosacarinas del tipo xiloglucano pueden degradarse o modificarse durante el transporte, aunque al mismo tiempo, este mismo tipo de oligosacarinas han demostrado mantenerse inalteradas después de 24 h de su aplicación (Larskaya y Gorshkova, 2015). Es por ello que Larskaya y Gorshkova, (2015) remarcan la importancia de conocer el mecanismo de acción de las oligosacarinas y sus posibles “receptores”, ya que aún no se ha elucidado completamente. De la misma forma, Ahmad et al. (2018) indicaron que es necesario conocer el mecanismo de acción de los diferentes estimulantes de plantas, con la finalidad de predecir los cambios específicos que pueden ocurrir en los frutos. Lo anterior facilitaría avances en la agricultura orgánica, ayudando a proteger el ambiente mediante la disminución del uso de agroquímicos sintéticos (Sarhan et al., 2011).
Conclusiones
La aplicación de PGPR y oligosacarinas en tratamientos sobre semillas y durante el ciclo del cultivo de calabacita, genera un impacto positivo sobre la poscosecha de frutos en cuanto a características físicas, bioquímicas y de calidad, en comparación con el cultivo sin tratar. Esto subraya la importancia de los tratamientos aplicados a lo largo del cultivo para la obtención de, además de un mayor rendimiento, productos con mejor calidad. Al mismo tiempo, remarca que los tratamientos de tipo sustentable o amigable con el ambiente tienen la capacidad de incrementar el contenido nutracéutico de los productos hortofrutícolas.











 text new page (beta)
text new page (beta)



