Introducción
La clorosis férrica en las plantas es originada por deficiencia de hierro (Fe) que afecta el desarrollo de los cultivos en suelos de elevada alcalinidad y calcáreos, pues existe un antagonismo entre los carbonatos y el Fe en los suelos. Los bajos niveles de materia orgánica también participan en el incremento de tal insuficiencia. La presencia de los síntomas en los cultivos es variable entre años o ciclos de siembra; además, depende de otros factores del suelo y condiciones climáticas (Mengel y Kirkby, 2001; Ozores-Hampton, 2013). Dado que las plantas cloróticas muestran una alta concentración de Fe en sus raíces, la clorosis podría estar relacionada con un problema de movilización y translocación del Fe a la parte aérea de las plantas; sin embargo, aún el problema de la clorosis férrica en los cultivos no está todavía completamente entendido (Álvarez et al., 2005). El Fe es el micronutriente más afectado por el pH del suelo ya que por cada unidad de aumento del pH (entre 4-9) su disponibilidad se reduce en 1000 veces, mientras que la disponibilidad de Mn, Zn y Cu disminuye en 100 veces por cada unidad de incremento en el pH (Ferreyra et al., 2008). Otro aspecto importante a considerar es la necesidad de aumentar la concentración de Fe en los alimentos derivados de cultivos ya que representa un desafío global debido a la alta incidencia de la deficiencia del micronutriente en las poblaciones humanas (Aciksoz et al., 2011).
En general los síntomas por deficiencia de Fe son fáciles de reconocer en las hojas. La clorosis ocurre debido a que el Fe es necesario, entre otros procesos, para la síntesis de clorofila, la cual es esencial en la actividad fotosintética. Los síntomas son más evidentes y críticos en estado de plántula (Lucena, 2009), de aquí la importancia de corregir la deficiencia en ese estado. Al inicio se observa en las hojas jóvenes clorosis intervenal, mientras que en estados más severos la clorosis se generaliza en toda la lámina y solamente las nervaduras verdes. Cabe mencionar que esta deficiencia no afecta el tamaño de las hojas y es intensa en brotes nuevos. En casos más severos la clorosis continua con manchas necróticas, que afecta tanto a las hojas nuevas como a las viejas, puede generar la caída de hojas e incluso la muerte de la planta (Álvarez et al., 2005; Arizmendi-Galicia et al., 2011). Además, la deficiencia de Fe también causa cambios morfológicos en las raíces mediante inhibición de la elongación radical (Schenkeveld y Temminghoff, 2011). Díaz y Ortegón (2000) señalaron que cuando la clorosis férrica no se corrige en el estado de plántula, las pérdidas en el rendimiento son proporcionales a la severidad observada. El nivel de clorofila puede monitorearse directamente en campo a través del índice SPAD (Soil Plant Analytical Development) (Schenkeveld et al., 2008; Xiong et al., 2015). Otra opción de monitoreo es el análisis del tejido vegetal en el laboratorio. Es importante anotar que el análisis de suelo no es un método confiable para prever la deficiencia de Fe (Ferreyra et al., 2008; Ozores-Hampton, 2013).
En particular, en el noreste de México, la deficiencia de hierro es común en los suelos de origen calcáreo, alcalinos y con bajos niveles de materia orgánica (Arizmendi-Galicia et al., 2011; Salinas et al., 2006; Ortiz et al., 2007). Se han hecho recomendaciones de diversos productos para la corrección de la clorosis, aunque no son siempre exitosas. El tratamiento de las semillas con sales de Fe o con quelatos de Fe han tenido resultados erráticos (Cantera et al., 2002; Farooq et al., 2012). Las aplicaciones al suelo de quelatos como EDTA (ac. etilendiaminotetracético) y DTPA (ac. dietilentriaminopentaacético) son ineficientes debido a que su efectividad se limita a suelos con pH < 7.4 (Lucena, 2009; Schenkeveld y Temminghoff, 2011; Whiting et al., 2015). La práctica que es utilizada para la corrección de clorosis en los cultivos consiste en aspersiones foliares de sulfato ferroso (FeSO4) (Fernández y Elbert, 2005; Ozores-Hampton, 2013). No obstante, esta práctica en muchos casos es infructuosa o inoperante ya que depende del grado de severidad de clorosis presente en el cultivo, de la oportunidad y de la frecuencia de las aspersiones (Kabir et al., 2016; Lucena, 2009). Las aspersiones de FeSO4 deben iniciarse al presentarse los primeros síntomas en estado de plántula ya que en plantas adultas pueden resultar ineficaces (Magallanes et al., 2014; Schenkeveld et al., 2008). En 2003 la Unión Europea inició la regulación para la producción comercial del quelato sintético tipo EDDHA [ac. etilendiamino-di-(o-hidroxifenilacético)], el cual muestra efectividad en suelos calcáreos con pH > 8.5 (Álvarez et al., 2005; García-Marco et al., 2006). Este quelato se ha utilizado para la corrección de clorosis férrica principalmente en frutales y cultivos hortícolas (Ozores-Hampton, 2013; Whiting et al., 2015); con escasa información de su aplicación en granos o cultivos extensivos. Por lo anterior, el presente trabajo evaluó la efectividad del quelato EDDHA-Fe, para prevenir o corregir químicamente la clorosis férrica en cuatro cultivos de interés agrícola, crecidos en suelos calcáreos y alcalinos.
Materiales y Métodos
Localidad
Una serie de experimentos se establecieron en los terrenos del Campo Experimental Río Bravo (CERIB), INIFAP, Río Bravo, Tamaulipas (25º 57’ 16.9’’ N, 98º 01’ 05.7’’ O; altitud 25 m). Se tomaron cuatro muestras aleatorias de suelo de tipo Vertisol en presiembra de los primeros 30 cm de profundidad, para analizar sus propiedades físicas y químicas (SEMARNAT, 2002) en el Laboratorio de Suelo, Planta y Agua del CERIB. El pH fue 8.0, la conductividad eléctrica (C.E.) 1.14 dS m-1, materia orgánica (M.O.) 1.7%, de textura arcillosa, y los macro-microelementos (mg kg-1) 20.6 N-NO3, 27.1 P, 1864 K, 0.622 Fe, 0.691 Cu, 0.853 Zn y 0.599 Mg.
Manejo experimental
Para el estudio se utilizaron cuatro cultivos sembrados a mediados de febrero 2016. Sorgo (Sorghum bicolor, ‘83G19’) sembrado el día 15, soya (Glycine max, ‘Vernal’) el 16, frijol (Phaseolus vulgaris, ‘Pinto Americano’) y okra (Abelmoschus esculentus, ‘Clemson Spineless 80’) sembrados el 17. Para la corrección de la clorosis férrica se manejaron los tratamientos indicados en el Cuadro 1.
Cuadro 1: Tratamientos utilizados en los cuatro cultivos para evaluar la respuesta a la corrección de clorosis férrica.
| Tratamiento | Descripción |
|---|---|
| 1 | Quelato de Fe3+ (6%) EDDHA [ac. etilendiamino-di-(o-hidroxifenilacético)] (Ultraferro®, Trade Corporation International, S.A.U., Madrid, España), aplicado al 1% sobre las semillas de cada especie, al momento de la siembra. |
| 2 | El quelato de Fe Ultraferro® más aplicación foliar de sulfato ferroso agrícola (FeSO4) al 1.5%. |
| 3 | Aplicación foliar de FeSO4 al 1.5%. |
| 4 | Testigo. |
La siembra se realizó manualmente y las aplicaciones de los tratamientos se efectuaron con una mochila con bomba de aspersión. En los tratamientos que llevaron FeSO4 foliar, se hicieron dos aplicaciones el 16 (30 dds) y 22 (36 dds) de marzo, respectivamente. Para cada cultivo, las parcelas consistieron de tres surcos de 5 m de longitud y los tratamientos se distribuyeron bajo un diseño de bloques completos al azar con tres repeticiones.
Variables medidas y análisis de datos
Para evaluar el efecto de los tratamientos, los ensayos se condujeron hasta los 48-50 días después de la siembra. En el desarrollo de los cultivos se tomaron tres lecturas de índice de clorofila SPAD (n = 30) con el medidor digital Minolta SPAD 502®, el primero el 15 de marzo (29 dds), con la presencia de los síntomas y antes de la primera aplicación foliar de FeSO4, los restantes fueron el 28 de marzo (40 dds) y 6 de abril (50 dds). Con los datos SPAD se realizó un análisis factorial, tratamiento × fecha de lectura. Al terminar los 48-50 días, de cada cultivo se tomaron al azar ocho plantas por parcela, de las cuales se determinó la biomasa seca aérea, foliar y radical. La biomasa seca se obtuvo después del secado en estufa a 60 ºC durante tres días. Los datos se sometieron a análisis de varianza y la separación de las medias de los tratamientos fue a través de la prueba DMS (P ≤ 0.05) con el programa SAS (SAS Institute, 2014).
Resultados y Discusión
En las condiciones del estudio, los cultivos manifestaron diferente reacción a la deficiencia de Fe, de los cuatro, las plantas de soya y okra, en los suelos del tratamiento testigo, mostraron la mayor sensibilidad, presentaron mayor severidad o intensidad de clorosis, hasta alcanzar necrosis en el follaje. En los suelos calcáreos del noreste de México es común observar daños severos por clorosis férrica tanto en frijol como en sorgo que causan pérdidas totales (Lara et al., 2004; Cortinas, 2006; Adame y Silva, 1994). Es indudable la variación de susceptibilidad que presentan los cultivos a la deficiencia de Fe (Ozores-Hampton, 2013), inclusive entre genotipos de la misma especie (Lara et al., 2004; Díaz y Ortegón, 2000). Por otro lado, las dos aplicaciones foliares de FeSO4, si resultaron uniformes en todos los cultivos (16 y 22 de marzo). Díaz y Ortegón (2000) indicaron que para corregir la clorosis férrica de frijol y chícharo de vaca (Vigna unguiculata) hasta los 50 días después de la siembra, requirieron de cinco aspersiones foliares de FeSO4 debido a la severidad de la deficiencia.
En el cultivo de soya se obtuvo una interacción significativa (P = 0.001) entre tratamiento y fecha de lectura para el índice de clorofila SPAD. En general, la mejor corrección de la clorosis en el cultivo se observó en las parcelas con EDDHA-Fe, los cuales registraron los mayores niveles de clorofila y fueron estadísticamente semejantes. En segundo término, el FeSO4 foliar superó al testigo en las dos últimas lecturas, debido a que mostró un ascenso gradual de SPAD en comparación a las fechas anteriores (Figura 1).
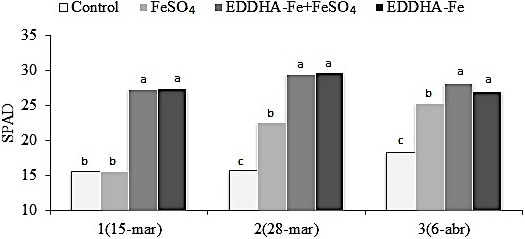
Figura 1: Índice SPAD (n = 30) en soya en tres lecturas (fechas) para cada tratamiento químico de clorosis férrica. Barras con la misma letra no difieren (DMS, P ≤ 0.05).
Resultados semejantes a los de clorofila se registraron con la biomasa de la soya. Los mayores valores de biomasa de follaje (P = 0.005) y radical (P = 0.01), se observaron estadísticamente similares con los dos tratamientos donde se aplicó EDDHA-Fe, seguido de la aplicación foliar de FeSO4 (Cuadro 2).
Cuadro 2: Respuesta de la soya ‘Vernal’ al control químico de clorosis férrica en función de biomasas foliar y radical.
| Tratamiento | Biomasa | |
|---|---|---|
| Foliar | Radical | |
| - - - - - - - - - - - g - - - - - - - - - - | ||
| EDDHA-Fe | 37.2 a† | 3.5 a |
| EDDHA-Fe + FeSO4 | 35.9 a | 3.0 a |
| FeSO4 | 22.0 c | 2.5 b |
| Testigo | 16.0 d | 1.8 c |
| Significancia F | 0.005 | 0.01 |
† Valores unidos con la misma letra no son diferentes, DMS P ≤ 0.05.
En okra el índice SPAD, mostró también una interacción (P = 0.001) entre el tratamiento químico y fechas de lecturas. En las dos primeras fechas, los tratamientos que llevaron EDDHA-Fe registraron los valores más altos; en la fecha del 6 de abril, todos los tratamientos superaron de forma similar a las parcelas testigo. En contraste con los demás cultivos, se observó que al parecer la okra es más demandante de nutrimentos y requiere de un manejo nutricional diferente, esto es debido a que en general en el último muestreo los índices SPAD decrecieron (Figura 2). La okra es un cultivo hortícola para el mercado de exportación, y en particular, tiene relevancia la intensidad de clorosis manifestada, dado a que la clorofila del fruto está estrechamente asociada con la clorofila foliar (r2= 0.77) y el fruto de baja intensidad de verdor, es causa de castigos en su comercialización (Díaz et al., 2007).
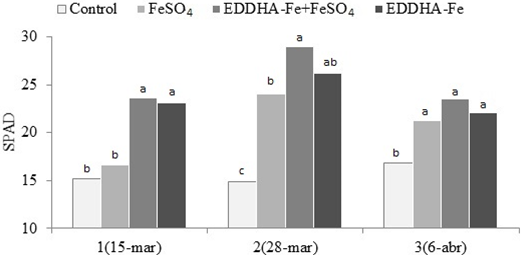
Figura 2: Índice SPAD (n = 30) en okra en tres lecturas (fechas) para cada tratamiento químico de clorosis férrica. Barras con la misma letra no difieren (DMS, P ≤ 0.05).
Semejante a la respuesta de la soya, los mayores pesos en biomasa foliar en las plantas de okra (P= 0.001) se registraron con los tratamientos que llevaron el quelato, seguido de la aplicación de FeSO4 foliar. Para la biomasa radical todos los tratamientos químicos superaron (P = 0.002) al testigo (Cuadro 3).
Cuadro 3: Respuesta de okra ‘Clemson Spineless 80’al control químico de clorosis férrica en función biomasas foliar y radical.
| Tratamiento | Biomasa | |
|---|---|---|
| Foliar | Radical | |
| - - - - - - - - - - - - - g - - - - - - - - - - - - | ||
| EDDHA-Fe | 95.3 a† | 9.8 a |
| EDDHA-Fe + FeSO4 | 105.3 a | 7.6 a |
| FeSO4 | 40.6 b | 6.7 a |
| Testigo | 26.0 c | 3.1 b |
| Significancia F | 0.001 | 0.002 |
† Valores unidos con la misma letra no son diferentes, DMS P ≤ 0.05.
En el frijol se observó interacción (P= 0.01) entre el tratamiento químico y fecha de lectura para el índice SPAD. En la primera lectura de clorofila (15 de marzo), se observó, al igual que en soya y okra, una marcada clorosis exhibida en las parcelas testigo y el FeSO4 previo a la primera aplicación. Mientras que los valores SPAD con EDDHA-Fe se mantuvieron altos en los mismos cultivos, por lo que estas plantas no reflejaron estrés clorótico. En la fecha del 28 de marzo el efecto de los tratamientos químicos fue semejante entre ellos, pero con valores superiores al testigo. Posteriormente, para la tercera fecha de lectura el cultivo no manifestó clorosis visible y se corroboró con los valores SPAD que fueron semejantes entre los tres tratamientos y el testigo. El genotipo de frijol mostró en las parcelas testigo un incremento escalonado natural en la corrección de la clorosis férrica (Figura 3), respuesta que puede estar vinculada a una tolerancia varietal (Díaz y Ortegón, 2000; Lara et al., 2004).
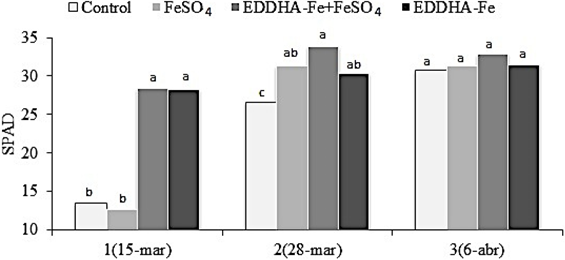
Figura 3: Índice SPAD (n = 30) en frijol en tres lecturas (fechas) para cada tratamiento químico de clorosis férrica. Barras con la misma letra no difieren (DMS, P ≤ 0.05).
Para la biomasa foliar y radical de las plantas de frijol, los pesos de las variables fueron estadísticamente semejantes (P = 0.04 y 0.007, respectivamente) con los tratamientos de control químico, los cuales fueron superiores a los obtenidos en las parcelas testigo (Cuadro 4).
Cuadro 4: Respuesta de frijol ‘Pinto Americano’ al control químico de clorosis férrica en función a las biomasas foliar y radical.
| Tratamiento | Biomasa | |
|---|---|---|
| Foliar | Radical | |
| - - - - - - - - - - - - - g - - - - - - - - - - - - | ||
| EDDHA-Fe | 66.0 a† | 1.13 a |
| EDDHA-Fe + FeSO4 | 54.6 ab | 1.16 a |
| FeSO4 | 52.5 ab | 1.06 a |
| Testigo | 35.0 b | 0.46 b |
| Significancia F | 0.04 | 0.007 |
† Valores unidos con la misma letra no son diferentes, DMS P ≤ 0.05.
En sorgo se obtuvo una respuesta diferente, comparada con los demás cultivos; la clorosis férrica no fue visiblemente evidente entre los tratamientos y se expresó en los índices SPAD no significativas (P= 0.71). Aunque por fecha de lectura, las dos primeras tuvieron valores inferiores (P = 0.043) en relación a la del 6 de abril (Cuadro 5). Los tratamientos químicos para la clorosis férrica tampoco tuvieron impacto en las variables de biomasa ya que no se observaron diferencias significativas para biomasa foliar y radical (P = 0.088 y 0.434, respectivamente) (Cuadro 5), debido a la ausente o leve clorosis manifestada.
Cuadro 5: Unidades SPAD y biomasa de sorgo ‘83G19’ en función al control químico de clorosis férrica.
| Tratamiento (T) | Unidades SPAD | Biomasa | ||
| Foliar | Radical | |||
| - - - - - - - - - - - - - g - - - - - - - - - - - - | ||||
| EDDHA-Fe | 31.1 | 41.1 | 6.4 | |
| EDDHA-Fe + FeSO4 | 28.9 | 40.8 | 6.0 | |
| FeSO4 | 30.7 | 47.9 | 6.8 | |
| Testigo | 28.7 | 39.7 | 4.5 | |
| Significancia F | 0.711 | 0.088 | 0.434 | |
| Fecha de lectura (F) | ||||
| 15 de marzo | 28.7 b† | |||
| 28 de marzo | 29.1 b | |||
| 6 de abril | 33.4 a | |||
| Significancia F | 0.043 | |||
| T × F | 0.406 | |||
† Valores unidos con la misma letra no son diferentes, DMS P ≤ 0.05.
Los mecanismos metabólicos que tiene el Fe en las plantas son diversos, está involucrado como un metal redox-activo en la fotosíntesis, en la respiración mitocondrial, en la asimilación de nitrógeno, en la biosíntesis hormonal, en la osmo-regulación, en la defensa de patógenos y como un factor limitante para la producción de biomasa (Briat, 2011). Los resultados del estudio demostraron que en general la aplicación del quelato EDDHA-Fe sobre las semillas solo o combinado con dos aspersiones foliares de FeSO4, fueron los más efectivos para la corrección de clorosis férrica en soya, okra y frijol. Fue visible la clorosis en las plantas testigo de esos cultivos y la efectividad del quelato se manifestó desde la aparición de los primeros síntomas en las hojas verdaderas. En contraste, en la última fecha de lectura (6 de abril) las plantas de las parcelas testigo de soya y okra, presentaron pobre desarrollo y manchas necróticas en las hojas, lo cual bajo estas condiciones no alcanzarían el estado reproductivo. De la misma forma, Álvarez et al. (2005) concluyeron que con una aplicación de los quelatos tipo EDDHA, EDDHMA [ac. etilendiamino di(2-hidroxi-4-metilfenilacético)] y EDDHSA [ac. etilendiamino di(2-hidroxi-5-sulfofenilacético)], fue suf iciente para causar una corrección de deficiencia de hierro en los cultivos de girasol (Helianthus annuus), pera (Pyrus communis) y durazno (Prunus persica).
Los tratamientos químicos tuvieron impacto en la promoción de la biomasa foliar y radical en soya, okra y frijol. Ante la severidad de clorosis férrica manifestada en las plantas de soya y okra, el EDDHA-Fe solo o en combinación con FeSO4 foliar, incrementaron 20.5 y 74.3 g (en promedio), respectivamente, el peso de biomasa foliar sobre el testigo. La aplicación de FeSO4 foliar en soya y okra, mantuvo incrementos en la biomasa superiores a los del testigo; mientras que en frijol los incrementos fueron similares al tratamiento quelante. Estos resultados coinciden con los reportados por García-Marco et al. (2006) quienes demostraron la efectividad del quelato EDDHA para la corrección de clorosis férrica, asociada a la mayor promoción de la biomasa aérea en plántulas de soya. De igual forma, Kabir et al. (2016) registraron en chícharo (Pisum sativum), corrección de clorosis férrica con aspersiones de FeSO4 e incrementos en la biomasa foliar. La respuesta de la planta al agente quelante como el EDDHA radica en que es una molécula orgánica (anión) de alta estabilidad, capaz de mantener los iones metálicos rodeados de modo que queden protegidos del entorno, de lo contrario, favorecería su precipitación en forma de hidróxido insoluble y no disponible para la planta (Lucena, 2009).
No se observó efecto aditivo en los valores SPAD ni en la biomasa de las plantas, al combinar el EDDHA-Fe con el FeSO4 foliar, lo que indica que con la actividad del quelato solo es suficiente para lograr un óptimo abatimiento de la clorosis. Para el caso particular de las plantas de okra, al observarse un decremento en los índices SPAD en la última lectura (6 de abril), esto refleja que el cultivo manifestó necesidades nutrimentales en ese estado, por lo que requiere de investigación adicional para determinar un manejo de fertilización integral. La opción de utilizar el quelato representa un manejo práctico y eficiente en suelos calcáreos y alcalinos ya que solo requiere su aplicación en la siembra (Álvarez et al., 2005), tal como fue demostrado en el presente estudio. Este quelato se ha utilizado para la corrección de clorosis férrica en árboles frutales y cultivos hortícolas, a través de riego por goteo (Arizmendi-Galicia et al., 2011; Ozores-Hampton, 2013; Whiting et al., 2015). Por otro lado, el FeSO4 foliar podría representar un control de clorosis férrica con algunas desventajas; por ejemplo, las aplicaciones deberán ser oportunas ya que de lo contrario el cultivo estaría bajo estrés clorótico. En condiciones climatológicas adversas no es posible realizar las aspersiones, en otros casos resulta inoperante debido al número de aplicaciones requeridas (Fernández y Elbert, 2005). Por lo anterior, Whiting et al. (2015) señalaron que el manejo de las aplicaciones foliares de FeSO4 y la frecuencia de éstas, no se pueden generalizar ya que dependerán del cultivo, así como la severidad o intensidad de la clorosis. No obstante, la práctica comercial común para el control de clorosis férrica en diferentes regiones con suelos calcáreos y alcalinos es mediante el empleo de FeSO4 foliar (Fernández y Elbert, 2005; Ozores-Hampton, 2013; Kabir et al., 2016). Por contrario, Schenkeveld y Temminghoff (2011), señalan que en Europa últimamente el mayor mercado lo ocupa el quelato Fe-EDDHA con una venta anual de 60 millones de euros.
Finalmente, los resultados aquí presentados tienen implicaciones trascendentes no solo desde el punto de vista agronómico, sino también en la nutrición humana. La deficiencia de Fe es un problema creciente de salud pública en las poblaciones humanas que se asocia con menor ingesta de Fe; de aquí la necesidad de mejorar las concentraciones de Fe en los cultivos (Márquez-Quiroz et al., 2015; Aciksoz et al., 2011).
Conclusiones
De los cuatro cultivos experimentados, las plantas de soya y okra presentaron la mayor severidad a la def iciencia de hierro (Fe). Aunque los efectos de los tratamientos químicos en el índice de clorofila y biomasa fueron variables entre los cultivos, en general, los resultados demuestran que la aplicación de EDDHA-Fe solo o combinado con FeSO4 foliar, ofrecen una efectiva corrección de la clorosis férrica.











 text new page (beta)
text new page (beta)


