Introducción
La viabilidad de la utilización de las lombrices como una técnica de tratamiento de materiales orgánicos, originados de la actividad agroindustrial ha sido bien establecida con resultados positivos (Bailey y Lazarovits, 2003; Arancon et al., 2003; Domínguez, 2004). La utilización de las lombrices del suelo puede ser una respuesta ecológicamente racional, económicamente viable y socialmente aceptable (Sharma et al., 2005). La lombriz compostera Eisenia andrei (Bouché) es un agente que se incluye entre las biotecnologías de la agricultura orgánica y agricultura en general, para incrementar el rendimiento de los cultivos (Suthar, 2012). La acción de la lombriz no es única; en la descomposición intervienen junto con los microorganismos degradadores aeróbicos (hongos, bacterias y actinomicetos), otros organismos: amilolíticos, lipolíticos, celulolíticos, ligninolíticos, amonificantes, fijadores de nitrógeno de vida libre, desnitrificantes y nitrificantes, que ayudan a digerir las substancias que componen la materia orgánica (Domínguez et al., 2010). Durante el proceso de vermicompostaje se generan compuestos bioactivos que son de importancia para los procesos bioquímicos y reguladores de los suelos, como las enzimas: amilasa, celulasa, lipasa, invertasa, proteasa, amidasa, ureasa, monoestereasa (fosfatasa ácida y alcalina), arilsulfatasa y deshidrogenasa (Askin y Kizilkaya, 2006; Karaca et al., 2010; Turgay et al., 2010). Además, se generan distintos tipos de antibióticos, vitaminas, hormonas y substancias húmicas (ácidos húmicos, fúlvicos y huminas), de gran valor para la nutrición vegetal. Por la utilidad que representan, para el hombre y la naturaleza, deben reconocerse las cualidades de las lombrices y del vermicompostaje, en general, para tratar de devolver a la naturaleza los nutrientes y la fertilidad que durante años se han tomado del suelo. Su aplicación puede contribuir considerablemente al aprovechamiento y reciclaje productivo de estos desechos orgánicos y promover una utilización sostenible del suelo, en armonía con la naturaleza (Singh y Sharma, 2002). El objetivo de la presente investigación fue evaluar la influencia del tamaño de paja y la presencia de lombriz en las poblaciones microbianas, actividad enzimática y substancias húmicas durante el proceso de compostaje y vermicompostaje de paja de avena, subproducto de la producción del hongo comestible Pleurotus ostreatus.
Materiales y métodos
El experimento se realizó, en el laboratorio de microbiología del Postgrado de Edafología, en las instalaciones del Colegio de Postgraduados, Campus Montecillo. Las unidades experimentales fueron cajas de plástico de 20 × 31 × 13 cm, donde se colocó paja de avena molida (< 2mm) y picada (< 4mm), en la que se había cultivado Pleurotus ostreatus, se humedeció al 80%. Al día siguiente, se colocaron 200 lombrices cliteladas (Eisenia andrei Bouché) por caja. Se consideraron cuatro tratamientos: 1) paja molida con lombriz, 2) paja molida sin lombriz, 3) paja picada con lombriz y 4) paja picada sin lombriz. Se utilizó un diseño experimental de bloques completamente al azar considerando 5 repeticiones.
Se muestreo a los 23, 46, 69, 92, 115 y 148 días después de la inoculación con las lombrices. La humedad de las cajas se mantuvo entre el 75 y 85% de la capacidad de campo y la temperatura entre 25 y 30 ºC. Se evaluó la dinámica de los grupos microbianos: bacterias, actinomicetos y hongos, mediante unidades formadoras de colonias (ufc) desarrolladas en los lapsos mencionados y las poblaciones de grupos microbianos específicos: celulolíticos, lipolíticos, ligninolíticos, proteolíticos, amonificantes, nitrificantes (nitrito oxidantes y amonio oxidantes), desnitrificantes y fijadores libres de nitrógeno (Cuadro 1).
Cuadro 1 Medios de cultivo, tiempo de incubación y formas de identificación empleados en la cuantificación de los grupos microbianos estudiados.

† ufc (unidades formadoras de colonias) cuantificadas en placas de agar. ‡ NMP = Grupos microbianos evaluados por el número más probable (NMP).
Las muestras de vermicomposta y composta se colectaron bajo condiciones asépticas, con una espátula acanalada, se colectaron 10 submuestras al azar de cada caja preparándose una muestra compuesta. Se tomaron 10 g de cada muestra compuesta y se realizaron diluciones decimales seriadas con agua destilada estéril, con una alícuota de 0.1 mL de diluciones 10-3 a 10-7, se inocularon placas Petri por quintuplicado con los medios de cultivo específicos para cada grupo microbiano (Cuadro 1). En el caso de los microorganismos amilolíticos, proteolíticos, amonificantes, nitrificantes (amonio oxidante y nitrito oxidante) y desnitrificantes, la evaluación se realizó mediante la técnica del número más probable (NMP). En esta técnica se inoculó 0.1 mL de diluciones seleccionadas de la muestra a analizar, en tubos, con medio de cultivo específico por quintuplicado y se incubaron de acuerdo con la mayor expresión de cada grupo microbiano a 28 ºC. El NMP se obtuvo interpolando el número característico, obtenido a través de reacciones de identificación correspondientes de cada grupo microbiano, en la tabla de números más probables de Cochran (1950) y Alexander (1982), para cinco tubos por dilución.
Se evaluó la actividad de las enzimas que participan en el ciclo del carbono (amilasa, celulasa, lipasa, invertasa), nitrógeno (proteasa, amidasa, ureasa y nitrogenasa), fósforo (fosfatasa ácida y alcalina, fosfomonoesterasas) y azufre (arilsufatasa); y la deshidrogenasa (Cuadro 2).
Cuadro 2 Metodologías empleadas en la cinética de las enzimas participantes en el ciclo del carbono, nitrógeno, fósforo, azufre y la deshidrogenasa.

La separación de las fracciones de ácidos húmicos (AH) a partir de las muestras de composta y vermicomposta, se hizo por medio del método de Kononova y Belchikova (1961). En este procedimiento se utilizan álcalis y ácidos diluidos como NaOH 0.1 M y Na4P2O7 0.1 M (pirofosfato de sodio). Se obtuvieron espectros de infrarrojo (IR) para identificar grupos funcionales, preparando en primer lugar pastillas de 1 g que contenían 99% de KBr y 1% de la muestra problema. El material se mezcló bien, moliéndolo en un mortero de ágata y compactándolo con una prensa que produce una presión de 10 Mg cm-2. La pastilla se colocó en un espectrofotómetro de IR Perkin Elmer modelo 683 y se adquirió el espectro entre 4600 y 400 cm-1. Posteriormente, se identificaron las principales bandas correspondientes a los distintos grupos funcionales (Stevenson, 1994).
Los datos obtenidos de la actividad microbiológica y enzimáica fueron sometidos a un análisis de varianza y las medias de los tratamientos a una prueba de Tukey (α = 0.05). Se emplearon los procedimientos incluidos en el paquete estadístico SAS (SAS Institute, 1998).
Resultados y discusión
Al finalizar el experimento (148 días), el tamaño de paja de avena, subproducto del cultivo de Pleurotus ostreatus, no influyó de manera significativa en la cantidad de microorganismos totales: bacterias, actinomicetos y hongos. Sin embargo, la presencia de la lombriz (Eisenia andrei Bouché) incrementó el número de unidades formadoras de colonias de las bacterias en los tratamientos de paja molida (PM) y paja picada (PP) en comparación con los tratamientos sin lombriz. Para los actinomicetos y los hongos los tratamientos de paja molida con lombriz (PMCL) tuvieron diferencias significativas con los que solo tenían PM, y ocurrió lo contrario en los tratamientos con PP que tuvieron más unidades formadoras de colonias de actinomicetos y hongos que los tratamientos de paja picada con lombriz (PPCL).
Las poblaciones de bacterias, actinomicetos y hongos disminuyeron entre los 69 y 148 días en todos los tratamientos, debido al agotamiento de compuestos carbonados de fácil descomposición (Paul y Clark, 1989; Brock y Madigan, 1993). La presencia de lombrices redujo el número de actinomicetos significativamente (α = 0.05) respecto a los tratamientos sin lombrices (Cuadro 3).
Cuadro 3 Unidades formadoras de colonias (ufc) de bacterias, actinomicetos y hongos durante el proceso de producción de vermicomposta y composta preparadas con paja de avena subproducto de la producción comercial del hongo Pleurotus ostreatus.
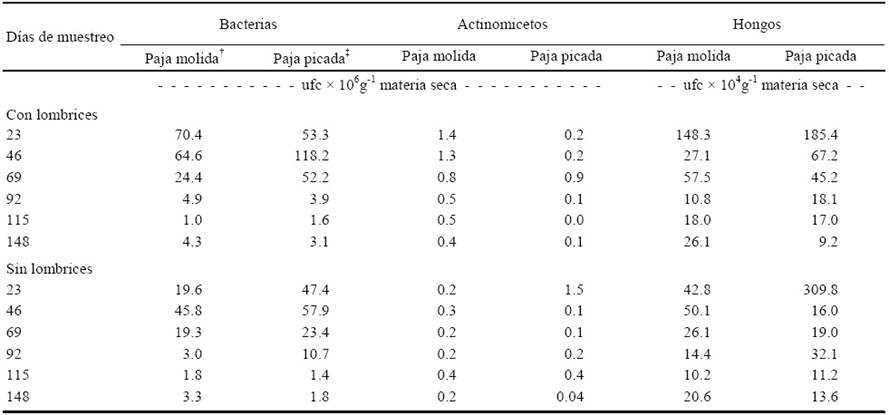
† Paja molida < 2mm; ‡ Paja picada < 4mm. Ufc: medio gelificado. DSH (0.05)Bacterias = 2.7209; DSH (0.05)Actinomicetos = 0.0306; DSH (0.05)Hongos = 2.2713.
Se observaron menos bacterias en composta de estiércol combinada con lombrices que en la composta de estiércol (Allievi et al., 1987), reportan la misma tendencia en vermicompostas preparadas con paja de avena, estiércol de bovino, desechos hortofrutícolas y mezclas de éstos. Los cambios inducidos por las lombrices; competencia por nutrimentos, depredación entre las lombrices y los grandes grupos microbianos, pueden explicar dicho comportamiento (Trigo y Lavelle, 1993).
En la parte anterior del tracto digestivo de las lombrices, las poblaciones microbianas ingeridas con el suelo, se reproducen rápidamente e incrementan su número, debido a la adición de agua, moco y CaCO3 (este último eleva el pH), así como al mezclado intensivo; posteriormente, en las porciones media y posterior del tracto digestivo, las poblaciones microbianas presentes degradan los materiales orgánicos en condiciones microaerofílicas, liberando nutrimentos tanto para los microorganismos como para la lombriz; una vez que se tienen los turrículos fuera de la lombriz, la actividad microbiana decrece por el cambio de las condiciones microaerofílicas o aerobias (Maboeta y Van Rensburg 2003; Suthar, 2012). Lo anterior se observó en Allolobophora molleri (Trigo y Lavelle, 1993), Amynthas corticis y A. gracilis (Barois, 1992). Brown (1995) indica que existe evidencia de que en el tracto digestivo de las lombrices hay substancias microbicidas y microbiostáticas, producidas por lombrices o microorganismos, donde las poblaciones con mayor capacidad de resistencia y adaptación predominan sobre las de menor capacidad. También se ha discutido el número de hongos y bacterias que fue mayor en los turrículos que en el tracto digestivo de la lombriz, debido a que pueden sobrevivir al proceso digestivo-enzimático (Toyota y Kimura, 1994). Heijnen y Marinissen (1995) señalan que las lombrices consumen microorganismos en forma selectiva, prefiriendo poblaciones introducidas en lugar de las autóctonas. En el caso de la proliferación de hongos, tanto en turrículos como en túneles, éstos disminuyeron (Stephens et al., 1993). En general, el número de hongos, bacterias y actinomicetos, decrece con respecto al tiempo ya que las lombrices reducen las poblaciones de estos grupos microbianos (Aira et al., 2007b; Vivas et al., 2009).
El tamaño de paja utilizado no provocó diferencias significativas entre tratamientos respecto a los microorganismos asociados al ciclo del carbono (Cuadro 4). Los microorganismos amilolíticos fueron significativamente diferentes en el tratamiento de paja molida con lombriz (PMCL) con respecto al que solo tenía paja molida (PM). En el tratamiento de paja picada con lombriz (PPCL) dichos microorganismos fueron menores que en el tratamiento con paja picada sin lombriz (PPSL). Esta tendencia cambio para los microorganismos celulolíticos, lipolíticos y ligninolíticos los tratamientos con lombriz (CL), tanto con PP y PM, se presentaron en mayor proporción que en los tratamientos sin lombriz (SL).
Cuadro 4 Número más probable (NMP) y de unidades formadoras de colonias (ufc) de microorganismos participantes en el ciclo del carbono 23, 46, 69, 92, 115 y 148 días después de iniciado el proceso de compostaje con y sin lombrices y dos tamaños de paja de avena (paja molida y paja picada), subproducto de la producción comercial del hongo Pleurotus ostreatus.

† Paja molida < 2mm; ‡ Paja picada < 4mm. Ufc medio gelificado. DSH (0.05)Amilolíticos = 0.9452; DSH (0.05)Celulolíticos = 1.0602; DSH (0.05)Lipolíticos = 1.1205; DSH (0.05)Ligninolíticos.
Los microorganismos amilolíticos presentaron un crecimiento mayor a los 69 días en los tratamientos con paja molida y picada con lombriz, mientras que en la paja picada sin lombriz su óptimo crecimiento fue a los 115 días, y en la paja molida sin lombriz a los 92 días (Cuadro 4). Las poblaciones de los cuatro tratamientos evaluados decrecieron a los 148 días. En el grupo microbiano celulolítico se observó una actividad máxima a los 46 días en todos los tratamientos y una disminución a los 69 días. Se observó un repunte de los organismos celulolíticos en los tratamientos con paja picada sin lombriz a los 115 días. Los microorganismos lipolíticos iniciaron con una población alta a los 23 días en los tratamientos PPCL: 155.1, PMCL: 70.4 y PPSL: 98.4, y sufrieron una caída considerable a los 46 días; PPCL: 87.8, PMCL: 25 y PPSL: 43.9, la tendencia se mantuvo hasta los 148 días de establecido el experimento con un máximo de ufc de los organismos lipolíticos a los 23 días, es probable que este comportamiento se deba a la mayor disponibilidad de compuestos lipídicos que son rápidamente aprovechados por los microorganismos. Barois et al. (1987) señalan que en el tracto digestivo de las lombrices predominan condiciones de microaerofílicas hasta anaerobias, las cuales pueden modificar el crecimiento de los microorganismos amilolíticos y celulolíticos, los cuales afectan la boitransformación del sustrato.
Las ufc de los organismos ligninolíticos (Cuadro 4) tuvieron su mayor actividad a los 69 días en los cuatro tratamientos. Los tratamientos con lombriz presentaron las mayores actividades para los microorganismos amilolíticos, celulolíticos, lipolíticos y ligninolíticos (Cuadro 4), lo que genera que haya una mayor disponobilidad de nutrientes en la vermicomposta que en la composta, debido al efecto degradador de las lombrices.
La cantidad de microorganismos relacionados con el ciclo del nitrógeno (Cuadro 5): proteolíticos, amonificantes, nitrificantes NO2 oxidantes y fijadores libres de nitrógeno, fue afectada por el tamaño de paja, PM tuvo diferencias con respecto a los tratamientos de PP. Los nitrificantes NH4 oxidantes, desnitrificantes y los tratamientos de PP tuvieron diferencias con los tratamientos de PM. En los tratamientos CL hubo más microorganismos proteolíticos, amonificantes, nitrificantes NH4 oxidantes en los dos tamaños de paja que en los tratamientos sin lombrices. En los tratamientos SL hubo mayor proporción de microorganismos nitrificantes NO2 oxidantes, desnitrificantes y para el tratamiento de PP en fijadores libres de nitrógeno.
Cuadro 5 Número más probable (NMP) y de unidades formadoras de colonias (ufc) de microorganismos participantes en el ciclo del nitrógeno a los 23, 46, 69, 92, 115 y 148 días después de iniciado el proceso de compostaje con y sin lombrices y dos tamaños de paja de avena (paja molida y paja picada), subproducto de la producción comercial del hongo Pleurotus ostreatus.

† paja molida < 2mm; ‡ paja picada < 4mm. Ufc: medio gelificado. DSH (0.05)Proteolíticos = 2.9241; DSH (0.05)Amonificantes = 1.8687; DSH (0.05)Nitrificantes - NH4oxidantes = 0.3981; DSH (0.05)Microorganismos nitrificantes NO2 oxidantes = 0.1205; DSH (0.05)Desnitrificantes = 3.2575; DSH (0.05)Fijadores libres de nitróeno = 0.9064.
Los microorganismos proteolíticos presentaron un máximo desarrollo a los 23 días de iniciado el experimento en los cuatro tratamientos evaluados (Cuadro 5). Al existir sustrato disponible para los microorganismos amonificantes, y de acuerdo con la secuencia de los procesos del ciclo del nitrógeno, se observó un incremento máximo de los desnitrificantes, lo cual desfavoreció la calidad del producto final obtenido. Se observó un aumento de los microorganismos fijadores de nitrógeno de vida libre a los 46 días en el tratamiento PMCL y PMSL, a los 23 días en el tratamiento PPCL y PPSL. El tratamiento de PMCL tuvo la mayor cantidadde ufc de microorganismos fijadores de nitrógeno de vida libre, el cual probablemente aportó más sustrato para los grupos de microorganismos que se presentaron en las siguientes fases en el proceso de biotransformación, como los amonificantes y los nitrificantes -NH4 oxidantes, con un óptimo en la dinámica poblacional a los 69 días en los cuatro tratamientos evaluados (Cuadro 5). Los nitrificantes -NO2 oxidantes presentaron una población máxima a los 92 días en el tratamiento de la paja molida sin lombrices y con lombrices a los 115 días, obteniendo mayor cantidad de nitritos, los cuales se biotransforman a nitratos por las bacterias nitritadoras, siendo esto favorable a los cultivos.
Barois et al. (1987) encontraron 2.7 veces más NH4 en turrículos de Pontoscolex corethrurus que en el suelo control, atribuyeron la alta excreción de nitrógeno por las lombrices a su eficiencia en la asimilación de carbono y a la estimulación de microorganismos amonificantes. Este amonio producido pudo favorecer la proliferación de nitrificantes, puesto que el amonio es usado como sustrato por estos microorganismos (Bohlen y Edwards, 1995), lo que concuerda con los resultados de los tratamientos con lombriz que obtuvieron los mayores resultados comparados con los tratamientos sin lombriz.
Actividad Enzimática del Ciclo del Carbono
La actividad de las enzimas amilasa, celulasa, lipasa e invertasa, tuvieron una caída en los últimos dos muestreos en los tratamientos con lombriz (Cuadro 6). La actividad de la amilasa se incrementó casi al triple a los 69 días en los tratamientos en que se adicionó lombriz (Tejada y González, 2009; Tejada y Benitez, 2011; Pramanilk et al., 2010; Kizilkaya y Hepsen, 2004; Kizilkaya, 2008). Los tratamientos sin lombriz presentaron un pequeño incremento en ese mismo lapso, sin embargo, continuó con una tasa similar hasta el día 148. La elevada actividad de los tratamientos con lombriz decreció rápidamente en el periodo de 69 a 92 días de incubación, para situarse en un nivel inferior durante el resto de los muestreos en comparación a los tratamientos sin lombriz. En los tratamientos con lombriz, la actividad media de la amilasa en los seis muestreos en la PM fue de 46.2 y en la PP fue de 47.7 mg de az. red. 10 g-1 de materia seca 24 h-1, más elevada que los tratamientos que no tuvieron lombriz, la PM de 39 y la PP de 41 mg de azúcares reductores 10 g-1 materia seca 24 h-1. Estos resultados implican un producto final de mejor calidad de las vermicompostas respecto a las compostas.
Cuadro 6 Actividad enzimática de las enzimas relacionados con el ciclo del carbono: amilasa, celulasa, lipasa e invertasa a 23, 46, 69, 92, 115 y 148 días de la incorporación de lombrices en vermicompost preparadas con dos tamaños de paja de avena, subproducto de la producción comercial del hongo Pleurotus ostreatus, comparadas con sus compostas correspondientes sin lombrices.
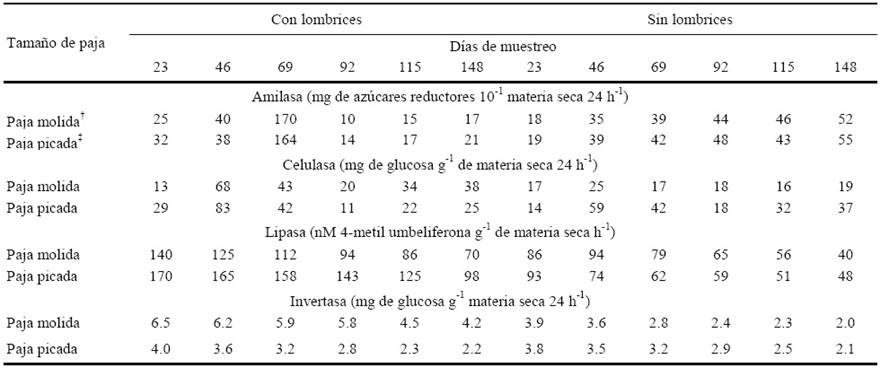
† Paja molida < 2mm; ‡ Paja picada < 4mm. Ufc: medio gelificado. DSH (0.05)Amilasa = 1.4614; DSH (0.05)Celulasa = 2.1364; DSH (0.05)Lipasa = 4.2054; DSH (0.05)Inversatasa = 0.2327.
La actividad de la celulasa presenta un máximo a los 46 días de haberse incorporado la lombriz en la PP y PM, en los tratamientos que no presentaron lombriz, la actividad de la celulasa fue menor (Cuadro 6). Aira et al. (2007a,b), encontraron un incremento en la actividad de la celulasa en un periodo corto y después un decaimiento en vermicomposta, lo cual influye en la disminución en general de las substancias húmicas. La media de la actividad celulasa en los tratamientos correspondientes a PM y PP entre los seis muestreos fue de 36 y 35.3 mg de glucosa g-1 de materia seca 24 h-1 respectivamente cuando se agregó lombriz, mientras que en los que no se agregó estas medias fueron de 18.7 y 33.7 mg de glucosa g-1 de materia seca 24 h-1 respectivamente (Cuadro 6), lo que representa una mayor degradación de celulosa. Kshattriya et al. (1992) observaron que el tamaño de paja influyó significativamente en la degradación de la celulosa, los tratamientos con paja picada tuvieron mayor actividad de la celulasa en comparación con los tratamientos con paja molida (Cuadro 6).
Actividad Enzimática del Ciclo del Nitrógeno
La proteasa presenta una actividad máxima a los 23 días y disminuye paulatinamente en el tiempo. Los tratamientos que mayor actividad de proteasa presentaron fueron los que tenían lombriz, el valor medio de todo el ciclo en la PM fue de 126.17 y en la PP de 102.5 en comparación con los tratamientos con los mismos tamaños de paja sin lombriz, 87.17 y 79.17 mg eq respectivamente. El tratamiento sin lombrices presentó menor Tirosina g-1 M. S. 24 h, 31 y 23% respectivamente, en comparación con el tratamiento con lombrices (Cuadro 7). Se observó que conforme aumentó el periodo de la composta y vermicomposta, disminuyó la proteasa, lo que concuerda con los resultados obtenidos por Perucci (1990 y 1992) y Nannipieri et al., (1990), obtieniéndose un producto final (vermicomposta) con mayor contenido de nitrógeno.
Cuadro 7 Actividad enzimática de proteasa, amidasa, ureasa y nitrogenasa a 23, 46, 69, 92, 115 y 148 días de la incorporación de lombrices en vermicomposta preparada con dos tamaños de paja de avena, subproducto de la producción comercial del hongo Pleurotus ostreatus, comparada con composta sin lombrices.

† Paja molida < 2mm; ‡ paja picada < 4mm. Ufc: medio gelificado. DSH (0.05)Proteasa = 3.9136; DSH (0.05)Amidasa = 0.0319; DSH (0.05)Ureasa = 0.0205; DSH (0.05)Nitrogenasa = 2.2727.
La amidasa presentó una disminución de actividad a partir de los 46 días, siendo más alta en los tratamientos con lombrices que en aquéllos sin lombrices, presentó mayor actividad a los 23 días en los cuatro tratamientos (Cuadro 7), concordando con los resultados de Frankenberger y Tabatabai (1981) en cuanto al comportamiento de actividad enzimática. La ureasa presentó una disminución gradual a partir de los 23 días, que fue el de máxima actividad para los cuatro tratamientos (Cuadro 7). La ureasa es muy estable en la vermicomposta (Fenn et al., 1992; Kizilkaya y Hepsen, 2004, 2007; Kizilkaya, 2008; Tejada y González, 2009; Tejada y Benitez, 2011), el comportamiento que tuvo donde se agregó lombriz se obtuvieron valores más altos, que en los tratamientos sin lombriz. La asociación entre lombrices y microorganismos favorece la descomposición de materia orgánica sobre la mineralización. La actividad enzimática de la nitrogenasa se observó en un óptimo a los 46 y 69 días después de inoculadas las lombrices en los tratamientos que así se plantearon, y una actividad mínima a los 92 días. Por lo tanto, para conservar una actividad óptima con respecto a los microorganismos fijadores de nitrógeno es conveniente la cosecha del vermicomposta a los 75 días después de su inoculación. La actividad de la proteasa disminuye fuertemente conforme las composta y vermicomposta tienen mayor tiempo de incubación (Cuadro 7) (Simek y Pizl, 1989; Domínguez y Edwards, 2004; Nagavallemma et al., 2004; Macci et al., 2010).
Actividad Enzimática de la Deshidrogenasa
Esta enzima se ha utilizado para calcular la actividad microbiana total en los procesos de mineralización (Frankenberger y Dick, 1983). La actividad de la deshidrogenasa en los procesos de vermicompostaje y compostaje evaluados, fue mayor en los tratamientos con lombriz, la paja molida de 1.48 y la paja picada de 1.50 que los tratamientos sin lombriz; paja molida de 1.24 y paja picada de 1.16 mg TPF g-1 materia seca 24 h-1, 16% menor en la paja molida y 22% menor en la paja picada (Cuadro 8). Lo anterior nos muestra la alta actividad de la deshidrogenasa en la vermicomposta debido a la actividad de la lombriz (Dick, 1997; Kizilkaya y Hepsen, 2004; Kizilkaya, 2008).
Cuadro 8 Actividad enzimática de deshidrogenasa, fostasa ácida, fosfatasa alcalina y arilsulfatasa a los 23, 46, 69, 92, 115 y 148 días de la incorporación de lombrices en vermicomposta preparada con dos tamaños de paja de avena subproducto de la producción comercial del hongo Pleurotus ostreatus, comparada con su composta correspondiente sin lombrices.

† Paja molida < 2mm; ‡ paja picada < 4mm. Ufc: medio gelificado. DSH (0.05)Deshidrogenasa = 0.0278; DSH (0.05)Fosfatasa ácida = 0.0194; DSH (0.05)Fostafasa alcalina = 0.0283; DSH (0.05)Arilsulfatasa = 0.0167.
Actividad Enzimática del Ciclo del Fósforo
Se observó que en los tratamientos con lombriz la actividad enzimática de la fosfatasa ácida se incrementó en 53% en la PM y en 22% en la PP con respecto a los tratamientos sin lombriz (Cuadro 8). En trabajos realizados por Satchell y Martin (1984) en los que se midió la actividad de la fosfatasa (ácida y alcalina) en vermicomposta con residuo de papel y cuatro especies de lombrices incluyendo Eisenia andrei, atribuyendo el incremento de la fosfatasa ácida y alcalina, a la actividad microbiana del tracto digestivo de la lombriz. En el caso de la fosfatasa alcalina, los valores medios de todo el ciclo en los tratamientos con lombriz fueron en PM de 2.00 y en PP de 1.79 y en los que no se agregó lombriz de 1.61 y 1.47 mg de p-nitrofenol g-1 materia seca h-1. En el caso de la fosfatasa alcalina se observó una mayor actividad en las vermicompostas que en las compostas, 20% mejor en los primeros con PM y 18% en la PP (Cuadro 8). La actividad de la fosfatasa alcalina fue mayor, comparada con la ácida en todos los tratamientos, y se atribuye a que las especies composteras como Eisenia andrei presentan glándulas calcíferas de Morren que excretan calcio (Edwards y Fletcher, 1988). Esto posiblemente sea el mecanismo por el cual se incremente el pH de los sustratos después de pasar por el tracto digestivo de la lombriz (Edwards y Fletcher, 1988).
Actividad Enzimática del Ciclo del Azufre
La actividad de la arilsufatasa, medida en las vermicompostas y compostas (Cuadro 8), mostró una tendencia a incrementarse en el último muestreo realizado a los 148 días, en los cuatro tratamientos evaluados. En los que se utilizó la PM con lombriz, la actividad media fue de 0.17 y sin lombriz 0.08, en la PP con lombriz de 0.14 y en la composta de 0.07. En el caso de la PM, la lombriz incrementó 53% y en la PP 50%, influyendo, además, el tamaño de la paja en dicha actividad. Según trabajos de Klose y Tabatabai (1999), esta enzima se ve influida por la biomasa microbiana y la lombriz empleada (Eisenia andrei), lo que concuerda con los resultados obtenidos.
Ácidos Húmicos
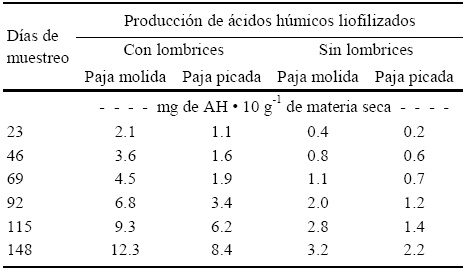
La producción de ácidos húmicos fue más alta en los tratamientos con paja molida (PM) con respecto a los de la paja picada (PP), tratamientos con lombrices (Cuadro 9). A los 148 días los tratamientos con mayor cantidad de mg de ácidos húmicos (AH) 10 g-1 de materia seca fueron los que contenían lombriz, y el mayor fue el de paja molida con lombrices (PMCL) con 12.3 mg de AH 10 g-1 de materia seca. Esto indica que los materiales molidos en las condiciones experimentales estudiadas tuvieron una mejor respuesta en la producción de AH liofilizados, debido a una más fácil degradación en comparación con la paja picada. En el caso de lostratamientos de PM y PP sin lombrices, la producción de los AH liofilizados fue más alta en el tratamiento con paja molida comparada con la paja picada en los diferentes periodos de muestreo durante el experimento, lo que beneficia la capacidad de intercambio catiónico en el suelo y mejora la actividad microbiológica del mismo.
Cuadro 9 Concentraciones de ácidos húmicos (AH) liofilizados a 23, 46, 69, 92, 115, y 148 días después de la incorporación de lombrices (Eisenia andrei) en vermicomposta preparada con paja molida (PM) y picada (PP) de avena, subproducto de la producción comercial de hongo Pleurotus ostreatus, comparado con su composta correspondiente sin lombrices.
Conclusiones
El tamaño de paja no influyó en las poblaciones microbianas, actividad enzimática y producción de ácidos húmicos liofilizados. Sin embargo, la incorporación de la lombriz Eisenia andrei (Bouché) tuvo influencia en las variables medidas que fueron: amilasa, celulasa, lipasa, invertasa, proteasa, amidasa, ureasa, nitrogenasa, fosfatasa ácida y alcalina, arilsulfatasa y deshidrogenasa,así como los microorganismos proteolíticos, amonificantes, nitrificantes, celulolíticos, amilolíticos, lipolíticos. Lo que muestra que la mineralización en el proceso de vermicompostaje se acelera respecto a una composta, lo que podría reflejarse en una mayor disponibilidad de nutrientes para los cultivos biofertilizados con vermicomposta.











 text new page (beta)
text new page (beta)


