Introducción
El fósforo (P) es un elemento esencial para la vida, siendo fundamental en el metabolismo de los organismos. Además de participar en innumerables rutas metabólicas, el P es un componente de las moléculas esenciales de la célula, tales como los fosfolípidos, ARN, ADN y del principal cofactor nucleotídico (ATP), requerido para la transferencia de energía y catálisis celular (White y Metcalf, 2007). En particular, las plantas y los microorganismos edáficos obtienen este elemento de la solución del suelo, principalmente de las formas inorgánicas más disponibles (ortofosfosfato PO4 3-), pero debido a su alta reactividad química y su demanda, su disponibilidad se reduce rápidamente. Cuando el ortofosfato no está disponible, es necesario adquirir el P de otras formas químicas, entre las cuáles, las formas orgánicas son la principal fuente alternativa. Los microorganismos pueden adquirirlo de formas orgánicas lábiles, como los ésteres de fosfato que son fácilmente hidrolizables, los cuales contienen P en su mayor estado de oxidación, +5 (Kononova y Nesmeyanova, 2002). Estos ésteres se caracterizan por tener uniones entre carbono-oxígeno-fósforo (C-O-P), los cuales son fáciles de romper. Así mismo, se sabe que algunas bacterias y hongos tienen la capacidad de utilizar como fuente de P algunos compuestos organofosforados con menor estado de valencia, +3 (White y Metcalf, 2007), principalmente los fosfonatos, los cuales se caracterizan por tener un enlace directo carbono-fósforo (C-P), pero se requiere de mayor energía para romper este enlace y por lo tanto, dejar disponible al P.
El presente trabajo es una revisión de la literatura sobre los procesos que determinan la dinámica del P en los ecosistemas terrestres, con principal énfasis en los sistemas oligotróficos y el papel de las bacterias en el control de la disponibilidad de este nutriente. Los temas abordados son la evolución del P en estos ecosistemas, los principales almacenes del P y las formas químicas en que se puede encontrar este nutriente. La última parte de esta revisión está dedicada a analizar la importancia de las bacterias en la mineralización de los ésteres de fosfato y de los fosfonatos, ya que puede representar la principal fuente de P disponible en los ecosistemas oligotróficos.
Evolución del Fósforo en los Ecosistemas Terrestres
En el suelo, los principales componentes de la materia orgánica son el Carbono (C), Nitrógeno (N), P y Azufre (S). El P es el nutriente que debe ser suministrado casi en su totalidad por el intemperismo del material parental, debido a que presenta un bajo retorno atmosférico (Walker y Syers, 1976). A consecuencia de esto, la principal fuente inicial del P son los minerales primarios, principalmente la apatita. El intemperismo de estos minerales suministra iones fosfato (H2PO4 - y HPO4 2-) a la solución del suelo (Cross y Schlesinger, 1995; Whalen y Sampedro, 2010) y posteriormente, las bacterias, hongos y plantas incorporan estos iones fosfato en su biomasa, iniciando con esto la ruta biológica del P (Cross y Schlesinger, 1995).
Walker y Syers (1976) propusieron un modelo que aún en la actualidad es ampliamente aceptado sobre la evolución del P en el suelo durante la pedogénesis. Este modelo sugiere que la disponibilidad y la oclusión de este nutriente depende de la edad del suelo. Por lo tanto, propone que en los diferentes estadios del suelo cambiará la proporción de las diferentes formas químicas del P. Por ejemplo, este modelo sugiere que para suelos jóvenes poco intemperizados, la proporción de P en minerales primarios (apatita) será alta en comparación con suelos viejos muy intemperizados, donde dominarán las fracciones de P orgánico (Po) y P inorgánico ocluido (Poc), reduciendo así su disponibilidad.
Generalmente, la concentración de iones fosfato en la solución del suelo es muy baja debido a su alta reactividad química. Estos iones pueden tener diferentes destinos y por lo tanto, formar parte de diferentes fracciones en el suelo: a) ser rápidamente asimilados por la biota, formando parte de la fracción de Po, una vez que retorna la materia orgánica al suelo, b) pueden reaccionar rápidamente quedando adsorbidos en la superficie de partículas órgano-minerales a través de fuerzas electrostáticas, la cual representa la fracción de P adsorbido (Pad) o c) precipitarse en minerales secundarios, con aluminio, hierro y calcio (Al, Fe, y Ca), lo que representaría al Poc.
En los ecosistemas donde el suministro de iones fosfato a partir de la fracción geoquímica no es suficiente para satisfacer los requerimientos de las plantas y microorganismos, el almacén orgánico puede representar la principal fuente de P disponible. Los residuos orgánicos de las plantas, animales y biomasa microbiana muerta contienen compuestos de fósforo orgánico que pueden ser hidrolizados y mineralizados por acción de enzimas (fosfomono-, fosfodi- y fosfotri-esterasas) de origen tanto microbiano, como vegetal. A este proceso se le conoce como mineralización bioquímica, debido a que se realiza extracelularmente. El producto de la mineralización bioquímica es la liberación de iones fosfato a la solución del suelo. Por lo que en los suelos intemperizados, la disponibilidad de P depende principalmente de la mineralización bioquímica (Walker y Syers, 1976; McGill y Cole, 1981; Cross y Schlesinger, 2001) y por lo tanto, está regulada por la actividad de los microorganismos que sintetizan las enzimas necesarias para llevar a cabo este proceso.
Formas Químicas del Fósforo
El P en el suelo puede encontrarse en diferentes formas químicas, cada una de las cuales juega un papel diferente y fundamental en el reciclado del P, influyendo además en la dinámica de otros nutrientes, tales como el C y el N (McGill y Cole, 1981; Lathja y Schlesinger, 1988; Cross y Schlesinger, 2001; Buckingham et al., 2010; Selmants y Hart, 2010). Se puede encontrar al P en compuestos inorgánicos y orgánicos que pueden ser desde iones en la solución del suelo hasta compuestos altamente estables (Negassa y Leinweber, 2009). El grado de estabilización depende de la complejidad de la molécula o el elemento de unión. De esta manera, los compuestos de Pi casi siempre se encuentran unidos a diferentes formas de Al, Fe y Ca, dependiendo del pH del suelo (Buckingham et al., 2010). Por su parte, los compuestos de Po están asociados a moléculas orgánicas que pueden variar en la complejidad del compuesto (Negassa y Leinweber, 2009; Buckingham et al., 2010).
En la dinámica del P en el suelo, se pueden identificar dos almacenes principales en los cuales se agrupan los compuestos orgánicos y los inorgánicos: a) el almacén biológico, representado por plantas, microorganismos y Po edáfico y b) el almacén geoquímico, representado por minerales primarios, secundarios, Pad y Poc (Walker y Syers, 1976; Johnson et al., 2003; Whalen y Sampedro, 2010). Sin embargo, ambos almacenes están fuertemente relacionados debido a que la acción de los mecanismos biológicos puede modificar el balance químico del suelo y éste a su vez, puede afectar los procesos biológicos. Por ejemplo, algunos microorganismos pueden sintetizar ácidos orgánicos con lo que se acidifica el suelo (en su proximidad) y se pueden liberar iones fosfato de las superficies de intercambio, aumentando la concentración de estos iones en la solución del suelo y por lo tanto, su disponibilidad (Coyne, 1999).
Una alta concentración de iones fosfato en la solución del suelo, está relacionada con una alta disponibilidad de P para la biota. Sin embargo, esta forma química del P es rápidamente ocluida por las partículas del suelo, lo cual limita su disponibilidad. El grado de estabilización funcional entre el P y las partículas del suelo ha sido ampliamente estudiado en diferentes ecosistemas que van desde desérticos (Cross y Schlesinger, 2001; Buckingham et al., 2010) hasta húmedos (Giardina et al., 2000; Tiessen et al., 1983).
En la mayoría de los estudios se pueden identificar tres niveles de estabilización del P, que va desde el P unido débilmente a las partículas del suelo (el cual es disponible), hasta el P que es prácticamente inaccesible para la biota debido a la complejidad de la unión. A estos grados, por simplicidad se les conoce como: a) lábil, b) moderadamente lábil y c) ocluido (Selmants y Hart, 2010). Para conocer cuáles son los procesos involucrados en la disponibilidad del P es necesario determinar en qué grado (lábil u ocluido) y en qué fracción (orgánica o inorgánica) se encuentra en el suelo.
El P en Ecosistemas Oligotróficos
Los ecosistemas oligotróficos son aquellos que presentan bajas concentraciones de algún nutriente y que a su vez no está disponible (Elser et al., 2005). Las relaciones estequiométricas de C:N:P se han utilizado como un indicador para saber si alguno de estos elementos es limitante. Por ejemplo, los valores promedio reportados de estos cocientes para suelo en sistemas pastoriles y forestales son 166:12:1 y 212:15:1, respectivamente (Cleveland y Liptzin, 2007).
En los suelos de los ecosistemas áridos se han reportado las concentraciones más bajas de P total (PT) (Cross y Schlesinger, 2001; Buckingham et al., 2010). Sin embargo, se ha observado un amplio rango de concentraciones en el mismo tipo de ecosistema (Figura 1). Por ejemplo, en una zona árida de Utah con vegetación de pastizales o matorrales y una precipitación media anual de 215 mm, la concentración de PT en el suelo oscila entre 500-1000 μg g-1; mientras que para una zona desértica de México con aproximadamente la misma precipitación (el valle de Cuatro Ciénegas), los pastizales presentan concentraciones más bajas que oscilan entre 70-90 μg g-1 y los suelos con matorrales presentan concentraciones de alrededor de 200 μg g-1.
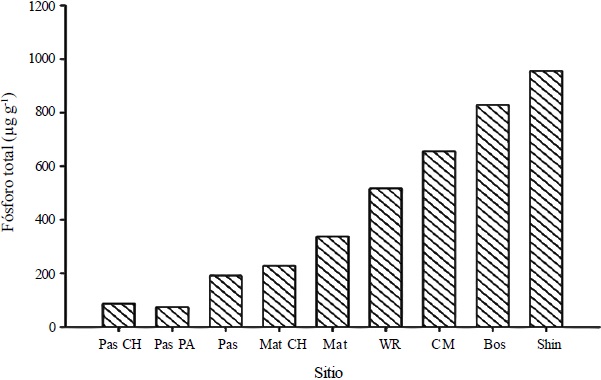
Los cuales corresponden a Pastizal y Matorral en Churince, Coahuila (Pas CH y Mat CH, respectivamente), Pastizal en Pozas Azules, Coahuila (Pas PA), Pastizal y Matorral (Pas y Mat, respectivamente, Cross y Schlesinger, 2001) y 4 sitios con cobertura vegetal que puede ser pastizal, matorral o juníperos, White Rim, Cedar Mesa, Bosque y Shinarump (WR, CM, Bos, Shin, respectivamente, Buckingham et al., 2010).
Figura 1 Concentración de fósforo total (PT, μg g-1) para 9 ecosistemas desérticos con diferentes coberturas vegetales.
A pesar de los estudios llevados a cabo en diferentes sistemas oligotróficos, ha sido difícil asignar un valor de concentración del PT a partir del cual considerar si un sistema es oligotrófico o no, debido a la complejidad de la dinámica de este nutriente. Por ejemplo, a pesar de las diferencias de PT entre algunos ecosistemas áridos, la mayoría de ellos se caracterizan por presentar una baja proporción de Po y una mayor dominancia de Pi (Figura 2). Los ecosistemas desérticos donde la fracción de Po es mayor o igual a la de Pisonraros, como es el caso de los pastizales de Churince en Cuatro Ciénegas, México (Pastizal CH, Figura 2), donde a pesar de su baja concentración de PT, presentan una alta proporción de Po (Figura 2).
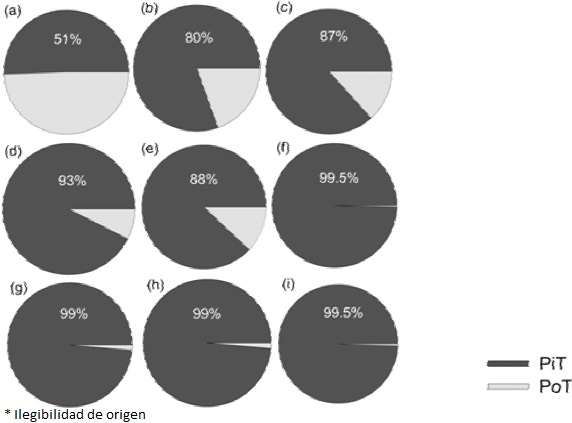
(a) Pastizal en Churince, Coahuila, (b) Pastizal en Pozas Azules, Coahuila (Montiel-González, (c) Pastizal (Cross y Schlesinger, 2001), (d) Matorral en Churince, Coahuila, (e) Matorral (Cross y Schlesinger, 2001) y 4 sitios con cobertura vegetal que puede ser pastizal, matorral y/o juníperos, (f) Shinarump, (g) White Rim, (h) Cedar Mesa y (i) Bosque (Buckingham et al., 2010).
Figura 2 Proporción de fósforo inorgánico total (PiT) y fósforo orgánico total (PoT) en el suelo de 9 ecosistemas desérticos con diferente cobertura vegetal.
Los patrones de fraccionamiento secuencial de P muestran una marcada diferencia entre sitios. Por ejemplo, en los suelos que presentan una mayor concentración de PT (Buckingham et al., 2010; Figura 3 f-i) dominan las fracciones de Pi ocluido (extraídas con HCl y H2SO4), las cuales son prácticamente inaccesibles para la biota. Sin embargo, en los pastizales y matorrales de Cuatro Ciénegas, donde la concentración de PT es baja, las fracciones de Pi y Po lábil y moderadamente lábil (extraídas con NaHCO3 y NaOH) pueden llegar a representar en algunos casos hasta el 15 % del valor total (Figura 3 a, b, d). Además, en este mismo sitio, la fracción de Po extraída con HCl que es una de las más recalcitrantes, también puede representar una fuente de P para la biota. A pesar de que este P no está en la fracción más disponible, puede ser accesible para la biota mediante la mineralización bioquímica. Lo cual no sucede con el Poc (extraído con HCl), el cual está formado por compuestos muy estables.
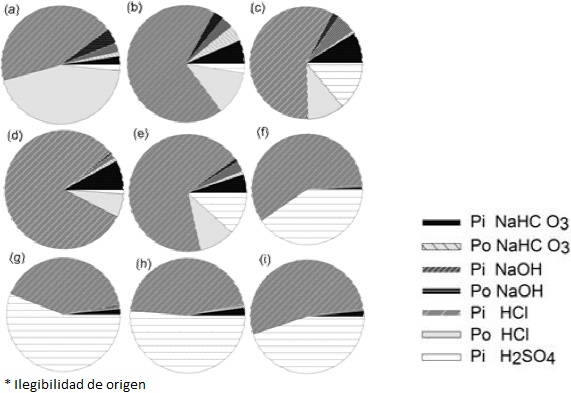
(a) Pastizal en Churince, Coahuila, (b) Pastizal en Pozas Azules, Coahuila, (c) Pastizal (Cross y Schlesinger, 2001), (d) Matorral en Churince, Coahuila, (e) Matorral (Cross y Schlesinger, 2001) y 4 sitios con cobertura vegetal que puede ser pastizal, matorral o juníperos, (f) Shinarump, (g) White Rim, (h) Cedar Mesa y (i) Bosque ( Buckingham et al., 2010).
Figura 3 Fraccionamiento secuencial de P en el suelo realizado en 9 ecosistemas desérticos con cobertura vegetal distinta.
En ecosistemas con características similares a las del valle de Cuatro Ciénegas (Po ≥ Pi), la mineralización del P es fundamental por la disponibilidad para las plantas y los microorganismos. En estos casos, la disponibilidad de P depende casi exclusivamente de la mineralización de las formas orgánicas y la rápida adquisición de las formas inorgánicas por la biota, como lo sugiere el modelo de Walker y Syers (1976).
Compuestos Organofosforados y su Mineralización
Entre los compuestos organofosforados que se conocen, los ésteres de fosfato son los más abundantes en la biósfera, por lo que han sido los más ampliamente estudiados. Sin embargo, la deficiencia de P en sistemas oligotróficos ha permitido estudiar otros compuestos organofosforados, tales como los fosfonatos que pueden representar una fuente alternativa de P (Clark et al., 1998; Kolowith, 2001).
La liberación del P de estos compuestos orgánicos debe ser mediante exoenzimas (fosfatasas, fosfonatasas y C-P liasas). Los genes codificantes de estas enzimas se cree que están mediados casi exclusivamente por el regulón pho (Quinn et al., 2007). Dentro de este regulón, se encuentran los genes específicos de lasfosfatasas mediados por el operón pho y los genes para las otras enzimas están mediados por el operón phn (Wackett et al., 1987; Metcalf y Wanner, 1991).
Ésteres de fosfato. En la biósfera, el P se encuentra principalmente en su mayor estado de oxidación (+5), como el ortofosfato inorgánico (PO4-), y los ésteres de ácido fosfórico (Quinn et al., 2007). Estas formas químicas de Po generalmente consisten en fosfomono ésteres de inositol, fosfolípidos y ácidos nucleicos que derivan de plantas y microorganismos (Figura 4) (Dao, 2011).

Figura 4 Compuestos orgánicos en donde el P (fósforo) presenta su mayor estado de valencia, +5 (Modificado de White y Metcalf, 2007).
Debido a que las plantas y microorganismos adquieren el P como Pi y no como Po, la disponibilidad del P depende de la mineralización de los ésteres de fosfato. Estos compuestos son mineralizados por la acción de enzimas hidrolíticas extracelulares, principalmente fosfatasas (Dinkelaker y Marschner, 1992). En el suelo, la mayor actividad de mineralización de Po ocurre en la rizósfera, ya que tanto las raíces de las plantas (López- Gutíerrez et al., 2004), como los microorganismos (Quan et al., 2003; Dao y Hoang, 2008) liberan fosfohidrolasas extracelulares (Ezawa et al., 2005).
Las raíces de las plantas y los hongos producen fosfatasas ácidas, mientras que las bacterias pueden producir fosfatasas alcalinas (Tarafdar y Marschner, 1994). La alta diversidad de enzimas extracelulares, garantiza el éxito en la adquisición del recurso (Pi) en los ecosistemas. Una vez que se libera el Pi en la solución del suelo por la acción de fosfohidrolasas extracelulares, es necesario introducirlo a la célula por mecanismos pasivos o activos a través de la membrana (Dao, 2011). Existen muchos transportadores de fosfato ampliamente estudiados presentes en células de raíces de plantas y en microorganismos (Kulaev y Kulakovskaya, 2000). Los transportadores son proteínas componentes de las membranas celulares, con la capacidad de absorber al fosfato inorgánico y a moléculas estructuralmente simples (Dao, 2011).
Fosfonatos. En las últimas décadas ha crecido el interés por el estudio y entendimiento de la bioquímica del P cuando se encuentra en un menor estado de valencia, +3 (ej. Fosfonato, Aminoetilfosfonato, Fosfito; Figura 5), principalmente a partir del trabajo de Horiguchi y Kandatsu (1959), el cuál describió la presencia de fosfonatos en organismos vivos.
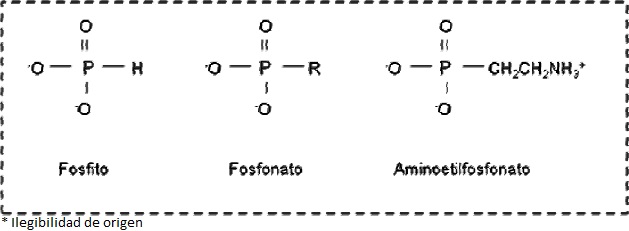
Figura 5 Compuestos orgánicos en donde el P presenta un estado de valencia de +3 (Modificado de White y Metcalf, 2007)
Los fosfonatos son una clase de compuestos organofosforados que contienen un enlace directo carbono-fósforo (C-P), en lugar del enlace éster más común C-O-P (Martínez et al., 2010; Sviridov et al., 2012). Debido a la estabilidad del enlace, estos compuestos son altamente resistentes a la biodegradación por factores químicos, térmicos, fotolíticos y enzimáticos (Hayes et al., 2000; Sviridov et al., 2012). Entre los fosfonatos conocidos se incluyen compuestos biogénicos y xenobióticos (Ternan et al., 2000), ambos de gran importancia en los ecosistemas. Los organofosfonatos sintéticos son ampliamente utilizados en la industria química como detergentes, anticongelantes y pesticidas, entre otros (Hayes et al., 2000). Por otro lado, dentro de los organofosfonatos naturales se incluyen una gran variedad de antibióticos de origen microbiano (Hayes et al., 2000; White y Metcalf, 2007).
Algunos ejemplos de bacterias con la habilidad de biosintetizar fosfonatos son Actinobacteria (Quinn et al., 2007), Pseudomonas y Bacillus, por lo que se ha sugerido que muchos microorganismos hayan adquirido esta habilidad durante su evolución (Kugler et al., 1990). Entre los fosfonatos de origen natural, el más común es el aminoetilfosfonato (AEPn), el cual se ha encontrado formando parte de fosfonolípidos, polisacáridos y glicoproteínas en numerosos procariontes y eucariontes (Horiguchi y Kandatsu, 1959; White y Metcalf, 2007). Una vez que los organofosfonatos entran al suelo, independientemente de la vía, se ha encontrado que la actividad microbiana es casi exclusivamente la única responsable de su degradación.
La habilidad que tienen algunas bacterias para utilizar a los fosfonatos como fuente de P presume la presencia de enzimas necesarias para romper el enlace C-P. Actualmente, se conocen dos estrategias para este fin: a) una que involucra hidrolasas con alta afinidad por el sustrato y b) otra basada en la acción menos específica de C-P liasa (Kononova y Nesmeyanova, 2002). Hasta hoy se conocen 3 diferentes hidrolasas que pueden ser las encargadas de romper el enlace C-P: fosfonoacetaldehído hidrolasa conocida como fosfonatasa (Morais et al., 2004), fosfonoacetato hidrolasa y fosfonopiruvato hidrolasa (Ternan et al., 2000).
El 2-aminoetilfosfonato (2AEP) es el organofosfonato biogénico más abundante en la naturaleza y se ha especulado que las bacterias pueden tomar y degradar esta molécula. Esta hipótesis surge de los trabajos realizados por Rosenberg y La Nauze (1967), quienes describieron el transporte de 2AEP en Bacillus cereus. Posteriormente, Lacoste et al. (1976) describieron el transporte de 2AEP en Pseudomona aeruginosa A237. Estos trabajos fueron los primeros en arrojar evidencia de que la degradación de 2AEP se lleva a cabo en una ruta de dos pasos (Figura 6).
La primera reacción en la ruta involucra la transaminación del 2AEP a 2-fosfonoacetaldehído (PAA) (OHC-CH2-PO3H2). La enzima responsable de catalizar esta reacción es conocida como la 2AEP- piruvato aminotransferasa, la cual tiene alta afinidad por los sustratos 2AEP y ácido pirúvico. En el segundo paso de la ruta degradativa, el PAA es dividido hidrolíticamente a fosfato inorgánico y acetaldehído. La enzima que cataliza esta reacción es la fosfonoacetaldehído hidrolasa comúnmente conocida como fosfonatasa, la cual fue aislada de B. cereus (La Nauze et al., 1970) y P. aeruginosa (Dumora et al., 1989). Fue gracias al entendimiento de esta ruta que se pudo aclarar el mecanismo por el cual se puede dividir o romper el enlace C-P (La Nauze et al., 1977; Olsen et al., 1988; Olsen et al., 1992).
Hasta hoy, existen pocos trabajos que evalúen la importancia cuantitativa de los fosfonatos naturales como fuente de P en la biósfera terrestre, por lo que aún no está bien comprendida. Algunos de estos trabajos se han hecho en ecosistemas acuáticos y se sabe que el P contenido en los fosfonatos representa más del 25% del P orgánico disuelto de alto peso molecular en las columnas de agua del pacífico (Clark et al., 1998) y otros océanos (Kolowith et al., 2001). Además, en los organismos en donde se han encontrado es claro que los fosfonatos desempeñan un papel fundamental debido a su abundancia. Por ejemplo, algunas especies de anémonas marinas tienen más del 50% de su P total en forma de fosfonatos (Quin, 1965), en Tetrahymena el 30% de sus membranas lipídicas están en forma de fosfonolípidos (Hilderbrand, 1983). Aunque los fosfonolípidos también se han encontrado en vertebrados (Hilderbrand, 1983), son más abundantes en las formas de vida más sencillas.
De esta manera, los compuestos C-P pueden representar un recurso clave, tanto en los ecosistemas marinos, como en los terrestres, en donde la productividad puede estar limitada por la disponibilidad de P y de esta manera, podrían jugar un papel importante en el ciclo global del P (Benítez-Nelson y O’Neill, 2004; Dyhrman et al., 2006). Es evidente que los organofosfonatos pueden representar una fuente alternativa de P, sobre todo en ecosistemas terrestres deficientes de este nutriente. Sin embargo, para conocer el papel real que pueden desempeñar los fosfonatos en el suelo, es necesario realizar estudios enfocados a identificar y cuantificar la actividad de las enzimas (fosfonatasas), así como los mecanismos que pudieran limitar o favorecer esta actividad. Así mismo, es importante conocer a los grupos bacterianos en los que está presente el regulón pho, los cuales pueden proveer claves sobre los factores que han permitido su evolución y su expresión.
Estrategias Bacterianas para la Adquisición y el Uso de P en Ambientes Oligotróficos
Para poder vivir en ambientes oligotróficos, las bacterias han desarrollado diferentes estrategias para la adquisición, inmovilización, reemplazo y uso eficiente del P (Adams y Wall, 2000; Tetu et al., 2009). El Pi es transportado al interior de la célula bacteriana mediante proteínas de membrana, conocidas como transportadores específicos de fosfatos, las cuales están codificadas en el operón pst (Figura 7). Este operón comprende diferentes subunidades codificadas por distintos genes (Hirota, et al. 2010).

pho: operón que codifica a los genes de fosfatasas. phn: operón que codifica a los genes de fosfonatasas y C-P liasas. Pi: fósforo inorgánico. Pn: fosfonato. APM: Alto peso molecular. phn CDE: genes codificantes para transportadores de membrana de fosfonatos de bajo peso molecular (BPM). Operón pst: conjunto de genes que codifican a los transportadores de membrana de Pi.
Figura 7 Estrategias bacterianas para la utilización de P (Adaptado de Hirota et al. 2010).
Debido a que en la membrana bacteriana únicamente existen transportadores de Pi y de fosfonatos de bajo peso molecular (Pn BPM) codificados por los genes phn CDE (Figura 7), los organofosfatos y los fosfonatos de alto peso molecular deben ser mineralizados por reacciones catalizadas por enzimas de origen bacteriano (Wackett et al., 1987). Las enzimas para degradar a los ésteres de fosfato, están codificadas en el conjunto de genes conocido como pho, mientras que las enzimas para degradar fosfonatos están codificadas en el conjunto genético conocido como phn, actualmente formado por 17 genes (Figura 7; Wackett et al., 1987; Metcalf y Wanner, 1991).
No todos los grupos bacterianos de ecosistemas oligotróficos presentan la habilidad para mineralizar diferentes formas orgánicas de P. Por lo que a continuación se describen las estrategias que utilizan las bacterias tanto edáficas como acuáticas para satisfacer las demandas biológicas del P.
Inmovilización. La inmovilización es la adquisición de nutrientes por la comunidad de microorganismos. Existen bacterias como los Gemmatimonadetes con la capacidad metabólica para remover el Pi de la solución del suelo y acumularlo dentro de la célula en forma de polifosfatos (García-Martín et al., 2006; Fukushima et al., 2010). El polifosfato es un polímero lineal que puede contener hasta cientos de fragmentos de fosfatos unidos por enlaces de alta energía conocidos como fosfoanhidridos (Kulaev y Kulakovskaya, 2000). Los polifosfatos le confieren al organismo un aumento en la resistencia a las fluctuaciones ambientales, ayudan en la regulación de la actividad enzimática y son fuente de fosfato, con lo cual se satisfacen las demandas energéticas internas (Dao, 2011). Si el P disponible en el suelo es muy limitado, los microorganismos pueden inmovilizar en su biomasa entre el 20-50% del Po contenido en las superficie del suelo (Walbridge, 1991).
Adquisición. Algunas bacterias representantes de grupos como Firmicutes y Gamma proteobacterias tienen la capacidad de sintetizar ácidos orgánicos que se utilizan para desplazar a los iones fosfato de los sitios de intercambio y ponerlos disponibles (Mehment et al., 2010).
Reemplazo. Tanto en bacterias terrestres (Dörmann y Benning, 2002; Alcaraz et al., 2008) como en acuáticas (Van Mooy et al., 2006, 2009) se ha observado que reemplazan al P por otros nutrientes en moléculas orgánicas esenciales, tales como fosfolípidos por sulfo-, galacto-, o fosfonolípidos con el objetivo de mantener la funcionalidad de la membrana.
Uso eficiente. Una de las estrategias bacterianas más sorprendentes es la capacidad de la reducción del genoma. Por ejemplo, la síntesis de ADN genómico puede representar más de la mitad de la demanda de P en picocianobacterias (Bertilsson et al., 2003). Prochlorococcus, una picocianobacteria que domina en ambientes oligotróficos en P, posee el genoma más pequeño de todos los organismos fotosintéticos reportados (Bertilsson et al., 2003). Otro ejemplo es el género Bacillus, donde Bacillus coahuilensis (aislado de Cuatro Ciénegas) tiene el genoma más pequeño de todas las especies de Bacillus hasta ahora secuenciados (3640 Mpb) (Alcaraz et al., 2008; Cerritos et al., 2008).
Conclusiones
-. En la mayoría de los ecosistemas, se había considerado que el fósforo (P) contenido en moléculas orgánicas complejas (fosfonatos) era inaccesible para la biota, con lo cual se limitaba la productividad en los ecosistemas con poca disponibilidad de P (oligotróficos). Sin embargo, actualmente se ha reconocido la importancia de las bacterias en liberar el P contenido en estas moléculas.
-. - Para que la comunidad bacteriana sea capaz de sintetizar las diferentes enzimas que mineralizan estos compuestos orgánicos, es necesaria la presencia de una maquinaria genética capaz de sintetizar dichas enzimas. En ecosistemas oligotróficos, las comunidades bacterianas pueden estar formadas por linajes filogenéticamente distantes, con una alta diversidad de metabolismos para utilizar diferentes sustratos de P, asociados a genomas funcional y estructuralmente distintos. Sin embargo, no todos los grupos bacterianos tienen esta maquinaria genética, por lo cual han desarrollado una diversidad de estrategias para optimizar la adquisición y el uso del P. Este conjunto de estrategias ha permitido la permanencia y evolución de las bacterias, a pesar de la poca disponibilidad del P.
-. Para poder entender los procesos que explican la disponibilidad del P en el suelo en estos ecosistemas es necesario realizar estudios integrales que consideren herramientas bioquímicas, biogeoquímicas y moleculares. Aún faltan estudios con análisis integrados que permitan elucidar el movimiento del P en los ecosistemas y como éste puede ser controlado por los microorganismos del suelo. Con estos estudios integrados será posible entender como se mantiene la vida en sistemas fuertemente limitados por el P, como es el caso de varios desiertos en el planeta.











 text new page (beta)
text new page (beta)



