Introducción
Los bosques de montaña se caracterizan por su biodiversidad y constituyen el 26% de la superficie forestal mundial (CDS, 2008). América Latina y el Caribe, junto con África, están perdiendo a un ritmo acelerado la biodiversidad y los hábitats que se encuentran en sus bosques de montaña (FAO, 2007), como consecuencia de la degradación provocada por la deforestación, el pastoreo extensivo, los incendios y el cambio de uso del suelo (Montaño-Arias et al., 2001; FAO, 2007). En 2004, la deforestación y el cambio de uso del suelo aportaron el 18% de las emisiones mundiales de gases de efecto invernadero, lo que incidió en el cambio climático a nivel mundial (Stern, 2006). Razón por la cual es urgente el restablecimiento de los bosques degradados y la ordenación forestal sostenible. Un estudio reciente apunta que la retención de carbono mediante el mantenimiento y el restablecimiento de los bosques puede ser más eficaz para reducir las emisiones de dióxido de carbono que la utilización de las mismas tierras para producir biocombustible con el propósito de sustituir los combustibles fósiles (Righelato y Spracklen, 2007).
El uso agrícola de los suelos del Parque Nacional Nevado de Toluca (PNNT) que realizan los campesinos, en él asentados, conlleva prácticas de cultivo como el barbecho y la aplicación creciente de fertilizantes, fungicidas y herbicidas (Tan, 2000). Estas prácticas modifican propiedades del suelo, como la estabilidad de los agregados y el contenido de materia orgánica; lo cual influye, a su vez, en el tamaño, composición y actividad de la biomasa microbiana (Elliot et al., 1996; Rath et al., 1998; Jones y Ananyeva, 2001; Genxu et al., 2004; Mc Kinley et al., 2005; Geissen et al., 2006) y sobre la fertilidad y productividad del suelo (Smith y Paul, 1990; Doran y Parkin, 1994; Webster et al., 2001; Andrew et al., 2004); no obstante, estudios relacionados con la modificación de la biomasa microbiana en suelos de montaña con diferentes usos, ubicados a una latitud mayor que tres mil metros, son escasos.
El objetivo de este trabajo fue: conocer el comportamiento de la biomasa microbiana y la mineralización del carbono en suelos adyacentes al Parque Nacional Nevado de Toluca, con diferentes usos (bosque, pradera y cultivo) y con adición de diferentes agroquímicos, en condiciones de laboratorio.
Materiales y métodos
El área de estudio se localizó en la ladera norte del Parque Nacional Nevado de Toluca, en la provincia fisiográfica Sistema Volcánico Transversal (18° 59’ y 19° 13’ N, 99° 37’ y 99° 58’ O). El clima predominante es templado, subhúmedo con lluvias en verano C (w2) (w) b (i”), con una temperatura promedio que oscila entre los 13.5 y 30.1 °C. La precipitación total anual es de 800 mm. Los suelos pertenecen a las subunidades Regosol éutrico y Andosol úmbrico y háplico (Vargas, 1997; Martínez y Vicencio, 1998). Dos comunidades fueron seleccionadas para realizar la colecta de las muestras de suelo. Se tomó como base de selección la altitud de las mismas, con el fin de captar las variaciones de la biomasa microbiana. La primer comunidad se llama Rosa Morada y la segunda Dilatada, ubicadas a una altitud de 3000 y 3290 m, respectivamente. Las muestras de suelo se tomaron, por triplicado a una profundidad de 0-10 cm, en suelos con diferente uso: cultivado con maíz, bosque [bajo la copa de oyamel (Abies religiosa)] y pradera natural. Las muestras de suelo de pradera y cultivo se tomaron en zig-zag con una pala recta, cada muestra compuesta se formó con 15 submuestras. En el caso del suelo de bosque se realizaron los siguientes pasos: primero, se identificaron tres árboles con altura y grosor de tronco semejantes, que no estuvieran alejados entre sí más de 100 m; una vez identificados, con una pala recta se tomaron cuatro submuestras de suelo a un metro de distancia de cada árbol seleccionado, en direcciones perpendiculares orientadas hacia los puntos cardinales; finalmente, las submuestras de cada uno de los árboles se mezclaron para obtener una muestra compuesta (Reyes et al., 2003). Las muestras se secaron a la sombra y a temperatura ambiente (18±2 °C); una vez secas, se molieron con un mazo de madera, se homogeneizaron y se hicieron pasar por un tamiz de acero inoxidable (malla 10) con abertura de 2 mm de diámetro y se almacenaron en bolsas de plástico a temperatura ambiente (±18 °C) en oscuridad, hasta su caracterización.
El contenido de humedad se determinó de acuerdo a la NOM-021-RECNAT-2000 (SEMARNAT, 2002) y la capacidad de retención de agua (CRA) como lo establece Reyes et al. (2003), se calcularon por gravimetría. El contenido de nitrógeno total se determinó por el método de Kjeldahl (Bremner, 1996) y el de materia orgánica del suelo (MOS), con el método de Walkley y Black modificado (Nelson y Sommers, 1996).
Determinación de la Respiración Basal
Para estimar la respiración basal se determinó la mineralización del carbono (C), se pesaron porciones de 30 g de cada una de las muestras y se colocaron en frascos transparentes de 100 ml, se les agregó agua destilada para alcanzar el 40% de su CRA y se preincubaron por 7 días a temperatura ambiente (18±2 °C). Al término de la preincubación, se aplicaron los siguientes tratamientos, por triplicado: sin aplicación, sulfato de amonio (585.36 kg ha-1), urea (250 kg ha-1) 2, 4-D amina (marca Dow Agrosciences: 1 L ha-1) y captan (50 PH marca Bayer: 2 kg ha-1). Cada uno de los frascos se colocó dentro de un tarro de vidrio ámbar, con capacidad de 1 L, dentro del cual se depositaron, en forma previa, 10 mL de agua y un frasco gotero de 50 mL con 20 mL de NaOH 1 N. Los tarros se cerraron herméticamente y se incubaron a temperatura ambiente (18±2 °C), en obscuridad durante 56 días. Para evitar anaerobiosis, los frascos se destaparon durante 10 min cada tercer día.
Al concluir el periodo de incubación se tomaron tres alícuotas de 5 mL de NaOH 1 N, de cada uno de los frascos gotero, previamente incubados, incluyendo los blancos, y se transfirieron a matraces Erlenmeyer de 125 mL. Con agua destilada se ajustó el volumen a 50 mL, aproximadamente, y se tituló con HCl 0.01N utilizando fenolftaleína como indicador (Jenkinson y Powlson, 1976). La cantidad de CO2 producido se obtuvo con la fórmula de Stotzky (1965). Para obtener la tasa de mineralización, el total de C-CO2 acumulado se dividió entre los 56 días de incubación transcurridos.
Determinación de la Biomasa Microbiana
Tres submuestras de 20 g de cada sitio y tratamiento se extrajeron con 80 mL de K2SO4 0.5 M (suelo no fumigado). Tres submuestras de 20 g de suelo se fumigaron por 30 min con cloroformo libre de etanol en la oscuridad a 22 °C y extraído con 80 mL de K2SO4 0.5 M (Müller et al., 1992). La biomasa microbiana (carbono biomasa microbiana y nitrógeno biomasa microbiana) se determinó en los extractos de suelos (Jenkinson y Powlson, 1976), fumigados y no fumigados (Müller et al., 1992; Joergensen, 1995). La diferencia entre las concentraciones de C orgánico cuantificados en los extractos de un mismo suelo, fumigado y no fumigado, multiplicada por 2.64 permitió calcular el CBM (Vance et al., 1987); para obtener el NBM se multiplicó la diferencia del N reactivo a la ninhidrina en un mismo suelo, fumigado y no fumigado, por 4.6 (Ocio et al., 1991).
La concentración de carbono orgánico se determinó, por triplicado, en los extractos de los distintos tratamientos, fumigados y no fumigados, como lo establecen Vance et al. (1987) y Müller et al. (1992). Asimismo, la concentración de nitrógeno reactivo a ninhidrina en los extractos de suelos, fumigados y no fumigados, se obtuvo con el método propuesto por Joergensen y Brookes (1990), Carter (1991) y Ocio et al. (1991).
Los datos obtenidos fueron sometidos a un análisis de varianza, mediante el paquete estadístico STATGRAPHICS® plus (1995). Se empleó la prueba de comparación del Método de la mínima diferencia significativa (LSD) para evaluar la diferencia entre las medias de los tratamientos.
Resultados y discusión
Capacidad de Retención de Agua, Materia Orgánica y Nitrógeno de los Suelos
Los suelos con cultivo de maíz presentaron los valores significativamente más bajos (P < 0.05), tanto en su capacidad para retener agua (CRA), como en su proporción de N y MOS (Cuadro 1) en comparación a los otros usos de suelo. La diferencia en el porcentaje de MOS fue 2.3 veces menor en los suelos bajo cultivo, en comparación con los suelos de bosque. En los suelos de pradera se encontró que los contenidos de MOS y N estaban significativamente disminuidos, en comparación con los suelos de bosque; sin embargo, según los criterios de SEMARNAT (2002) el contenido de MO en ambos suelos puede considerarse como muy alto. Wang et al. (2004), mencionan que después de varios años de cultivo, la cantidad de MOS disminuye. La conversión de suelos de bosque a suelos de cultivo conduce a una reducción del contenido de MOS (Mann, 1986; Reyes et al., 2002), ya que, la labranza afecta el tamaño de los reservorios de MOS (Nissen y Wander, 2003).

† Cada valor es el promedio de nueve determinaciones. Valores en la misma columna con letras iguales son estadísticamente semejantes (P < 0.05).
Cuadro 1. Valores promedio† de características fisicoquímicas de suelos con diferentes usos del Parque Nacional Nevado de Toluca, México.
En el caso del N, en este estudio la concentración fue estadísticamente diferente (P < 0.05) entre los suelos con diferentes usos (valores promedio entre 0.29 y 0.55 %). El contenido de nitrógeno total (N) se encontró significativamente disminuido en el suelo de cultivo en comparación con el suelo de pradera y bosque, el resultado es congruente con el hallazgo de Yang et al. (2008), quienes indican que existen pérdidas de nitrógeno cuando el suelo de bosque de montaña es destinado a diferentes usos.
Carbono Biomasa Microbiana
La proporción de carbono biomasa microbiana (CBM) en los suelos de bosque fue significativamente mayor (P < 0.05) con respecto a los otros usos de suelo (Figura 1). Esta diferencia esta relacionada con el contenido de MOS (r = 0.22), como lo menciona Tan (2000). Asimismo, en la Figura 1 se observa que el contenido promedio de CBM en suelos de pradera es mayor al encontrado en los suelos con cultivo. Lo anterior se debe a que las poblaciones microbianas y su actividad son mayores en suelos no labrados que en suelos con agricultura convencional (Smith y Conen, 2004). Por otra parte, la baja concentración de CBM en los suelos de cultivo puede atribuirse a un decremento en la disponibilidad de carbono y nitrógeno en la MOS, como consecuencia de la acelerada mineralización de la misma y la lixiviación de nutrientes minerales, procesos que son favorecidos por la destrucción de los agregados del suelo (Gregorich et al., 1997; Brady y Weil, 1999; Chaplot et al., 2005).
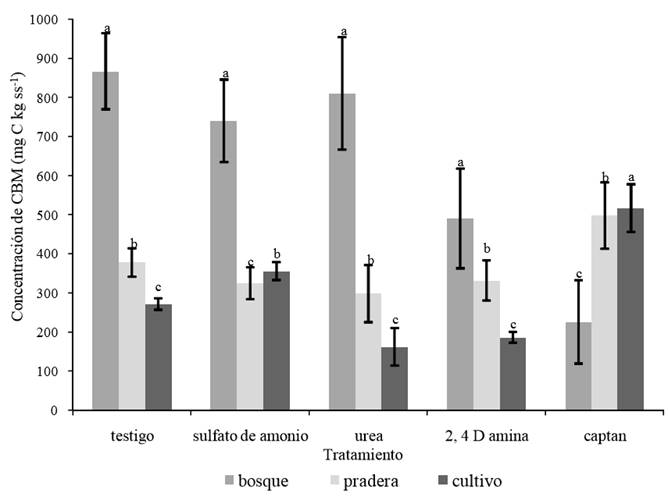
Las letras diferentes en la misma clase de agregados indican diferencias significativas con P < 0.05.
Figura 1. Concentración de carbono biomasa microbiana (CBM) en suelos con diferentes usos del Parque Nacional Nevado de Toluca, bajo diferentes tratamientos (n = 9), incubados 56 días a 18 °C±2.
Cuando se aplicó sulfato de amonio y urea se observó, en general, una disminución del CBM (Figura 1). Lo anterior se debe a que existe una modificación de la comunidad microbiana, lo que concuerda con las observaciones de Böhme et al. (2005), quienes reportaron efectos negativos de los fertilizantes nitrogenados. En cambio, cuando se adicionaron biocidas se tuvieron efectos dispares (Figura 1). En los tres suelos con diferentes usos, el tratamiento 2, 4-D amina provocó un decremento del CBM en comparación con los suelos sin aplicación, lo anterior puede deberse al efecto tóxico de este agroquímico sobre los microorganismos del suelo, al respecto Joshi y Deep (2008), señalaron que este herbicida interfiere en la densidad poblacional bacteriana y fúngica. En el tratamiento con captan se observó un incremento significativo (P < 0.05) del CBM en los suelos de pradera y bajo cultivo, y una disminución del 75% en suelos de bosque. Siendo los hongos la población predominante en suelos de bosque, lo anterior puede ser consecuencia del efecto fungicida del captan sobre la comunidad microbiana, su CBM se ve notablemente disminuido (Vyas, 1988).
Nitrógeno Biomasa Microbiana
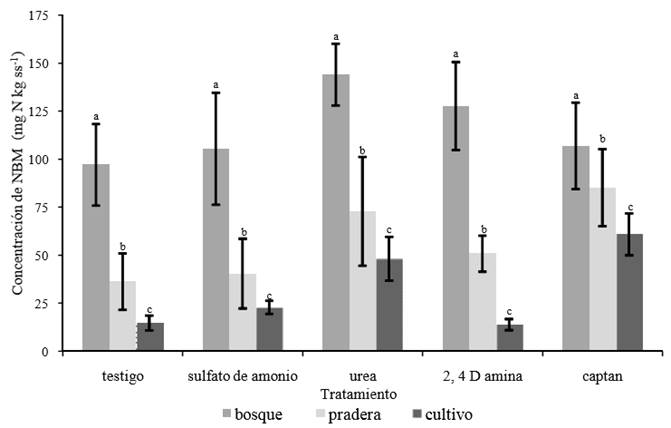
La concentración de nitrógeno biomasa microbiana (NBM), en los suelos de bosque (Figura 2) fue significativamente mayor (P < 0.05) que en los suelos de pradera y con cultivo. Prasad et al. (1995), mencionan que la conversión del bosque a diversos usos del suelo lleva a la pérdida del NBM del mismo. Asimismo, la urea modificó la proporción de NBM, de manera significativa (P < 0.05), en los distintos suelos que se estudiaron. Este resultado puede atribuirse a la hidrólisis de la urea en suelos forestales; además, del efecto que tiene en el aumento del número y actividad de los microorganismos heterotróficos (Stotzky y Bollag, 1996). Cuando se aplicó 2, 4-D amina el NBM en suelos de bosque y pradera fue mayor que en el suelo sin aplicación; no así en los suelos bajo cultivo (Figura 2). Los incrementos observados en los suelos de bosque y de pradera pueden atribuirse a la utilización de 2, 4-D amina como fuente de energía por los microorganismos, lo que causa un incremento en su actividad. Al respecto Schinner et al., (1983), identificaron que la aplicación de dicho herbicida causa un incremento en la actividad microbiana debido a la resistencia o adaptación de los microorganismos. La adición de captan incrementó significativamente (P < 0.05) el contenido de NBM en los suelos de bosque, pradera y con cultivo en relación a los suelos sin aplicación. El efecto hace suponer, por una parte, la modificación de la comunidad microbiana como consecuencia del daño provocado por el captan sobre las poblaciones fúngicas y la proliferación de bacterias y, por otra, la utilización del fungicida como sustrato (Vyas, 1988). Los resultados obtenidos son contrarios a los hallazgos de Chen et al. (2001), quienes encontraron menor proporción de NBM en los suelos tratados con captan, que en los suelos sin tratar.
Tasa de Mineralización de Carbono
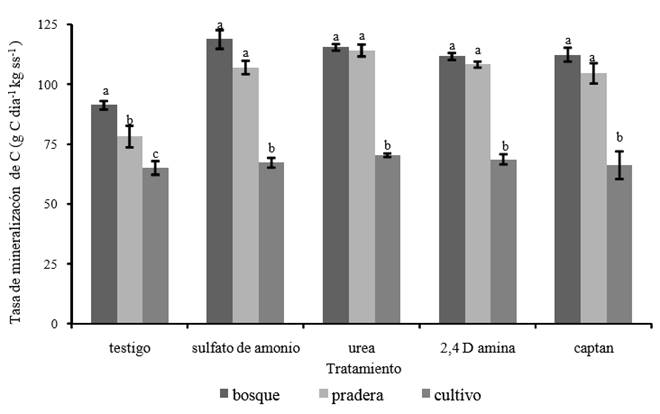
Se identificaron diferencias significativas (P < 0.05) en la tasa de mineralización (tm) de carbono en los suelos sin aplicación; el valor mayor correspondió a los suelos de bosque y el menor a los suelos bajo cultivo (Figura 3). La magnitud de la tm de C, en los suelos en estudio, el indicador del estado biológico de los suelos (Nannipieri et al., 1990) se conservó como bosque mayor que pradera, pradera mayor que cultivo, con los diferentes tratamientos. Los cuatro tratamientos provocaron que la tm del C se incrementara significativamente (P < 0.05) en los suelos de bosque y pradera con respecto al suelo sin aplicación; pero no en los suelos con cultivo. En concordancia con Meng et al. (2005), el aumento en la tm de C fue mayor en los suelos con fertilizantes que en aquellos con biocidas; sin embargo, la diferencia entre los tratamientos no fue significativa (P > 0.05). Schinner et al. (1983) y Chen et al. (2001), obtuvieron resultados similares y los atribuyeron al efecto de los fungicidas sobre las poblaciones de hongos y sobre la actividad de ciertos grupos de hongos, lo que genera una reducción en la respiración y en la biomasa microbiana activa (West et al., 1986); por otra parte, los microorganismos muertos por los biocidas servirían de sustrato a los organismos que sobrevivan.
Conclusiones
Los resultados obtenidos, en este trabajo, en relación a las características biológicas de los suelos, señalan que la aplicación de fertilizantes nitrogenados (sulfato de amonio y urea), al igual que la adición de los biocidas (2, 4-D amina y captan), en suelos de bosque y pradera, del Parque Nacional Nevado de Toluca, alteran significativamente la actividad microbiana del suelo y favorecen la pérdida del carbono almacenado en los suelos de estos ecosistemas. La tasa de mineralización de C se mantiene estable con la adición de urea, sulfato de amonio, 2, 4-D amina y captan en suelos con cultivo de maíz, degradados por el laboreo. La biomasa microbiana [(carbono de la biomasa microbiana (CBM) y nitrógeno de la biomasa microbiana (NBM)] es afectada negativamente por la conversión de suelos de bosque a tierras de cultivo, por lo anterior tanto CBM y NBM pueden ser utilizadas como un indicador del estado de degradación de los suelos de bosque de montaña.











 text new page (beta)
text new page (beta)