Introducción
Como resultado del metabolismo, algunos organelos celulares como mitocondrias, lisosomas, peroxisomas, membrana nuclear, citoplásmica y retículo endoplásmico originan radicales libres, como las especies reactivas de oxígeno (ROS): superóxido (O2 ˙ -), hidroxilo (OH˙), peroxilo (R-OO˙), alcoxilo (RO˙) e hidroperoxilo (HOO˙) y las especies reactivas de nitrógeno (RNS): óxido nítrico (NO), dióxido de nitrógeno (NO2) y peróxido de nitrato (Maldonado et al., 2010). Sin embargo, éstos también pueden generarse por factores externos como contaminación ambiental, exposición a radiación y productos químicos como medicamentos, aditivos alimenticios, pesticidas, herbicidas y tabaco, entre otros.
Estos radicales atacan moléculas como aminoácidos, carbohidratos, lípidos, proteínas y ácidos nucleicos. Para contrarrestar su efecto, las células han desarrollado mecanismos de protección y reparación del daño, como la producción de enzimas antioxidantes como superóxido dismutasa, catalasa, glutatión peroxidasa, glucosa-6-fosfato deshidrogenasa, NADPH-quinona oxidorreductasa y epóxido hidrolasa (Finkel y Holbrook, 2000) y de metabolitos antioxidantes que atrapan y neutralizan los radicales libres; sin embargo, resultan insuficientes para protegerlas completamente (Smina et al., 2011).
Cuando los oxidantes superan la cantidad de antioxidantes ocurre un estrés oxidativo, que provoca daños importantes en biomoléculas y componentes celulares (Halliwell, 1996), lo cual está asociado con enfermedades crónico degenerativas como Alzhaimer, Parkinson, arteriosclerosis, cáncer, artritis, desórdenes neurodegenerativos, enfermedades coronarias y envejecimiento, entre otras (Yoshikawa et al., 2000; Álvarez et al., 2008; Badarinath et al., 2010; Kozarski et al., 2011).
Debido a lo anterior, es importante la búsqueda de productos naturales con propiedades antioxidantes que al incluirse en la dieta diaria contribuyan a mantener la salud, al prevenir y curar enfermedades, siendo interesante el estudio de especies fúngicas que poseen potencial medicinal. Existen varios hongos medicinales entre ellos los del género Ganoderma que tienen agentes antioxidantes como polifenoles, terpenoides, triterpenos y esteroles (Smina et al., 2011), como el ergosterol y sus derivados que reducen la peroxidación lipídica (Kobori et al., 2007) y poseen propiedades antitumorales y anticancerígenas (Wasser y Weis, 1997).
Ganoderma es un género lignícola que crece en ambientes tropicales causando pudrición blanca de duramen y raíz especialmente en latifoliadas y algunas coníferas (Cibrián-Tovar et al., 2007), entre ellas Quercus spp., Ulmus spp., Acer spp., Fraxinus spp., Acacia spp., Populus spp., Macadamia spp., Abies spp, Tsuga sp., Cocus nucifera, Areca catechu, Prunus persica, Pyrus communis, Paullinia cupana, Vitis spp. y Coffea spp. (Sánchez, 1980; Ariffin et al., 2000; Stamets, 2000; Pilotii et al., 2004; Alvarado-Rosales et al., 2007).
Entre los trabajos sobre actividad antioxidante para el género Ganoderma, destacan los de Mau et al. (2005a, b) y Tseng et al. (2008) que evaluaron extractos acuosos y metanólicos, así como compuestos polisacáridos de basidiomas de G. tsugae; Chen et al. (2008) realizaron pruebas con polisacáridos de basidiomas de G. atrum; Saltarelli et al. (2009) cuantificaron la actividad del micelio de G. lucidum;Kalyoncu et al. (2010) con el micelio de 21 especies silvestres incluyendo G. lucidum; Smina et al. (2011) probaron la fracción triterpénica de G. lucidum con diferentes métodos in-vitro e in-vivo; Kozarski et al. (2011) con la fracción polisacárida de cuatro hongos medicinales incluido G. lucidum; Ćilerdžić et al. (2014) evaluaron basidiomas cultivados de G. lucidum mientras que Nagaraj et al. (2014) y Acharya et al. (2015) los basidiomas silvestres de G. applanatum.
Singdevsachan et al. (2015) compararon la composición química y actividad de G. applanatum, G. lipsiense, G. chalceum y G. tsugae. Por otra parte, Tamrakar et al. (2016) estudiaron 62 especies de hongos silvestres de Nepal incluidas cuatro de Ganoderma. Para México destaca el trabajo de Garza et al. (2006) que investigaron la actividad biológica de extractos acuosos de cuatro especies fúngicas del noreste de México incluyendo G. applanatum y el de Huerta et al. (2016) que estimaron la actividad de extractos alcohólicos e hidroalcohólicos de basidiomas silvestres de G. curtisii del estado de Michoacán. Sin embargo, existen pocos estudios sobre la composición química y actividad biológica de especies de Ganoderma nativas de México, que confirmen las propiedades atribuidas a este género.
El objetivo del trabajo fue determinar la capacidad antioxidante y el contenido de polifenoles totales presentes en extractos etanólicos y acuosos de basidiomas y micelio de Ganoderma curtisii, G. applanatum y G. brownii, procedentes de tres localidades del estado de Hidalgo, México.
Materiales y Métodos
Recolecta de material biológico
Se recolectaron basidiomas maduros de Ganoderma curtisii, G. applanatum y G. brownii en bosques templados de tres localidades del Estado de Hidalgo (Tabla 1). Los ejemplares fueron identificados siguiendo técnicas convencionales de taxonomía (Largent, 1973; Largent et al., 1977; Gilbertson y Ryvarden, 1986; Ryvarden, 1991) y las claves de identificación para el género propuestas por Ryvarden y Gilbertson (1993), Cibrian-Tovar et al. (2007) y Torres et al. (2015); posteriormente fueron deshidratados a temperatura ambiente en obscuridad. Un espécimen de cada especie se depositó en la colección de hongos “Dr. Gastón Guzmán Huerta” del herbario de la Escuela Nacional de Ciencias Biológicas (ENCB) del Instituto Politécnico Nacional, con los números de registro IslasGA10, IslasGA14, IslasGAB20, IslasGCT36, IslasGCZ28 (Tabla 2).
Tabla 1 Localidades de recolecta de basidiomas de Ganoderma spp.
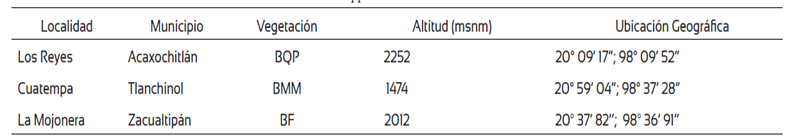
BPQ (bosque de Quercus-Pinus), BMM (bosque mesófilo de montaña), BF (bosque de Fagus).
Cultivo en laboratorio
Se realizaron aislamientos somáticos a partir de basidiomas silvestres (IslasGA14, IslasGAB20, IslasGA10), en cajas Petri con medio malta-peptona-levadura-agar (MYPA) (Shoji, 1999; Postemsky et al., 2006) suplementado con benomil (3 ppm) y aureomicina (10 ppm) para prevenir crecimiento de contaminantes (Stalpers, 1978). Las cepas obtenidas se registraron con las claves UAEH0018 (G. curtisii), UAE0019 (G. applanatum) y UAEH0020 (G. brownii) (Tabla 2). Posteriormente se propagaron en medio líquido malta-levadura-peptona (MYP) a 25 ºC durante 15 días, el micelio obtenido se lavó con agua y se secó a temperatura ambiente en obscuridad. La cepa UAEH0018 (G. curtisii) se cultivó en aserrín de encino suplementado con salvado, en bolsas de 2 kg que se incubaron a 25 ºC durante 1 mes. Una vez invadidas se inició el riego y la fructificación, transcurridos 3 meses se recolectaron los basidiomas y se deshidrataron a temperatura ambiente en oscuridad.
Preparación de extractos
Todas las muestras deshidratadas se molieron manualmente. Para los extractos etanólicos se colocaron 2 g de muestra en 100 mL de etanol durante 24 h con agitación magnética en oscuridad, se filtró y aforó a 100 mL con etanol. En los extractos acuosos se preparó una infusión con 2 g de muestra en 100 mL de agua destilada en ebullición, de igual forma se filtró y aforó a 100 mL.
Pruebas antioxidantes
Ensayo ABTS. La capacidad antioxidante se evaluó con el método de ABTS (Re et al., 1999), el radical ABTS•+ se obtiene mediante la reacción de una solución stock de ABTS ácido 2,2´-azino-bis(3-etilbenzotiazolin-6-ácido sulfónico) (Sigma) 7 mM (19.4 mg) con persulfato potásico 2.45 mM (3.3. mg) en 5 mL de agua desionizada, la solución se almacenó en oscuridad a temperatura ambiente por 16 h antes de su uso. Posteriormente se diluyó con etanol hasta obtener una absorbancia de 0.60 (±0.1) a una longitud de máxima absorción de 734 nm. La curva de calibración se realizó con una solución estándar de Trolox (6-hidroxi-2,5,7,8-tetrametilcromo-2-ácido carboxílico) 1mM (2.5 mg en 10 mL de etanol) a partir de la cual se obtuvieron concentraciones en un intervalo de 10-50 µM. Los extractos a evaluar se diluyeron con etanol en una proporción 1:10 y 1:5, se colocaron 100 µL de cada muestra en una celda espectrofotométrica y se adicionaron 1000 µL de ABTS•+, las lecturas se realizaron por triplicado en un espectrofotómetro marca Jenway 6405UV/Vis a una absorbancia de 734 nm durante 10 min, los resultados se expresaron en mg equivalentes Trolox por gramo de muestra (mg Trolox/g).
Contenido de fenoles totales. La cuantificación de fenoles totales se realizó con el método de Folin Ciocalteu (F-C) (Singleton, et al., 1999), utilizando como buffer Na2CO3 al 4%, la curva de calibración se hizo utilizando como estándar una solución de ácido gálico 2.5 µM (10 mg en 10 mL de agua destilada) a partir de la cual se prepararon concentraciones en un intervalo de 20-100 µM. En un matraz se colocó 1 mL de muestra, 1 mL de reactivo de Folin (Sigma), 4 mL de solución de Na2CO3 y se aforó a 10 mL con agua destilada, se calentó a 50 ºC en baño María por 10 min y se midió la absorbancia por triplicado a 765 nm. Las muestras se analizaron de igual forma sustituyendo el patrón de ácido gálico por 1 mL del extracto a evaluar. Los resultados promedio de las lecturas se expresaron en mg equivalentes de ácido gálico por gramo de muestra (mg EAG/g).
Los datos se estandarizaron mediante la siguiente fórmula:
En donde CR= concentración del referente, A= absorbancia, m= pendiente de la curva patrón, b= ordenada al origen de la curva patrón, PM= peso molecular del compuesto de referencia (g/mol) y C= concentración de la muestra (g/mL).
Los datos resultantes se evaluaron con un análisis de varianza (ANOVA) y se compararon las medias con una prueba de Tukey (p < 0.05). Así mismo, se realizó un análisis discriminante generalizado lineal (AFDG), con los datos de actividad antioxidante expresados en mg Trolox/g de muestra y con la concentración de fenoles totales en mg EAG/g de muestra.
Resultados
Actividad antioxidante
Para los extractos etanólicos se formaron tres grupos con la prueba de Tukey, la mayor capacidad antioxidante se observó en Ganoderma brownii (GbT-b y GbT-m con 68.54 y 67.82 mg Trolox/g respectivamente), G. applanatum (GaA-b con 67.53 mg Trolox/g), G. curtisii (GcZ-b con 66.38 mg Trolox/g) y G. curtisii (GcA-b con 64.94 mg Trolox/g); y la menor en G. curtisii (GcA-bc y GcA-m con 47.82 y 50.41 mg Trolox/g) (Figura 1). En los extractos acuosos se integraron cuatro grupos con la prueba de Tukey los valores más altos se obtuvieron en basidiomas de G. curtisii (GcA-m con 67.96 mg Trolox/g), G. brownii (GbT-b con 66.81 mg Trolox/g), G. curtisii (GcA-m con 66.387 mg Trolox/g) y G. brownii (GbT-m con 65.24 mg Trolox/g); los valores más bajos se observaron en G. curtisii (GcA-b y GcA-bcm con 56.45 y 59.76 mg Trolox/g) (Figura 1).
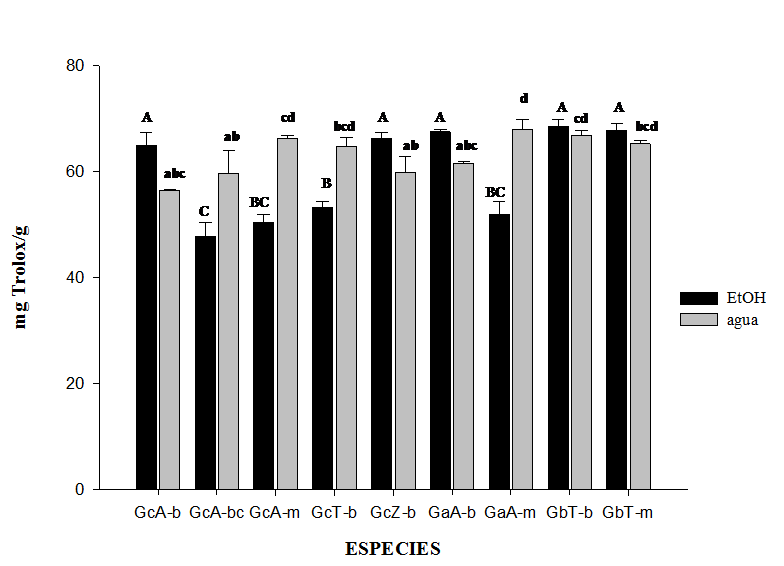
Figura 1 Actividad antioxidante de los extractos crudos de Ganoderma curtisii, G. applanatum y G. brownii, el valor promedio (n=3) se expresa en mg equivalentes de Trolox por gramo de muestra (mg Trolox/g). Letras diferentes representan diferencias significativas según Tukey (α= 0.05), mayúsculas para extractos etanólicos y minúsculas para acuosos.
Cuantificación de fenoles
La prueba de Tukey permitió diferenciar siete grupos para los extractos etanólicos y nueve para los acuosos (Figura 2).La mayor cantidad de fenoles totales se determinó en extractos etanólicos de G. brownii (GbT-m con 100.33 mg EAG/g) y G. applanatum (GaA-b con 61.36 mg EAG/g) y los valores más bajos en G. curtisii (GcA-m y GcA-b con 13.57 y 19.09 mg EAG/g, respectivamente). En los extractos acuosos, los valores máximos fueron para G. curtisii (GcA-bc con 146.64 mg EAG/g), G. brownii (GbT-b con 104.37 mg EAG/g) y G. curtisii (GcA-m con 96.65 mg EAG/g) y los valores más bajos para G. applanatum (GaA-m), G. curtisii (GcT-b) y G. applanatum (GaA-b con 47.76, 55.11 y 58.79 mg EAG/g respectivamente) (Figura 2).

Figura 2 Cuantificación de fenoles totales en los extractos crudos de Ganoderma curtisii, G. applanatum y G. brownii, expresados en miligramos equivalentes de acido gálico por gramo de muestra (mg EAG/g). Letras diferentes representan diferencias significativas según Tukey (α=0.05), mayúsculas para extractos etanólicos y minúsculas para acuosos.
Para comprobar la relación entre el contenido de polifenoles y la actividad antioxidante, se realizó una prueba de correlación para los extractos etanólicos y acuosos por separado, observándose correlación positiva en los extractos etanólicos (R2=0.280 y P=0.004); sin embargo para los extractos acuosos no hubo correlación (R2=0.072 y P=0.173).
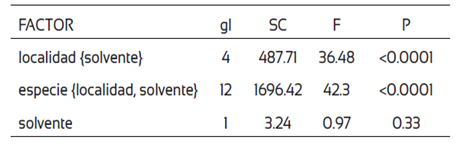
En el análisis de ANOVA anidado se obtuvo un efecto significativo (P=< 0.0001) de la localidad (solvente) y especie (localidad-solvente) sobre el contenido de polifenoles totales y la capacidad antioxidante; sin embargo, no se observó un efecto significativo por sí solo del solvente utilizado para obtener los extractos en las variables, sino en la interacción (Tabla 3).
En el análisis discriminante generalizado AFDG de la actividad antioxidante y de fenoles totales, se obtuvo que el 77.96% de la varianza se explica por el contenido de fenoles de los extractos etanólicos mg EAG/g (r=(0.033) y por los mg Trolox/g de los extractos etanólicos (r=(0.325) en la primera función discriminante (FD1). Por otra parte, para la segunda función discriminante (FD2) las variables que más se correlacionaron fueron fenoles de los extractos etanólicos mg EAG/g (r=0.558), fenoles y antioxidantes de los extractos acuosos (r=0.051 y r=(0.193, respectivamente) con lo cual se explicó el 20.07% de la variación total (Tabla 4).
Tabla 4 Análisis de función discriminante que muestra la correlación de las variables con las funciones discriminantes, valores propios, significancia (P) y porcentaje de varianza (%)

En este análisis se establecieron cinco grupos, en el primero se encuentra G. brownii (GbT-m) con el mayor contenido de polifenoles etanólicos; el segundo grupo integrado por G. curtisii (GcT-b y GcZ-b) y G. applanatum (GaA-b) que exhiben una capacidad antioxidante intermedia para los extractos acuosos (54 mg Trolox/g); en el tercer grupo se ubica G. brownii (GbT-b) con una proporción intermedia en polifenoles y capacidad antioxidante de la fracción etanólica pero una mayor cantidad de polifenoles en la fracción acuosa (104.37 mg EAG/g); en el cuarto grupo con una menor actividad se encuentra G curtisii (GcA-bc) con menor cantidad de polifenoles y capacidad antioxidante baja en los extractos etanólicos, sin embargo, contiene la mayor cantidad de polifenoles en los extractos acuosos (146.65 mg EAG/g); y el quinto grupo conformado por G. curtisii (GcA-b, GcA-m) y G. applanatum (GaA-m) con los valores de polifenoles más bajos para los extractos etanólicos (Figura 3).
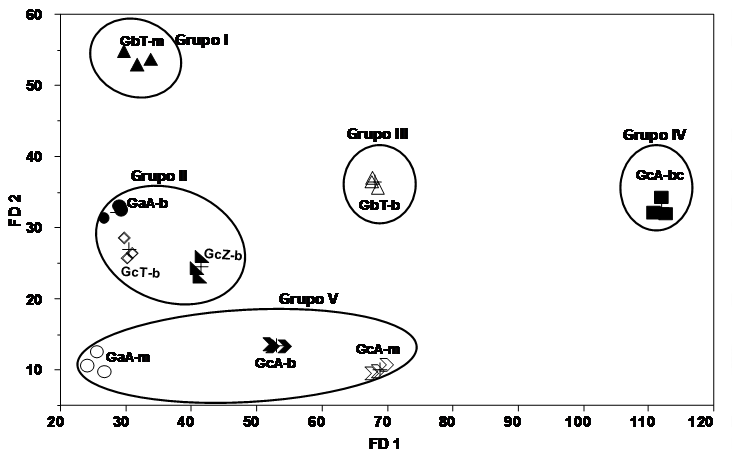
Figura 3 Análisis discriminante generalizado lineal (AFDG) de la actividad antioxidante de los extractos de Ganoderma spp. Grupo 1: G. brownii micelio(GbT-m), grupo 2: G. curtisii basidioma (GcT-b y GcZ-b) y G. applanatum basidioma(GaA-b); grupo 3: G. brownii basidioma (GbT-b); grupo 4: G. curtisii basidioma cultivado(GcA-bc) y grupo 5: G. curtisii micelio (GcA-m) y basidioma (GcA-b) y G. applanatum micelio (GaA-m).
Discusión
Se analizaron nueve muestras correspondientes a tres especies silvestres en dos etapas de desarrollo: cinco basidiomas silvestres y uno cultivado, además de tres en fase miceliar, todas originarias de tres localidades del estado de Hidalgo, México. El propósito de comparar dos disolventes de alta polaridad (agua y etanol) fue demostrar si existía un efecto en la capacidad antioxidante y contenido de polifenoles de las muestras, debido a que el consumo tradicional de basidiomas del género Ganoderma es principalmente mediante infusiones y tinturas.
Los extractos acuosos de G. curtisii (GcT-b, GcA-m y GcA-bc) y G. applanatum (GaA-m) mostraron mayor actividad antioxidante que los extractos etanólicos, lo que corresponde con lo reportado para G. lucidum (Kalyoncu et al., 2010) y G. tusgae (Mau et al., 2005 a,b). Sin embargo, difiere en G. brownii (GbT-by Gb), G. curtisii (GcZ-b y GcA-b) y G. applanatum (GaA-b), que mostraron una mayor actividad en los extractos etanólicos en relación con los acuosos, lo que es similar a lo reportado para G. applanatum, G. chalceum y G. tsugae (Singdevsachan, et al., 2015).
El contenido de fenoles totales en las muestras analizadas de Ganoderma, fue mayor a lo reportado para algunos hongos comestibles en extractos hidroalcohólicos de Agaricus bisporus (19.97 mg EAG/g), Pleurotus eryngii (12.74 mg EAG/g), Lentinula edodes (10 mg EAG/g) y Pleurotus ostreatus (16.05 mg EAG /g) (Penzete et al., 2012) y en extractos metanólicos de Agaricus bisporus variedad blanca y café (23.34 y 37.33 mg EAG/g), Pleurotus ostreatus (12.54 mg EAG/g), Pleurotus eryngii (7.14 mg EAG/g) y Lentinula edodes (8.84 mg EAG/g) (Reis et al., 2012). La cantidad de polifenoles de los extractos etanólicos de basidiomas de G. curtisii cultivado (GcA-bc) y basidiomas silvestres de G. curtisii (GcZ-b y GcT-b) corresponden con lo obtenido para extractos hidroalcohólico y etanólico de G. curtisii (35.63 mg EAG/g y 49.1 mg EAG/g) (Huerta et al., 2016) y para extractos etanólicos de G. lucidum (33-52 mg EAG/g) (Ćilerdžić et al., 2014). Para G. applanatum se observó que el contenido de fenoles en los extractos etanólico y acuoso (61.36 y 58.79 mg EAG/g) es análogo a lo reportado en trabajos similares entre 47 y 71 mg (Kozarski et al., 2011; Nagaraj et al., 2014).
Al comparar el extracto acuoso del micelio de G. curtisii, se obtuvo que la concentración de 96.65 mg EAG/g, fue mayor a lo encontrado para micelio de G. tsugae (41.3 mg EAG/g) (Mau et al., 2005b) a diferencia del extracto etanólico que tuvo una concentración de 13.57 mg EAG/g, menor a lo reportado para el extracto metanólico de G. tsugae (35.6 mg EAG/g) (Mau et al., 2005a) y para extractos hidroalcohólicos de dos cepas de G. lucidum (Italia y China) con valores de 27.9 y 16.5 mg equivalentes de ácido cafeico/g, respectivamente (Saltarelli et al., 2009).
La actividad antioxidante se ha relacionado con la presencia de compuestos de bajo peso molecular (fenoles) responsables de capturar radicales libres (Gursoy et al., 2009). Sin embargo, también contribuyen los triterpenos (Smina et al., 2011) y polisacáridos de alto peso molecular, como se demostró en pruebas con G. tsugae (Tseng et al., 2008)] y G. curtisii (Saltarelli et al., 2009), estos compuestos además poseen propiedades reguladoras del sistema inmune, anti-radiación, anti-coagulantes, anti-cáncer, anti-HIV e hipoglicémicas (Lee et al., 2002; Yoon et al., 2003; Yang et al., 2005). De igual forma, se conoce que los micoesteroles como el ergosterol y sus derivados, contribuyen a inhibir la peroxidación lipídica (Kobori et al., 2007).
Las diferencias en las muestras analizadas indican que la concentración de metabolitos secundarios (polisacáridos, triterpenos, fenoles y esteroles) puede variar dependiendo de la especie y etapa de desarrollo. Se observó que los basidiomas maduros de las especies no laqueadas (G. brownii y G. applanatum) presentaron mayor actividad antioxidante y contenido de compuestos fenólicos que las laqueadas (G. curtisii). La variación existente entre las dos etapas de desarrollo pudiera deberse a que el micelio (fase inmadura) se conforma de hifas generativas y esqueléticas que producen enzimas lignolíticas como oxidasas y peroxidadas (lacasas, lignino peroxidasa y manganeso peroxidasa) para colonizar el sustrato (Arboleda y Mejía, 2010), mientras que los basidiomas al ser estructuras especializadas en donde se forman las esporas tienen mayor cantidad de triterpenos y polisacáridos. Así mismo, se observó que el disolvente utilizado y la temperatura de extracción influyeron en la actividad antioxidante y el contenido de polifenoles dependiendo de la especie y etapa desarrollo. De igual forma, los factores bióticos y abióticos de las localidades de recolecta pudieran influir en la composición química de las muestras, sin embargo no se analizaron a profundidad, por lo que sería conveniente realizar un estudio complementario. En este estudio preliminar se destaca el potencial antioxidante que tienen las cepas nativas de Ganoderma spp. del estado de Hidalgo con resultados promisorios que motivan la realización de investigaciones futuras enfocadas a la biotecnología y biomedicina.











 text new page (beta)
text new page (beta)