Introducción
El Agave cupreata Trel. & Berger es una especie endémica de la Cuenca del Balsas, México (http://www.biodiversidad.gob.mx/usos/mezcales/A_cupreata.htlm), introducida al cultivo debido a que a partir de la fermentación del jugo de las piñas de las plantas adultas se produce una bebida alcohólica artesanal conocida como mezcal (Martínez-Palacios et al., 2011). En los últimos años, los estudios se han enfocado en la conservación y diversidad genética de las plantaciones de A. cupreata para un manejo sustentable (Martin et al., 2011; Martínez-Palacios et al., 2011), sin considerar la importancia de los microorganismos asociados con su rizosfera, los que juegan un papel importante y clave para el mantenimiento y productividad de las plantas en los ecosistemas (Zak et al., 2003; Tarkka et al., 2008). Dentro de estos microorganismos asociados a la rizosfera se encuentran los hongos micorrízicos arbusculares (HMA), Phylum Glomeromycota (Schüβler et al., 2001). Los HMA forman simbiosis con alrededor del 80 % de las plantas terrestres, en esta asociación, el hongo transporta los nutrientes del suelo hacia la planta y ésta en compensación le brinda una fuente de carbono, además, los HMA forman un puente que facilita la interacción de las raíces de las plantas con otros componentes de la microbiota y la parte abiótica del suelo (Jeffries et al., 2003; Smith y Read, 2008).
Los HMA influyen en la diversidad y productividad de las comunidades de plantas, ya que las especies de HMA pueden asociarse simultáneamente con especies vegetales de diferentes afinidades filogenéticas, a las que permiten coexistir en un mismo ambiente, por lo que promueven la diversidad de plantas en la comunidad (van der Heijden et al., 1998, 2006) y en el caso de los agaves se ha propuesto que las especies y su distribución geográfica influyen en la conformación de sus microbiomas, parte de los cuales están integrados por HMA (Coleman-Derr et al., 2016). Debido a ello, es necesario conocer la riqueza, diversidad y funcionalidad de las especies de HMA que se encuentran asociadas con plantas de interés económico, ecológico y cultural como es el caso del A. cupreata. Durante el estudio de la riqueza de HMA en especies particulares de plantas, como es A. cupreata, es asimismo importante considerar los patrones estacionales (épocas de muestreo) (Oliveira y Oliveira, 2005; Su et al., 2011; Zangaro et al., 2013) y la variación espacial (los sitios de muestreo) (Stutz et al., 2000; Bohrer et al., 2004; Wolfe et al., 2007), ya que influyen en la riqueza, diversidad, abundancia de esporas y colonización de los HMA.
El género Agave es micorrizable (Cui y Nobel, 1992; Carrillo-García et al., 1999; Camargo-Ricalde et al., 2003; Li et al., 2004; Ochoa-Meza et al., 2009; Carballar-Hernández et al., 2013; Hernández-Morales et al., 2014) y no obstante que existen 150 especies y 36 taxa infraespecíficos en México (García-Mendoza, 2007), sólo para dos de ellas hay reportes sobre la composición de especies de HMA asociadas a su rizosfera. Para Agave angustifolia Haw. en Sonora se encontraron 32 morfo-tipos (Ochoa-Meza et al., 2009), mientras que para A. potatorum Zucc. en Oaxaca, Carballar-Hernández et al. (2013) reportaron 20 morfo-tipos y Hernández-Morales et al. (2014) nueve. Otra especie de agave que cuenta con registros de morfo-tipos de HMA es A. americana L., aunque proviene de China, donde fue introducida (Li et al., 2004). En todos los casos, incluido este último, los géneros Glomus (sensu lato) y Acaulospora fueron dominantes. Lo anterior pone de manifiesto el gran desconocimiento que hasta el momento existe sobre la riqueza de HMA asociados con el género Agave, por lo cual el objetivo de este trabajo fue determinar la composición y abundancia de esporas de hongos micorrízicos arbusculares asociados a la rizosfera de Agave cupreata en la época seca y de lluvia en algunas regiones mezcaleras del estado de Michoacán.
Materiales y Métodos
Sitios de muestreo
El muestreo se realizó en ocho sitios diferentes donde crece A. cupreata, en forma silvestre y cultivado, dos y seis sitios, respectivamente; todos los sitios se ubicaron en el estado de Michoacán (Tabla 1).
Tabla 1 Ubicación geográfica de sitios muestreados en tres localidades productoras de Agave cupreata en el estado de Michoacán
| Municipio (Localidad) | Sitio | Condición de A. cupreata | Coordenadas geográficas | Altitud (msnm) | Clave del sitio |
|---|---|---|---|---|---|
| 19° 24' 20.1"N | |||||
| Las Campesinas | Cultivado | 101° 11' 57"O | 1537 | LC | |
| 19° 25' 31.4"N | |||||
| Madero (Etúcuaro) | El Huizachal | Cultivado | 101° 12' 51.4"O | 1624 | EH |
| 19° 24' 20.1"N | |||||
| Rancho Carlos Rojas | Silvestre | 101° 11' 57"O | 1853 | CR | |
| 19° 32' 21.4"N | |||||
| El Limón | Cultivado | 101° 05' 41.8"O | 1866 | EL | |
| Morelia-Madero (Tumbisca) | 19° 32' 21.3"N | ||||
| Agua Dulce | Cultivado | 101° 05' 41.8"O | 1890 | AD | |
| 19° 30' 1.7"N | |||||
| Paso Ancho | Cultivado | 100° 54' 51.1"O | 1006 | PA | |
| 19° 33' 55.1"N | |||||
| Tzitzio (Tzitzio) | Barranca de la Nueces | Cultivado | 100° 55' 39"O | 1471 | BN |
| 19° 34' 22.3"N | |||||
| Cerro del Metate | Silvestre | 100° 56' 27.5"O | 1915 | CM |
Obtención de las muestras
La recolecta del suelo rizosférico se realizó durante dos épocas del año, en la temporada seca (mayo del año 2011) y de lluvia (agosto-septiembre del año 2011). De cada sitio y época de muestreo se recolectaron muestras de suelo rizosférico de plantas de A. cupreata seleccionadas al azar tanto en plantaciones como en poblaciones silvestres. Por cada planta se tomaron cuatro submuestras ubicadas en los cuatro puntos cardinales de la planta desde la base hasta una profundidad del suelo de entre 15 a 20 cm (Carballar-Hernández et al., 2013), posteriormente las submuestras fueron mezcladas para hacer una muestra compuesta de aproximadamente 2 kg por planta. En el laboratorio, las muestras fueron colocadas en botes de plástico de 1 L de capacidad, etiquetadas y almacenadas a temperatura ambiente hasta su posterior uso. Las muestras obtenidas en la época de lluvia fueron secadas a temperatura ambiente durante dos semanas bajo sombra antes de su almacenamiento. De acuerdo con la disponibilidad de plantas, en la época seca se muestrearon cinco plantas para el sitio El Huizachal (EH), cuatro plantas para Las Campesinas (LC), tres plantas para Rancho Carlos Rojas (CR) y Paso Ancho (PA), cinco plantas para El Limón (EL), dos plantas para Barranca de las Nueces (BN) y Cerro del Metate (CM) y una planta para Agua Dulce (AD), para un total de 25 plantas muestreadas. Para la época de lluvia se muestrearon cinco plantas para EH, seis plantas para LC, dos plantas para CR, BN, AD y CM, ocho plantas para EL y tres plantas para PA, en total se muestrearon 30 plantas.
Análisis físico-químico del suelo rizosférico
El análisis físico-químico de los suelos recolectados de la rizosfera de A. cupreata durante la época seca se realizó a través del Laboratorio de Análisis Agrícola de la empresa Servicios Analíticos Agroindustriales (SEANA), ubicado en la ciudad de Tarímbaro, Michoacán. Los análisis incluyeron las determinaciones de: fósforo disponible (P), nitrógeno total (Nt), potasio (K), magnesio (Mg), calcio (Ca), cloro (Cl), azufre (S), hierro (Fe), cobre (Cu), manganeso (Mn), aluminio (Al), pH (H2O), materia orgánica (MO), conductividad eléctrica (CE) y los porcentajes de arcilla, limo y arena; las características de estos suelos son mostradas en la Tabla 2.
Tabla 2 Propiedades físico-químicas de los suelos rizosféricos de Agave cupreata muestreados durante la época seca en distintos sitios distribuidos en el estado de Michoacán
| Sitio | pH | CE dS m-1 | MO (%) | Nt (mg kg-1) | P (mg kg-1) | K (mg kg-1) | Mg (mg kg-1) | Ca (mg kg-1) | Cl (mg kg-1) | S (mg kg-1) | Fe (mg kg-1) | Cu (mg kg-1) | Mn (mg kg-1) | Al (mg kg-1) | Arc (%) | Li (%) | Are (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| LC | 5.6 | 0.050 | 2.8 | 79.2 | 100 | 125 | 215 | 300 | 7.5 | 5 | 15 | 2 | 18 | 22 | 41 | 22 | 37 |
| EH | 5.7 | 0.062 | 2.4 | 51.8 | 75 | 100 | 155 | 305 | 22 | 20 | 17.5 | <2 | 25 | 25 | 44 | 34 | 22 |
| CR | 5.1 | 0.078 | 2.1 | 44.0 | 75 | 110 | 288 | 422 | 15 | 15 | 28 | 2 | 17 | 20 | 64 | 18 | 18 |
| EL | 5.2 | 0.093 | 1.8 | 52.0 | 70 | 75 | 125 | 225 | 12 | 15 | 18 | <2 | 25 | 25 | 17 | 26 | 57 |
| AD | 5.2 | 0.059 | 2.0 | 62.6 | 60 | 80 | 144 | 275 | 5 | 5 | 10 | <2 | 15 | 15 | 19 | 15 | 66 |
| PA | 6.9 | 0.063 | 2.1 | 55.8 | 65 | 100 | 175 | 250 | 5 | 5 | 10 | <2 | 20 | 10 | 23 | 20 | 57 |
| BN | 7.4 | 0.109 | 1.7 | 49.5 | 65 | 75 | 115 | 265 | 5 | 3 | 18 | <2 | 15 | 10 | 17 | 11 | 72 |
| CM | 4.8 | 0.024 | 1.3 | 36.8 | 50 | 75 | 110 | 250 | 30 | 25 | 15 | 2 | 25 | 35 | 34 | 5 | 61 |
CE: Conductividad eléctrica; MO: Materia orgánica; Arc: Arcilla; Li: Limo; Are: Arena
Identificación taxonómica
La identificación taxonómica de las esporas de HMA se realizó para cada uno de los ocho sitios muestreados en ambas épocas. Para esto, se tomó una muestra de 100 g de suelo de cada planta de un mismo sitio y época de muestreo para obtener una muestra compuesta por sitio y época, teniendo como resultado 16 muestras compuestas de suelo rizosférico. Se tomaron 100 g de suelo seco de cada una de las muestras compuestas para extraer las esporas de HMA mediante la técnica de tamizado húmedo, decantación (Gerdemann y Nicolson, 1963) y centrifugación con sacarosa al 44 % (Brundrett et al., 1996), la extracción de esporas se realizó en dos fracciones de 50 g cada una, por muestra. Las esporas fueron extraídas con micropipeta con ayuda de un estéreomicroscopio y se colocaron en un portaobjetos en grupos de esporas con características similares de color y tamaño. A los grupos de esporas se les agregó una gota de alcohol polivinílico en lactoglicerol (PVLG) mezclado con Reactivo de Melzer (1:1, v:v) con la finalidad de observar cambios de color en la pared. Posteriormente se cubrieron con un cubreobjetos para su observación al microscopio compuesto (Schenck y Pérez, 1990; Tapia-Goné et al., 2008).
La observación de las preparaciones se realizó con un microscopio Zeiss Axioscop II-Plus con contraste de interferencia de Nomarski; con una cámara digital Olympus DPI acoplada al microscopio se capturaron imágenes de las esporas y detalles de la pared e hifas, las que se procesaron mediante el software Image Pro® Plus versión 4.5 (Media Cybernetics, 2001). La identidad de las esporas fue determinada por comparación y contrastación de las características morfológicas observadas contra la descrita para las especies de HMA que están disponibles en la página electrónica de la International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi (http://www.invam.wvu.edu/), del Prof. Janusz Blaszkowski (http://www.zor.zut.edu.pl/Glomeromycota) y de las descripciones originales de diferentes especies, obtenidas a través de enlaces en la página Arbuscular Mycorrhizal Fungi Phylogeny (http://www.arbuscular-mycorrhiza.net/amphylo_home.html) y revistas especializadas. Se sigue la clasificación propuesta por Schüßler et al. (2001) y Redecker et al. (2013). Preparaciones permanentes con las esporas de HMA se encuentran depositadas en el herbario TLXM de la Universidad Autónoma de Tlaxcala.
Con la finalidad de obtener esporas de los HMA en buenas condiciones y corroborar algunas características morfológicas que no se hubieran observado en las esporas extraídas de los suelos de campo, así como para obtener esporas de especies que no se encontraron durante los muestreos de campo y complementar el registro de especies, una parte del suelo rizosférico de A. cupreata de los ocho sitios y dos épocas de muestreo se colocó en macetas con sorgo [Sorghum bicolor (L.) Moench], alfalfa (Medicago sativa L.), cebolla (Allium cepa L.) y agave (A. cupreata) como plantas trampa, las que se mantuvieron en condiciones de invernadero durante ocho meses.
Abundancia de esporas
Paralelo a la identificación taxonómica, se realizó el conteo las esporas extraídas; se consideró como esporas viables a aquellas que presentaron contenido celular y ningún daño aparente al ser observadas al microscopio óptico. Para expresar la abundancia de esporas en 100 g de suelo seco, 10 g de cada suelo de cada muestra se colocaron en un horno de convección (Binder®) a 80 °C hasta peso constante para determinar el contenido de humedad y hacer la corrección correspondiente en el número de esporas.
Resultados
Los ocho sitios de muestreo mostraron tener características físico-químicas variables para la mayoría de los parámetros evaluados (Tabla 2). Resulta de particular importancia notar la baja cantidad de MO y la gran cantidad de Ca presente, que indica una preferencia de A. cupreata por habitar en suelos calizos. Sin embargo, no se observó relación entre las características físico-químicas y la riqueza de morfo-tipos o la abundancia de esporas de HMA encontradas en cada sitio de muestreo.
La riqueza de HMA encontrada en las 16 muestras compuestas de suelo rizosférico de A. cupreata fue de 38 morfo-tipos incluidos en nueve familias y 15 géneros para las dos épocas (seca y lluvia) (Tabla 3). En las familias Glomeraceae y Acaulosporaceae se registraron la mayor abundancia con un 37 y 34 % del total de los morfo-tipos, respectivamente, seguidas de la familia Gigasporaceae con un 10 %. Dentro de la familia Glomeraceae se registraron cinco géneros, con Glomus como el más abundante con el 18 % de los morfo-tipos (Tabla 3).
Tabla 3 Especies de hongos micorrízicos arbusculares asociadas a la rizosfera de Agave cupreata, en distintos sitios y épocas de muestreo (seca=S y lluvia=L) en el estado de Michoacán (continúa).
| Hongo micorrízico arbuscular | LC | EH | CR | EL | AD | PA | BN | CM | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| S | L | S | L | S | L | S | L | S | L | S | L | S | L | S | L | |
| Familia: Ambisporaceae | ||||||||||||||||
| 1. Ambispora appendicula* (Spain, Sieverding & Schenck) C. Walker | X | |||||||||||||||
| Familia: Archaeosporaceae | ||||||||||||||||
| 2. Archaeospora schenckii (Sieverding & S. Toro) C. Walker & A. Schüßler | X | X | X | X | X | X | X | X | ||||||||
| Familia: Acaulosporaceae | ||||||||||||||||
| 3. Acaulospora delicata C. Walker, C. M. Pfeiff. & Bloss | X | X | ||||||||||||||
| 4. Acaulospora denticulata Sieverding & S. Toro | X | X | X | |||||||||||||
| 5. Acaulospora excavata Ingleby & C. Walker | X | X | ||||||||||||||
| 6. Acaulospora laevis Gerd. & Trappe | X | X | X | X | ||||||||||||
| 7. Acaulospora mellea* Spain & N. C. Schenck | X | X | X | |||||||||||||
| 8. Acaulospora morrowiae* Schenck, Spain, Sieverd. & How. | X | X | ||||||||||||||
| 9. Acaulospora rehmii* Sieverding & S. Toro | X | X | ||||||||||||||
| 10. Acaulospora scrobiculata* Trappe | X | X | X | X | X | X | X | X | X | X | X | X | X X | |||
| 11. Acaulospora spinosa* C. Walker & Trappe | X | X | X | X | X | X | X | X | X | X | ||||||
| 12. Acaulospora sp. 1 | X | X | X | X | ||||||||||||
| 13. Acaulospora sp. 2 | X | X | ||||||||||||||
| 14. Acaulospora sp. 3 | X | |||||||||||||||
| 15. Acaulospora sp. 4 | X | X | X | |||||||||||||
| Familia: Claroideoglomeraceae | ||||||||||||||||
| 16. Claroideoglomus claroideum* (N. C. Schenck & G. S. Sm.) C. Walker & A. Schüßler | X | X | ||||||||||||||
| 17. Claroideoglomus etunicatum* (W. N. Becker & Gerd.) C. Walker & A. Schüßler | X | X | X | X | X | X | ||||||||||
| Familia: Diversisporaceae | ||||||||||||||||
| 18. Diversispora aurantia (Błaszk., Blanke, Renker & Buscot) C. Walker & A. Schüßler | X | X | X | X | X | X | X | X | ||||||||
| Familia: Entrophosporaceae | ||||||||||||||||
| 19. Entrophospora infrequens (I. R. Hall) R. N. Ames & R. W. Schneid | X | X | X | X | X | |||||||||||
| Familia: Glomeraceae | ||||||||||||||||
| 20. Funneliformis geosporum* (T. H. Nicolson & Gerd.) C. Walker & A. Schüßler | X | X | X | |||||||||||||
| 21. Funneliformis mosseae* (T. H. Nicolson & Gerd.) C. Walker & A. Schüßler | X | X | X | X | X | X | ||||||||||
| 22. Glomus deserticola Trappe, Bloss & J. A. Menge | X | X | X | X | X | X | X | X | X | X | X | X | X | X | ||
| 23. Glomus glomerulatum Sieverding | X | X | X | |||||||||||||
| 24. Glomus microaggregatum Koske, Gemma & P. D. Olexia | X | X | X | X | ||||||||||||
| 26. Glomus sp. 1 | X | |||||||||||||||
| 27. Glomus sp. 2 | X | |||||||||||||||
| 28. Glomus sp. 3 | X | |||||||||||||||
| 29. Rhizophagus clarus T.H. Nicolson & N.C. Schenck) C. Walker & A. Schüßler | X | |||||||||||||||
| 30. Rhizophagus diaphanum (C. Cano & Y. Dalpé) C. Walker & A. Schüßler | X | X | X | |||||||||||||
| 31. Rhizophagus intraradices + (N. C. Schenck & G. S. Sm.) C. Walker & A. Schüßler | ||||||||||||||||
| 32. Sclerocystis rubiformis Gerd. & Trappe | X | |||||||||||||||
| 33. Sclerocystis sinuosa Gerd. & B. K. Bakshi | X | |||||||||||||||
| 34. Septoglomus viscosum* (T.H. Nicolson) C. Walker | X | X | X | X | X | X | ||||||||||
| Familia: Gigasporaceae | ||||||||||||||||
| 35. Dentiscutata erythropus* (Koske & C. Walker) C. Walker & D. Redecker | X | |||||||||||||||
| 36. Racocetra gregaria (N. C. Schenck & T. H. Nicolson) Oehl, F. A. Souza & Sieverding | X | |||||||||||||||
| 37. Scutellospora dipurpurescens J. B Morton & Koske | X | |||||||||||||||
| 38. Scutellospora sp. 1 | X | |||||||||||||||
| Familia: Pacisporaceae | ||||||||||||||||
| 39. Pacispora sp. 1 | X | |||||||||||||||
X: Presencia de la especie; *Especie propagada en maceta; +Especie encontrada exclusivamente en las macetas de propagación. Nombres de especies y familias de acuerdo con Schüßler y Walker (2010) y Redecker et al. (2013). Las Campesinas (LC); El Huizachal (EH); Rancho Carlos Rojas (CR); El Limón (EL); Agua Dulce (AD); Paso Ancho (PA); Barranca de la Nueces (BN); Cerro del Metate (CM).
Acaulospora scrobiculata, A. spinosa y Glomus deserticola se encontraron en todos los sitios de muestreo (Figura 1), seguidas por Diversispora aurantia (siete sitios), Funneliformis mosseae (cinco sitios), Archaeospora schenckii, Claroideoglomus etunicatum, Glomus microaggregatum y Septoglomus viscosum (cuatro sitios) (Tabla 3). Los 29 morfo-tipos restantes fueron encontrados en menos de cuatro sitios. Se encontraron morfo-tipos de HMA que no corresponden con las características taxonómicas típicas de las especies de HMA descritas hasta la fecha, por lo cual pueden considerarse potencialmente como especies nuevas. Éstas representaron el 23 % del total y se registraron para los géneros Acaulospora (4 morfo-tipos), Glomus (3), Scutellospora (1) y Pacispora (1).
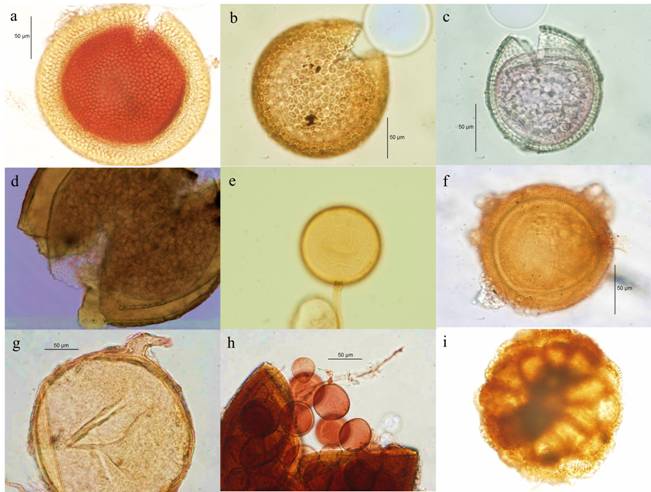
Figura 1 Algunas especies de hongos micorrízicos arbusculares encontradas en la rizosfera de Agave cupreata de distintas regiones del estado de Michoacán. a. Acaulospora denticulata; b. A. excavata; c. A. scrobiculata; d. Ambispora appendicula; e. Diversispora aurantia; f. Entrophospora infrequens; g. Funneliformis mosseae; h. Esporas de Glomus microaggregatum dentro de una espora muerta de otro HMA; i. Esporocarpo de Sclerocystis sinuosa.
Las épocas de muestreo (seca y lluvia) afectaron la presencia de especies de HMA en la rizosfera de Agave cupreata, siendo variable entre sitios así como entre épocas de un mismo sitio (Figura 2A). La riqueza de morfo-tipos encontrada en los sitios de muestreo varió entre cinco a 13 para la época seca y de cinco a 11 para la de lluvia. El 45 % de los morfo-tipos fueron encontrados solamente en una época de muestreo (seca o lluvia). El sitio de muestreo que mayor riqueza mostró en conjunto (época seca y de lluvia) fue PA con 17 morfo-tipos; el sitio con menor riqueza fue CR con sólo nueve morfo-tipos. La abundancia de esporas varió entre sitios y épocas de muestreo, en promedio la abundancia de esporas fue entre 50 a 400 esporas en 100 gramos de suelo seco en la época seca y de entre 20 a 350 esporas para la época de lluvia (Figura 2B); en ambas temporadas de muestreo, una gran cantidad de las esporas observadas fueron no viables, es decir, no presentaron contenido citoplasmático o se encontraron parasitadas o dañadas (Figura 2B). Los morfo-tipos de HMA que se presentaron con mayor frecuencia en las muestras compuestas de suelo rizosférico fueron Glomus deserticola y Acaulospora scrobiculata con un 87 %, A. spinosa con el 62 %, Diversispora aurantia y Archaeospora schenckii con el 50 % (Figura 3).
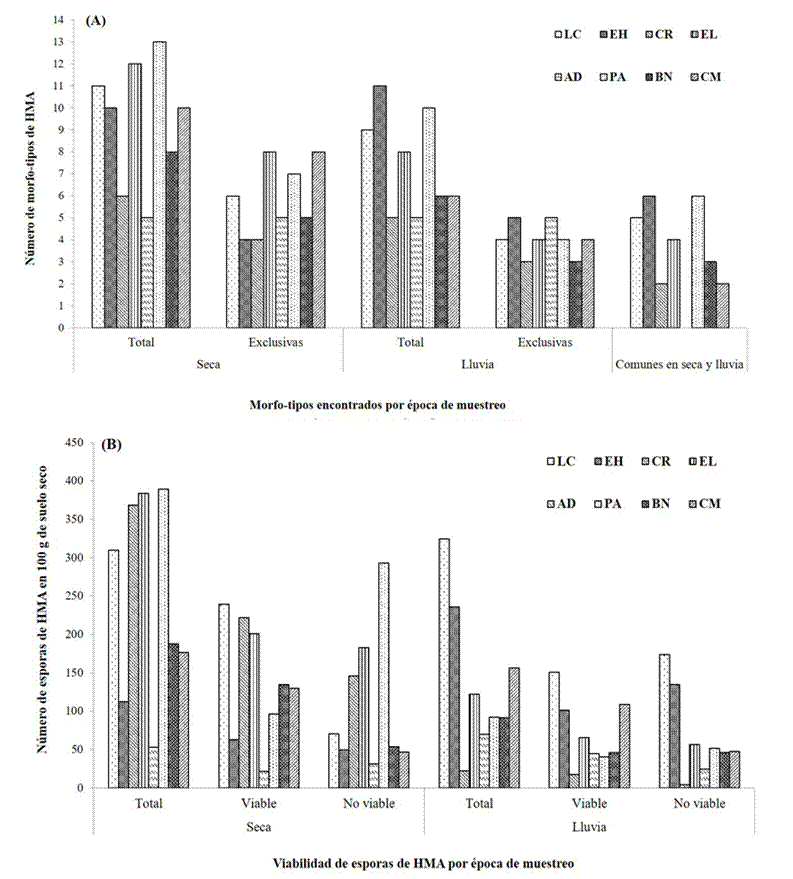
Figura 2 Número de morfo-tipos (A) y abundancia de esporas viables (B) de hongos micorrízicos arbusculares (HMA) en distintos sitios de muestreo durante dos épocas del año (seca y lluvia) en la rizosfera de Agave cupreata del estado de Michoacán. Las Campesinas (LC); El Huizachal (EH); Rancho Carlos Rojas (CR); El Limón (EL); Agua Dulce (AD); Paso Ancho (PA); Barranca de la Nueces (BN); Cerro del Metate (CM).

Figura 3 Riqueza de especies de hongos micorrízicos arbusculares (HMA) registradas en los ocho sitios de muestreo en ambas épocas del año (seca y lluvia) en la rizosfera de Agave cupreata del estado de Michoacán (clave morfo-tipo de HMA ver la Tabla 3).
En las macetas de propagación, en conjunto, se obtuvieron esporas de 12 de los morfo-tipos de HMA registradas de los suelos de campo (31 %). El número de morfo-tipos obtenidos en las macetas varió entre sitios de origen, presentándose la menor cantidad (cuatro morfo-tipos) en el suelo del sitio CM y la mayor (siete) en el suelo del sitio AD; en el sitio CR no hubo propagación (Tabla 3). Rhizophagus intraradices, especie no registrada en los suelos de campo, solo se detectó en macetas de propagación con suelo del sitio LC. Claroideoglomus claroideum, C. etunicatum y A. spinosa fueron los morfo-tipos de HMA mejor propagadas, con 42.3, 147.5 y 60.4 esporas en 100 g de suelo seco, respectivamente.
Discusión
Se registró una gran riqueza de morfo-tipos de HMA asociados a la rizosfera de A. cupreata en ocho sitios de muestreo y dos épocas del año en las regiones mezcaleras del estado de Michoacán exploradas en este estudio, siendo éste el primer reporte sobre riqueza de especies de HMA asociada a la rizosfera de esta especie de agave. Para México se han registrado la presencia de 104 especies de HMA (Chimal-Sánchez et al., 2016), por lo que en este estudio, sin considerar los morfo-tipos potencialmente nuevos, las especies de HMA encontradas en la rizosfera de A. cupreata representan el 28 % de las registradas para México para el género Agave (Alarcón et al., 2012; Chimal-Sánchez et al., 2015). Con respecto a las especies de HMA que se han reportado para el estado de Michoacán, Bárcenas-Ortega et al. (2011) encontraron 49 morfo-tipos de HMA en huertos comerciales de aguacate var. Hass (Persea americana M.), 43 % de los cuales son registrados para Agave cupreata en este trabajo; dentro de estos morfo-tipos en común destaca Diversispora aurantia, especie frecuente encontrada en siete de los ocho sitios de muestreo en las regiones mezcaleras del estado de Michoacán; su presencia en el suelo rizosférico de aguacate (cultivar Hass), de chile poblano (Capsicum annuum L.) (Carballar-Hernández com. pers.) y ahora de A. cupreata, constituyen los únicos registros de esta especie para México. Por otra parte, González-Cortés et al. (2012) encontraron 38 especies de HMA asociadas a bosques de pino-encino, plantaciones de aguacate y campos de maíz en el estado de Michoacán; cerca del 37 % de las especies encontradas por dichos autores son comunes con las reportadas en este estudio.
La ausencia de especies del género Gigaspora en este estudio, contrasta con los datos reportados para aguacate, maíz y bosques de pino-encino en el estado de Michoacán, donde encontraron a Gigaspora albida, G. decipiens, G. gigantea y tres morfo-tipos de Gigaspora designados como sp. (Bárcenas et al., 2007; Bárcenas-Ortega et al., 2011; González-Cortés et al., 2012; Carreón-Abud et al., 2013). Resulta difícil determinar si la ausencia de especies de Gigaspora es debido a que estas especies ya no forman parte de las comunidades de HMA en las plantaciones de Agave cupreata, puesto que, los cambios en la composición de las especies de plantas y la variación estacional influyen en la riqueza y los patrones de esporulación de las especies de HMA (Pringle y Bever, 2002; Lekberg et al., 2007; Oehl et al., 2009), no obstante, llama la atención que para las otras especies de Agave que se han estudiado en México se ha reportado únicamente a una especie, Gigaspora decipiens para Agave potatorum (Carballar-Hernández et al., 2013) o ninguna para A. angustifolia (Ochoa-Meza et al., 2009). En este estudio, como se muestra en la Figura 2A, cada sitio presentó una riqueza de especies singular, en función de la época de muestreo (seca o lluvia) con especies en común y diferentes entre épocas para cada sitio. Al respecto, Su et al. (2011) encontraron que los muestreos en los pastizales de Mongolia durante los meses de mayo a octubre y en cinco especies de plantas influyeron en el número de esporas, la riqueza de especies y el índice de diversidad Shannon-Wiener de los HMA; además encontraron que significativamente la época de muestreo tuvo mayor influencia que el tipo de hospedero. En otros estudios se ha encontrado que los patrones estacionales influyen en diversidad y abundancia de esporas (Šmilauer, 2001; Lugo et al., 2003; Camargo-Ricalde y Esperón-Rodríguez, 2005; Oliveira y Oliveira, 2005; Zangaro et al., 2013). Con respecto a la distribución geográfica, Wolfe et al. (2007) encontraron que la riqueza de comunidades de HMA fue variable aun en pequeñas escalas de muestreo cercanas (parcelas de 2x2 m) sin encontrar una asociación significativa entre la diversidad de las comunidades de HMA y la diversidad de plantas. Coleman-Derr et al. (2016) encontraron una influencia fuerte de la distribución geográfica sobre la diversidad y composición de los recursos microbianos (incluidos los HMA) asociados con Agave deserti Engelm., A. salmiana L. y A. tequilana Weber y señalaron a Glomus y Entrophospora como los HMA presentes, situación que concuerda con los resultados de este trabajo ya que E. infrequens fue una de las especies observada en tres de los sitios estudiados y el género Glomus tuvo el mayor número de especies y una distribución amplia (Tabla 3). No obstante a lo anterior, el hecho de que el 45 % de las especies de HMA registradas en este estudio fueron encontradas dependiendo de la época (seca o lluvia) y a que el 76 % de las especies se encontraron en menos de cuatro sitios, evidencian la importancia de muestrear el suelo en otros momentos del año (inicio y termino de lluvias y de secas) y sitios, para conocer con mayor precisión la diversidad de HMA presentes en los suelos rizosféricos de toda la zona de distribución de especies vegetales particulares, como en este caso en Agave cupreata; igualmente importante será abordar el estudio de la riqueza de HMA por medio de técnicas moleculares que permitan identificar a aquellos que estén presentes no sólo en los suelos, sino en las raíces de la planta (Al-Yahyaʼei et al., 2011).
Los morfo-tipos que podrían representar especies nuevas, deben obtenerse en cultivos monoespóricos para describir detalladamente y con precisión sus características morfológicas en diferentes fases de desarrollo, además de que es necesario procesarlos mediante técnicas de biología molecular para comparar las secuencias genéticas de regiones especificas, como el gen SSU rRNA, con las que existen en las bases de datos y realizar análisis filogenéticos que permitan relacionarlas con otras especies y definirlas como especies nuevas de HMA de origen mexicano (Montaño et al., 2012; Öpik et al., 2013), lo cual no ha sido posible hasta el momento. La riqueza de especies de los morfo-tipos de cada sitio encontrada en las macetas de propagación después ocho meses de propagación disminuyó con respecto a la encontrada en los suelos rizosféricos de A. cupreata de campo a excepción de algunos morfo-tipos que solo se observaron después de la propagación (Tabla 3). La disminución de especies de HMA en macetas de propagación es un fenómeno que se ha documentado previamente para suelos rizosféricos de diferentes tipos de vegetación sometidos a dos años de propagación (Velázquez y Cabello, 2011), indicándose que bajo tales condiciones los HMA de Glomeraceae se evidencian como competidores contra hongos de otras familias. Este fenómeno fue confirmado para un inóculo obtenido a partir de suelo rizosférico de maíz sometido a ocho ciclos de cultivo (Trejo-Aguilar et al., 2013) donde predominó nuevamente Glomeraceae. Es importante señalar que en este estudio se emplearon plantas comúnmente usadas para la propagación (sorgo, alfalfa y cebolla) y plantas de la misma especie de agave de la que procedían los suelos para promover la proliferación de las especies de HMA, no obstante, se presentó un efecto de reducción de especies, el cual pudo deberse en parte a dos aspectos: 1) el cambio de hospedero y de plantas de ciclo corto actúa como un selector de especies de HMA, y 2) la edad de las plantas de agave, dado que las que se usaron como plantas trampa tenían de dos a tres hojas verdaderas después de su germinación y aunque se desarrollaron durante ocho meses, dicho tiempo no fue suficiente para promover la esporulación de más especies de HMA, las que pueden responder al estado fisiológico de la plantas de campo (estrés por nutrimentos, agua o temperatura) que promueve la esporulación de más especies de HMA que las propagadas en invernadero.
Se concluye que la rizosfera de Agave cupreata explorada en ocho sitios de muestreo de la región mezcalera del estado de Michoacán, durante la época seca y de lluvia, presenta una riqueza alta de especies de HMA (38 morfo-tipos). El 55 % de los morfo-tipos fue encontrado en ambas épocas de muestreo, un 29 % de los morfo-tipos únicamente en la época seca y un 16 % en la época de lluvia. Se encontraron morfo-tipos potencialmente nuevos (23 %) para México. Este es el primer reporte de la riqueza de especies de HMA asociadas a la rizosfera de A. cupreata en el estado de Michoacán y México. Es necesario determinar cómo la riqueza de especies de HMA puede influir en el crecimiento y la productividad de las plantas de A. cupreata para proponer estrategias de manejo encaminadas hacia la sustentabilidad de las plantaciones de agave y la conservación de los HMA.











 text new page (beta)
text new page (beta)


