ANTECEDENTES
En todo el mundo se han creado diversas organizaciones que estudian la hidradenitis supurativa, entre ellas, Hidradenitis Suppurativa Foundation, Canadian Hidradenitis Suppurativa Foundation, The HS Trust, British Skin Foundation, European Hidradenitis Suppurativa Foundation y en España la Asociación de Enfermos de Hidrosadenitis (ASENDHI), que ha publicado la iniciativa HERCULES (iniciativa estratégica en hidradenitis supurativa). Consultamos las recomendaciones y los métodos propuestos en estas asociaciones para la atención de los enfermos con hidradenitis supurativa.
La hidradenitis supurativa, conocida también como acné inverso, enfermedad de Verneuil o apocrinitis, es una enfermedad inflamatoria, crónica y recurrente que se manifiesta principalmente en las zonas intertriginosas del cuerpo y se distingue por nódulos subcutáneos, abscesos dolorosos, fístulas y cicatrices hipertróficas.1,2 Estas lesiones se localizan predominantemente en las axilas, la región inguinal y perianal o perigenital, la región glútea y en las zonas inframamarias (esto último en las mujeres).3
Esta enfermedad se distingue por cuatro componentes fundamentales: a) oclusión folicular, b) inflamación, c) alteraciones inmunológicas y d) infecciones polimicrobianas,4 por lo que la atención del paciente con hidradenitis supurativa debe considerar estas características patogénicas para el manejo clínico integral.5 La oclusión folicular es la principal característica clínica reportada en la bibliografía. En las etapas tempranas de la enfermedad se desarrolla una perifoliculitis linfocítica, hiperqueratosis folicular, específicamente infundibular, seguida de la ruptura de la estructura folicular.6,7
Casi un tercio de los pacientes con hidradenitis supurativa tienen antecedentes familiares porque se hereda de manera autosómica dominante.1 Se ha reportado que incluso 34% de los familiares en primer orden de los que sufren esta enfermedad pueden llegar a padecerla. En un estudio realizado en la unidad de proctología del servicio de gastroenterología en el Hospital General de México, realizado mediante la revisión de 12,689 expedientes, se encontraron 15 casos de hidradenitis supurativa, es decir, una prevalencia de 1 en cada 846 pacientes (0.12%), valor menor al reportado en otros estudios previos.8 Las mujeres tienen mayor probabilidad de padecer esta afección después de la pubertad.9
Las comorbilidades reportadas con más frecuencia en la bibliografía son la obesidad, el síndrome metabólico y la diabetes mellitus.3 Sin embargo, también se reportan con menos frecuencia las espondiloartropatías, dislipidemia, reacciones alérgicas de hipersensibilidad, enfermedad inflamatoria intestinal, síndrome de ovario poliquístico, dependencia de drogas, hipertensión, linfoma y enfermedad tiroidea, la enfermedad de Crohn -con la que se comparten muchas características y puede ser confundida con hidradenitis supurativa -, la espondilitis anquilosante y también se ha descrito anemia como complicación de la enfermedad atribuida al proceso inflamatorio de la hidradenitis supurativa que se agrava por la pérdida de sangre a través de las lesiones fistulares, que pueden generar el agotamiento que se reporta en diversos estudios.3,10-14
En los pacientes con hidradenitis supurativa, existe alta prevalencia de infecciones por Staphylococcus aureus, Staphylococcus coagulasa negativos y Corynebacterium sp. Asimismo, Propionibacterium acnes fue otra especie localizada como biopelícula en los folículos del cabello y tractos sinusales de las lesiones.15 Además, existen hallazgos crecientes que sugieren una respuesta inmunológica disfuncional en el sistema innato y en el adaptativo.16
En un estudio de casos y controles se identificaron cinco tipos de microbiomas en pacientes con hidradenitis supurativa (87% de ellos con escala II de Hurley): Corynebacterium (tipo I), Acinetobacter y Moraxella (tipo II), Staphylococcus epidermidis (tipo III), Porphyromonas y Peptoniphilus (tipo IV), Propionibacterium acnes (tipo V). Los microbiomas que más predominaron son I y IV. Este último no se detectó en controles sanos. Además, se detectó más Propionibacterium en los controles sanos, lo que sugiere que esta bacteria desempeña una función en la patogénesis de dicha enfermedad.17 Este hallazgo no revela las susceptibilidades antibióticas de los microorganismos evaluados ni la cuenta bacteriana, solo la existencia o no de material genético, por tanto, esta evidencia no tiene relevancia clínica o terapéutica porque sólo sugiere una vía de patogénesis enfocada a las bacterias y el huésped.
La severidad de la enfermedad se relaciona con el sexo masculino, el índice de masa corporal, el número de cajetillas de cigarro consumidas por año y la ubicación de las lesiones (las axilas, la región perianal e inframamaria son las de mayor severidad).18
El efecto económico en el manejo clínico de la hidradenitis supurativa es un tema relevante debido a que hay estudios que indican que el tratamiento de la enfermedad representa mayor costo por consultas, ingresos a urgencias, ingreso hospitalario y cirugías, en comparación con otras enfermedades inflamatorias o autoinmunitarias, como psoriasis.19,20
Debido a la apariencia, topografía, dolor y mal olor de las lesiones, los pacientes con hidradenitis supurativa sufren efectos considerables en diversos aspectos en su calidad de vida,21,22 como la salud sexual,21 salud mental23 y productividad laboral.24 Además, el diagnóstico de estos pacientes puede tardar años, lo que implica retraso en el acceso al tratamiento adecuado.25
La hidradenitis supurativa se considera una enfermedad inflamatoria no infecciosa; sin embargo, los tratamientos antiinflamatorios esteroides e inmunomoduladores no selectivos no han mostrado efectividad satisfactoria, por lo que se ha propuesto la administración de antibióticos para el manejo clínico, según la severidad de las lesiones.(26,27
Aunque no existen datos precisos de recurrencia tras el tratamiento farmacológico, en general, se ha observado que después de la suspensión del tratamiento farmacológico ocurre recurrencia de la hidradenitis supurativa en todos los tratamientos. De acuerdo con las guías clínicas europeas S1 para el tratamiento de la hidradenitis supurativa,28 en los procedimientos quirúrgicos de lesiones individuales se ha reportado una tasa de recurrencia muy variable que va de 1.1 a 69.9% de acuerdo con la técnica usada en la cirugía, entre las que se incluyen el destechamiento, la escisión de la lesión, el láser de CO2 y la electrocirugía, mientras que con la cirugía radical la recurrencia es de 1.75 a 34%.
Las características de la enfermedad representan un reto para los médicos tratantes, debido a la complejidad y las diversas comorbilidades asociadas con la misma; por lo anterior, es conveniente que los pacientes con hidradenitis supurativa sean evaluados por internistas para realizar las evaluaciones clínicas y paraclínicas pertinentes y, de esta manera, llegar al diagnóstico integral, dar el tratamiento más adecuado a cada caso y, de ser necesario, encauzar al paciente a la subespecialidad correspondiente. Por ello, mediante una reunión de consenso se han desarrollado estas recomendaciones de tratamiento de acuerdo con las condiciones que prevalecen en México. La reunión se realizó el 25 de enero de 2018 en la Ciudad de México a la que se invitó a médicos especialistas en el área de Dermatología, Coloproctología, Cirugía general, Cirugía plástica, Infectología, Ginecología y Medicina interna con experiencia clínica en la atención de pacientes con hidradenitis supurativa.
MÉTODO
Se convocó a un grupo multidisciplinario de médicos con experiencia en el tratamiento de la hidradenitis supurativa desde su área de especialización, como Medicina interna, Dermatología, Ginecología, Cirugía, Infectología y Proctología. Antes de la reunión se realizó la búsqueda sistemática de bibliografía de la que se seleccionaron los textos que daban sustento a la discusión. Se recuperaron 1563 publicaciones, de las que se seleccionaron 59 para el análisis. No se consideraron resúmenes de conferencias o carteles (pósters), debido a su bajo grado de evidencia.
Después de la discusión de los temas con los panelistas se incluyeron otros artículos. La mayor parte de los artículos fueron de bajo nivel de evidencia debido a que los estudios fueron observacionales, retrospectivos con una población de estudio pequeña. Los documentos se calificaron de acuerdo con su nivel de evidencia y el grado de recomendación mediante la metodología de GRADE (ver archivo complementario).
Ante la escasa evidencia científica de esta enfermedad, gran parte de las recomendaciones hacen referencia a ensayos clínicos con poblaciones pequeñas, cohortes, reportes de casos y opinión de los expertos convocados. Este documento está segmentado por los temas más relevantes relacionados con el manejo clínico de los pacientes con hidradenitis supurativa con base en la bibliografía revisada (ver archivo complementario) y las aportaciones de los expertos, con la finalidad de consensar una estrategia clínica, desde la atención primaria hasta el segundo y tercer nivel de atención.
Las recomendaciones fueron emitidas y consensuadas por los expertos invitados a esta reunión, con un acuerdo de 100% en cada una de ellas.
Diagnóstico clínico
Recomendación 1
El diagnóstico de la enfermedad debe hacerse considerando las características topográficas, la morfología de las lesiones, la cronicidad y su recurrencia. (Nivel de evidencia [NE] 4; Grado de recomendación [GR] 1; Grado de acuerdo [GA] 100%)
El diagnóstico de la hidradenitis supurativa se establece mediante la evaluación de la morfología, localización y evolución de las lesiones (dos recurrencias en seis meses o lesiones crónicas o recurrentes ≥ 3 meses).3 Para ello deben considerarse tres criterios:
Topografía: axilas, pliegues inframamarios, área genital, inguinal e interglútea (áreas con mayor densidad de glándulas apocrinas).
Lesiones típicas: nódulos, abscesos, fístulas con o sin drenaje, y cicatrices hipertróficas, retráctiles o en acordeón (Figura 1).
Evolución: crónica y recidivante: al menos dos brotes en seis meses.
Con base en la experiencia clínica de los expertos y debido a la escasa evidencia disponible, se consideró que los comedones dobles no son relevantes para el diagnóstico.5,29
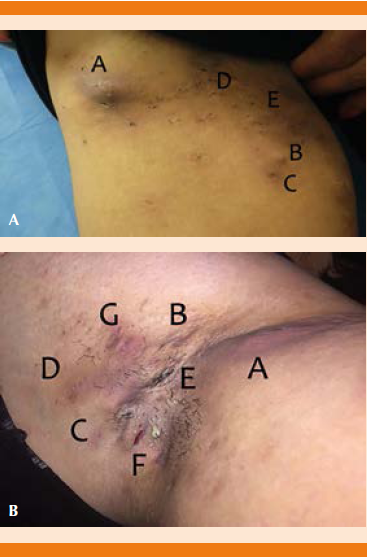
Figura 1 Tipos de lesiones en hidradenitis supurativa. A. Imagen clínica de la región inguinal con hidradenitis supurativa. Se observan diferentes lesiones dermatológicas (cortesía de la Dra. Lorena Estrada Aguilar). A: absceso; B: nódulo no inflamatorio; C: nódulo inflamatorio; D: comedones dobles; E: cicatriz hipertrófica. B. Imagen clínica de la región axilar con hidradenitis supurativa. Se observan diferentes lesiones dermatológicas (cortesía de la Dra. Yakelín Morales Miranda). A: fístula no drenante; B: cicatriz hipertrófica; C: nódulo no inflamatorio; D: nódulo inflamatorio; E: cicatriz retráctil; F: fístula drenante;G: absceso.
En hidradenitis supurativa, la recurrencia, cronicidad, morfología y localización de las lesiones son los elementos clave para el diagnóstico de la enfermedad.3 En el diagnóstico diferencial debe descartarse acné vulgar, enfermedad pilonidal, pioderma folicular, granuloma inguinal, linfogranuloma venéreo, actinomicosis, enfermedad por arañazo de gato, tuberculosis cutánea y esteatocistomas múltiples, entre otras.
Hasta el momento se desconoce si el tratamiento antibiótico modifica la recurrencia de la enfermedad.30 Existen diversos reportes que mencionan que la escisión amplia es la técnica quirúrgica con menor recurrencia de la enfermedad poscirugía (13% de recurrencia).31 Lo que sí se ha mencionado es que la suspensión de tratamiento o cirugía ocurre en aproximadamente 43% de la población.28
Otro aspecto determinante para lograr el adecuado manejo clínico de la hidradenitis supurativa es el establecimiento de un diagnóstico temprano y oportuno, porque se ha reportado que la falta de diagnóstico retrasa el tratamiento incluso ocho años.25
Recomendación 2
El ultrasonido no es una técnica indispensable para el diagnóstico de hidradenitis supurativa. (NE 2; GR 1; GA 100%)
No existen pruebas diagnósticas confirmatorias en hidradenitis supurativa; la ultrasonografía es, por ahora, una herramienta complementaria en casos específicos en que se requiere apoyo para toma de decisiones quirúrgicas.32 Se requiere mayor evidencia para posicionarla como criterio diagnóstico.
Recomendación 3
La falla de la terapia con antibióticos tópicos por más de siete días es un criterio relevante para el manejo de los pacientes con hidradenitis supurativa. Si no hay respuesta a la terapia inicial en el primer contacto, el diagnóstico diferencial deberá realizarlo un dermatólogo. (NE 4; GR 1; GA 100%)
Ante la falta de respuesta a antibióticos durante siete días, los expertos recomiendan que el paciente debe ser referido a dermatología. A partir de la evaluación del dermatólogo el paciente podrá ser derivado a ginecología, proctología o a la especialidad que corresponda.
Calidad de vida
Recomendación 4
Se debe evaluar el efecto en la calidad de vida del paciente con hidradenitis supurativa, abarcando los aspectos físico, emocional, social y laboral. (NE 3; GR 1; GA 100%)
El paciente con hidradenitis supurativa sufre diversas afectaciones en su calidad de vida. El inicio tardío de la enfermedad se vincula con baja calidad de vida sexual.21 El efecto emocional de la enfermedad es fuerte, desde estigmatización, depresión, ansiedad, hasta el grado de provocar aislamiento social.33-37 La hidradenitis supurativa con frecuencia ocasiona ausentismo laboral, que afecta negativamente la productividad de los pacientes y puede llevar al desempleo.38
Estadificación y clinimetría
Existen diversas escalas para valorar la severidad de la hidradenitis supurativa; a continuación, mencionamos recomendaciones para tres de las escalas más utilizadas en México. Además, a principios de 2018 se presentó la escala Severity Assessment of Hidradenitis Suppurativa score
(SAHS), como alternativa para que los médicos puedan dar seguimiento de la respuesta al tratamiento. Esta escala demostró correlación positiva moderada con la escala modified Hidradenitis suppurativa score (mHSS) y correlación positiva baja con la escala Hurley; no obstante, aún es necesario hacer más estudios de validación para obtener evidencia de la utilidad e interpretabilidad de la escala.39
Recomendación 5
La escala de Hurley es adecuada para valorar la severidad de la hidradenitis supurativa y estratificar a los pacientes diagnosticados. (NE 2; GR 1; GA 100%)
Debido a su simplicidad, rapidez y correcto enfoque, la escala Hurley es de uso común en la clínica, principalmente para la estadificación inicial y para guiar en la decisión terapéutica (Figura 2); sin embargo, por ser una escala diseñada con fines quirúrgicos, no permite detectar el componente inflamatorio de la enfermedad e impide medir la respuesta al tratamiento prescrito.5,18
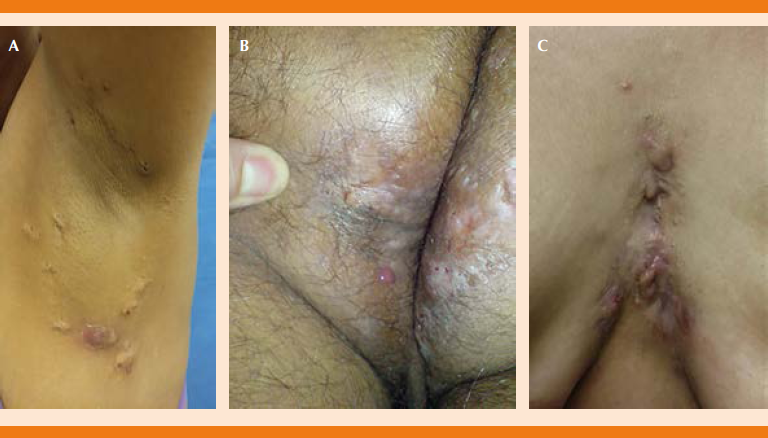
Modificada de la referencia 28.
Imágenes cortesía de la Dra. Lorena Estrada Aguilar.
Figura 2 Clasificación y valoración de la severidad de hidradenitis supurativa por la escala de Hurley. A. Etapa 1: formación de abscesos, sencillos o múltiples. No hay fístulas ni cicatrices. B. Etapa II: abscesos re currentes con formación de tractos y cicatrización, sencillos o múltiples. Lesiones muy separadas. C. Etapa III: lesiones difusas o interconectadas. Múltiples fístulas y cicatrices. Abscesos alrededor de toda el área afectada.
Recomendación 6
La escala de iHS4 es adecuada para valorar la severidad de la hidradenitis supurativa considerando su componente inflamatorio. Ayuda a estratificar a los pacientes diagnosticados y a elegir el tratamiento adecuado. (NE 2; GR 1; GA 100%)
La escala iHS4 permite valorar la severidad de la enfermedad de manera dinámica. Se puede utilizar en ensayos clínicos o en estudios de la vida real. Los resultados del proceso de validación de esta escala indican buena correlación con la clasificación Hurley, la escala modificada Sartorius, la valoración global del médico y la opinión de los expertos.40
Recomendación 7
La escala HiSCR es adecuada para valorar la respuesta al tratamiento debido a la facilidad de su aplicación y la sensibilidad para detectar alivio de las lesiones de los pacientes con hidradenitis supurativa. (NE 2; GR 1; GA 100%)
La escala sobre respuesta clínica de hidradenitis supurativa (HiSCR) es una herramienta útil para evaluar la respuesta a los tratamientos en pacientes con hidradenitis supurativa. La HiSCR50 se define como la reducción en al menos 50% en el conteo total de abscesos y nódulos inflamados, sin incremento en el conteo de abscesos y fístulas drenantes con respecto a los valores basales. Comparativamente, la HiSCR ha mostrado mayor respuesta de cambio que la HS-PGA en pacientes con hidradenitis supurativa.32
Recomendación 8
La valoración de la calidad de vida y la escala del dolor del paciente son importantes para su estadificación. (NE 2; GR 1; GA 100%)
El dolor es el síntoma más importante y debilitante de la hidradenitis supurativa; comúnmente se relaciona con lesiones nodulares inflamadas profundas que afectan la calidad de vida.28 La calidad de vida y el dolor son características esenciales en la clinimetría de la enfermedad, por ello se recomienda valorarlas con herramientas como el cuestionario DLQI (puede ser consultado y descargado desde: http://sites.cardiff.ac.uk/dermatology/quality-of-life/dermatology-quality-of-life-index-dlqi/dlqi-different-language-versions/), que correlaciona estrechamente los aspectos dermatológicos con la calidad de vida de los pacientes41 y la escala visual análoga de do lor, que es la herramienta de valoración del nivel de dolor.42
Manejo terapéutico en primer nivel de atención
Recomendación 9
Los médicos de primer contacto deben realizar el control oportuno de las comorbilidades y los factores de riesgo y hacer recomendaciones de cuidado personal. (NE 3; GR 1; GA 100%)
La obesidad y el tabaquismo son factores predisponentes ampliamente descritos en la hidradenitis supurativa. Se ha demostrado que el índice de masa corporal está significativamente relacionado con la hidradenitis supurativa.43 La obesidad es un factor de riesgo de severidad44 y contribuye a la ineficacia farmacológica en enfermedades dermatológicas inflamatorias.45 Asimismo, el tabaquismo se ha identificado como factor predisponente porque el consumo de tabaco en pacientes diagnosticados con hidradenitis supurativa se vincula con mayor severidad clínica de la enfermedad.43
El uso de ropa ajustada es un factor de riesgo asociado con la hidradenitis supurativa porque se considera que repercute en el cuadro clínico del paciente.44 Se recomienda evitar el uso de ropa ajustada, la depilación mecánica y los productos de limpieza íntima.
Recomendación 10
El tratamiento farmacológico deberá administrarse a los pacientes diagnosticados con hidradenitis supurativa desde el estadio Hurley I. La administración de agentes tópicos, sistémicos, biológicos o los tres dependerá del nivel de aten ción y de la severidad clínica de la enfermedad. (NE 3; GR 1; GA 100%)
En pacientes con severidad clínica Hurley I se recomienda que los médicos de primer contacto indiquen clindamicina tópica 1%, 10 mg/ mL cada 12 h durante 7 días (Figura 3).46 Si la severidad clínica es mayor, antes de ser referido a especialidad, se puede: 1) drenar los abscesos localizados, 2) limpiar con jabón neutro (una o dos veces al día), 3) aplicar sulfato de cobre o polvo de cinc, cobre y alcanfor sobre la lesión en forma de fomentos, 4) indicar tratamiento con antibióticos sistémicos durante 7 días (las dosis de antibióticos comúnmente prescritas son: rifampicina + clindamicina oral, 600 mg/600 mg cada 24 h durante 10-12 semanas; ertapenem (intramuscular), 1 g/día durante 7 días; sonrifampicina + moxifloxacino, 600 mg/400 mg cada 24 h durante seis semanas; metronidazol, 500 mg cada 8 h durante seis semanas; rifampicina + moxifloxacino, 600 mg/400 mg cada 24 h durante 6 semanas). No se recomienda la administración de analgésicos tópicos (como lidocaína 5% y diclofenaco 1% en gel) por el alto riesgo de dermatitis por contacto, secundaria a la aplicación de estos productos.
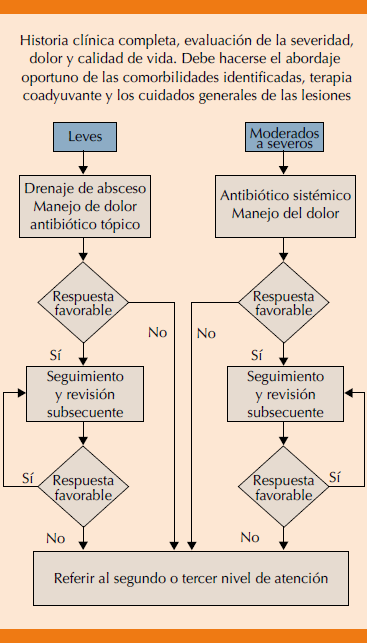
Figura 3 Algoritmo propuesto para el manejo de lahidradenitis supurativa en la atención primaria. Nota: La severidad clínica puede medirse con cualquiera de las escalas disponibles (Hurley, HiSCR, iHS4). La calidad de vida dermatológica se mide con la escala DLQI. Para valorar la severidad del dolor usar la Escala Visual Análoga.
Recomendación 11
Los médicos de primer nivel de atención deben comenzar el manejo del dolor con base en la escalera de manejo del dolor de la Organización Mundial de la Salud (OMS). (NE 3; GR 1; GA 100%)
Los expertos recomiendan el uso de la Escalera de Manejo del Dolor, emitida por la Organización Mundial de la Salud.47
Manejo terapéutico en segundo y tercer nivel de atención
Recomendación 12
En pacientes con Hurley I, atendidos en el segundo nivel de atención puede administrarse resorcinol 15% tópico en segunda línea de tratamiento. (NE 4; GR 2; GA 100%)
Existe evidencia que recomienda la administración de resorcinol tópico 15% cada 12 horas durante un mes en pacientes con Hurley I y II.48 Sin embargo, en México no se cuenta con experiencia en la administración de esta terapia.
Recomendación 13
Los pacientes con Hurley I en segundo nivel de atención pueden ser tratados con glucocorticoides por vía intralesional. (NE 3; GR 1; GA 100%)
Se recomienda la aplicación intralesional de glucocorticoides en dosis de 10 mg/mL durante siete días (acetónido de triamcinolona o betametasona) como monoterapia o coadyuvante en inflamación aguda localizada. Con esta terapia se ha reportado reducción significativa de eritema, edema, supuración y tamaño de la lesión en pacientes con hidradenitis supurativa.49
Recomendación 14
Se recomienda la administración de clindamicina + rifampicina vía oral como tratamiento antibiótico para pacientes Hurley II o III en el segundo y tercer nivel de atención. (NE 3; GR 1; GA 100%)
Existe evidencia limitada de la combinación de clindamicina más rifampicina (600 mg/600 mg cada día durante 10 a 12 semanas), no obstante, se ha demostrado eficacia y un perfil de seguridad aceptable.50,51 Este tratamiento combinado reduce las tasas de resistencia, además de sus propiedades antiinflamatorias debido a su efecto inmunomodulador.52
Recomendación 15
En pacientes con intolerancia a la clindamicina, o Hurley III se recomienda ertapenem IM + rifampicina + moxifloxacino + metronidazol vía oral. (NE 3; GR 1; GA 100%)
Un esquema alternativo a 12 semanas para pacientes intolerantes a clindamicina o en estadios Hurley III es ertapenem 1 g/día vía IM durante 7 días, seguido de rifampicina 600 mg/día más moxifloxacino 400 mg/día y metronidazol 500 mg tres veces al día durante seis semanas; las siguientes seis semanas se administran rifampicina 600 mg/día más moxifloxacino 400 mg/día.53 En los casos en que no hay respuesta en 12 semanas de tratamiento, o cuando el paciente no tolere o tenga alguna contraindicación al tratamiento, se recomienda prescribir inmunomoduladores sistémicos. Es importante vigilar constantemente al paciente siempre que se prescriban antibióticos porque su administración se asocia con la generación de eventos adversos, como dolor abdominal, náusea, vómito, leucopenia transitoria o alteración de la función hepática, así como interacciones y resistencia bacteriana.
Recomendación 16
Ante el fallo a otros tratamientos se recomienda adalimumab (administración aprobada en México) en el tratamiento de hidradenitis supurativa. (NE 1; GR 1; GA 100%)
En casos resistentes o de difícil control, se recomienda la administración de agentes biológicos, siempre bajo la supervisión de un especialista. Los médicos tratantes deben poner mucha atención en el tratamiento de las comorbilidades y las complicaciones derivadas de la enfermedad. En estos pacientes es fundamental la búsqueda intencionada de tuberculosis latente, que puede realizarse mediante PPD o ensayos de liberación de interferón gamma (por ejemplo, QuantiFERON Gold Plus). En caso de resultado positivo debe realizarse nuevamente la historia clínica completa y una radiografía de tórax para descartar tuberculosis activa y referir para tratamiento en cualquiera de los casos.
Entre los agentes biológicos, adalimumab es el que tiene el mejor perfil de eficacia y seguridad (> 50% de la población con mejoría clínica). Este medicamento debe prescribirse bajo el esquema siguiente: dosis inicial de 160 mg, 80 mg en la semana 2 y 40 mg semanales a partir de la semana 4. La recurrencia después de la suspensión del medicamento se reportó en 71% de los pacientes.54
Los estudios realizados con etanercept no ofrecen evidencia concluyente, aunque se sabe que su eficacia es menor en comparación con adalimumab; su prescripción queda a criterio del médico tratante.54-57
Infliximab también se ha probado en pacientes con hidradenitis supurativa y, aunque se percibe un efecto benéfico, no se han obtenido resultados concluyentes que permitan recomendarlo.54
Se han realizado investigaciones con ustekinumab, con poblaciones muy pequeñas o en estudios abiertos, por lo que los resultados no son concluyentes. Es importante que la prescripción de agentes biológicos la realicen y supervisen médicos con experiencia en la administración de estos fármacos.58
Se debe dar seguimiento adecuado a los pacien tes con anemia, porque al reducirla, es posible que los pacientes tengan mejor respuesta al tratamiento contra la hidradenitis supurativa. En el estudio de Tennat12 se planteba la hipótesis de que la fatiga de los pacientes con hidradenitis supurativa es causada por anemia; no obstante, en el estudio de Miller se identificó que no existe tal relación, aunque en los casos de pacientes con hidradenitis supurativa que también tienen anemia, 60% es de tipo normocítico y 40% de tipo microcítico.13
Tratamiento de subgrupos específicos de pacientes con hidradenitis supurativa
Recomendación 17
En el subgrupo de pacientes en los que predomina la oclusión folicular puede prescribirse isotretinoína en el tratamiento de la hidradenitis supurativa (administración no aprobada en México) siempre y cuando sea recomendado por un médico con experiencia en la administración de este medicamento. (NE 4; GR 2; GA 100%)
En los pacientes en que predomina la oclusión folicular se recomienda parcialmente la administración de isotretinoína (prescripción no aprobada en México) a dosis de 0.45 ± 0.20 mg/kg cada 24 h, hasta la remisión de los síntomas; debe prescribirla un médico con experiencia en su administración. Los resultados de estudios clínicos indican que es más efectiva en pacientes con severidad clínica Hurley I y II y menos eficaz en pacientes con mayor severidad.59
Recomendación 18
En pacientes de hidradenitis supurativa con datos de hiperandrogenismo pueden prescribirse agentes antiandrogénicos en el tratamiento de la hidradenitis supurativa (administración no aprobada en México), siempre y cuando los recomiende un especialista en ginecología o endocrinología. (NE 4; GR 2; GA 100%)
No hay evidencia que sustente la administración de agentes antiandrogénicos como finasterida, 5 mg cada 24 h durante 3 meses (administración no aprobada en México), aunque se ha sugerido que pueden ser útiles en el tratamiento de pacientes con hidradenitis supurativa e hiperandrogenismo.60 En hombres los eventos adversos son relativamente benignos y transitorios, mientras que está contraindicado en mujeres en edad fértil o embarazadas, por la teratogenicidad y la sensibilidad y agrandamiento de las mamas, y el potencial de feminización de los fetos varones.61 En caso de requerirse, estos fármacos deberán ser indicados por el internista o especialistas en ginecología o endocrinología, y solo en casos específicos donde exista evidencia de hiperandrogenismo.
Asimismo, la combinación de etinilestradiol/ciproterona 50 mg/50 mg administrada en régimen inverso ha demostrado eficacia en el tratamiento de la hidradenitis supurativa, medida en términos de reducción del número de lesiones y estado libre de enfermedad a 18 meses.62
Recomendación 19
Puede prescribirse metformina en pacientes con hidradenitis supurativa únicamente si tienen síndrome metabólico (administración no aprobada en México), siempre y cuando la recomiende un especialista con experiencia en su administración. (NE 4; GR 2; GA 100%)
Se han realizado estudios con la administración de metformina de 500 a 1500 mg cada 24 horas durante 3 meses en pacientes que no responden a otras terapias (administración no aprobada en México), principalmente en mujeres embarazadas con síndrome de ovario poliquístico para evaluar en ellas la reducción de las complicaciones intraparto.63,64 Los resultados demuestran eficacia en pacientes con hidradenitis supurativa, evaluada mediante la reducción en la escala Sartorius, disminución del ausentismo laboral y mejoría de la calidad de vida de acuerdo con la escala DLQI.65 Respecto a la prescripción de metformina en hidradenitis supurativa, se recomienda que se ofrezca como parte de una terapia combinada y bajo la supervisión de un especialista ginecólogo o endocrinólogo con experiencia en el manejo de este medicamento.
Recomendación 20
La administración de prednisona oral o la combinación de tetraciclina oral con colchicina solo se recomienda como terapia de rescate contra la hidradenitis supurativa (NE 3; GR 2; GA 100%)
No hay evidencia que sustente la administración de prednisona o colchicina; no obstante, pueden prescribirse como medicamento de rescate en hidradenitis supurativa. Se sugiere una dosis de 0.5-0.7 mg/kg de prednisona vía oral de administración a corto plazo para la atención de exacerbaciones;28 o colchicina vía oral en combinación con tetraciclina vía oral (0.5 mg de colchicina dos veces al día /100 mg de tetraciclina/día) durante 3 meses.66 Es recomendable que estos medicamentos los prescriban médicos con experiencia en su administración.
La dapsona es un medicamento autorizado por la autoridad sanitaria para su distribución en el mercado mexicano. El consenso reconoce que la administración de dapsona en la clínica es una realidad. En la bibliografía se encuentran algunos experimentos con pocos pacientes67,68 y con resultados muy variables, por ello es importante que el médico tratante estime el beneficio de prescribir este tratamiento. Existe poca evidencia en relación con la adminis tración de doxiciclina en hidradenitis supurativa, en comparación con otras tetraciclinas; por ejemplo, el estudio de Ardon,69 en el que ambos productos no fueron tan eficaces; no obstante, se han prescrito frecuentemente a dosis de 100 a 200 mg/día por periodos de incluso 3 meses. El efecto inmunomodulador de la tetraciclina, además de su efecto antibiótico, hace que este fármaco, así como la clindamicina, sean mejores opciones para tratar esta enfermedad.
Asimismo, la administración de dicloxacilina está poco documentada para tratar esta enfermedad y los resultados no permiten recomendar su prescripción en el tratamiento de este padecimiento.
En México no se distribuye azitromicina en solución tópica, por lo que en este consenso no se recomienda su administración.
Manejo quirúrgico
Recomendación 21
La intervención quirúrgica en la hidradenitis supurativa debe hacerse como complemento del tratamiento médico. Los procedimientos quirúr gicos deben realizarse de manera oportuna en los pacientes que lo requieran según la severidad del cuadro clínico o para evitar eventos adversos. (NE 3; GR 1; GA 100%)
En hidradenitis supurativa el tratamiento médico y el quirúrgico se consideran complementarios. La cirugía local es útil en enfermedad temprana (Hurley I), mientras que la cirugía radical se recomienda en pacientes con enfermedad persistente pero localizada o con secuelas de la misma.63
Los procedimientos quirúrgicos en el primer nivel de atención deben limitarse al drenaje de abscesos en los casos de Hurley I; al mismo tiempo, el paciente podrá recibir tratamiento con antibióticos sistémicos y analgésicos según sea el caso. Si a pesar de esto el proceso persiste, el paciente deberá ser derivado al especialista correspondiente porque es más probable la recurrencia de la enfermedad en pacientes con mayor severidad clínica.70 Los criterios recomendados para realizar el drenaje de una lesión localizada, en etapa Hurley I, en primer nivel de atención son: a) la existencia de abscesos y b) los signos de inflamación y fluctuación. La derivación a los servicios de especialidad dependerá del tipo y localización de la lesión (Figura 4).

Figura 4 Algoritmo propuesto para el manejo de la hidradenitis supurativa en segundo y tercer nivel de atención en salud.
En el caso de pacientes en etapa Hurley II o III que sean referidos a cirugía oportuna se pueden realizar procedimientos de destechamiento (deroofing), resección localizada y resección amplia. El tipo de cirugía usado en cada caso será valorado por el especialista, aunque la evidencia señala que la resección amplia utilizando colgajos o injertos de piel tienen la menor tasa 2019 julio-agosto;35(4) de recurrencia de la enfermedad (13% [IC95%, 5-22%]), seguida de incisión local (22% [IC95%, 10-37%]) y destechamiento (27% [IC95%, 23 31%]).31
Se ha reportado que después de la cirugía los pacientes están sumamente satisfechos con los resultados, al tiempo que en la evaluación de calidad de vida (no dermatológica) el promedio aumentó significativamente de 5.0 en la etapa preoperatoria a 8.4 después de la cirugía.71 Se recomienda el seguimiento posoperatorio convencional y el tratamiento médico sistémico en caso necesario.
Otros tratamientos
Recomendación 22
Cuando las lesiones son amplias, está indicado el tratamiento farmacológico en monoterapia o combinado con cirugía radical. Para el tratamiento de lesiones recurrentes en áreas localizadas se han desarrollado otras alternativas de tratamiento intervencionista contra la hidradenitis supurativa, específicamente contra lesiones localmente recurrentes que, en beneficio de los pacientes, dejan cicatrices menos notorias y reducen la cantidad de lesiones crónicas. Entre éstas están la terapia láser y otras terapias lumínicas. Estas alternativas aún no se usan ampliamente en todo el mundo y no están disponibles en todos los centros de salud en México.
La terapia con láser de CO2 se usa en dos técnicas; la primera es la resección en bloque, en la que se extraen áreas de piel; esta técnica permite menor sangrado y mejor visualización que las resecciones estándar.72,73 Esta técnica se recomienda para pacientes con lesiones estacionarias en estadios Hurley II y III.74 La técnica de cirugía de vaporización se utiliza en pacientes con lesiones pequeñas y estacionarias.74 La zona debe tratarse en varias ocasiones hasta lograr la destrucción del tejido objetivo.28 Con esta técnica la tasa de complicación y de infección de las lesiones es baja.75
Otra alternativa aún en investigación es la utilización de láser Nd-YAG (acrónimo del inglés neodymium-doped yttrium aluminium garnet). El objetivo del tratamiento es reducir la actividad de la enfermedad mediante la destrucción de los folículos.74 Esta técnica se aplica una vez al mes durante cuatro meses, y sus efectos parecen mantenerse hasta por dos meses después de la última sesión.28 El mecanismo de acción es a través de la disminución de la cantidad de brotes dolorosos de hidradenitis supurativa al reducir el número de folículos pilosos, glándulas sebáceas y la carga bacteriana en las zonas afectadas.75 Se considera que esta técnica ayuda en mayor medida a los pacientes con hidradenitis supurativa con el subfenotipo folicular.76
Otra alternativa en el tratamiento de la hidradenitis supurativa es la luz pulsada intensa (intense pulsed light, IPL); es una fuente de luz policromada, de amplio espectro, que emite luz en longitudes de onda de 390 a 120 nm. En el rango de longitud de onda de 420 a 550 nm el pulso se enfoca en destruir al cabello pigmentado con melanina mediante el proceso de fototermólisis.77,78
DISCUSIÓN
Se han desarrollado varios documentos a manera de guía de práctica clínica en diferentes regiones del mundo,28,63,79-82 en los que es patente la dificultad de diagnosticar la enfermedad debido a las semejanzas con otros padecimientos de la piel. Asimismo, se ha identificado que los pacientes tardan mucho tiempo en recibir la atención de un especialista, por lo que la enfermedad puede avanzar y, en consecuencia, afectar la calidad de vida. La cirugía y las terapias farmacológicas han sido parte fundamental del tratamiento de la hidradenitis supurativa siempre que el paciente recibe la atención adecuada, por lo que es imprescindible que el médico de primer contacto tenga la capacidad de identificar, tratar la enfermedad en casos leves y, en casos graves, derivar al paciente con un especialista que podrá implementar tratamientos específicos acordes con la severidad de la enfermedad.
En este consenso se abordaron los temas que hemos considerado más relevantes para la atención de los pacientes con hidradenitis supurativa en México considerando la experiencia clínica de los especialistas invitados.
Áreas de oportunidad
Este consenso representa el primer intento por estandarizar la práctica médica en relación con el manejo de la hidradenitis supurativa en México en todos los niveles de atención. Esto representa un gran avance en el desarrollo de una medicina basada en la evidencia que permita ofrecer al paciente un diagnóstico más rápido y certero, ahorro en el gasto de recursos médicos para las instituciones de salud y para el propio paciente, así como la aplicación de terapias eficaces y seguras que permitan controlar el avance de esta enfermedad.
Sin embargo, aún existe la necesidad de fomentar la evaluación continua de la práctica clínica, el desarrollo de investigación enfocada a aspectos relevantes de la enfermedad y a la valoración de nuevos tratamientos con alto beneficio para el paciente, además del manejo de información epidemiológica que ayude a caracterizar el efecto de esta enfermedad en la salud pública, así como favorecer actividades académicas que van desde la descripción del estado del arte y generación de foros nacionales, hasta la consolidación de equipos de trabajo que valoren nuevas guías clínicas y consensos en aspectos específicos en el manejo de la hidradenitis supurativa en México.











 text new page (beta)
text new page (beta)



