ANTECEDENTES
En 1954 Benjamín Castleman describió la enfermedad de Castleman en un paciente con sospecha de timoma, posteriormente, en 1956, realizó la descripción en una serie de 13 casos de masas mediastinales,1 en los que describió histológicamente la existencia de folículos con centro germinal atrófico, rodeado de una zona de manto prominente con pequeños linfocitos con una morfología característica “en capa de cebolla”.2
La incidencia reportada de este trastorno linfoproliferativo ha sido baja, hasta 1984 en todo el mundo se tenía registro de sólo 235 casos.3 En la actualidad, aunque se considera subdiagnosticada, se calcula una incidencia de enfermedad de Castleman de 21 a 25 casos por millón de personas/año, sólo 14% de los casos reportados con manifestación retroperitoneal.4,5
Se acepta el epónimo de enfermedad de Castle-man en tres variedades histopatológicas de trastornos linfoproliferativos subclasificados por Keller6 variedad hialino-vascular (HV es la más frecuente: hasta 90%2), variedad de células plasmáticas (PC) y variedad mixta (o tipo células plasmáticas hialino-vascular). En términos clínicos, la enfermedad de Castleman puede ser unicéntrica (también llamada localizada) o multicéntrica, esta última representa aproximadamente 23% de los casos.5,7
La forma localizada usualmente tiene un curso benigno y se alivia en la mayoría de las veces con la escisión quirúrgica de los nódulos linfáticos afectados.8 En contraste, en la forma multicéntrica, si bien es menos frecuente, sus manifestaciones son sistémicas, con afección de más de una región, tiene un curso potencialmente maligno.9,10
CASO CLÍNICO
Paciente femenina de 70 años de edad, originaria de Chihuahua, Chihuahua, residente de Poza Rica, Veracruz, sin antecedentes de toxicomanías ni de enfermedades crónicas. En 2011 se le diagnosticó mieloma múltiple IgG kappa estadio clínico III-B, recibió quimioterapia con bortezomib + lenalidomia + dexametasona; finalmente se realizó trasplante autólogo de células troncales y progenitoras hematopoyéticas en noviembre de 2013; en esa ocasión tuvo fibrilación auricular, extrasístoles e hipotensión resistente con recuperación, debido a toxicidad a dimetil sulfóxido. Permaneció asintomática durante seis meses, posterior a lo cual fue dada de alta.
En noviembre de 2016 acudió nuevamente al servicio de urgencias por padecer astenia, adinamia, pérdida de peso y dolor en el epigastrio, de tipo urente, transfictivo. Se realizó un ultrasonido abdominal que reportó probable lesión hepática con infiltración a epiplón, los marcadores tumorales se reportaron alterados: Ca 125 en 579.3 ng/mL y Ca 19.9 en 87 U/mL. La tomografía abdominal con doble contraste mostró un tumor retroperitoneal y derrame pleural derecho de más de 50% del área pulmonar total. Fue valorada por el servicio de hematología donde se consideró la posibilidad de recaída del mieloma múltiple o una segunda neoplasia (Figuras 1 y 2).
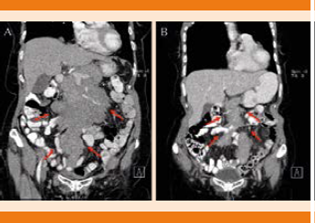
Figura 1 A. Tumor retroperitoneal corte coronal, previo a quimioterapia. B. Tumor retroperitoneal corte coronal, con disminución del tamaño posterior a ciclo de quimioterapia.
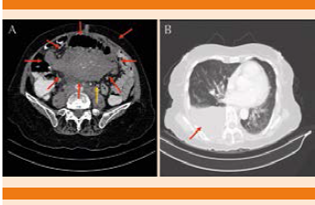
Figura 2 A. Tumor retroperitoneal en corte axial (flecha roja), conglomerado ganglionar (flecha amarilla). B. Derrame pleural derecho (ventana para pulmón).
Durante su hospitalización se realizaron los siguientes estudios:
Toracocentesis evacuadora y diagnóstica: la citología de líquido pleural reportó cocos grampositivos, eritrocitos 30-35/campo y leucocitos 1400, recibió fluoroquinolona y egresó por mejoría, posteriormente el estudio citopatológico reportó compatibilidad con plasmocitoma.
Inmunofenotipo en muestra de médula ósea: células viables 91.8%, sin aislamiento de células sugerentes de malignidad.
Electroforesis de proteínas: proteínas totales 6.5 g/dL, albúmina 3.2 g/dL, globulinas 3.3, gammaglobulina 1.4 g/dL, relación albúminaglobulina 1.0.
Inmunofijación de proteínas en sangre: banda monoclonal: IgG: 1569 mg/dL.
Biopsia incisional de tumor retroperitoneal: tejido linfoide maduro, compatible con linfoma no Hodgkin con granulomas tipo Castleman. Con segunda interpretación en el Servicio de Patología el reporte fue de ganglio linfático con enfermedad de Castleman variedad hialino-vascular (Figura 3).
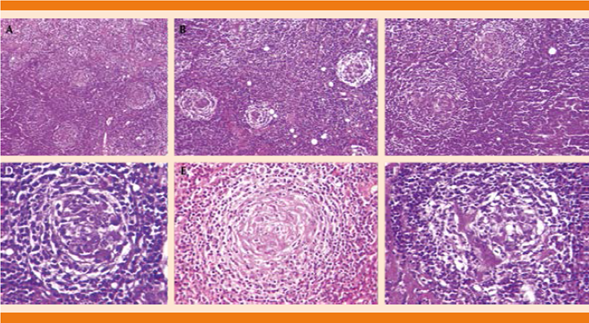
Figura 3 Ganglio linfático que muestra hiperplasia folicular. Fotos panorámicas en las que se observan folículos linfoides de diferentes tamaños (A, B, C). A mayor detalle se observan capas concéntricas de linfocitos en la periferia de los centros germinales, con aspecto en tela de cebolla (D, E), así como vasos de pared hialinizada en el centro de un folículo linfoide (F).
Reporte de inmunohistoquímica: CD 68: negativo, CD 3: positivo reactivo, CD 20: positivo reactivo, CD 138: negativo, BcL-2: negativo en centro germinal, BcL-6: positivo focal, CD 21: positivo en el centro germinal (Figura 4).
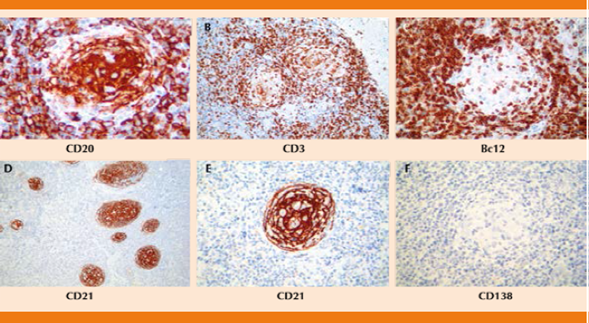
Figura 4 Reacciones de inmunohistoquímica que muestran positividad para CD20 en linfocitos B del centro germinal (A), para CD3 en linfocitos del manto y de la zona interfolicular (B), negatividad para bcl-2 en la zona del centro germinal (C) y positividad para CD21 en células dendríticas foliculares de los centros germinales (D, E). No se encontraron células plasmáticas, evidenciadas con esta reacción para CD138 que resultó negativa (F).
Se estableció el diagnóstico de enfermedad de Castleman multicéntrica por biopsia de tumor retroperitoneal de variedad histopatológica hialino-vascular, afección pleural, manifestaciones sistémicas y bioquímicas (hipergammaglobulinemia), por lo que se inició tratamiento con quimioterapia al momento con adecuada tolerancia y mejoría clínica.
DISCUSIÓN
La enfermedad de Castleman tiene baja incidencia, es más frecuente en los adultos jóvenes, comúnmente se manifiesta como una masa con media de tamaño de 5.5 cm; presente principalmente en el tórax (24%), el cuello (20%), el abdomen (18%), el retroperitoneo (14%), los sitios menos comunes son las axilas, las articulaciones y la pelvis,4 con ligero predominio en el sexo masculino en algunas revisiones,11 por lo que el caso clínico queda fuera de las manifestaciones más comunes de la enfermedad, más aún, los trastornos linfoproliferativos postrasplante sobrevienen con mayor incidencia posterior a trasplante de órganos sólidos, mientras que en los trasplantes alogénicos de médula ósea la frecuencia global es inferior a 1%.12 No se cuenta con la incidencia precisa de la enfermedad de Castleman en este grupo específico de pacientes, lo que da relevancia al caso comunicado.
La paciente se diagnosticó con la variedad histológica del subtipo hialino vascular. Este subtipo es el más frecuente y se caracteriza por folículos con centro germinal atrófico, rodeado de una zona de manto prominente (con pequeños linfocitos). Los centros germinales generalmente no contienen linfocitos, sino una población residual de células dendríticas que frecuentemente expresan CD21, CD23, CD35, y el receptor de factor de crecimiento epidermoide. La morfología característica por las células dendríticas se conoce como “en capa de cebolla”.13,14
La enfermedad de Castleman multicéntrica engloba un espectro de condiciones que dan lugar al solapamiento de manifestaciones clínico-patológicas que hace necesario tomar en cuenta una amplia variedad de diagnósticos diferenciales según los síntomas y signos que manifieste cada paciente.15,16
El mecanismo patogénico fundamental implicado es la actividad desregulada de citocinas,17 principalmente interleucina 6 en los centros germinales e incluyen nódulos linfáticos de múltiples regiones, lo que ha abierto la puerta al inicio de estudios que tienen como blanco terapéutico tratamientos biológicos dirigidos a esta interleucina.18 Mientras tanto, la mayor tasa de remisión sostenida se da con la combinación de tratamientos que usualmente se prescriben para tratar linfomas;16 sin embargo, los beneficios y efectos adversos deben ser equilibrados, especialmente en pacientes mayores con mal estado general.
CONCLUSIÓN
La enfermedad de Castleman se ha relacionado con diversos factores causales, entre los que destacan la inflamación crónica, estados de inmunodeficiencia y autoinmunidad. La paciente del caso comunicado tenía el antecedente de quimioterapia para tratar mieloma múltiple y trasplante autólogo de células troncales y progenitoras hematopoyéticas. Para establecer el diagnóstico definitivo se precisó la biopsia compatible junto con el cuadro clínico, que se complementó con pruebas de laboratorio e imagen que permitieron establecer el diagnóstico diferencial adecuado, a pesar de que salió del común epidemiológico por la baja incidencia de la enfermedad y por la variedad de manifestación. El tratamiento en la variedad multicéntrica es con quimioterapia, la administración de tratamientos biológicos como anticuerpos monoclonales depende de los resultados de inmunohistoquímica y se espera un futuro prometedor con el blanco terapéutico en la interleucina 6. Por último, el seguimiento a mediano y largo plazos y la vigilancia periódica nos permitirán detectar recurrencias de la enfermedad o degeneración en otras malignidades.











 text new page (beta)
text new page (beta)


