ANTECEDENTES
Las especies de Aeromonas de la familia Aeromonadaceae son bacilos gramnegativos, anaerobios facultativos, citocromo oxidasa, catalasa e indol positivo.1
Aeromonas está ampliamente distribuida en el medio ambiente, pero principalmente se ha encontrado en agua dulce y salina y se ha aislado de vegetales, carne, mariscos y alimentos procesados (Figura 1).2,3
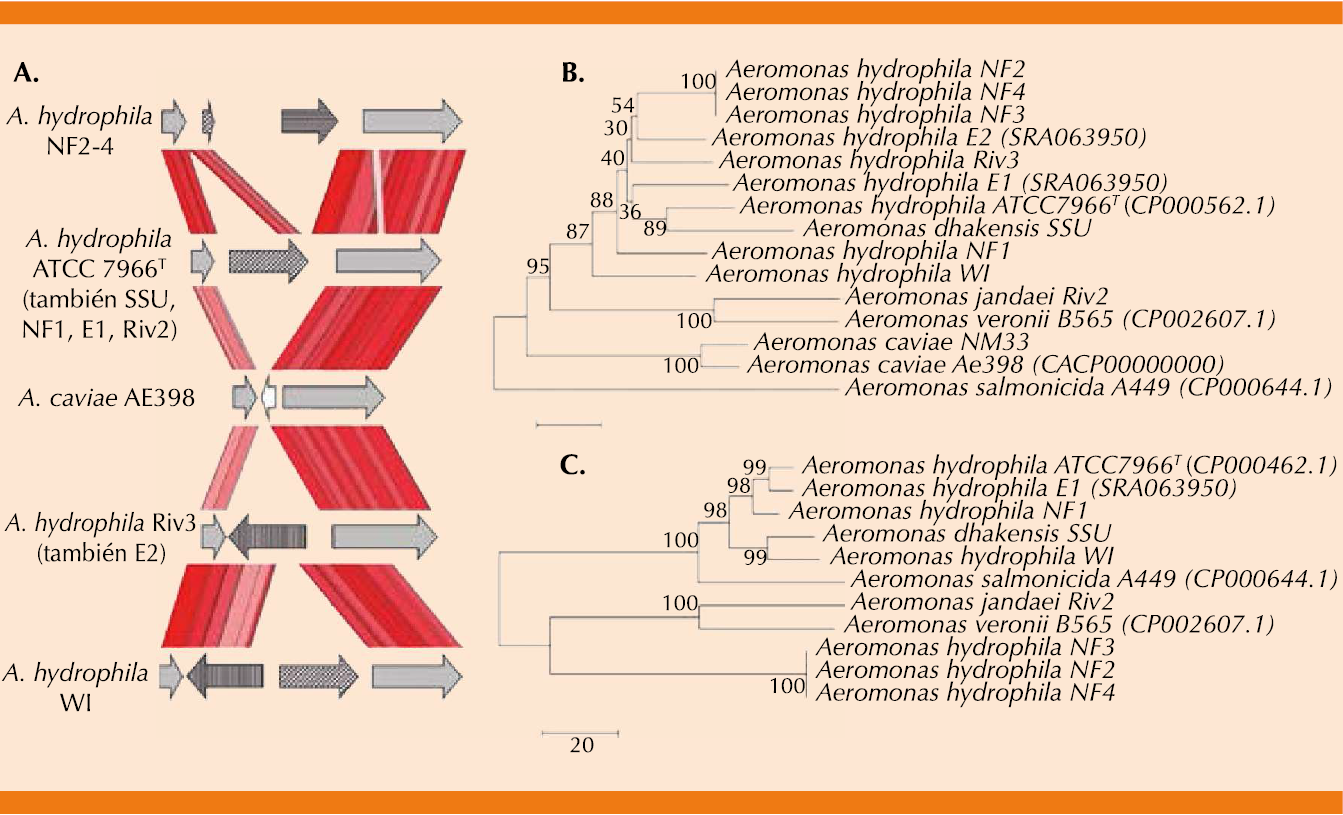
El género de Aeromonas es taxonómicamente complejo, por lo que se ha clasificado en dos grandes grupos: Aeromonas no móviles representada por Aeromonas salmonicida con capacidad de crecer a temperatura de 22 a 28ºC en medio salino a 0-6% y las mesofílicas que son móviles, capaces de crecer entre 35 y 37ºC y pH entre 4 y 10, por tanto, constituyen un problema potencial de contaminación alimentaria. Estas últimas son las responsables de ocasionar enfermedades en seres humanos (Figura 2).2,4,5
Alrededor de 21 especies se han reconocido como patógenas para el hombre, pero sólo tres especies (A. caviae, A. veroni biovar sobria y A. hydrophila) están relacionadas con la mayor parte de las infecciones en el ser humano.2,6 Por lo general, afecta a individuos inmunodeprimidos; habitualmente se manifiesta como patógeno oportunista (Cuadro 1).4
Cuadro 1 Especies de Aeromonas identificadas por cultivo por Vitek MS y Vitek 25
| Vitek 2 | Vitek MS | ||
|---|---|---|---|
| Cultivos | Probabilidad (%) | Cultivos | Probabilidad (%) |
| A. hydrophila/caviae | 98.29 | A. hydrophila/caviae | 99.9 |
| A. hydrophila/caviae | 99.0 | A. hydrophila/caviae | 99.9 |
| A. hydrophila/caviae | 99.0 | A. hydrophila/caviae | 99.9 |
| A. hydrophila/caviae | 99.0 | A. hydrophila/caviae | 99.9 |
| A. hydrophila/caviae | 98.29 | A. hydrophila/caviae | 99.9 |
| A. hydrophila/caviae | 98.28 | A. hydrophila/caviae | 99.9 |
| A. hydrophila/caviae | 99.0 | A. hydrophila/caviae | 99.9 |
| A. hydrophila/caviae | 98.29 | A. hydrophila/caviae; A. sobria | 50;50 |
| A. sobria | 98.03 | A. sobria/A. veronii | 51.2; 48.4 |
| A. sobria | 94.21 | A. sobria/A. veronii | 50; 50 |
De los casos reportados en humanos la gastroenteritis se manifiesta con mayor frecuencia; sin embargo, se han descrito infecciones extraintestinales de gravedad que ponen en peligro la vida, como septicemia, fascitis necrotizante y mionecrosis.7
Se han reportado casos de septicemia con carga gastrointestinal asintomática de A. caviae en pacientes inmunodeprimidos sin antecedentes de diarrea ni hospitalizaciones, por lo que estas cepas de A. caviae con notable grado de invasión pueden atravesar el tubo gastrointestinal alcanzando el torrente sanguíneo (como en casos por Salmonella typhi, Yersinia enterocolitica, Shigella dysenteriae, etc.), produciendo septicemia. La carga gastrointestinal asintomática de A. caviae invasiva es un hallazgo poco frecuente y de importancia en términos epidemiológicos en áreas con alta incidencia de gastroenteritis aguda por Aeromonas, que puede conllevar a ser portador asintomático de Aeromonas invasiva.8
La bacteremia por Aeromonas se define como el crecimiento de esta especie en un hemocultivo en un paciente con sepsis. Se considera bacteremia asociada con cuidados de la salud si una especie de Aeromonas se aísla de un hemocultivo mayor de 72 horas de hospitalización en un paciente asintomático a su ingreso o de un paciente que recibió tratamiento antineoplásico en las dos semanas precedentes a la toma de hemocultivo (Figura 3).9,10
Comunicamos un caso de mionecrosis fulminante por Aeromonas caviae que evolucionó desfavorablemente con desenlace fatal.
CASO CLÍNICO
Paciente masculino de 20 años de edad, mestizo, con diagnóstico de lupus eritematoso sistémico diagnosticado a los 15 años de edad (2009), con nefritis lúpica que evolucionó a insuficiencia renal crónica con requerimiento de terapia de reemplazo renal. En 2012 recibió trasplante renal de donador cadavérico. El Cuadro 2 muestra los resultados de laboratorio del paciente a su ingreso. El urocultivo no mostró desarrollo bacteriano a las 48 horas de incubación.
Cuadro 2 Resultados de laboratorio al ingreso hospitalario (18 de septiembre de 2014)
| Leucocitos | 8030 | VSG | 27 |
| Neutrófilos | 6242 | PCR | 2.5 |
| Linfocitos | 1124 | Glucosa | 87 |
| Hemoglobina | 10.7 | BUN | 174 |
| Hematócrito | 32.1 | Creatinina | 25.6 |
| Plaquetas | 155.000 | Acido úrico | 9.2 |
| Complemento C3 | 80 | Complemento C4 | 80 |
Tuvo mantenimiento inmunosupresor con tacrolimus, prednisona y micofenolato de mofetilo. En septiembre de 2014 ingresó a Urgencias por retención hídrica e insuficiencia cardiorrenal aguda. Inició hemodiálisis convencional por requerimiento por azoemia y sobrecarga hídrica.
El tratamiento médico inicial incluyó metilprednisolona 1 g cada 24 horas durante tres días, se suspendió tacrolimus, comenzó sirolimus 2 g cada 24 horas y restricción hídrica.
La biopsia del injerto renal reportó lo siguiente:
Rechazo activo túbulo intersticial (BANFF 1B) con datos sugerentes de componente humoral (glomerulonefritis activa y capilaritis peritubular con células plasmáticas), sobreimpuesto en cambios crónicos (glomerulopatía crónica del trasplante, fibrosis intersticial grado II y arteriolopatía crónica del injerto); CD4 positivo difuso (rechazo crónico/activo BANFF 2013).
Cambios regenerativos acentuados del epitelio tubular SV40 y CMV negativos.
Microcalcificaciones intratubulares.
Arteriolopatía hialina nodular moderada.
Sugerente de rechazo humoral
Se decidió iniciar tratamiento con timoglobulina antitimocito de conejo a dosis de 1.5 mg/kg de peso, con el fin de preservar la función del injerto (Cuadro 3).
Cuadro 3 Resultados de laboratorio del paciente un mes después de su admisión (20 de octubre de 2014, 24 horas postratamiento)
| Leucocitos | 600 | Hemoglobina | 6.4 |
| Neutrófilos | 486 | Hematocrito | 18.3 |
| Linfocitos | 78 | Plaquetas | 21,000 |
A las 48 horas de recibir el inmunosupresor, a las 18:20 horas del 20 de octubre, el paciente se quejó de dolor en el miembro pélvico derecho, en la pantorrilla, sin especificar el tipo de dolor, intensidad 4/10, progresivo, ascendente, unilateral, constante, sin cambios de coloración, sin alteraciones en los pulsos, ni cambios de temperatura. A la revisión primaria dio la impresión de ser de causa mecánica o posicional. Se medicó con ketorolaco 30 mg intravenoso, dosis única. No se conocía neuropatía en el enfermo; sin embargo, la asociación de la gammaglobulina antitimocito de conejo causa efectos adversos en 1 a 10% que se asocian con edema periférico hasta en 34% y dolor en 46%. La reacción adversa más común es la debilidad muscular.
A las 23:30 horas, y a pesar de la administración de opioide débil, persistía el dolor con tendencia al edema, hubo aumento de la temperatura a nivel del gastrocnemio y disminución en la temperatura distal, se notaban cambios discretos en la coloración. El ultrasonido doppler arterial únicamente reportó edema de tejidos blandos. Se solicitaron hemocultivos.
A las 02:00 horas el paciente mostró crepitación en el pie derecho, una hora después aumentó hasta la rodilla, un nuevo doppler refirió edema y gas en tejidos blandos. Inició tratamiento antibiótico empírico con ceftazidima y levofloxacino, ajustada a la función renal.
La gangrena gaseosa no traumática generalmente ocurre por especies de Clostridium, originarias del tubo gastrointestinal con diseminación hematógena por vía portal. Se siembra en el músculo. Puede crecer en condiciones aerobias, pero es facultativo. Por lo general, tiene resistencia a penicilina, cefalosporinas y clindamicina.11
En términos clínicos, estas infecciones se manifiestan con dolor súbito, pesantez y disestesias. Progresa rápidamente con edema y bulas, con halo púrpura, que asemeja daño vascular por las toxinas infiltrativas. En términos histopatológicos, se observa lisis, gas y no hay infiltración celular del bacilo.9
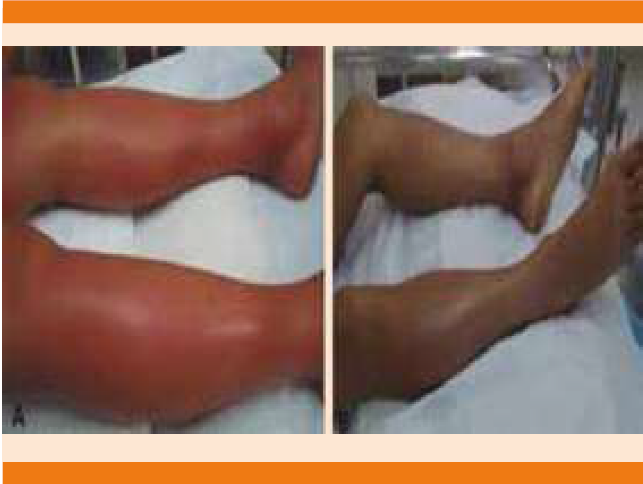
A las 07:00 horas se interconsultó al servicio de Angiología y se realizó exploración de pulsos con doppler que evidenció ausencia de pulso poplíteo. Dos horas después, a las 09:00 horas, se encontró crepitación de todo el miembro pélvico derecho, con cianosis y temperatura distal de la extremidad disminuida. La piel tenía signo de Nikolsky generalizado (Figura 4).12
Se tomaron nuevos hemocultivos. Un nuevo doppler color evidenció formación de gas intravascular, así como extensión a tejidos blandos.
Existe un caso reportado por Shiina y colaboradores en 2004, en la isla de Japón, que describe el caso de una paciente de 15 años, asiática, previamente sana, con antecedente de 21 horas de dolor y aumento progresivo del volumen del miembro pélvico derecho, que sugería origen traumático y evolucionó con respuesta inflamatoria sistémica fulminante en tres horas, la paciente falleció. La tomografía axial computada (TAC) reveló gas intravascular generalizado.
En el estudio de necropsia encontraron hemólisis y gas intravascular con numerosos bacilos gramnegativos susceptibles a cefalosporinas de tercera generación. Al examen histopatológico no se encontró infiltración inflamatoria en el músculo afectado, pero con numerosos bacilos (identificados como Aeromonas biovar sobria).12,13Figura 5
Al cumplir 15 horas del inicio del dolor, a las 10:00 horas, el paciente tenía inestabilidad hemodinámica, con datos de choque séptico. Se requirió apoyo con norepinefrina y requirió ventilación mecánica. Realizamos nuevo hemocultivo central.
Han-Chuan Chuang y colaboradores, en 2011, en una revisión de un centro hospitalario de tercer nivel en Taiwán, publicada en una revista coreana, definieron las siguientes características de sus pacientes con sepsis por Aeromonas.
Se considera intrahospitalaria si la aparición de los síntomas y el crecimiento bacteriano ocurre en más de 72 horas del ingreso hospitalario en un paciente sin datos clínicos infecciosos previos, o que haya recibido QT dos semanas antes del cultivo de sangre a pesar de los síntomas previos a la admisión hospitalaria.
La sepsis se manifestó en 126 pacientes (82%) con fiebre, 107 (69%) tuvieron trombocitopenia y sólo 40 (26%) tuvieron leucocitosis; 22 (14%) pacientes tuvieron bacteriemia porA. caviae, uno se manifestó con colecistitis aguda, otro con herida traumática infectada y uno con absceso pulmonar. Los demás como bacteriemia primaria. La mortalidad fue de 55 pacientes durante la hospitalización.
En la bacteriemia por A. hydrophila, la manifestación con trombocitopenia, diarrea, índice APACHE II > 20 puntos, así como la prescripción de antibiótico empírico se identificaron como factores asociados con la mortalidad por bacteriemia.
El único factor independiente de supervivencia fue el índice APACHE II en el análisis de regresión logística multivariado (razón de momios: 22.501; p < 0.001).9
Alrededor de las 14:00 horas, las características de edema, la denudación de piel y la crepitación de tejidos blandos se extendieron al miembro torácico derecho y a las 15:45 horas a las cuatro extremidades.
Tras realizar fasciotomía, encontramos gas, hemólisis, mionecrosis, sin recuperar pulsos distales, pero con cambios regionales en la coloración.
El paciente progresó a choque séptico resistente, a pesar de tratamiento con hidrocortisona a dosis de choque, a las 18:50 horas tuvo parada cardiaca irreversible por choque cardiogénico y falleció. La hora de muerte se estableció a las 19:34 horas.
Después de 72 horas del evento fatal, se recabaron hemocultivos con reporte de Aeromonas caviae, sensible a cafalosporinas de tercera generación.
En 2014, Spadaro realizó una revisión de la bibliografía en fascitis necrotizante y sepsis por Aeromonas sobria, y encontró que los pacientes generalmente cursan con enfermedades malignas tipo leucemia, diabetes mellitus 2, hepatitis C, VIH, insuficiencia cardiaca o hepatopatía. Generalmente la fascitis se contuvo a una extremidad. No hay antecedente de mionecrosis metastásica fulminante ni de obtención hematógena de Aeromonas caviae.14
DISCUSIÓN
Las infecciones de piel y tejidos blandos por Aeromonasspp son poco frecuentes. Se han reportado infecciones en tejido blando secundarias a traumatismo local en contacto con tierra o agua,15 intervención quirúrgica o a diseminación hematógena en enfermos inmunodeprimidos a partir de translocación bacteriana intestinal (como en nuestro caso), trasplantados de médula ósea,16 pacientes con neoplasias hematológicas,17 falla en la hemofiltración arteriovenosa en pacientes con enfermedad hepática,18 sometidos a hemodiálisis,19 estasis linfática y excepcionalmente en personas sin antecedentes traumáticos o enfermedades predisponentes.
La mionecrosis por Aeromonasspp es excepcional. De acuerdo con las infecciones de piel o tejidos blandos la celulitis es la manifestación clínica más frecuente y en su evolución puede formar abscesos y progresar localmente a través de las fascias y ocasionalmente llegar a ampollas. Los cuadros clínicos de mayor gravedad son la mionecrosis, la celulitis crepitante y sinérgica y la ectima gangrenosa.20 En individuos inmunodeprimidos se han descrito formas fulminantes y fatales. Este caso se trata de un paciente con inmunodepresión por haber recibido ciclos de esteroides, así como globulina T antitimocito, alteraciones inmunológicas por lupus eritematoso sistémico y enfermedad renal crónica de base.
Las especies de Aeromonas producen varios factores de virulencia que incluyen hemolisinas, enterotoxinas, citotoxinas y adhesinas que determinan su patogenicidad. De éstas, la aerolisina con actividad enterotóxica, citotóxica y hemolítica se ha asociado como el factor de virulencia más importante en una gastroenteritis producida por Aeromonas. Después de su adhesión a la célula, su capacidad de virulencia y producción de enterotoxinas destruye células de un sistema inmunológico afectado e invaden la membrana epitelial.21-23
La mionecrosis fulminante constituye una grave infección del músculo con infiltración de gas entre los haces musculares y necrosis que afecta desde la piel produciendo sangrado en capa, denudación de la epidermis, hemorragias en astilla o puntilleo, invasión a tejido adiposo, fascia, músculo, así como toxemia intensa que produce hemólisis intravascular que lleva a insuficiencia multiorgánica y a la muerte.17,24 Es importante distinguir la causa de la infección debido a que la mionecrosis por Aeromonas spp es clínicamente indistinguible de la producida por otros microorganismos como Clostridium perfringens, Clostridium septicum y Streptococcus pyogenes, por lo que la existencia de bacilos gramnegativos en la tinción de Gram obliga a prescribir antibióticos con actividad contra Aeromonasspp tomando en cuenta que es universalmente resistente a la penicilina. Los antibióticos eficaces contra Aeromonasspp son las cefalosporinas de tercera generación, aminoglucósidos (especialmente gentamicina) y fluoroquinolonas.25
El tratamiento de mionecrosis requiere la combinación de tratamiento antibiótico y quirúrgico en diferentes grados, limpieza, exéresis, desbridamiento o amputación.
Aeromonas spp es un microorganismo muy agresivo en casos con inmunodepresión con pronóstico adverso debido a la rápida progresión en la mayoría de los casos. En la bibliografía se refieren celulitis y fascitis como principales complicaciones u órgano blanco asociadas con Aeromonasspp; sin embargo, la mionecrosis metastásica fulminante es poco reconocida.16
Diagnósticos diferenciales
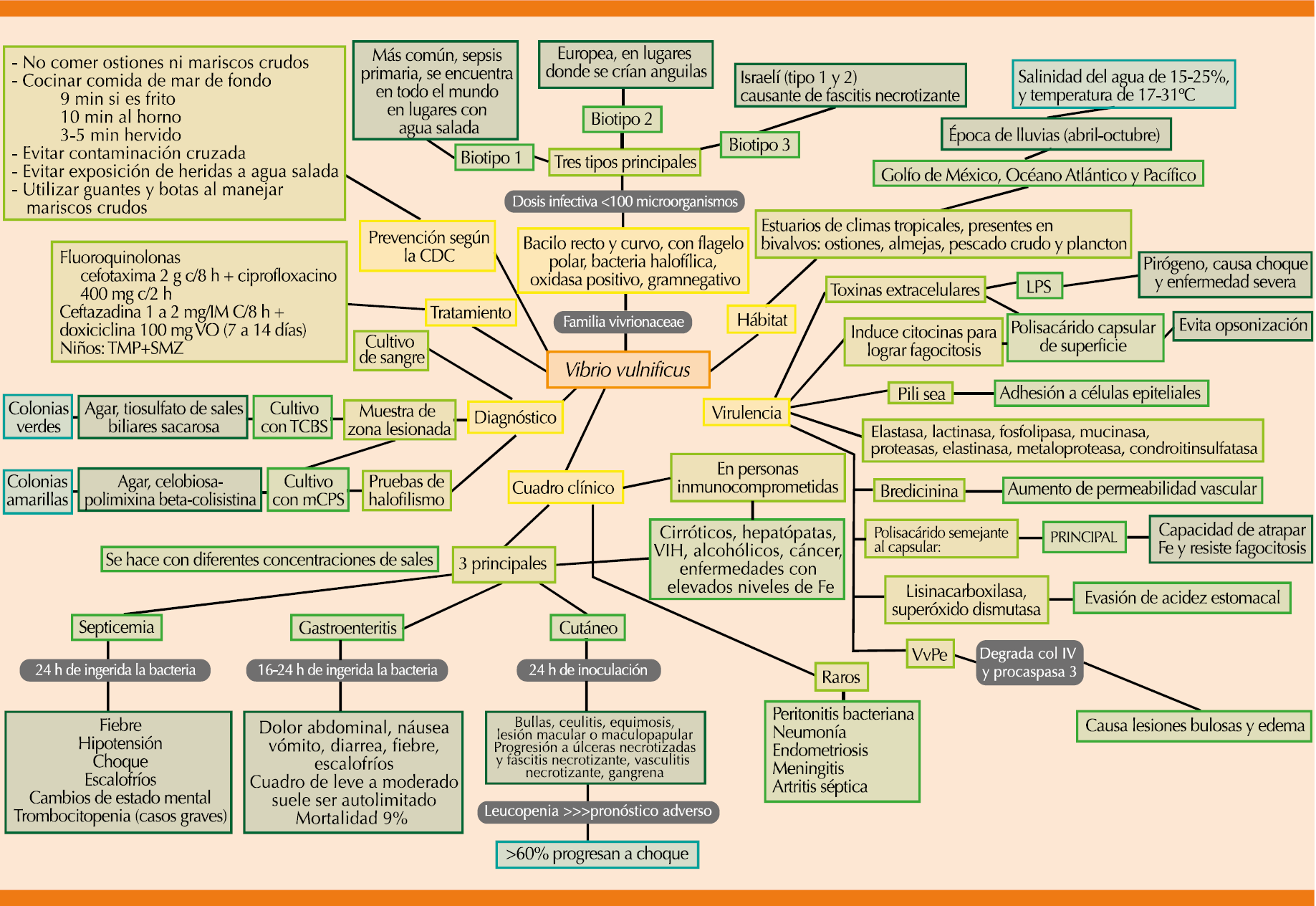
Infección por Vibrio vulnificus (Figura 6).
Infección por Clostridium perfringes
El botulismo por heridas es infrecuente y se produce cuando las esporas entran en una herida y pueden reproducirse en un medio anaerobio. Los síntomas son similares a los del botulismo de trasmisión alimentaria, pero pueden tardar incluso dos semanas en aparecer. Esta forma de la enfermedad se ha relacionado con el abuso de sustancias, especialmente con la inyección de heroína (alquitrán negro).
Las infecciones de los tejidos blandos muestran aspectos de distinta gravedad. El término dermohipodermatitis bacterianas no necrosantes se refiere a cuadros muy próximos a las erisipelas y celulitis infecciosas superficiales. Fundamentalmente se deben a estreptococos y su tratamiento, principalmente médico, se basa en antibióticos con penicilina G y la prevención de recidivas mediante el seguimiento de factores predisponentes.16-18
Infecciones bacterianas
Por el contrario, las dermohipodermatitis bacterianas necrosantes, que incluyen las celulitis necrosantes, fascitis necrosantes, miositis y gangrenas gaseosas, muestran cuadros graves desde el punto de vista local y general, relacionados con la extensión superficial y hacia planos profundos con lesión necrótica de la aponeurosis superficial y de los músculos subyacentes. Constituyen urgencias farmacológicas y quirúrgicas cuyo tratamiento debe asociar el seguimiento de un estado séptico grave, el inicio rápido del tratamiento antibiótico e intervención quirúrgica lo más pronto posible; en ocasiones se prescribe también oxigenoterapia hiperbárica. Pese a estas medidas, la mortalidad de estas formas necrosantes sigue siendo muy elevada, aproximadamente de 30% y, a menudo, las secuelas funcionales y estéticas son considerables.13,26











 text new page (beta)
text new page (beta)