Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Universidad y ciencia
Print version ISSN 0186-2979
Universidad y ciencia vol.24 n.1 Villahermosa Apr. 2008
Artículos
Registro de la larva del tercer estadio avanzado de Gnathostoma sp (nematoda: Gnathostomatidae) en la cuenca del río Usumacinta, Tabasco, México
Record of the advanced third-stage larva of Gnathostoma sp (Nematoda:Gnathostomatidae) in the Usumacinta river watershed, Tabasco, Mexico
RE Hernández-Gómez 1, LJ Rangel-Ruiz2, S López-Jiménez3
1 Ingeniería en Acuacultura. División Académica Multidisciplinaria de los Ríos. Universidad Juárez Autónoma de Tabasco. Carretera Tenosique - Estapilla km. 1.0. 86901 Tenosique, Tabasco, México. raul.hernandez@damr.ujat.mx.
2 División Académica de Ciencias Biológicas, UJAT.
3 División Académica de Ciencias Agropecuarias, UJAT.
Nota científica recibido: 13 de diciembre de 2005
Aceptado: 24 de febrero de 2008
Resumen
Las larvas del tercer estadio avanzado (L3A) de algunas especies del género Gnathostoma son responsables de la gnathostomosis humana. Durante marzo y mayo de 2005, nueve especies de peces dulceacuícolas se examinaron en cinco localidades distribuidas a lo largo de la cuenca del Río Usumacinta. Gobiomorus dormitor, Parachromis managuensis y Vieja synspila se registraron como hospederos para la L3A de Gnathostoma sp. Jonuta, Balancán y Tenosique representan nuevas localidades para la distribución de este nemátodo.
Palabras clave: Gnathostoma, larva, peces dulceacuícolas, Nematoda, Río Usumacinta, Tabasco.
Absrtact
The advanced third-stage larvae (AdvL3) of some species of the genus Gnathostoma are responsible for human gnathostomosis. During March and May 2005, nine freshwater fish species were collected from five localities along the Usumacinta river watershed and examined. Gobiomorus dormitor, Parachromis managuensis and Vieja synspila were recorded as hosts for the AdvL3 Gnathostoma sp. Jonuta, Balancan and Tenosique represent new localities for the distribution of this nematode.
Key words: Gnathostoma, larva, freshwater fish, Nematoda, Usumacinta river, Tabasco.
INTRODUCCIÓN
Las larvas de tercer estadio avanzado (L3A) de varias especies de nemátodos del género Gnathostoma Owen, 1836 son las responsables de ocasionar la gnathostomosis humana. Esta enfermedad se adquiere por comer carne cruda o insuficientemente cocida de peces de agua dulce y salobres, en forma de cebiche, sushi o sashimi, que contengan la L3A de Gnathostoma (Lamothe-Argumedo R 1999. Revista Patología Clínica 46: 86-91). El padecimiento se presenta en forma de varias manifestaciones cutáneas o viscerales de gravedad variable (Rojas-Molina N, Balfra-Torres B, Meza-Martínez HR 1994. Revista Alergia Mexicana XLI (5): 133-136).
En México, la presencia de las L3A de Gnat-hostoma se ha registrado en vertebrados de 12 estados de la República. Entre estos hay registros de infección humana en 10 de ellos, que son Baja California Norte, Sinaloa, Nayarit, Jalisco, Aguascalientes, Guerrero, Oaxaca, Tamaulipas, Veracruz, y Tabasco (Lamothe-Argumedo R 2003. Anales del Instituto de Biología. Universidad Nacional Autónoma de México 74: 99-103). En Tabasco, el único caso de gnat-hostomosis humana fue diagnosticado en una joven procedente del municipio de Centla (Wong-Ortiz F, López-Jiménez S, Ble-Castillo Jl 2001 Revista Mexicana de Oftalmología 75: 180-184).
Los primeros registros de la infección por L3A de Gnathostoma en el estado de Tabasco fueron obtenidos en peces dulceacuícolas, Rham-dia guatemalensis (juil), Belonesox belizanus (picudo), Parachromis managuensis (mojarra pinta), "Cichlasoma" urophthalmus (castarrica), y Atrac-tosteus tropicus (pejelagarto), capturados en la Reserva de la Biosfera Pantanos de Centla: (López-Jiménez S, García-Magaña L 2000. Universidad y Ciencia 16(31): 41-48; Barajas-Moran KB 2003. Datos no publicados). Recientemente, estas larvas han sido detectadas en Gobiomorus dormitor (guavina) y Petenia splendida (tenhuayaca) en la Reserva de la Biosfera Pantanos de Centla (KifuneT, Lamothe-Argumedo R, García-Prieto L, Oceguera-Figueroa A, León-Régagnon V 2004. Revista de Biología Tropical 52: 371-376). Por este motivo, surgió la necesidad de realizar un estudio prospectivo de la presencia de la L3A de Gnathostoma sp. en peces y establecer sus parámetros de infección en los cinco municipios que integran la cuenca del Río Usuma-cinta en el estado de Tabasco.
MATERIALES Y MÉTODOS
Área de estudio
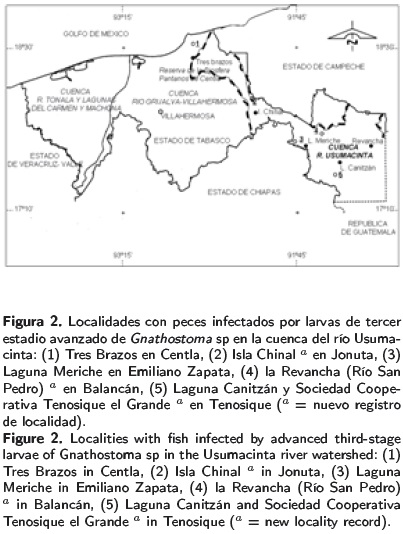
Los sitios de muestreos están ubicados en cinco municipios que integran la cuenca del río Usuma-cinta en el estado de Tabasco: Tenosique, Balancán, Emiliano Zapata, Centla y Jonuta. Las localidades de muestreos en cada municipio fueron la Laguna Canitzán y la Sociedad Cooperativa Tenosique el Grande (17° 20' N y 91° 25' W) en Tenosique, la Revancha (17° 46' N y 91° 09' O) en Balancán, Laguna Meriche (17° 40' N y 91° 31' O) en Emiliano Zapata, Tres Brazos (18° 25' N y 92° 38' O) en Centla e Isla Chinal (18° 06' N y 92° 36' O) en Jonuta (Tabla 1).
Muestreo
El muestreo fue realizado de marzo a mayo de 2005. Un total de nueve especies de peces de agua dulce fueron analizadas: Gobiomorus dormitor (Lacepéde, 1800) (n = 100), Parachromis managuensis (Günther, 1867) (n = 103), "Cichlasoma" urophthalmus (Günther, 1862) (n = 100), Petenia splendida (Günther, 1862) (n = 100), Oreochromis niloticus niloticus (Linnaeus, 1758) (n = 100), Eugerres mexicanus (Steindachner, 1863) (n = 10), Centropomus undecimalis (Bloch, 1792) (n = 5), Vieja synspila (Hubbs, 1935) (n = 8) y V. bifasciata (Steindachner, 1864) (n = 8) (Fish Base 2007. www.fishbase.com) (Tabla 1). Los peces fueron comprados directamente en las Sociedades Cooperativas o con los grupos locales de pescadores.
Métodos y técnicas
Los peces fueron medidos para obtener la longitud patrón y altura del cuerpo. El peso se midió con una balanza granataria de 2 610 g de capacidad. El sexo fue determinado visualmente y corroborado al realizar la disección. Cada pez fue eviscerado y fileteado para obtener el hígado y piezas delgadas de musculatura, tipo filete, entre 5 y 8 cm de longitud. Las piezas fueron comprimidas y observadas a contraluz, con una lupa bifocal y un microscopio estereoscópico, para localizar larvas libres y encap-suladas. Las larvas fueron extraídas con pinceles y agujas finas de disección y conservadas en alcohol etílico al 70% (Lamothe-Argumedo R 1997. Manual de técnicas para preparar y estudiar parásitos de animales silvestres. A.G.T. Editor S.A. D.F.). La longitud total y ancho máximo de las larvas se midieron en mm y su correspondiente promedio total ± desviación estándar fue calculado.
Análisis de datos
Los parámetros de infección calculados para cada localidad de muestreo fueron la prevalencia (P), calculada en porcentaje de organismos parasitados por una especie de parásito, y la intensidad media (IM) como promedio de parásitos en organismos infectados (Margolis L, Esch GW, Holmes JC, Kuris AM, Schad GA 1982. Journal of Parasitology 68:131-133).
Los ejemplares de Gnathostoma sp. (larvas) recolectados en peces hospederos en Jonuta, Balan-cán y Tenosique fueron depositados en la Colección Parasitológica del Sureste de México de la División Académica de Ciencias Biológicas de la Universidad Juárez Autónoma de Tabasco. Los números de acceso son: NE-003-001, NE-003-002, NE-003-003, NE-003-004, NE-003-005.
RESULTADOS Y DISCUSIÓN
De las nueve especies de peces estudiadas, tres resultaron positivas a la infección por las L3A de Gnathostoma sp. (Figura 1). Gobiomorus dor-mitor en los municipios de Centla y Balancán, P. managuensis en los municipios de Tenosique y Jonuta, y V. synspila en el municipio de Balancán. Esta última especie representó un nuevo registro de hospedero intermediario para la larva en la zona de estudio (Tabla 1); mientras que los tres últimos municipios se consideran como nuevos sitios con presencia de la L3A de Gnathostoma en peces dulceacuícolas (Figura 2).

Un total de 11 L3A de Gnathostoma sp. fueron recolectadas en la zona de estudio, estas midieron de 3.37 a 4.45 mm (promedio = 3.92 ± 0.48 mm) de longitud por 0.30 - 0.47 mm (promedio = 0.37 ± 0.06 mm) de ancho máximo. El esófago midió de 0.05 - 1.42 mm (promedio = 1.02 ± 0.48 mm) de longitud por 0.14 - 0.25 mm (promedio = 0.20 ± 0.03 mm) de ancho. Las papilas cervicales se sitúan entre las hileras de las espinas 11 y 22 (promedio = 13 ± 2.84) y el poro excretor entre las hileras 21 y 29 (promedio = 25.88 ± 2.84). El número de ganchos en los anillos del bulbo cefálico fue de 34 - 43 (promedio = 38.25 ± 3.07) en la primer hilera, 35 - 46 (promedio = 41.08 ± 2.64) en la segunda, 38 - 51 (promedio = 43.75 ± 3.27) en la tercera y 41 - 52 (promedio = 46 ± 3.14) en la cuarta.
Morfométricamente, estas larvas difirieron de las L3A de Gnathostoma procyonis (5.20 x 1.20) por ser de talla menor, 3.92 mm de longitud por 0.37 mm de ancho máximo del cuerpo (Ash LR 1962. Journal of Parasitology 48: 306-313). También, las L3A de este estudio se diferenciaron de G. spinige-rum por presentar un menor número de ganchos en las cuatro hileras del bulbo cefálico. Gnathostoma sp. de este estudio registró 38.25 ganchos en la primer hilera, 41.08 en la segunda, 43.75 en la tercera y 46 en la cuarta, mientras que G. spinigerum presentó 44.30 en la primer hilera, 47.30 en la segunda, 49.60 en la tercera y 52.00 en la cuarta (Miyazaki I 1954. Kyushu Memoirs of Medical Sciences 5: 123139).
Sin embargo, la longitud y ancho del cuerpo y del esófago, así como el número de ganchos de las L3A de Gnathostoma sp. del presente estudio coincidieron con los intervalos descritos para G. binucleatum (Kifune T, Lamothe-Argumedo R, García-Prieto L, Oceguera-Figueroa A, León-Régagnon V 2004. Revista de Biología Tropical 52:371-376; Martínez-Salazar EA 2001. Tesis de Licenciatura en Biología. Universidad Nacional Autónoma de México. 76 pp; León-Régagnon V, Osorio-Sarabia D, García-Prieto L, Akahane H, Lamothe-Argumedo R, Koga M, Messina-Robles M, Álvarez-Guerrero C 2002. Parasitology International 51: 201204; León-Régagnon V, Osorio-Sarabia D, García-Prieto L, Martínez-Salazar E, Oceguera-Figueroa A, Lamothe-Argumedo R, Díaz-Camacho SP, Naum-tanong S, Waikagul J, Akahane H, Lazo R, 2003. The Bulletin of Central Research Institute Fukuoka University Serie E: Interdisciplinary Sciences 1: 237247). Asimismo, fueron similares para las L3A de Gnathostoma sp. registradas en peces del estado de Tabasco (López-Jiménez S, García-Magaña L 2000. Universidad y Ciencia 16(31): 41-48). Sin embargo, destaca la posición de la papila cervical de una larva proveniente del municipio de Jonuta, la cual esta ubicada entre las hileras 21 y 22. Esta posición podría indicar la existencia de otra especie en la zona o que podría tratarse de una variación intraespecífica de G. binucleatum, pero esto no puede ser confirmado debido al bajo número de larvas obtenidas.
Los bajos valores de intensidad media para P. managuensis en los municipios de Jonuta y Tenosique, así como para G. dormitor en Centla y Balancán (Tabla 1), son similares a los anteriormente registrados para G. dormitor, P. managuensis y P. splendida en el municipio de Centla, Tabasco (Barajas-Moran KB datos no publicados; Ki-fune T, Lamothe-Argumedo R, García-Prieto L, Oceguera-Figueroa A, León-Régagnon V 2004. Revista de Biología Tropical 52: 371-376), así como para peces de la zona del Río Papaloapan, Veracruz (Almeyda-Artigas RJ, Mosqueda-Cabrera MA, Carranza-Calderón L, Sánchez-Miranda E 1991. II Congreso Nacional de la Sociedad Mexicana de Medicina Tropical: 29). Sin embargo, los registros de los índices de infección en el presente estudio son superiores a los citados en Cosamaloapan, Veracruz para G. dormitor (Osorio-Sarabia D, Oceguera-Figueroa A, García-Prieto L, Lamothe-Argumedo R, Akahane H 2003. The Bulletin of Central Research Institute Fukuoka University Serie E: Interdisciplinary Sciences 1: 213-219).
Por consiguiente, las especies de peces G. dor-mitor, P. managuensis y V. synspila se confirman como peces que actúan como segundos hospederos intermediarios de la L3A de Gnathostoma sp. en la cuenca del Río Usumacinta. Cabe destacar que los huevos fertilizados de las especies del género Gnat-hostoma, son liberados al medio acuático a través de las heces fecales de los hospederos definitivos (por ejemplo mamíferos como mapaches, gatos y perros) tanto en agua dulce como salobre. Los huevos eclo-sionan al cabo de siete días y liberan el segundo estadio larvario (L2) que es ingerido por el primer hospedero intermediario, como copépodos de las especies Mesocyclops leuckarti, Eucyclops serrulatus, Cyclops strennus y C. viscinus. En la cavidad de los copépodos las larvas maduran al estadio larvario L3 temprano o inicial. Cuando el pez consume al copépodo, actúa como segundo hospedero intermediario y la larva desarrolla a tercer estadio avanzado (L3A) (Miyazaki I 1966. Maguro Parasitology Museum, Tokyo, Japan 3: 529:586. y Rojekittikhun W 2002. Journal Tropical Medicine. 25: 91-98).
En México, la infección en humanos con la L3A de Gnathostoma sp. se debe principalmente al consumo de cebiche, platillo típico de regiones costeras del país, el cual se prepara con carne cruda de peces. Los ceviches preparados con peces dulceacuícolas y salobres son la fuente principal de infección (Martínez-Cruz JM, Bravo-Zamudio R, Arandia-Patraca A, Marañón RM 1989. Revista de Salud Pública de México 31: 541-549).
En Tabasco, la presencia de la L3A de este nemátodo en los cuatro sitios de la cuenca del Río Usumacinta en peces de importancia comercial, indica que existe la posibilidad de haber infección en humanos que hayan consumido filete de pescados crudos que contengan la larva. Por lo tanto, las autoridades responsables de la salud pública deben orientar a la población para evitar el consumo de peces dulceacuícolas en forma de cebiche y otros platillos a base de carne cruda de peces, y de otros organismos que pudieran estar actuando como hospederos intermediarios o paraténicos.
Las autoridades responsables de la salud pública en el estado, así como investigadores de granjas acuícolas e instituciones públicas y privadas relacionadas con el sector pesquero, deben formar parte de grupos multidisciplinarios para planear estrategias que promuevan la prevención hacia el consumo de pescado crudo. Así como realizar investigaciones para determinar la especie o especies de Gnathostoma que pueden estar distribuidas en la región. Actualmente, en Tabasco sólo se conoce a G. binucleatum como la responsable de la zoonosis parasitaria en peces dulceacuícolas, aún cuando existe el registro de L3A de tres especies de Gnathostoma en México (Kifune T, Lamothe-Argumedo R, García-Prieto L, Oceguera-Figueroa A, León-Régagnon V 2004. Revista de Biología Tropical 52: 371-376; Bertoni-Ruiz F, García-Prieto L, Osorio-Sarabia D, León-Régagnon V 2005. Journal of Parasitology 91: 11431149).














