Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.49 Ensenada Jan./Dec. 2023 Epub Dec 08, 2023
https://doi.org/10.7773/cm.y2023.3332
Artículos
Puestas naturales de la cabrilla sardinera (Mycteroperca rosacea) en cautiverio en La Paz, México
1Centro de Investigaciones Biológicas del Noroeste, 23090 La Paz, Baja California Sur, Mexico.
Se estudió el desove natural de la cabrilla sardinera,Mycteroperca rosacea, en cautiverio, de 2004 a 2008 en condiciones naturales de luz y temperatura. Los peces desovaron naturalmente en 2006, pero solo se recolectaron 90,000 huevos no fertilizados. Se observó un total de 43 días de desove en 2007 y 27 días en 2008. La temporada de desove comenzó en marzo y se prolongó hasta mayo-junio, lo cual se relacionó con un aumento en la temperatura del agua de 21.1 a 23.8 °C. La media (error estándar) del número de huevos liberados diariamente fue de 101,705 (13,876) en 2007 y 40,510 (7,874) en 2008, y el número total de huevos recolectados fue de 4.37 × 106y 1.07 × 106, respectivamente. El número de huevos recolectados por mes no fue significativamente diferente dentro de cada año (P> 0.05), pero sí al comparar 2007 y 2008 (P< 0.05). La puesta relativa anual fue de 288,750 huevos·kg-1en 2007 y 72,919 huevos·kg-1en 2008, y la producción de huevos viables fue de 184,800 huevos·kg-1en 2007 y 25,375 huevos·kg-1en 2008. La tasa de fertilización (%) de los huevos recolectados diariamente fue significativamente diferente a lo largo de la temporada de desove de 2007 (P< 0.05). La tasa de fertilización también difirió significativamente (P< 0.05) entre 2007 (61.10%) y 2008 (32.30%). El análisis estadístico indicó que no hubo correlación entre la tasa de fertilización y el número de huevos liberados en ambas temporadas de desove. El efecto de la luna sobre el desove también se analiza en el documento. Durante todo el estudio, los peces desovaron al anochecer antes de la oscuridad total. El diámetro medio (± desviación estándar) del huevo fue de 864.0 ± 22.0 µm.
Palabras clave: rosacea; puestas naturales; mero; producción; fotoperiodo
Natural spawning of the leopard grouper (Mycteroperca rosacea) was studied in captivity from 2004 to 2008 under natural photoperiod conditions. Fish spawned naturally in 2006, but only 90,000 unfertilized eggs were collected. A total of 43 and 27 spawning days were observed in 2007 and 2008, respectively. Spawning season began in March and lasted until May-June and was related to an increase in water temperature from 21.1 to 23.8 °C. The mean (SE) number of eggs released each day was 101,705 (13,876) in 2007 and 40,510 (7,874) in 2008, and the total number of eggs collected in 2007 and 2008 was 4.37 × 106and 1.07 × 106, respectively. The number of eggs collected per month was not significantly different within each year (P> 0.05), although a significant difference was observed between 2007 and 2008 (P< 0.05). The annual relative number of eggs released was 288,750 eggs·kg-1in 2007 and 72,919 eggs·kg-1in 2008, and viable egg production was 184,800 eggs kg-1in 2007 and 25,375 eggs kg-1in 2008. The fertilization rate (%) of the eggs collected daily differed significantly throughout the spawning season of 2007 (P< 0.05). The fertilization rate also differed (P< 0.05) between 2007 (61.10%) and 2008 (32.30%). Statistical analysis of the 2 consecutive spawning seasons indicated no correlation between the fertilization rate and fecundity. The effect of the moon phase on spawning was also considered. The fish spawned at dusk before total darkness. Mean (SD) egg diameter was 864.0 ± 22.0 µm.
Key words: rosacea; natural spawning; grouper; production; photoperiod
Introducción
La cabrilla sardinera,Mycteroperca rosacea(Streets 1877), pertenece a la familia Epinephelidae. La distribución de esta especie se extiende desde el golfo de California hasta la costa oeste del Pacífico mexicano. Los adultos de la cabrilla sardinera forman agregaciones de desove de abril a junio en diferentes sitios del golfo de California (Erisman et al. 2007), lo que incrementa su vulnerabilidad a la presión pesquera (Sala et al. 2004). Desde 2018, la cabrilla sardinera ha figurado como “Preocupación menor” en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza desde 2018 (Erisman y Craig 2018). Por la calidad de su carne, la cabrilla sardinera es un recurso muy valorado con un alto precio de mercado, con desembarques de entre 200 y 400 t anuales (González-Cuellar et al. 2019). Previo al año 2000, la información sobre esta especie era escasa y estaba relacionada con aspectos biológicos como los hábitos alimenticios (Peláez-Mendoza 1997). Desde entonces, se han realizado diversos estudios sobre la reproducción de la cabrilla sardinera en vida silvestre.
En el presente estudio pudimos verificar la información que se ha generado a la fecha con respecto a la reproducción de la cabrilla sardinera. Esta especie, en efecto, forma grandes agregaciones de desove durante periodos prolongados; sin embargo, también se agrega fuera de los periodos de desove, y el desove parece no estar sincronizado con el ciclo lunar (Erisman et al. 2007). La cabrilla sardinera es gonocórica (Erisman et al. 2008) y muestra un desarrollo ovárico grupal sincrónico (Estrada-Godinez et al. 2011). Se ha observado que la puesta de la cabrilla sardinera en vida silvestre ocurre de mayo a junio (Estrada-Godínez et al. 2011), de marzo a mayo (Sala et al. 2003) o de abril a junio (Erisman et al. 2007). Además, se han observado diferencias en los bioindicadores y los parámetros bioquímicos en el ciclo reproductivo de esta especie (Estrada-Godínez et al. 2014).
Actualmente, existen diversos estudios sobre la cabrilla sardinera en condiciones de cautiverio. Por ejemplo, se indujo el desove en hembras silvestres suministrando 2 inyecciones de 1,000 y 500 UI·kg-1de gonadotropina coriónica humana (hCG) con 24 h de diferencia (Gracia-López et al. 2004a). En otro estudio, en el cual la inducción se hizo con hCG y la hormona liberadora de la hormona luteinizante (LHRHa), las hembras inducidas con hCG produjeron mejores resultados (Kiewek-Martínez et al. 2010). Además, las mejoras en el cultivo de larvas y juveniles han permitido producir miles de juveniles (Gracia-López et al. 2005). También se ha estudiado la fisiología reproductiva de la cabrilla sardinera en cautiverio, específicamente el papel de los esteroides sexuales (estradiol, testosterona y 11-ketotestosterona) en el ciclo reproductivo (Maldonado-García et al. 2018).
Al mismo tiempo, se han realizado grandes esfuerzos para mejorar nuestro entendimiento de las diferentes fases de cultivo de esta especie. Por ejemplo, Gracia-López et al. (2004a) reportaron tasas de eclosión mejoradas a temperaturas que oscilaron entre 24.0 y 30.0 °C y volúmenes de saco vitelino mejorados a 26.0 y 28.0 °C. Además, las temperaturas más altas y la salinidad de 32 resultaron en una mejor tasa de crecimiento y mejores tasas de eclosión (Gracia-López et al. 2004a). La producción de larvas y juveniles se ha logrado con tasas de fertilización, eclosión y supervivencia del 76.8%, 71.2% y 1.38%, respectivamente (Gracia-López et al. 2005, Martínez-Lagos y Gracia-López 2009). Sin embargo, a pesar de estos avances, la baja supervivencia de las larvas en etapas tempranas siguen siendo un problema, lo que ha dado lugar a estudios de enzimología, probióticos y enfermedades (Reyes-Becerril et al. 2008, 2011; Martínez-Lagos et al. 2014).
En la industria del cultivo de meros, las grandes limitaciones han llevado a la inadecuada supervivencia larval y una producción de huevos inconsistente (Okumura et al. 2002). La captura de juveniles silvestres para criarlos en granjas no es una estrategia de producción óptima debido a la escasez de estos organismos (Kungvankij et al. 1986, Lim 1993). Lee y Yang (2002) y varios estudios han identificado las causas que impiden que las hembras en cautiverio completen la maduración del ovocito (Zohar y Mylonas 2001). En la mayoría de los peces de cultivo, a menudo es necesario manipular los factores abióticos, como el fotoperiodo y la temperatura (Carrillo et al. 1989, Zanuy et al. 1995), o acudir al uso de tratamientos con hormonas exógenas para estimular la maduración final del ovocito y la ovulación (Mylonas y Zohar 2001).
Un medio para mejorar la fecundidad, la fertilización y la producción de huevos es a través del desove natural porque los reproductores se mantienen en tanques de tamaño apropiado con condiciones óptimas de agua y requerimientos nutricionales. Este método ha sido exitoso con varias especies de mero (Toledo et al. 1993, James et al. 1997, Ranjan et al. 2017) y parece ser una forma logísticamente factible para obtener buena calidad de huevos en cantidades adecuadas (Mylonas et al. 2004, Jerez et al. 2006).
A pesar de los resultados que se han obtenido en estudios anteriores con inducción hormonal, aún falta mucho por entender sobre la reproducción de la cabrilla sardinera en cautiverio. Con este fin, se llevó a cabo un estudio de largo plazo para evaluar la maduración y el desove natural de la cabrilla sardinera en cautiverio. Este estudio evaluó la producción de huevos y la fertilización a lo largo de múltiples temporadas de desove y determinó qué factores pueden influir en la reproducción.
Materiales y métodos
Reproductores y cultivo
En mayo de 2004, los reproductores utilizados en este estudio (n= 17) fueron capturados con anzuelo en la zona norte de la isla San José, Baja California Sur (México) y fueron transportados al Centro de Investigaciones Biológicas del Noroeste (CIBNOR) en tanques cilíndricos de 500 L provistos de oxigenación suplementaria. En el laboratorio, los organismos fueron anestesiados con 50 mg·L-1de tricaína metanosulfonato (MS-222), pesados y marcados en el dorso con marcas Spaghetti Floy Tags externas (Floy Tags & Mfg.; Seattle, WA, EE. UU.) para su posterior identificación.
Los peces fueron colocados en el exterior en un tanque circular (7 m3, 1 m de profundidad) a una densidad de 1.40 kg·m-3en condiciones naturales de temperatura y fotoperiodo. El grupo estaba formado por 14 hembras y 3 machos con peso medio (desviación estándar [DE]) de 1.17 (0.36) kg y 1.36 (0.15) kg, respectivamente. Los peces fueron alimentados en días alternos con sardina congelada y caballa hasta saciedad. De 2004 a 2007, los peces fueron mantenidos en el exterior; luego, fueron transferidos a un tanque negro cilíndrico (7 m3) en un laboratorio cerrado, donde se mantuvieron hasta 2009. Las condiciones de agua adecuadas y estables se mantuvieron a través de un sistema de recirculación compuesto por sedimentadores, filtros, lámparas de luz UV, y enfriadores. Este tipo de sistema permite controlar los parámetros fisicoquímicos, como temperatura, oxígeno disuelto, CO2, nitrógeno amónico, nitritos y nitratos. La oxigenación suplementaria se proporcionó con aireación por sopladores.
Se midió diariamente la temperatura (registrador de temperatura sumergible HOBO TidbiT, Onset; Bourne, MA, EE. UU.), la salinidad (refractómetro ATAGO; Bellevue, WA, EE. UU.) y el oxígeno disuelto (YSI 85, Yellow Springs Instruments; Yellow Springs, OH, EE. UU.). La temperatura media del agua durante el periodo de desove fue de 22.9 (1.2) °C, y osciló entre 21.1 y 23.8 °C. La temperatura del agua anual y el fotoperiodo se muestran en la Figura 1. La salinidad fue de 37 y el oxígeno disuelto osciló entre 5.3 y 6.2 mg·L-1.
Madurez
Los peces fueron pesados, y se tomaron muestras de las gónadas para determinar el estado de maduración y el sexo en febrero, julio, septiembre y noviembre de 2007 y enero de 2008. Se tomaron muestras de semen aplicando suave presión abdominal, y las muestras se colocaron en tubos Eppendorf para posteriormente observar la motilidad espermática. Las muestras de gónadas de hembras se obtuvieron introduciendo una cánula de polietileno en el oviducto. Para determinar el diámetro del ovocito y el estado de madurez, se capturaron imágenes de las muestras con una cámara digital Coolsnap-Pro Color (MediaCybernetics; Rockville, MD, EE. UU.) instalada sobre un microscopio óptico Bx-41 (Olympus; Tokio, Japón), y las imágenes se procesaron con el software Image-Pro Plus (v.5.0, MediaCybernetics).
Recolección y análisis de huevos
Después del desove, los huevos flotantes se pasaron a través de la tubería de salida al tanque recolector, donde se retuvieron por una malla (300 µm). Los huevos fueron recolectados todas las mañanas de los días de desove, lavados con agua de mar estéril y transferidos a un tanque (35 L) con aireación para estimar el número de huevos liberados y la tasa de fertilización (%). En este estudio, la tasa de fertilización representa los huevos obtenidos en un día de desove y no representa la fertilización de una hembra en particular. El número total de huevos se calculó contando el número de huevos en 20 muestras de 15 mL. El diámetro medio de los huevos se midió con el programa Sigma Scan 5.0 (Systat Software; Chicago, IL, USA). Los huevos fueron examinados bajo el estereoscopio para monitorear el desarrollo embrionario, y la tasa de fertilización se calculó tomando en cuenta las primeras etapas del desarrollo embrionario. Los huevos se colocaron individualmente en placas de microtitulación de 96 pocillos (en réplicas), un huevo por pocillo, y se mantuvieron a 23.0 ± 1.2 °C.
La tasa de fertilización se evaluó diariamente y se calculó como el número de huevos fertilizados/huevos flotantes totales. El número de huevos viables se calculó multiplicando el número total de huevos por la tasa de fertilización. En cuanto a la producción de huevos, se calculó el número relativo de huevos liberados anualmente (huevos·kg-1) y la producción de huevos viables (huevos·kg-1) tomando en cuenta la masa total de las hembras (kg) en el tanque. La hora del día en que se produjo el desove se determinó cuando se recogió el primer huevo en el tanque recolector.
Análisis estadístico
Las diferencias mensuales y anuales en el número de huevos recolectados y la tasa de fertilización para las 2 temporadas de desove se examinaron utilizando un análisis de varianza (ANDEVA,P< 0.05). El efecto lunar sobre la fecundidad se determinó mediante un ANDEVA de una vía, después de registrar el número de huevos por fase lunar y mes. La significancia estadística se determinó mediante elsoftwareStatistica v.8.0 (Stat Soft; Tulsa, OK, EE. UU.). Se modeló la tasa de fertilización esperada usando la función de enlace logit del modelo lineal generalizado en R v.4.1.2 (RStudio Team 2020) en función de la fecha de desove y el número de huevos liberados por día. Se utilizó la desviación residual para evaluar la bondad de ajuste y la prueba de chi cuadrada para evaluar la validez del modelo.
Para asignar las fases lunares, se asignaron valores del 0 al 29 a cada fecha, donde 0 representa luna llena, y los demás valores, los días sucesivos. Los días se agruparon en 8 fases lunares adaptadas por Grant et al. (2009) de Stolov (1965) y Bell y Defouw (1966). El histograma circular se realizó con la longitud de la barra que representa el número acumulado de huevos liberados (×106), las líneas discontinuas y los puntos que representan la frecuencia de desove y el color que representa la tasa de fertilización según la fase lunar. Los datos se analizaron para determinar la posible correlación con la fase lunar utilizando la prueba de Rao. En este caso, se supuso significancia conP< 0.1 (Grant et al. 2009).
Este estudio se llevó a cabo bajo los Lineamientos del Consejo de la Unión Europea (2010/63/EU) y el Gobierno de México (NOM-062-ZOO-1999) para la producción, el cuidado y el uso de animales de experimentación. Los protocolos y procedimientos experimentales contaron con la revisión y la aprobación del comité de acuicultura del CIBNOR. Los autores confirman que se cumplieron las políticas éticas de la revista Ciencias Marinas, como se indica en las directrices para autores, y que se recibió la aprobación del comité de revisión ética correspondiente.
Resultados
Época de desove
En 2006, luego de 22 meses desde el inicio del estudio, ocurrió una puesta de 90,000 huevos no fecundados, el único desove en ese año. Los primeros huevos fértiles se recolectaron hasta 2007. En ese año, el primer lote de huevos se recolectó el 9 de marzo y el último se recolectó el 29 de junio. En 2008, la fecha del primer desove fue el 12 marzo, y la temporada de desove finalizó el 21 de mayo. Las épocas de puesta ocurrieron en los periodos en los cuales la temperatura aumentó (de 21.1 a 23.8 °C en 2007 y de 21.2 a 23.6 °C en 2008) con el incremento de las horas de luz (Fig. 1). Durante este experimento, los primeros huevos fertilizados se recolectaron justo antes de la oscuridad total, entre el atardecer y el anochecer, cuando era imposible observar algún signo de cortejo. El diámetro de los huevos presentó una media (±DE) de 864.0 ± 22.0 µm y un rango de 848.0 a 884.0 µm.
Maduración
Los peces muestreados en febrero de 2007 mostraron evidencia de madurez, aunque diferentes estados de madurez para los machos y las hembras. Once días después de este muestreo, se observó el primer desove de ese año. El tamaño de los ovocitos (media ± DE) osciló entre 107 ± 42 y 554 ± 103 µm. En julio de 2007, solo los machos estuvieron maduros (machos fluyentes); 4 hembras mostraron ovocitos vitelogénicos y 10 hembras mostraron ovocitos previtelogénicos. En septiembre y noviembre de 2007 no se observó ningún signo de madurez en ningún individuo. En enero de 2008, 3 hembras mostraron ovocitos hidratados, pero los machos aún no estaban maduros.
Producción de huevos
Hubo 43 días de desove en 2007 y 27 en 2008, con un número similar de días de desove (9 a 13 días) y huevos en cada mes, excepto en marzo de 2008, cuando solo se registraron 5 días de desove debido a que la temporada de desove comenzó a mediados de ese mes. El número medio mensual y anual de huevos obtenidos por día de desove (± error estándar) y la tasa de fertilización media (± error estándar) para 2007 y 2008 se presentan en la Tabla 1. Hubo una gran variación en la liberación de huevos diaria, de 18,560 o 471,000 huevos liberados por día en 2007 (media [± error estándar]: 101,705 [13,876]) y 800 a 145,000 huevos liberados por día en 2008 (media [± error estándar]: 40,510 [7,874]) (Fig. 2). No se observó ni una tendencia constante durante la temporada de desove. El número total de huevos obtenidos fue de 4.37 × 106en 2007 y 1.07 × 106en 2008 (Fig. 3, Tabla 2). El número relativo anual de huevos liberados fue de 288,750 huevos·kg-1en 2007 y 72,919 huevos·kg-1en 2008, y la producción de huevos viables fue de 184,800 huevos·kg-1en 2007 y 25,375 huevos·kg-1en 2008.
Tabla 1. Número de días de desove y huevos liberados por mes. Número medio (error estándar) de huevos por puesta y tasa de fertilización (F) por mes obtenidos en 2007 y 2008.
| Year | Month | Spawning days | Eggs | Eggs/release (×103) | F(%) |
| 2007 | |||||
| March | 11 | 1,045,667 | 95.0 (54.8)a | 16.8 (20.0)a | |
| April | 13 | 886,111 | 68.2 (28.6)a | 76.7 (24.0)b | |
| May | 10 | 1,139,828 | 114.0 (132.0)a | 80.6 (16.3)b | |
| June | 9 | 1,301,692 | 144.6 (121.0)a | 71.0 (28.0)b | |
| 2008 | |||||
| March | 5 | 194,870 | 38.9 (40.8)a | 23.1 (38.5)a | |
| April | 12 | 428,373 | 35.7 (35.5)a | 30.3 (33.1)a | |
| May | 10 | 470,537 | 47.0 (46.8)a | 39.2 (34.6)a | |
| Total | 2007 | 43 | 4,373,298 | 101.7 (91.0)x | 61.1 (34.2)x |
| Total | 2008 | 27 | 1,093,780 | 40.5 (40.9)y | 32.3 (33.8)y |
Means within a column followed by different letters are significantly different (P< 0.05).
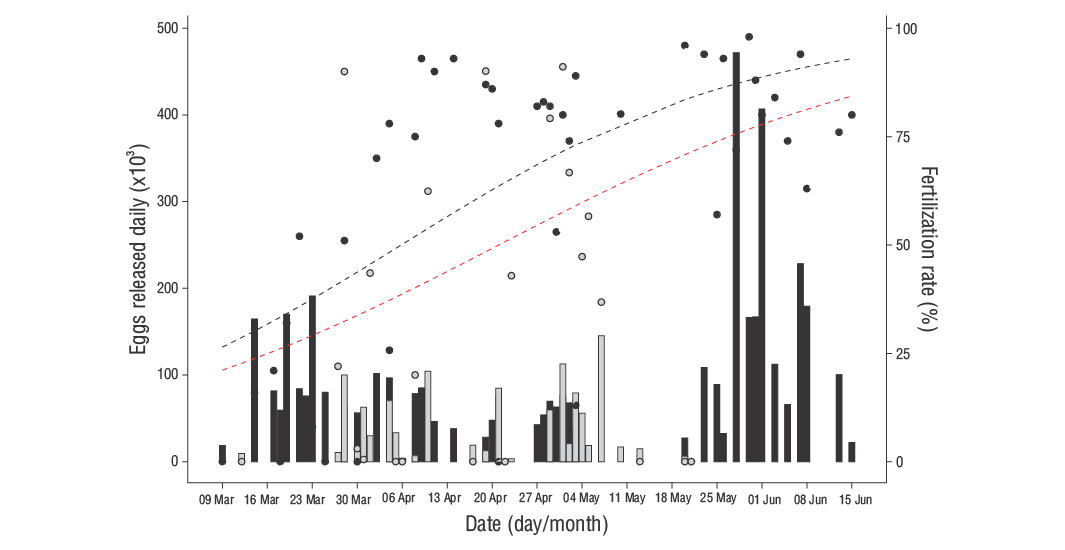
Figura 2. Huevos liberados por día en 2007 (barras negras) y 2008 (barras grises) y tasa de fertilización en 2007 (puntos negros) y 2008 (puntos grises) con base en los desoves naturales de la cabrilla sardinera. Se muestra la relación entre el número de huevos liberados y la fecha de desove en 2007 (línea discontinua negra) y para los valores combinados de 2007 y 2008 (línea discontinua roja) con base en el enlace logit del modelo lineal general.

Figura 3. Huevos de la cabrilla sardinera acumulados durante la temporada de desove de 2007 y de 2008 en cautiverio.
Table 2. Parámetros acumulados de los desoves de la cabrilla sardinera durante 2 temporadas de desove consecutivas (2007 y 2008).
| 2007 Mean (SE) | 2008 Mean (SE) | |
| Eggs released daily (×103eggs) | 101.70 (13.9)a | 40.50 (7.8)b |
| Total eggs released (×106eggs) | 4.37 | 1.07 |
| Annual relative number of eggs released (103eggs·kg-1) | 288.00 | 73.00 |
| Fertilization (%) | 61.10 (5.2)a | 32.30 (6.5)b |
| Viable egg production (103eggs·kg-1) | 184.80 | 25.30 |
Statistically significant differences between the 2 years were present in the parameters examined (P< 0.05).
Análisis estadístico
El número de huevos recolectados por día de desove varió de 68,200 (abril) a 144,600 (junio) en 2007 y de 38,900 (marzo) a 47,000 (mayo) en 2008. No hubo diferencias estadísticamente significativas dentro de cada año (P> 0.05; Tabla 1), pero sí se observaron diferencias significativas entre 2007 y 2008 (P< 0.05). Se registró una tasa de fertilización baja cuando comenzó la temporada de desove, y esta aumentó gradualmente, con diferencias significativas entre meses en 2007 (P< 0.05). La tasa de fertilización presentó mayor variación diaria en 2007 en comparación con 2008, y se encontraron diferencias significativas (P< 0.05) entre los 2 años, con una disminución del 61.1% en 2007 al 32.3% en 2008.
En 2007 hubo una interacción significativa entre la tasa de fertilización y la fecha de desove, pero no se detectó una relación entre la tasa de fertilización y el número de huevos liberados diariamente (Fig. 2). La misma interacción significativa entre la tasa de fertilización y la fecha de desove se detectó para los datos combinados de 2007 y 2008. La expectativa no se desvió de cero. Además, la mayoría de los residuos presentaron un valor absoluto menor que 2. Aparentemente, no hubo puntos de datos influyentes, solo 3 valores atípicos sin influencia. La prueba de chi cuadrada para la desviación estándar residual arrojó un valor P de 0.99 para ambos modelos, por lo que podemos concluir que el modelo se ajustó bien. Para 2008, no se observó relación entre factores.
La frecuencia de desove fue significativamente diferente según las fases lunares. Se observaron más días de desove (9 días) durante la fase de luna llena en comparación con las fases gibosa menguante (4 días), menguante (3 días) o primer cuarto (2 días). Además, el número de huevos liberados fue significativamente mayor durante las fases de luna llena (1,067,696 huevos) y gibosa menguante (742,876 huevos) y significativamente menor durante el primer cuarto (107,222 huevos) en comparación con el número de huevos en las otras fases lunares (de 371,540 a 637,046 huevos). No se hallaron diferencias significativas en la tasa de fertilización. No obstante, se observó una tendencia a mayores tasas de fertilización desde la fase gibosa creciente hasta la de tercer cuarto (Fig. 4).
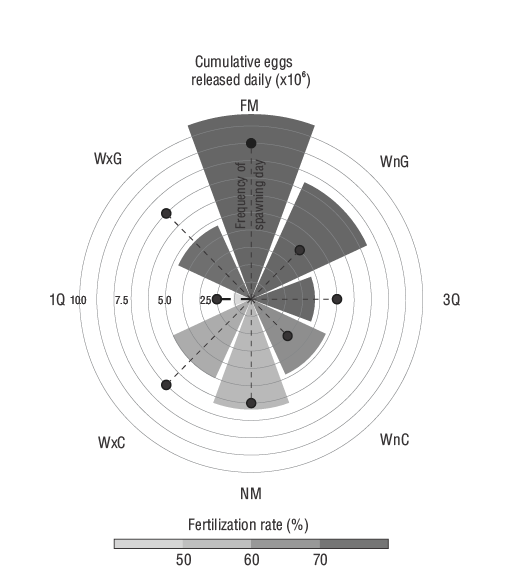
Figura 4. Fecundidad (número acumulado de huevos ×106), frecuencia de desove (número de días de desove) y tasa de fertilización de los desoves naturales de la cabrilla sardinera según las fases lunares. FM: luna llena; WnG: gibosa menguante; 3Q: cuarto menguante; WnC: luna menguante; NM: luna nueva; WxC: luna creciente; 1Q: cuarto creciente; WxG: gibosa creciente.
Discusión
Condiciones para el desove natural en cautiverio
La aclimatación de los organismos a las condiciones de cautiverio, la madurez gonadal y el desove natural están influenciados por un gran número de factores biológicos, físicoquímicos y ambientales. Por ejemplo, los peces criados en cautiverio pueden presentar problemas reproductivos si las condiciones ambientales no son adecuadas (Mustafa et al. 2015). Por tanto, el mantener a los individuos de diferentes especies a temperatura y condiciones de tanque adecuadas con una alimentación y cuidados apropiados puede promover la reproducción espontánea en cautiverio. Nuestros resultados comprueban que el sistema de recirculación utilizado en los tanques (7 m3) en este estudio fue eficiente y produjo condiciones deseables para la maduración y la reproducción natural de la cabrilla sardinera. Además, los regímenes de alimentación y fotoperiodo y las condiciones de oxígeno, salinidad y temperatura fueron adecuados para el buen mantenimiento de los reproductores silvestres y el desarrollo de la reproducción con desove espontáneo de esta especie. El desove natural se ha reportado en un gran número de especies que incluye la seriola,Seriola dumerili(Jerez et al. 2006), y el lenguado fino,Paralichthys adspersus(Angeles y Mendo 2005). Existen numerosos ejemplos de especies de cabrilla en los que los individuos se mantuvieron en tanques de fibra de vidrio, jaulas o tanques de concreto con sistemas de recirculación (Toledo et al. 1993, James et al. 1997, Jagadis et al. 2006, Mathew 2010, Ranjan et al. 2017).
La dieta proporcionada durante este estudio estuvo compuesta principalmente de sardina, caballa y calamar. Esta dieta fue similar a las observadas en estudios de alimentación natural de poblaciones silvestres deM. rosaceacon organismos del mismo tamaño que aquellos utilizados en el presente estudio (Peláez-Mendoza 1997, Pérez-Rojo 2016). La dieta fue suficiente para mantener reproductores saludables y lograr la maduración y el desove. Sin embargo, se necesitan más estudios para desarrollar dietas artificiales que mejoren la calidad y cantidad de desoves. A pesar de que se conoce la importancia de la nutrición de los reproductores sobre la calidad de los huevos y las larvas, y la fecundidad, la nutrición de meros no ha sido estudiada adecuadamente (Luo et al. 2005). Durante un estudio del desove natural deEpinephelus tauvina, los reproductores fueron alimentados con morralla, pequeños cefalópodos, vitaminas E y B12, y otros suplementos nutricionales para proporcionar un enriquecimiento esencial deácido eicosapentaenoico, ácido docosahexaenoico y ácidos grasos poliinsaturados (Mathew 2010).
El tiempo de aclimatación y la madurez de peces en cautiverio dependen de varios factores, como las instalaciones, el manejo, la nutrición, y los aspectos biológicos de las especies. Los peces marinos comoSolea solea(Ofelio et al. 2020) yS. dumerli(Jerez et al. 2006) pueden tardar 2 y 6 años en madurar en cautiverio, respectivamente. Los meros han sido descritos como especies que pueden madurar y desovar naturalmente en cautiverio después de un periodo de aclimatación poscaptura, que puede ser relativamente corto en especies comoEpinephelus suillus(Toledo et al. 1993),Epinephelus polyphekadion(James et al. 1997) yEpinephelus merra(Jagadis et al. 2006).
Ciclo reproductivo, época de desove e influencia de la temperatura, el fotoperiodo y la fase lunar
En la naturaleza, se ha observado que la cabrilla sardinera desova de mayo a junio (Estrada-Godínez et al. 2011), de marzo a mayo (Sala et al. 2003) o de abril a junio (Erisman et al. 2007). Estrada-Godínez et al. (2011) observaron, en la temporada de desove, temperaturas que variaron entre 21 y 25 °C y aproximadamente 13 h de luz (Estrada-Godínez et al. 2011). Las diferencias en la temporada de desove entre los diferentes estudios podrían referirse a diferencias en la temperatura y otras variables entre los sitios de estudio. Sala et al. (2003) sugirieron que las diferencias latitudinales en el golfo de California, relacionadas con la temperatura del agua, pueden provocar diferencias en los periodos de desove de la cabrilla sardinera. El ciclo reproductivo de la cabrilla sardinera en la naturaleza y en cautiverio muestra diferentes fases reproductivas a lo largo del año (Erisman et al. 2008, Estrada-Godínez et al. 2011). Hay un periodo de reposo, desde agosto hasta noviembre, en el que los ovocitos comienzan a desarrollarse (Kiewek-Martínez et al. 2010). Luego ocurre un periodo de maduración de 4 meses, que comienza cuando las horas de luz y la temperatura aumentan progresivamente.
En el presente estudio, la maduración final en las hembras y la maduración completa en los machos se observó en febrero de 2007 y enero de 2008 tras el análisis de los ovocitos. Con base en los huevos recolectados, el desove comenzó en marzo y duró hasta mayo-junio. Notamos que el comienzo de la época de desove ocurrió conforme incrementó el fotoperiodo, que puede ser lo que desencadena la madurez gonadal después del solsticio de invierno. No obstante, se requieren más estudios para comprobar esta hipótesis. De hecho, se han realizado pocos estudios sobre la influencia del fotoperiodo y la temperatura del agua en los meros a pesar de que estas variables son importantes en el proceso reproductivo (Rimmer y Glamuzina 2019). Kanemaru et al. (2012) observaron la maduración en ejemplares deE. merraluego de la inducción con un análogo de la hormona liberadora de gonadotropina (GnRHa) y un fotoperiodo largo. La influencia de la temperatura sobre la madurez gonadal y el desove es poco conocida, y la temperatura por sí sola no fue suficiente para controlar el desarrollo gonadal enEpinephelus fuscoguttatus(Rimmer y Glamuzina 2019).
La frecuencia de desove y la frecuencia de la liberación de huevos diaria fueron significativamente diferentes según las fases lunares, aunque no se hallaron diferencias significativas en las tasas de fertilización luego del análisis de 70 días a lo largo de la temporada de desove. Cabe señalar que estos resultados se basan en el efecto de la luna sobre un grupo de peces y no son los resultados de observaciones de peces individuales. Se ha encontrado que el ritmo lunar influye en el desove natural deE. merra(Jagadis et al. 2006) yE. tauvina(Mathew 2010) en cautiverio. En otro estudio, se encontró que la asociación del desove con el ciclo lunar se debilitó durante el periodo experimental (Ranjan et al. 2017).
Producción de huevos
Los meros se aclimatan bien al confinamiento y generalmente pueden reproducirse espontáneamente en esas condiciones (Tucker 1994). La eficiencia de la producción de huevos por animal fue muy clara, lo que respalda que la puesta natural es un componente importante en la reproducción de la cabrilla, especialmente si se consideran los beneficios asociados adicionales como menores costos de personal, instalaciones y energía y menos manejo de animales. El total de huevos liberados durante la temporada de desove fue de 4.3 × 106en 2007 y 1.0 × 106en 2008. Además, el desove natural también dio resultados exitosos en la producción de huevos.
En estudios previos, se recolectaron un total de 47.00 × 106huevos conEpinephelus coioides(Ranjan et al. 2017), 9.20 × 106huevos conE. tauvina(Mathew 2010) y más de 17.00 × 106huevos enE. polyphekadion(James et al. 1997). Son evidentes las grandes diferencias en la producción de huevos entre estos estudios, pues utilizaron diferentes especies, tamaños de individuos, condiciones de confinamiento, métodos de alimentación e instalaciones. En el presente estudio hubo diferencias entre 2007 y 2008, incluso diferencias significativas en el número de huevos recolectados y sus tasa de fertilización. Estas diferencias pueden deberse a que los animales fueron trasladados a un laboratorio cerrado en 2007 después de la época de desove. No obstante, las razones de estas diferencias no son claras, ya que los parámetros físicoquímicos, la alimentación y el manejo fueron similares en ambos años.
Es difícil comparar los resultados del presente estudio con aquellos estudios que han empleado la inducción hormonal. Los resultados aquí expuestos se obtuvieron de un grupo de peces y no provinieron de datos de los individuos. Sin embargo, los resultados colectivos de todos los estudios sobre este tema permiten visualizar las mejoras que se han producido con el desove natural en comparación con la inducción hormonal. La tasa de fertilización y la fecundación que se han obtenido tras la inducción con hormonas (hCG y LHRHa) enM. rosaceason muy variables y oscilan entre 3 × 103y 571 × 103huevos por puesta (Kiewek-Martínez et al. 2010), lo que resultó en la producción de 3.70 × 106huevos viables con 97 hembras y una baja tasa de fertilización. En general, los estudios de la reproducción en la cabrilla sardinera demuestran los beneficios de la reproducción natural dado que, en comparación con la inducción hormonal, la reproducción natural rinde una mayor producción de huevos con un menor número de ejemplares.
La producción de huevos estimada fue de 288 × 103y 73 × 103huevos·kg-1en 2007 y 2008, respectivamente. La variación interespecífica en la fecundidad se ha observado con otras especies que presentan mayor fecundidad que la cabrilla sardinera. Por ejemplo, se observó que la fecundidad relativa anual fue mayor que 400,000 huevos·kg-1con el pargo rojo,Pagrus pagrus(Mylonas et al. 2004), y de 2.80 a 4.90 × 106huevos·kg-1con el pargoDiplodus puntazzo(Papadaki et al. 2008).
Número de puestas
Las hembras de cabrilla sardinera presentan desarrollo ovárico sincrónico por grupos (Maldonado-García et al. 2018). Los peces sincrónicos grupales tienen ovarios con distintos tipos de ovocitos al mismo tiempo. Estos peces pueden ovular una vez o durante unos pocos días o semanas en un ciclo reproductivo. En el presente estudio, se observaron 43 días de desove en 2007 y 27 días de desove en 2008, y el número de días de desove por mes se mantuvo relativamente constante (9-13 días de desove por mes) excepto en marzo de 2008. En este mes, los peces comenzaron a desovar el 12 de marzo, lo que dio como resultado solo 5 desoves en ese mes.
En general, las especies de mero que se reproducen de forma natural en cautiverio desovan varias veces al mes durante varios meses del año. El desove natural ha sido observado en casi todos los meses durante 2 años consecutivos (Mathew 2010). Durante la temporada de desove, se ha observado un aumento en la frecuencia de desove de 5 a 13 puestas por mes (Ranjan et al. 2017). Además, se observaron múltiples puestas entre agosto y octubre en 2004, con un número de huevos por puesta que osciló entre 22,000 y 180,000 (Jagadis et al. 2006). Finalmente, se encontró que meros que habían desovado unas cuantas veces al año durante 3 años consecutivos fueron capaces de desovar 2-3 veces al mes durante 4 meses después de que se implementaron cambios a la nutrición de los reproductores (James et al. 1997). Como futura meta de investigación, se deben incorporar organismos reproductores silvestres en los programas de crianza en cautiverio para aprovechar su composición genética y evitar la endogamia, lo que puede impactar de manera negativa las generaciones posteriores (Bright et al. 2016, Superio et al. 2021).
Época de desove
La falta de luz en el momento del cortejo y el desove no permitió la observación directa de estas 2 acciones. Sin embargo, las observaciones directas a lo largo de este experimento permitieron confirmar que los primeros óvulos fecundados obtenidos en el recolector aparecieron entre la puesta del sol y la noche, justo antes de la oscuridad total. Erisman et al. (2007) estudió el comportamiento de desove de la cabrilla sardinera en su entorno natural e indicó que el desove ocurrió al final de la tarde a pocas horas antes de la puesta del sol. El desove conforme se acerca la oscuridad es un comportamiento regular que se ha observado con frecuencia en otras especies, como el meroEpinephelus marginatus, el cual fue observado desovar una hora antes y media hora después de la puesta del sol alrededor del periodo de la luna nueva (Zabala et al. 1997). Este comportamiento de desove también se ha observado con el mero de Nassau,Epinephelus striatus(Whaylen et al. 2004). El desove de entre 10 y 17 individuos se observó en el anochecer a pocos días después de la luna llena (Rowell et al. 2019). Los desoves naturales en cautiverio a menudo se han observado durante la tarde, el atardecer y la noche (Jagadis et al. 2006, Mathew 2010, Ranjan et al. 2017), pero también pueden ocurrir por la mañana (James et al. 1997).
Tamaño de los ovocitos fertilizados
El diámetro medio (±DE) de huevos del desove natural fue de 864.0 ± 22.0 μm (848.0 a 884.0 μm). Se han encontrado diámetros de huevo similares mediante la inducción hormonal, a saber: 859.0 ± 18.0 μm (Gracia-López et al. 2005), 860.0 ± 30.0 μm y 880.0 ± 20.0 μm (Gracia-López et al. 2004a), y 872.0 ± 15.0 μm (Gracia-López et al. 2004b). Los huevos deE. merrafueron descritos como perfectamente esféricos y flotantes, con diámetros que oscilaron entre 710.0 y 730.0 μm (Jagadis et al. 2006). Los huevos fertilizados deE. coioideseran redondos y midieron alrededor de 857.7 μm (Fourooghifard et al. 2017). El diámetro de los huevos deE. polyphekadionfue de 757.3 ± 37.4 μm (James et al. 1997). Es importante mencionar que el diámetro de huevo resultante fue mayor en los huevos obtenidos por desove natural que en aquellos obtenidos por inducción hormonal (Papanikos et al. 2003).
En conclusión, con nuestra metodología, podemos asegurar una producción de huevos constante en cautiverio con peces capturados en libertad y mantenidos durante aproximadamente 2 años sin manipular los parámetros que comúnmente afectan la reproducción de los peces. La cabrilla sardinera desova durante 3-4 meses y puede producir 184 × 103huevos viables·kg-1. En este estudio, la época de desove (marzo a mayo-junio) estuvo relacionada con el incremento de la temperatura y el fotoperiodo, aunque se requieren más estudios para confirmar el efecto de estas variables sobre la reproducción de la cabrilla sardinera. Por último, la fase lunar tuvo un efecto sobre la fecundidad a lo largo de la temporada de desove.
Agradecimientos
Este proyecto fue financiado por la Comisión Nacional de Pesca y Acuacultura (CONAPESCA) y, de manera conjunta, por la Secretaría de Educación Pública y el Consejo Nacional de Ciencia y Tecnología (SEP-CONACYT). Los autores agradecen a Francisco Nieto la coordinación del proyecto por parte de la CONAPESCA, a Vanessa Díaz la edición del idioma inglés y a Alexia Omont el apoyo estadístico. Todos los coautores declaran que no tienen conflicto de intereses. Los datos que respaldan este estudio están disponibles a través el autor para la correspondencia.
REFERENCIAS
Angeles B, Mendo J. 2005. Crecimiento, fecundidad y diferenciación sexual del lenguadoParalichthys adspersus(Steindechner) de la costa central del Perú. Ecología aplicada. 4(1-2):105-112. https://doi.org/10.21704/rea.v4i1-2.304 [ Links ]
Bell B, Defouw RJ. 1966. Dependence of the lunar modulation of geomagnetic activity on the celestial latitude of the moon. J Geophys Res. 71:951-957. [ Links ]
Bright D, Reynolds A, Nguyen NH, Knuckey R, Knibb W, Elizur A. 2016. A study into parental assignment of the communal spawning protogynous hermaphrodite, giant grouper (Epinephelus lanceolatus). Aquaculture. 459:19-25. https://doi.org/10.1016/j.aquaculture.2016.03.013 [ Links ]
Carrillo M, Bromage N, Zanuy S, Serrano R, Prat F. 1989. The effects of modifications in photoperiod on spawning time ovarian development and egg quality in the sea bass (Dicentrarchus labrax). Aquaculture. 81(3-4):351-365. https://doi.org/10.1016/0044-8486(89)90159-2 [ Links ]
Erisman BE, Buckhorn ML, Hastings PA. 2007. Spawning patterns in the leopard grouper,Mycteroperca rosacea, in comparison with other aggregating groupers. Mar Biol. 151:1849-1861.https://doi.org/10.1007/s00227-007-0623-2 [ Links ]
Erisman B, Craig MT. 2018. Mycteroperca rosacea. The IUCN Red List of Threatened Species 2018: e.T14053A100466656. [place unknown]: International Union for Conservation of Nature; [accessed 2021 February 09]. https://doi.org/10.2305/IUCN.UK.2018-2.RLTS.T14053A100466656.en. [ Links ]
Erisman BE, Rosales-Casián JA, Hasting PA. 2008. Evidence of gonochorism in a grouper,Mycteroperca rosacea, from the Gulf of California, Mexico. Environ Biol Fish. 82:23-33. https://doi.org/10.1007/s10641-007-9246-1 [ Links ]
Estrada-Godinez JA, Maldonado-García M, Gracia-López V, Carrillo M. 2011. Reproductive cycle of the leopard grouper,Mycteroperca rosacea(Streets) and evidence of hermaphroditism = Ciclo reproductive de la cabrilla sardineraMycteroperca rosaceaen la bahía de La Paz, México. Cienc Mar. 37(4):425-441. [ Links ]
Estrada-Godínez JA, Maldonado-García M, Gracia-López V, Carrillo M, Rebollar-Prudente R,Spanopoulos-Zarco M. 2014. Efecto del fotoperiodo y la temperatura sobre la composición bioquímica en Reproductores silvestres de cabrilla sardinera,Mycteroperca rosacea(Streets, 1877) = Effect of photoperiod and temperature on the biochemical composition in wild broodstock of sardine cabrilla,Mycteroperca rosacea(Streets, 1877). Lat Am J Aquat Res. 42(1):85-96. http://doi.org/10.3856/vol42-issue1-fulltext-6 [ Links ]
Fourooghifard H, Matinfar A, Abdolalian E, Moezzi M, Roohani-Ghadikolaee K, Kamali E, Allen S, Zahedi MR. 2017. Egg production and larval rearing of orange-spotted grouper (Epinephelus coioides) using reared broodstocks in Hormozgan Province, Iran. Iranian J Fish Sci. 16(3):984-992. [ Links ]
González-Cuellar OT, Plomozo-Lugo T, Castro-Moreno P, Weaver AH, Álvarez-Flores CM. 2019. Información de los recursos pesqueros, costa sudoriental de Baja California Sur. La Paz (Baja California Sur, Mexico): Sociedad de Historia Natural Niparajá AC y ProNatura Noroeste AC. 68 p. [ Links ]
Gracia-López V, Kiewek-Martínez M, Maldonado-García M. 2004a. Effects of temperature and salinity on artificially reproduced eggs and larvae of leopard grouperMycteroperca rosacea. Aquaculture . 237(1-4):485-498. http://doi.org/10.1016/j.aquaculture.2004.04.018 [ Links ]
Gracia-López V, Kiewek-Martínez M, Maldonado-García M, Monsalvo-Spencer P, Portillo-Clark G, Civera-Cerecedo R, Linares-Aranda M, Robles-Mungaray M, Mazón-Suástegui JM. 2005. Larvae and juvenile production of the leopard grouper,Mycteroperca rosacea(Streets 1877). Aquacult Res. 36(1):110-112. https://doi.org/10.1111/j.1365-2109.2004.01186.x [ Links ]
Gracia-López V, Rodríguez-Romero J, Pérez-Ramírez JM. 2004b. Inducción del desove con HCG y desarrollo embrionario y de larvas de la cabrilla sardinera,Mycteroperca rosacea(Streets, 1877) = Hormone Induced spawning (HCG) and embryonic and larval development of the leopard grouperMycteroperca rosacea(Streets 1877). Cienc Mar . 30(2):279-284. https://doi.org/10.7773/cm.v30i2.246 [ Links ]
Grant RA, Chadwick EA, Halliday T. 2009. The lunar cycle: a cue for amphibian reproductive phenology?. Anim Behav. 78(2):349-357. https://doi.org/10.1016/j.anbehav.2009.05.007 [ Links ]
Jagadis I, Ignatius B, Kandasami D, Khan MA. 2006. Embryonic and larval development of honeycomb grouperEpinephelus merraBloch. Aquacult Res . 37(11):1140-1145. http://doi.org/10.1111/j.1365-2109.2006.01538.x [ Links ]
James CM, Al-Thobaiti SA, Rasem BM, Carlos MH. 1997. Breeding and larval rearing of the camouflage grouperEpinephelus polyphekadion(Bleeker) in the hypersaline waters of the Red Sea coast of Saudi Arabi. Aquacult Res . 28(9):671-681. https://doi.org/10.1046/j.1365-2109.1997.00908.x [ Links ]
Jerez S, Samper M, Santamaría FJ, Villamandos JE, Cejas JR, Felipe BC. 2006. Natural spawning of greater amberjack (Seriola dumerili) kept in captivity in the Canary Islands. Aquaculture . 252(2-4):199-207. http://doi.org/10.1016/j.aquaculture.2005.06.031 [ Links ]
Kanemaru T, Nakamura M, Murata R, Kuroki K, Horie H, Uchida K, Senthilkumaran B, Kagawa H. 2012. Induction of sexual maturation of the female honeycomb grouper,Epinephelus merra, in the non-breeding season by modulating environmental factors with GnRH analogue implantation. Aquaculture . 358-359:85-91. http://doi.org/10.1016%2Fj.aquaculture.2012.06.026 [ Links ]
Kiewek-Martinez M, Gracia-Lopez V, Carrillo-Estevez M. 2010. Comparison of the effects of HCG and LHRHa on the induction of ovulation of wild and captive leopard grouper,Mycteroperca rosacea. J World Aquacult Soc. 41(5):733-745. https://doi.org/10.1111/j.1749-7345.2010.00415.x [ Links ]
Kungvankij P, Tiro LB, Pudadera BP, Potestas IO. 1986. Induced spawning and larval rearing of grouper (Epinephelus salmoidesMaxwell). In: Maclean JL, Dizon LB, Hosillos LV (eds.), Proceedings of the First Asian Fisheries Forum., May 26-31, 1986. Manila (Philippines): Asian Fisheries Society. p. 663-666. [ Links ]
Lee WK, Yang SW. 2002. Relationship between ovarian development and serum levels of gonadal steroid hormones, and induction of oocyte maturation and ovulation in the cultured female Korean spotted sea bassLateolabrax maculates(Jeom-nong-eo). Aquaculture . 207(1-2):169-183. http://dx.doi.org/10.1016/S0044-8486(01)00728-1 [ Links ]
Lim LC. 1993. Larviculture of the greasy grouperEpinephelus tauvinaF. and the brown-marbled grouperE. fuscoguttatusF. in Singapore. J World Aquacult Soc . 24(2):262-273. https://doi.org/10.1111/J.1749-7345.1993.TB00015.X [ Links ]
Luo Z, Liu Y, Mai K, Tian L. 2005. Advances in the study on nutrient requirements of grouper (Epinephelussp.): a review. J Ocean Univ China (English Edition). 4:93-98. http://doi.org/10.1007/s11802-005-0001-y [ Links ]
Maldonado-García M, Gracia-López V, Kiewek-Martínez M, Carrillo M, Zanuy S. 2018. Reproductive cycle of leopard grouperMycteroperca rosacea(Streets, 1877) held in captivity: relationship between gonad development and sex steroid concentration. Lat Am J Aquat Res . 46(1):83-90. https://doi.org/10.3856/vol46-issue1-fulltext-10 [ Links ]
Martínez-Lagos R, Gracia-López V. 2009. Morphological development and growth patterns of the leopard grouperMycteroperca rosaceaduring larval development. Aquacult Res . 41:120-128. https://doi.org/10.1111/j.1365-2109.2009.02313.x [ Links ]
Martínez-Lagos R, Tovar-Ramírez D, Gracia-López V, Lazo JP. 2014. Changes of digestive enzyme activities during larval development of leopard grouper (Mycteroperca rosacea). Fish Physiol Biochem. 40(3):773-785. https://doi.org/10.1007/s10695-013-9884-5 [ Links ]
Mathew G. 2010. Spontaneous spawning ofEpinephelus tauvina(Forskal) in captivity. J Mar Biol Ass India. 52(1):14-18. [ Links ]
Mustafa S, Hajini MH, Senoo S, Kian AYS. 2015. Conditioning of broodstock of tiger grouper,Epinephelus fuscoguttatus, in a recirculating aquaculture system. Aquacult Rep. 2:117-119. https://doi.org/10.1016/j.aqrep.2015.09.004 [ Links ]
Mylonas CC, Papadaki M, Pavlidis M, Divanach P. 2004. Evaluation of egg production and quality in the Mediterranean red porgy (Pargus pargus) during two consecutive spawning seasons. Aquaculture . 232(1-4):637-649. https://doi.org/10.1016/s0044-8486(03)00534-9 [ Links ]
Mylonas CC, Zohar Y. 2001. Use of GnRHa-delivery systems for the control of reproduction in fish. Rev Fish Biol Fish. 10:463-491. http://dx.doi.org/10.1023/A:1012279814708 [ Links ]
Ofelio C, Guarniero I, Cariani A, Viroli C, Bonaldo A, Gatta PP, Parma L. 2020. Monitoring of common soleSolea solea(L) captive broodstock from Northern Adriatic Sea over consecutive spawning seasons. Aquacult Rep . 18(2020):100495. https://doi.org/10.1016/j.aqrep.2020.100495 [ Links ]
Okumura S, Okamoto K, Oomori R, Nakazono A. 2002. Spawning behavior and artificial fertilization in captive reared red spotted grouperEpinephelus akaara. Aquaculture . 206(3-4):165-173.http:// doi.org/10.1016/S0044-8486(01)00722-0 [ Links ]
Papadaki M, Papadopoulou M, Siggelakia I, Mylonas CC. 2008. Egg and sperm production and quality of sharpsnout sea bream (Diplodus puntazzo) in captivity. Aquaculture . 276(1-4):187-197. http://doi.org/10.1016/j.aquaculture.2008.01.033 [ Links ]
Papanikos N, Phelps RP, Williams K, Ferry A, Maus D. 2003. Egg and larval quality of natural and induced spawns of red snapper,Lutjanus campechanus. Fish Physiol Biochem . 28(1-4):487-488. http://doi.org/10.1023/B:FISH.0000030636.08228.4e [ Links ]
Peláez-Mendoza AK. 1997. Hábitos alimenticios de la cabrilla sardineraMycteroperca rosaceaStreets, 1877 (Pisces: Serranidae) en la Bahía de La Paz BCS y zonas adyacentes [BSc thesis]. [La Paz (BCS, Mexico)]: Universidad Autónoma de Baja California Sur (UABCS). 71 p. [ Links ]
Pérez-Rojo MP. 2016. Hábitos alimentarios de la cabrilla sardineraMycteroperca rosacea(Streets, 1877), en Santa Rosalía, BCS, México [MSc thesis]. [La Paz (BCS, Mexico): Instituto Politécnico Nacional. Centro Interdisciplinario de Ciencias Marinas. 65 p. [ Links ]
Ranjan R, Megarajan S, Xavier B, Dash B, Ghosh S, Menon M, Edward LL. 2017. Conditioning, maturation and year‐round natural spawning of orange‐spotted grouper,Epinephelus coioides(Hamilton, 1822) in recirculating aquaculture system. Aquacult Res . 48(12):5864-5873. https://onlinelibrary.wiley.com/doi/epdf/10.1111/are.13409 [ Links ]
Reyes-Becerril M, Tovar-Ramírez D, Ascencio-Valle F, Civera-Cerecedo R, Gracia-López V, Barbosa-Solomieu V. 2008. Effects of dietary live yeastDebaryomyces hanseniion the immune and antioxidant system in juvenile leopard grouperMycteroperca rosaceaexposed to stress. Aquaculture . 280(1-4):39-44. http://dx.doi.org/10.1016/j.aquaculture.2008.03.056 [ Links ]
Reyes-Becerril M, Tovar-Ramírez D, Ascencio-Valle F, Civera-Cerecedo R, Gracia-López V, Barbosa-Solomieu V, Esteban MA. 2011. Effects of dietary supplementation with probiotic live yeastDebaryomyces hanseniion the immune and antioxidant systems of leopard grouperMycteroperca rosaceainfected with Aeromonas hydrophila. Aquacult Res . 42(11):1676-1686. https://doi.org/10.1111/j.1365-2109.2010.02762.x [ Links ]
Rimmer MA, Glamuzina B. 2019. A review of grouper (Family Serranidae: Subfamily Epinephelinae) aquaculture from a sustainability science perspective. Rev Aquacult. 11:58-87. https://doi.org/10.1111/raq.12226 [ Links ]
Rowell TJ, Aburto-Oropeza O, Cota-Nieto JJ, Steele MA, Erisman BE. 2019. Reproductive behaviour and concurrent sound production of Gulf grouperMycteroperca jordani(Epinephelidae) at a spawning aggregation site. J Fish Biol. 94(2):277-296. https://doi.org/10.1111/jfb.13888 [ Links ]
RStudio Team (2020). RStudio: Integrated Development for R. Boston, MA: RStudio, PBC; accessed 24 August 2022. http://www.rstudio.com/. [ Links ]
Sala E, Aburto-Oropeza O, Paredes G, Thompson G. 2003. Spawning aggregations and reproductive behavior of reef fishes in the Gulf of California. Bull Mar Sci. 72(1):103-121. [ Links ]
Sala E, Aburto-Oropeza O, Reza M, Paredes G, López-Lemus LG. 2004. Fishing down coastal food webs in the Gulf of California. Fisheries. 29(3):19-25. http://doi.org/10.1577/1548-8446(2004)29[19:FDCFWI]2.0.CO;2 [ Links ]
Stolov HL. 1965. Further investigations of a variation of geomagnetic activity with lunar phase. J Geohys Res. 70:4921-4926. https://doi.org/10.1029/JZ070i019p04921 [ Links ]
Superio J, Fakriadis I, Tsigenopoulos CS, Lancerotto SA, Rodriguez AV, Vervelakis E, Mylonas CC. 2021. Spawning kinetics and parentage contribution of European sea bass (S) broodstocks, and influence of GnRHa-induced spawning. Aquacult Rep . 21:100766. https://doi.org/10.1016/j.aqrep.2021.100766 [ Links ]
Toledo JD, Nagai A, Javellana D. 1993. Successive spawning of grouper,Epinephelus suillus(Valenciennes), in a tank and a floating net cage. Aquaculture . 115(3-4):361-367. http://doi.org/10.1016/0044-8486(93)90149-S [ Links ]
Tucker JW Jr. 1994. Spawning by captive Serranid fishes: a review. J World Aquacult Soc . 25(3):345-359. https://doi.org/10.1111/j.1749-7345.1994.tb00218.x [ Links ]
Whaylen L, Pattengill-Semmens, Semmens BX, Bush PG, Boardman MR. 2004. Observations of a Nassau grouper,Epinephelus striatus, spawning aggregation site in Little Cayman, Cayman Islands, including multi-Species spawning information. Environ Biol Fish . 70:305-313. https://doi.org/10.1023/B:EBFI.0000033341.57920.a8 [ Links ]
Zabala M, Garcia-Rubies A, Louisy P, Sala E. 1997. Spawning behaviour of the Mediterranean dusky grouper,Epinephelus marginatus(Lowe, 1834) (Pisces: Serranidae), in the Medes Islands Marine Reserve (NW Mediterranean, Spain). Sci Mar. 61(1):65-77. [ Links ]
Zanuy S, Prat F, Carrillo M, Bromage NR. 1995. Effects of constant photoperiod on spawning and plasma 17β-oestradiol levels of sea bass (Dicentrarchus labrax). Aquat Living Resour. 8(2):147-152. http://dx.doi.org/10.1051/alr:1995011 [ Links ]
Zohar Y, Mylonas CC. 2001. Endocrine manipulations of spawning in cultured fish: from hormones to genes. Aquaculture . 197(1-4):99-136. https://doi.org/10.1016/S0044-8486(01)00584-1 [ Links ]
Recibido: 13 de Diciembre de 2021; Aprobado: 18 de Junio de 2022; Publicado: 25 de Mayo de 2023











 text in
text in 




