Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.49 Ensenada Jan./Dec. 2023 Epub Dec 08, 2023
https://doi.org/10.7773/cm.y2023.3300
Artículos
Efectos de la irradiación y el nitrato sobre la fotosíntesis en el pasto marino Cymodocea nodosa
1Universidad Autónoma de Baja California, Instituto de Investigaciones Oceanológicas, 22860 Ensenada, Baja California, Mexico.
2Universidad Autónoma de Baja California, Escuela de Ciencias de la Salud, 22800 Ensenada, Baja California, Mexico.
3Universidad de Málaga, Instituto de Biotecnología y Desarrollo Azul, Centro Experimental Grice Hutchinson, E-29004, Málaga, Spain.
Los efectos de la temperatura, la irradiancia y otras variables ambientales sobre la fotosíntesis en los pastos marinos son bien conocidos. Sin embargo, existe poca información sobre los efectos del nitrato en el agua marina sobre las características fotosintéticas de los macrófitos marinos. En este estudio, se planteó determinar el efecto de la concentración de nitrato en el agua marina sobre el rendimiento cuántico efectivo del pasto marino Cymodocea nodosa. Los haces de C. nodosa se incubaron con diferentes concentraciones de nitrato y bajo diferentes niveles de irradiancia. En contraste, hubo una disminución de la transmitancia y un aumento exponencial de la absortancia de los haces en función del aumento de los niveles de nitrato. Además, el rendimiento cuántico efectivo del fotosistema II (ΦFSII) en los haces de C. nodosa aumentó exponencialmente al aumentar la concentración de nitrato en el medio. Los valores de ΦFSII en los haces disminuyeron a medida que aumentaba la irradiancia y alcanzaron valores mínimos al mediodía solar o 2 h después. Esta disminución en los valores de ΦFSII, sin embargo, fue 4 veces mayor en los haces incubados bajo radiación solar completa (100% de Eo) en comparación con los incubados con 20% de Eo. Los valores de ΦFSII disminuyeron a casi cero en los haces pre-incubados con 0 µM de NO3 -, mientras que los valores de ΦFSII en los haces pre-incubados con 25 y 100 µM de NO3 - disminuyeron aproximadamente un 25% de sus valores iniciales. Estos resultados indican que los niveles de nitrógeno en el agua marina regulan los valores del rendimiento cuántico efectivo de C. nodosa, lo que sugiere que las características fotosintéticas de este pasto marino podrían estar reguladas por los niveles fluctuantes de nitrato en la columna de agua como aquellos observados en las regiones de surgencia.
Palabras clave: Cymodocea nodosa; clorofila a in vivo; fluorescencia; nitrato; fotosíntesis; pasto marino
The effects of temperature, irradiance, and other environmental variables on photosynthesis in seagrasses are well understood. However, little information is available regarding the effects of the nitrate concentration in seawater on the photosynthetic characteristics of marine vegetation. Thus, the aim of this study was to determine the effect of the nitrate concentration in seawater on the effective quantum yield of the seagrass Cymodocea nodosa. Cymodocea nodosa shoots were incubated under different irradiance levels and with different nitrate concentrations. In contrast, a decrease in transmittance and an exponential increase in the absorptance of the shoots were observed as a function of increasing nitrate levels. Furthermore, the effective quantum yield of photosystem II (ΦPSII) in C. nodosa shoots increased exponentially as the nitrate concentration in the media increased. The ΦPSII values in the shoots decreased as irradiance increased and reached minimum values at solar noon or 2 h afterward. However, the decrease of ΦPSII values was 4-fold greater in shoots incubated under full solar radiation (100% natural incident irradiance, Eo) compared to those of shoots incubated with 20% Eo. The ΦPSII values decreased to almost zero in shoots pre-incubated with no nitrate (0 µM NO3 -), whereas ΦPSII values in shoots pre incubated with 25 and 100 µM NO3 - decreased by approximately 25% of their initial values. Collectively, these results indicate that nitrogen levels in seawater regulate the effective quantum yield values of C. nodosa, which suggests that the photosynthetic characteristics of this seagrass might be regulated by fluctuating nitrate levels in the water column such as those that are observed in upwelling regions.
Key words: Cymodocea nodosa; in vivo chlorophyll a fluorescence; nitrate; photosynthesis; seagrass
INTRODUCCIÓN
Las praderas de pastos marinos juegan papeles ecológicos críticos en las áreas costeras tropicales y templadas y se consideran de los sistemas más productivos dentro de los ambientes marinos (Phillips y McRoy 1980). En el mar Mediterráneo, Cymodocea nodosa y Posidonia oceanica forman grandes praderas y son la vegetación dominante en las zonas costeras. En México, Zostera marina es la principal vegetación acuática que se encuentra sumergida en las lagunas costeras y ensenadas someras de la península de Baja California y el golfo de California (Muñiz-Salazar et al. 2005). Además de la importancia de la biomasa de brotes y rizomas, las praderas de pastos marinos sirven como sustratos para una gran cantidad de algas, invertebrados y vertebrados (Brito et al. 2005). Al igual que con otras plantas acuáticas, las fluctuaciones estacionales en la temperatura del agua de mar y la disponibilidad de nutrientes afectan la productividad y la biomasa de los pastos marinos y a sus epífitas asociadas. Por ejemplo, tanto la biomasa superficial como la productividad primaria de C. nodosa y Z. marina disminuyen en invierno debido a las bajas temperaturas del agua de mar (Cabello-Pasini et al. 2004).
Junto con la biomasa y la productividad primaria, los componentes bioquímicos de las algas marinas y los pastos marinos fluctúan en respuesta a las condiciones ambientales. Por ejemplo, se ha encontrado que el contenido de clorofila en los brotes de Z. marina y C. nodosa aumenta con la profundidad y la limitación de luz (Mazzella y Alberte 1986, Cabello-Pasini et al. 2003). El contenido de carbono y nitrógeno en los tejidos de la vegetación marina también varía según las fluctuaciones en la irradiancia, la temperatura y la concentración de nitrógeno en el agua de mar (Cabello-Pasini et al. 2004). En general, la absorbancia en los tejidos de algas marinas también varía según las concentraciones de clorofila y nitrógeno y el nivel de irradiancia. Por lo tanto, la absorción tisular fluctúa estacionalmente. Sin embargo, los medios y la medida en que la absorción tisular y la asimilación de carbono y nitrógeno están reguladas por la concentración de nitrato en el agua de mar aún no se comprenden bien en los pastos marinos, aunque está bien consolidado que los niveles de nitrato en la columna de agua y de reserva de carbono activan la actividad de la nitrato reductasa en brotes de Z. marina (Touchette y Burkholder 2007).
Las tasas fotosintéticas en las plantas generalmente se determinan evaluando la evolución de oxígeno o la incorporación de carbono en los tejidos. Durante las últimas 2 décadas, la fluorometría ha demostrado ser un medio confiable y efectivo para evaluar los procesos fotosintéticos en macrófitos marinos (Edwards y Baker 1993; Beer et al. 1998, 2000). De hecho, los métodos fluorométricos que estiman las características fotosintéticas no son intrusivos y son mucho más rápidos que las técnicas de evolución de oxígeno o de incorporación de carbono. En particular, la fluorometría modulada por amplitud de pulso (PAM, por sus siglas en inglés) de la fluorescencia de clorofila in vivo asociada con el fotosistema II (FSII) se puede usar para monitorear las reacciones primarias de la fotosíntesis en condiciones de luz artificial o natural (Beer et al. 2000). Los estudios empíricos han demostrado que la tasa de transporte de electrones (TTE) está estrechamente relacionada con la evolución de oxígeno y la fijación de CO2 en plantas C4 (Edwards y Baker 1993), y se han reportado valores cercanos a la relación teórica de producción de TTE:oxígeno de 5-7 mol de electrones por mol de producción de oxígeno en 2 especies de Ulva (Figueroa et al. 2003).
Al igual que en las plantas, las tasas fotosintéticas en los pastos marinos dependen de factores ambientales, como la temperatura del agua de mar y la irradiancia, y de factores biológicos, como el tipo de tejido y la historia lumínica a largo plazo de la muestra. Tanto la radiación como la temperatura del agua de mar regulan las tasas fotosintéticas de las algas y los pastos marinos. Sin embargo, los efectos de las concentraciones de nutrientes en el agua de mar sobre la TTE en estas plantas acuáticas son menos conocidos. El conocimiento de los efectos de los nutrientes sobre la TTE en el aparato fotosintético es fundamental para comprender las fluctuaciones estacionales de la fotosíntesis, el crecimiento y otras características metabólicas en los pastos marinos. En el fitoplancton y las macroalgas, se ha demostrado que el rendimiento cuántico óptimo covaría con las concentraciones de silicio y fósforo en el agua de mar (Kolber et al. 1990, Young y Beardall 2003). Además, se ha demostrado que la concentración de nitrógeno en el agua de mar regula la relación entre la TTE y la fotosíntesis bruta en el alga verde U. rigida (Cabello-Pasini y Figueroa 2005). Por lo tanto, el objetivo de este estudio fue evaluar los efectos de los niveles de irradiancia y las concentraciones de nitrato en el agua de mar sobre la TTE del pasto marino C. nodosa.
MATERIALES Y MÉTODOS
Material vegetal
Cymodocea nodosa se recolectó en la zona intermareal de Fuengirola, España (36°30′20″ N, 4°39′10″ E). Las muestras se colocaron en hieleras y se transportaron al laboratorio dentro de las 2 h posteriores a la recolección. Los efectos de la concentración de nitrógeno en el agua de mar sobre la reflectancia, la transmitancia, el rendimiento cuántico efectivo y las concentraciones de nitrógeno y carbono en los tejidos se evaluaron incubando brotes de C. nodosa en medios con diferentes concentraciones de nitrato. Los brotes se incubaron durante 3 semanas en recipientes de acrílico (2 L, 15 muestras por recipiente) con medios que contenían 10 µM de PO4 y 0, 2, 5, 25, 50 y 100 µM de NO3 -. La concentración de nitrógeno en los medios fue inferior a 1 µM de NO3 - y NH3 +. Los medios en la cámara de incubación se cambiaron cada 2 días y se agregaron nutrientes (KNO3, KH2PO4) de una solución madre. Las muestras se incubaron a 15 °C y 100 µmol fotón·m-2·s-1 con lámparas fluorescentes de luz diurna (FL 18W; Osram, Munich, Alemania). Los rizomas de los brotes se aseguraron al fondo de cada recipiente acrílico con una malla de plástico con peso. Se introdujeron burbujas de aire filtrado en cada recipiente para mantener el medio en constante movimiento.
Determinación CHN
Después del periodo de incubación, las muestras se secaron (60 °C) durante 48 h. El contenido de nitrógeno y carbono intracelular (% peso seco [PS]) se evaluó (n = 6) con un analizador elemental CHN 2400 (Perkin-Elmer, Waltham, MA, EE. UU.).
Fluorescencia de clorofila a in vivo
Las tasas fotosintéticas de los brotes (n = 6) se estimaron midiendo la fluorescencia de clorofila a in vivo del FSII con un fluorómetro portátil DIVING-PAM (Heinz Walz GmbH, Effeltrich, Alemania). La fluorescencia basal (Fo) se estimó antes del amanecer después del periodo de oscuridad natural (noche). La fluorescencia máxima (Fm) se determinó en brotes aclimatados a la oscuridad mediante la aplicación de un pulso de luz actínica saturante (9,000 µmol fotón·m-2·s-1, 800 ms). La fluorescencia variable (Fv) se calculó como la diferencia entre Fm y Fo, y el rendimiento cuántico óptimo (Fv/Fm) se estimó como la relación de Fv a Fm (Schreiber et al. 1994). El rendimiento cuántico efectivo de FSII (ΦFSII) se estimó en tejidos aclimatados a la luz según la ecuación de Schreiber y Neubauer (1990):
donde Ft es la fluorescencia intrínseca en estado estacionario en el tejido bajo condiciones de luz y Fʹm es la fluorescencia máxima del tejido aclimatado a la luz inducida por un pulso de luz actínica saturante (9,000 µmol fotón·m-2·s-1, 800 ms). El componente de fibra óptica del fluorómetro DIVING-PAM se mantuvo en un ángulo de 45° con respecto a la planta. El ΦFSII se determinó a lo largo del día bajo irradiación solar natural.
La TTE a través del FSII se determinó con la siguiente ecuación:
donde AQλ es la cantidad de fotones absorbidos estimados como el producto de la integración de la absorbancia espectral (Aλ) en los espectros de la radiación fotosintética activa (λ = 400-700 nm), y FII es la cantidad de AQ dirigida a FSII. El valor de FII para Chlorophyta y pastos marinos es de aproximadamente 0.5 (Figueroa et al. 2003, Johnsen y Sakshaug 2007).
La absorbancia del tejido (Aλ, n ≥ 6) se determinó a intervalos de 1 nm entre 400 y 700 nm utilizando una esfera integradora (LICOR-1802) conectada a un espectrorradiómetro 1800 UW (LICOR, Lincoln, NE, EE. UU.) de acuerdo con la ecuación de Figueroa et al. (2003):
donde Tλ es la transmitancia y Rλ es la reflectancia del tejido.
Diseño experimental
Se monitorearon las fluctuaciones diurnas en el rendimiento cuántico efectivo en brotes de C. nodosa que se habían incubado previamente durante 2 semanas a 25 µM de NO3 -, como se describió anteriormente. Los brotes (n = 10) se incubaron bajo diferentes niveles de irradiación natural en contenedores de espuma de poliestireno de 30 L en la azotea de un edificio. La irradiancia incidente natural (Eo) se redujo a 20%, 33%, 60% y 100% Eo utilizando una malla de pantalla. Las mediciones de rendimiento cuántico (n = 10) se realizaron aproximadamente cada 2 h desde el amanecer hasta aproximadamente 2 h después de la puesta del sol. La radiación solar fotosintéticamente activa (RFA) incidente en el sitio de muestreo se midió cada minuto a lo largo del día usando un radiómetro ELDONET (Real Time Computer, Möhrendorf, Alemania). La irradiancia integrada diaria de la energía solar cuántica se determinó desde el amanecer hasta la puesta del sol mediante la integración de los valores de irradiancia instantánea.
Para evaluar el efecto del nitrato sobre el rendimiento cuántico efectivo de C. nodosa, se incubaron brotes durante 2 semanas a 0, 5, 25 y 100 µM NO3 - en recipientes acrílicos a 15 °C y 100 µmol fotón·m-2·s-1 con lámparas fluorescentes de luz diurna (FL 18W, Osram) como se describió anteriormente. Los brotes se transfirieron a contenedores de espuma de poliestireno de 30 L bajo irradiación natural, que se atenuó al 33% de Eo usando mallas de pantalla. Las mediciones de rendimiento cuántico (n = 10) se realizaron aproximadamente cada 2 h desde el amanecer hasta aproximadamente 2 h después de la puesta del sol.
Análisis de los datos
Se calcularon los efectos del nitrato o la irradiancia sobre el rendimiento cuántico efectivo de C. nodosa con un ANDEVA de una vía. Se evaluó la homocedasticidad y la normalidad de los datos mediante las pruebas de Bartlett y Shapiro-Wilk, respectivamente, y se evaluaron las comparaciones múltiples con pruebas post hoc de Tukey (Sokal y Rohlf 1995) en SigmaStat (Systat Software, San Jose, CA, EE. UU.). Se evaluó la significancia a P < 0.05 de las correlaciones producto-momento de Pearson entre el carbono efectivo, el nitrógeno, la proporcion C:N, el rendimiento cuántico efectivo y la concentración de nitrato en el medio.
RESULTADOS
Las concentraciones de carbono y nitrógeno en los tejidos de C. nodosa variaron en relación con la concentración de nitrato en el medio (Fig. 1). Los niveles de carbono tisular aumentaron 6.5% (P < 0.05) cuando la concentración de nitrato en el medio aumentó de 0 a 100 µM NO3 -. En contraste con la concentración de carbono en los tejidos, los niveles de nitrógeno aumentaron (P < 0.05) más del 60.0% en C. nodosa cuando la concentración de nitrato en los medios aumentó de 0 a 100 µM NO3 -. La relación C:N del tejido disminuyó significativamente de 18.5 ± 2.2 en tejidos incubados sin nitrato (0 µM NO3 -) a 12.6 ± 1.9 en tejidos incubados con 100 µM NO3 -.

Figura 1 Concentración de carbono (C) (% peso seco [PS]), concentración de nitrógeno (N) (%PS) y la relación C:N en tejidos de Cymodocea nodosa incubados con diferentes concentraciones de nitrato (NO3 -). Los puntos de datos representan el promedio de 6 muestras ± desviación estándar.
La concentración de nitrato en el medio reguló la transmitancia y reflectancia de los brotes de C. nodosa (Fig. 2). La transmitancia en los brotes disminuyó exponencialmente (P < 0.05) de 0.290 ± 0.07 en brotes incubados sin nitrato (0 µM NO3 -) a 0.198 ± 0.07 en brotes incubados con 100 µM NO3 -. La reflectancia no mostró un patrón claro con respecto a la concentración de nitrato en el medio, aunque los valores máximos de reflectancia se observaron en los brotes incubados con 25 y 50 µM de NO3 -.
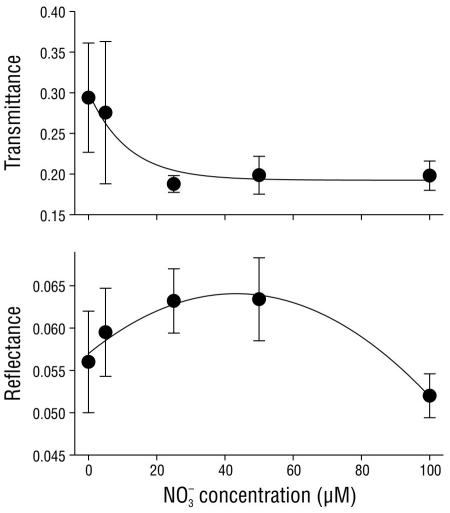
Figura 2 Transmitancia, reflectancia y absorbancia de tejidos de Cymodocea nodosa incubados con diferentes concentraciones de nitrato (NO3 -). Los puntos de datos representan el promedio de 10 muestras ± desviación estándar.
El rendimiento cuántico efectivo en los brotes de C. nodosa se vio afectado por la concentración de nitrato en el medio (Fig. 3). Los valores de ΦFSII aumentaron significativamente (P < 0.05) de 0.70 ± 0.03 en brotes incubados sin nitrato (0 µM NO3 -) y llegaron a saturación (0.78 ± 0.01) en brotes incubados con 50 y 100 µM NO3 -.
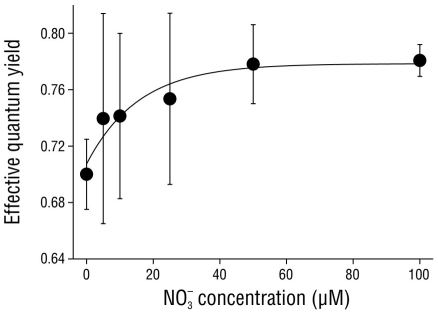
Figura 3 Rendimiento cuántico efectivo en brotes de Cymodocea nodosa incubados con diferentes concentraciones de nitrato (NO3 -). Los puntos de datos representan el promedio de 10 muestras ± desviación estándar.
El rendimiento cuántico efectivo en los brotes de C. nodosa repletos de nitrato fluctuó como resultado del nivel de irradiación a lo largo del día (Fig. 4). La irradiancia siguió una curva sinusoidal típica, aunque se observaron ligeras desviaciones del modelo debido a cielos despejados. El rendimiento cuántico efectivo en los brotes disminuyó significativamente (P < 0.05) a medida que aumentaba la irradiancia, con valores mínimos observados al mediodía solar o 2 h después. Sin embargo, la disminución de los valores de ΦFSII fue 4 veces mayor en los brotes incubados con radiación solar total (100 % Eo) en comparación con los incubados con solo 20% Eo. Los valores de ΦFSII se recuperaron 2 h después de la puesta del sol en brotes incubados con 20%, 33% y 60% de Eo. Por el contrario, los valores de ΦFSII de los brotes incubados con radiación solar total (100% Eo) no se recuperaron por completo durante el mismo periodo de tiempo. No obstante, los valores de ΦFSII en estos brotes se recuperaron por completo a la mañana siguiente (datos no mostrados).

Figura 4 Radiación fotosintéticamente activa (RFA) incidente en octubre de 2004 en el sitio de estudio. Valores del rendimiento cuántico efectivo en los brotes de Cymodocea nodosa incubados con diferentes niveles de RFA incidentes. Los símbolos representan la media ± desviación estándar. Las barras de error que no se muestran son más pequeñas que el tamaño del símbolo.
El rendimiento cuántico efectivo en los brotes de C. nodosa se vio afectado de manera diferencial por la irradiación que recibieron a lo largo del día (Fig. 5). El primer valor de rendimiento cuántico efectivo (irradiancia = 0 µmol fotón·m-2·s-1) corresponde a Fv/Fm, ya que las plantas se mantuvieron en la oscuridad durante toda la noche. Como se preveía, los valores de Fv/Fm fueron mayores que los valores de ΦFSII. En todos los casos, se observó una disminución lineal (P < 0.05) en los valores de ΦFSII desde el amanecer hasta el mediodía solar. La recuperación de los valores de ΦFSII también fue lineal, y se observó la misma tasa en los brotes incubados con 20% y 33% de Eo (Fig. 5a, b). La pendiente de la curva de recuperación disminuyó significativamente en las muestras de la tarde incubadas con 60% y 100% de Eo (Fig. 5c, d).
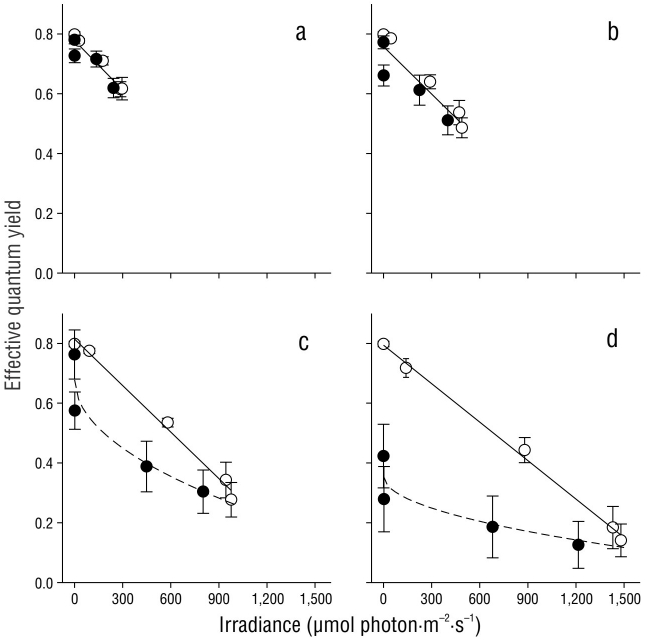
Figura 5 Rendimiento cuántico efectivo en brotes de Cymodocea nodosa incubados con 20% (a), 33% (b), 60% (c) y 100% (d) de irradiancia incidente (Eo). Los símbolos vacíos indican muestras desde el amanecer hasta el mediodía solar, mientras que los símbolos llenos indican muestras desde el mediodía solar hasta la puesta del sol. Los símbolos representan la media ± desviación estándar. Las barras de error que no se muestran son más pequeñas que el tamaño del símbolo.
Los valores de rendimiento cuántico efectivo fluctuaron en brotes de C. nodosa en condiciones de atenuación de luz (33% Eo) como resultado de la concentración de nitrato en el tratamiento de pre-incubación (Fig. 6). La irradiancia siguió una curva sinusoidal típica, aunque se observó dispersión de los datos como resultado de la nubosidad en el sitio de estudio. En general, los valores de ΦFSII disminuyeron (P < 0.05) a medida que aumentaba la irradiación a lo largo del día. Sin embargo, mientras que los valores de ΦFSII disminuyeron a casi cero en brotes pre-incubados sin nitrato (0 µM NO3 -), los valores iniciales de ΦFSII disminuyeron ~25% en brotes pre-incubados con 25 y 100 µM de NO3 -. El rendimiento cuántico efectivo en brotes pre-incubados con 5 µM de NO3 - disminuyó a valores ligeramente inferiores a los de los brotes pre-incubados con 25 y 100 µM de NO3 -. La recuperación completa de los valores de ΦFSII 3 h después de la puesta del sol solo se observó en brotes pre-incubados con 25 y 100 µM de NO3 -. En brotes incubados con 0 y 5 µM de NO3 -, la recuperación completa de los valores de ΦFSII no se observó hasta la mañana siguiente (datos no mostrados).

Figura 6 Radiación fotosintéticamente activa (RFA) incidente en octubre de 2004 en el sitio de estudio. Valores del rendimiento cuántico efectivo en brotes de Cymodocea nodosa incubados con diferentes niveles de FRA incidentes. Los símbolos representan la media ± desviación estándar. Las barras de error que no se muestran son más pequeñas que el tamaño del símbolo.
Los valores de rendimiento cuántico efectivo disminuyeron a medida que aumentó la irradiancia. El rendimiento cuántico efectivo antes del amanecer (irradiancia = 0 µmol fotón·m-2·s-1) correspondió a Fv/Fm, ya que las plantas se mantuvieron en la oscuridad durante toda la noche. La disminución del rendimiento cuántico efectivo en función de la irradiancia de la mañana fue significativamente mayor (P < 0.05) en los brotes incubados con 0 y 5 µM de NO3 - y menor en los brotes incubados con 25 y 100 µM de NO3 - (Fig. 7). Por el contrario, la tasa de recuperación fue similar entre todos los tratamientos.
DISCUSIÓN
La concentración de nitrógeno externo en los medios parece desempeñar un papel fundamental en la determinación de las concentraciones de carbono y nitrógeno en los tejidos de C. nodosa. Además, los cambios en las características bio-ópticas de los brotes se asociaron con la concentración de nitrato en el medio, lo que sugiere que el nitrógeno puede asignarse en respuesta a los requisitos de luz de la fotosíntesis. Se ha encontrado que tanto el contenido de nitrógeno como el de carbono en las células de algas marinas cambia rápidamente durante horas o días como resultado de las fluctuaciones en la concentración de nitrato en el agua de mar (Young y Beardall 2003). Como se ha observado en otras algas marinas y especies de plantas superiores, en este estudio se observó una disminución en la transmitancia a medida que aumentaban los niveles de nitrógeno en los tejidos (Carter y Spiering 2002), lo que probablemente fue el resultado del aumento de los niveles de clorofila dentro de las células de los tejidos (Cabello-Pasini y Figueroa 2005). Los estudios realizados en varios pastos marinos del mar Mediterráneo han encontrado que las relaciones de luz son similares a las que ocurren en las macroalgas marinas, es decir, que la absorción de luz aumenta de forma no lineal a medida que aumenta el contenido de clorofila a (Enriquez et al. 1994). Esto tiene implicaciones para el crecimiento y la asignación de nitrógeno a la clorofila. Por ejemplo, las poblaciones submareales de Halophyla ovalis presentaron un mayor contenido de nitrógeno tisular que el de las plantas intermareales como resultado directo del elevado contenido de clorofila y, consecuentemente, de la elevada capacidad de captación de luz de esta especie a bajos niveles de irradiancia (Dawson y Dennison 1996).
Además de la irradiancia, la disponibilidad de nitratos afectó el ΦFSII. Pocos estudios han examinado los efectos de los nutrientes en las reacciones fotoquímicas primarias. Si las reservas de nitrógeno se asignan a la clorofila, la limitación afectará directamente al complejo de recolección de luz. En condiciones de limitación de nitrógeno, la sección transversal de absorción funcional del FSII aumenta junto con una disminución posterior en la transferencia de energía entre los centros de reacción del FSII (Young y Beardall 2003). En nuestro estudio, el aumento de las concentraciones de nitrato se relacionó solo con un ligero aumento en la fotosíntesis, que se midió en términos de rendimiento cuántico efectivo. De hecho, a 0 µM de NO3 -, los brotes siguieron exhibiendo valores altos de ΦFSII, lo que puede indicar que la limitación de nitrógeno no estimula la extinción no fotoquímica (i.e., la disipación térmica) a corto plazo. Alternativamente, las reservas de nitrógeno se pueden removilizar para proporcionar precursores de clorofila.
El rendimiento cuántico efectivo de la fluorescencia de clorofila a in vivo en C. nodosa varió a lo largo del día. Este patrón se ha observado comúnmente en macroalgas (Franklin y Forster 1997, Hader y Figueroa 1997, Hanelt 1998) y en algunos pastos marinos, como Posidonia oceanica (Figueroa et al. 2002). Como se esperaba, Fv/Fm al amanecer (i.e., después de la incubación en la oscuridad durante la noche) fue mayor que el rendimiento cuántico efectivo en condiciones de luz. Se ha propuesto que el incremento en la disipación de energía térmica al mediodía es responsable de estas variaciones diurnas. Sin embargo, nuestros resultados demuestran que tanto el contenido de carbono como el de nitrógeno en los tejidos de C. nodosa dependen del historial de pre-incubación con nitrato. La disponibilidad de nitrato en los medios también afectó el rendimiento cuántico efectivo determinado por fluorometría. En general, este estudio sugiere que las reducciones en la concentración de nitrato en el agua de mar reducen la capacidad de fotoinhibición dinámica de C. nodosa, lo que probablemente sea el caso para otras macrófitas marinas. Por lo tanto, se necesita investigar más a fondo como la disponibilidad de nutrientes y el nitrato en el agua de mar afecta la fotosíntesis, la respiración y las relaciones de rendimiento cuántico óptimo.
AGRADECIMIENTOS
Los fondos fueron proporcionados por la Junta de Andalucía (RNM-295), el Ministerio de Ciencia y Tecnología de España (AGL 2001-1888-C03-02) y el Ministerio de Educación y Ciencia de España (SAB2002-0209).
REFERENCIAS
Beer, S, Larsson, C, Poryan, O, Axelsson, L. 2000. Photosynthetic rates of Ulva (Chlorophyta) measured by pulse amplitude modulated (PAM) fluorometry. Eur J Phycol. 35(1):69-74. https://doi.org/10.1080/09670260010001735641 [ Links ]
Beer, S, Vilenkin, B, Weil, A, Veste, M, Susel, L, Eshel, A. 1998. Measuring photosynthetic rates in seagrasses by pulse amplitude modulated (PAM) fluorometry. Mar Ecol Prog Ser. 174:293-300. https://doi.org/10.3354/meps174293 [ Links ]
Brito, MC, Martin, D, Núñez, J. 2005. Polychaetes associated to a Cymodocea nodosa meadow in the Canary Islands: assemblage structure, temporal variability and vertical distribution compared to other Mediterranean seagrass meadows. Mar Biol. 146:467-481. https://doi.org/10.1007/s00227-004-1460-1 [ Links ]
Cabello-Pasini, A, Figueroa, FL. 2005. Effect of nitrate concentration on the relationship between photosynthetic oxygen evolution and electron transport rate in Ulva rigida (Chlorophyta). J Phycol. 41(6):1169-1177. https://doi.org/10.1111/j.1529-8817.2005.00144.x [ Links ]
Cabello-Pasini, A, Muñiz-Salazar, R, Ward, DH. 2003. Annual variations of biomass and photosynthesis in Zostera marina at its southern end of distribution in the North Pacific. Aquat Bot. 76(1):31-47. https://doi.org/10.1016/S0304-3770(03)00012-3 [ Links ]
Cabello-Pasini, A, Muñiz-Salazar, R, Ward, DH. 2004. Caracterización bioquímica del pasto marino Zostera marina en el límite sur de su distribución en el Pacífico Norte = Biochemical characterization of the eelgrass Zostera marina at its southern distribution limit in the North Pacific. Cienc Mar. 30(1A):21-34. http:/doi.org/10.7773/cm.v30i11.123 [ Links ]
Carter, GA, Spiering, BA. 2002. Optical properties of intact leaves for estimating chlorophyll concentration. J Environ Qual. 31(5):1424-1432. https://doi.org/10.2134/jeq2002.1424 [ Links ]
Dawson, SP, Dennison, WC. 1996. Effects of ultraviolet and photosynthetically active radiation on five seagrass species. Mar Biol. 125:629-638. https://doi.org/10.1007/BF00349244 [ Links ]
Edwards, GE, Baker, NR. 1993. Can CO2 assimilation in maize leaves be predicted accurately from chlorophyll fluorescence analysis? Photo Res. 37:89-102. https://doi.org/10.1007/BF02187468 [ Links ]
Enriquez, S, Agustí, S, Duarte, CM. 1994. Light absorption by marine macrophytes. Oecologia. 98:121-129. https://doi.org/10.1007/BF00341462 [ Links ]
Figueroa, FL, Conde-Álvarez, R, Gómez, I. 2003. Relations between electron transport rates determined by pulse amplitude modulated chlorophyll fluorescence and oxygen evolution in macroalgae under different light conditions. Photo Res. 75:259-275. https://doi.org/10.1023/A:1023936313544 [ Links ]
Figueroa, FL, Jiménez, C, Viñegla, B, Pérez-Rodríguez, E, Aguilera, J, Flores-Moya, A, Altamirano, M, Lebert, M, Häder, DP. 2002. Effects of solar UV radiation on photosynthesis of the marine angiosperm Posidonia oceanica from southern Spain. Mar Ecol Prog Ser. 230:59-70. https://doi.org/10.3354/meps230059 [ Links ]
Franklin, L, Forster, RM. 1997. The changing irradiance environment: consequences for marine macrophyte physiology, productivity and ecology. Eur J Phycol. 32(3):207-232. https://doi.org/10.1080/09670269710001737149 [ Links ]
Häder, DP, Figueroa, FL. 1997. Photoecophysiology of marine macroalgae. Photochem Photobiol. 66(1):1-14. https://doi.org/10.1111/j.1751-1097.1997.tb03132.x [ Links ]
Hanelt, D. 1998. Capability of dynamic photoinhibition in Arctic macroalgae is related to their depth distribution. Mar Biol. 131:361-369. https://doi.org/10.1007/s002270050329 [ Links ]
Johnsen, G, Sakshaug, E. 2007. Biooptical characteristics of PSII and PSI in 33 species (13 pigment groups) of marine phytoplankton, and the relevance for pulse‐amplitude‐modulated and fast‐repetition‐rate fluorometry. J Phycol. 43(6):1236-1251. https://doi.org/10.1111/j.1529-8817.2007.00422.x [ Links ]
Kolber, Z, Wyman, KV, Falkowski, PG. 1990. Natural variability in photosynthetic energy conversion efficiency: A field study in the Gulf of Maine. Limnol Oceanogr. 35(1):72-79. https://doi.org/10.4319/lo.1990.35.1.0072 [ Links ]
Mazzella, L, Alberte, RS. 1986. Light adaptation and the role of auto-trophic epiphytes in primary production of the temperate seagrass, Zostera marina L. J Exp Mar Biol Ecol. 100(1-3):165-180. https://doi.org/10.1016/0022-0981(86)90161-9 [ Links ]
Muñiz-Salazar, R, Talbot, S, Sage, K, Ward, DH, Cabello-Pasini, A. 2005. Population genetic structure of annual and perennial populations of Zostera marina L. from the Pacific coast of Baja California and the Gulf of California. Mol Ecol. 14(3):711-722. [ Links ]
Phillips, RC, McRoy, CP. 1980. Handbook of Seagrass Biology. New York (NY) and London (UK): Garland STPM Press. 402 p. https://doi.org/10.4319/lo.1980.25.3.0579 [ Links ]
Schreiber, U, Bilger, W, Neubauer, C. 1994. Chlorophyll fluorescence as a nonintrusive indicator for rapid assessment of in vivo photosynthesis. In: Schulze, E., Caldwell, M. (eds.), Ecophysiology of Photosynthesis. Berlin-Heidelberg (Germany): Springer Study Edition. p. 49-70. [ Links ]
Schreiber, U, Neubauer, C. 1990. O2-dependent electron flow, membrane energization and mechanism of non-photochemical quenching of chlorophyll fluorescence. Photo Res. 25:279-293.https://doi.org/10.1007/BF00033169 [ Links ]
Sokal, RR, Rohlf, FJ. 1995. Biometry: the principles and practice of statistics in biological research. New York (NY): WH Freeman and Company. 887 p. [ Links ]
Touchette, BW, Burkholder, JM. 2007. Carbon and nitrogen metabolism in the seagrass, Zostera marina L.: Environmental control of enzymes involved in carbon allocation and nitrogen assimilation. J Exp Mar Biol Ecol. 350(1-2):216-233. https://doi.org/10.1016/j.jembe.2007.05.034 [ Links ]
Young, EB, Beardall, J. 2003. Rapid ammonium- and nitrate-induced perturbations to Chl a fluorescence in nitrogen-stressed Dunaliella tertiolecta (Chlorophyta). J Phycol. 39(2):332-342. https://doi.org/10.1046/j.1529-8817.2003.02109.x [ Links ]
Recibido: 13 de Julio de 2021; Aprobado: 11 de Noviembre de 2022











 text in
text in 




