Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.49 Ensenada Jan./Dez. 2023 Epub 08-Dez-2023
https://doi.org/10.7773/cm.y2023.3294
Artículos
Estructura de las comunidades meiofaunales en una playa arenosa tropical urbana en Pernambuco, Brasil
1Laboratório de Bentos, Departamento de Oceanografia, Universidade Federal de Pernambuco, Av. Prof. Moraes Rego, 1235 - Cidade Universitária, S/N, Recife, Pernambuco, 50670-901, Brazil.
2Laboratório de estudos meiofaunísticos e socioambientais, Departamento de Biologia, Universidade Federal Rural de Pernambuco, Av. Manoel de Medeiros, S/N, Dois Irmãos, Recife, Pernambuco, 52171-900, Brazil.
3Laboratório de Evolução de Organismos Meiofaunais, Departamento de Biologia Animal, Instituto de Biologia, Universidade Estadual de Campinas, Rua Carlos Gomes, 241, Cidade Universitária, S/N Campinas, São Paulo, 13083-970, Brazil.
Las playas arenosas son uno de los ecosistemas costeros más extensos de Brasil y constituyen importantes zonas de amortiguamiento entre el ambiente terrestre y el marino. El presente estudio tuvo como objetivo analizar la distribución y la variación espaciotemporal de la comunidad meiofaunal de una playa arenosa tropical urbana con particular énfasis en la nematofauna. Establecimos 4 transectos durante 2 periodos de muestreo para evaluar diferentes zonas de playa. La meiofauna estuvo compuesta por 8 taxones, y la nematofauna consistió en 5 órdenes, 16 familias y 45 géneros. Las comunidades meiofaunales siguieron los estándares cualitativos-cuantitativos de las de otras playas arenosas tropicales en el noreste de Brasil. La comunidad nematofaunal presentó variación en su composición y estructura trófica entre los meses secos y los lluviosos, los cuales no presentaron correlación significativa con las características granulométricas. Esto sugiere que otras variables pueden influir en la estructura de las comunidades nematofaunales en la playa de Gaibu. Se requieren urgentemente más estudios de investigación sobre la biodiversidad de las comunidades meiofaunales en las playas arenosas del noreste de Brasil debido a la falta de información disponible sobre estos ambientes y el estrés extremo bajo al que están sujetas.
Palabras clave: nematoda; comunidad intersticial; sedimento de playa; meiofauna; eutrofización
Sandy beaches are among the most extensive coastal ecosystems in Brazil and constitute important buffer zones between terrestrial and marine environments. The present study aimed to analyze the distribution and spatiotemporal variation of the meiofaunal community of an urban tropical sandy beach in northeastern Brazil with a particular focus on nematofauna. We set up 4 transects during 2 sampling periods to evaluate different beach zones. The meiofauna comprised 8 taxa, and the nematofauna consisted of 5 orders, 16 families, and 45 genera. The meiofaunal communities followed the qualitative-quantitative standards of those of other tropical sandy beaches in northeastern Brazil. The nematofaunal community showed variation in its composition and trophic structure between dry and rainy months, which were not significantly correlated with granulometric characteristics. This suggests that other variables may influence the structure of nematofaunal communities in Gaibu Beach. Further research on the biodiversity of the meiofaunal communities on sandy beaches in northeastern Brazil is urgently needed given the lack of available information of these environments and the extreme stress they are currently under.
Keywords: nematoda; interstitial community; beach sediment; meiofauna; eutrophication
INTRODUCCIÓN
Las playas arenosas se encuentran entre los ambientes costeros más extensos de Brasil. Además de su importancia ecológica, las playas arenosas brindan servicios ecosistémicos esenciales (Short y Klein 2016). Aproximadamente el 40% de la costa de Brasil se encuentra en la región noreste del país. Las playas estrechas, particularmente aquellas ubicadas entre arrecifes de arenisca que forman franjas paralelas a la costa, predominan en la región oriental de Brasil, que comprende el área al este de Río Grande do Norte, Paraiba, Pernambuco y Alagoas (Zacagnini-Amaral et al. 2016). Estos arrecifes protegen la costa de la energía costera altamente dinámica y aumentan la heterogeneidad del paisaje, la cual sustenta una gran biodiversidad. Sin embargo, las playas arenosas son vulnerables debido a los impactos del desarrollo urbano, industrial y portuario y del turismo, los cuales ejercen presión sobre las playas de Brasil mientras proporcionan fuentes esenciales de ingresos para muchas ciudades (Schlacher et al. 2007).
Debido a las funciones cruciales que desempeñan las comunidades meiofaunales en las cadenas tróficas bentónicas en el mar y a sus características ecológicas, la meiofauna presente en las playas arenosas puede proporcionar información que refleja los primeros signos de cambio ambiental (Moens et al. 2013, Schratzberger e Ingels 2018). Los nematodos dominan la meiofauna de la mayoría de los hábitats bentónicos y pueden alcanzar densidades de varios millones de individuos por metro cuadrado (Moens y Vincx 1997). Las características ecológicas y biológicas de los nematodos justifican su uso como bioindicadores del cambio ambiental, en particular su tendencia a permanecer presentes en condiciones estresantes y su cutícula permeable, que les permite responder a una amplia gama de cambios ambientales que pueden resultar en que su abundancia aumente o disminuya (Ferris y Bongers 2006). A pesar de la alta importancia ecológica y económica de las playas arenosas en el noreste de Brasil, hay poca información disponible sobre la biodiversidad de la meiofauna de esta región (Fabricio-Maria et al. 2016).
La playa de Gaibu, ubicada en el estado de Pernambuco, en el noreste de Brasil, fue contaminada por un derrame de petróleo crudo en agosto de 2019. Este desastre ambiental afectó 4,334 km de costa en 11 estados en las regiones del noreste y sureste del país. De hecho, este derrame se considera uno de los peores desastres por derrame de petróleo en la historia de Brasil y se encuentra entre los más grandes registrados en el mundo (de Araújo et al. 2020, de Santana-Campelo et al. 2021).
El objetivo del presente estudio fue caracterizar la meiofauna de la playa de Gaibu por medio de análisis de la distribución espacial y variación temporal de las comunidades de Nematoda y sus relaciones con la granulometría.
MATERIALES Y MÉTODOS
El área de estudio se ubicó en la playa de Gaibu (8°19′ S y 34°57′ W), la cual se encuentra en el estado de Pernambuco, en el noreste de Brasil (Fig. 1). De acuerdo con la clasificación climática de Koppen, el clima regional se puede categorizar como Am (húmedo y tropical con lluvias de otoño/invierno; Manso et al. 2006). La playa de Gaibu se caracteriza por grandes extensiones de arrecifes de arenisca periféricos y costas rocosas (Pereira et al. 2002).
Recolectamos muestras biosedimentológicas en septiembre y diciembre de 2014. En septiembre de 2014 ocurrieron precipitaciones superiores al promedio (APAC 2014), aunque los niveles de precipitación más altos se registraron en mayo y junio de 2014 (278.8 y 322.7 mm, respectivamente) a pesar de ser similares o inferiores a los registrada en los últimos 30 años. Por lo tanto, septiembre se consideró como “el mes lluvioso” (217.3 mm) en este estudio, mientras que diciembre se consideró como “el mes seco” (62.0 mm).
Establecimos 4 transectos fijos y equidistantes (T1, T2, T3 y T4) separados por 100 m y perpendiculares a la línea de flotación, considerando las características relevantes de la playa para garantizar una alta homogeneidad (Fig. 2). El transecto 1 se ubicó frente a las rocas de la playa y el T4 se ubicó donde se descargaban las aguas residuales al mar abierto.
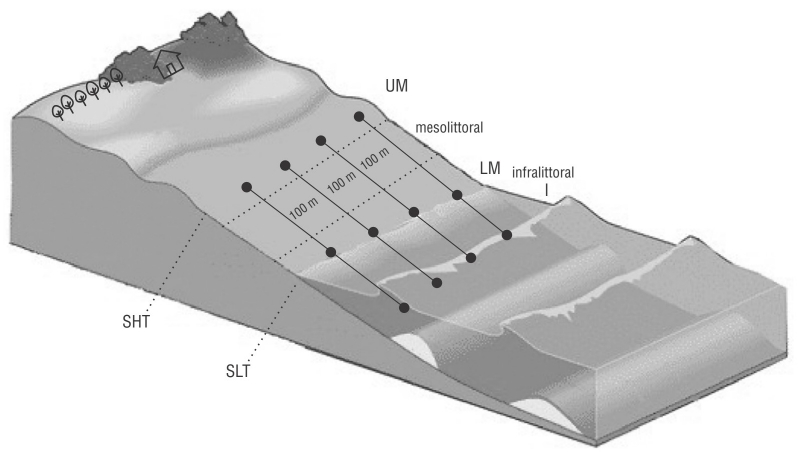
Figura 2 Diseño de muestreo: transectos 1-4. Zonas de playa: mesolitoral superior (UM), mesolitoral inferior (LM) e infralitoral (I). SHT: marea alta de primavera; SLT: marea baja de primavera.Figure 3. Multidimensional scaling (MDS) analysis of meiofaunal communities of Gaibu Beach per sampling period.
Se recolectaron 3 réplicas de cada muestra sedimentológica con un nucleador de sedimentos de PVC (diámetro: 2.5 cm2, largo: 10 cm; hecho en el laboratorio) sin cortar el sedimento en capas. Las zonas del mesolitoral superior, mesolitoral inferior e infralitoral se muestrearon en cada transecto con el nucleador de sedimentos durante la marea baja. Todas las muestras se fijaron en formalina al 4%. En total recolectamos 48 muestras biosedimentológicas por periodo de muestreo (lluvioso y seco). Se utilizó el mismo procedimiento para recolectar las muestras de granulometría, aunque no se recogieron réplicas de estas muestras y no se fijaron.
El tamaño de grano del sedimento se determinó a partir de las muestras de sedimento seco con tamices con diferentes tamaños de malla (2.000, 1.000, 500.000, 250.000, 125.000 y 0.063 mm; Suguio 1973). Clasificamos los sedimentos según la escala de Wentworth (Buchanan et al. 1984). Los parámetros texturales se calcularon utilizando las ecuaciones de Folk y Ward (1957). Los datos obtenidos fueron analizados con el software SYSGRAN 3.0 (Camargo 2006).
En el laboratorio, extrajimos la meiofauna de las muestras de sedimento mediante tamizado húmedo y elutriación manual (Elmgren 1973). El sobrenadante se pasó a través de tamices de malla de 0.044 y 0.500 mm. La meiofauna se identificó al nivel taxonómico más alto posible (orden o clase) y se contó por grupo utilizando una placa Dollfus y un estereomicroscopio Olympus (×10 a ×400). Se extrajeron los primeros 50 nematodos, se colocaron en placas de embriones para su diafanización siguiendo los métodos de De Grisse (1969) y se montaron en portaobjetos de vidrio permanentes. Identificamos especímenes a nivel de género con la clave pictórica de Warwick et al. (1998) y la base de datos digital Nemys (Nemys 2022). El tipo de alimentación se clasifico de acuerdo con las clasificaciones de Wieser (1953, 1960).
Para cada muestra biosedimentológica, calculamos la densidad faunística (individuos por 10 cm-2), la riqueza (número de taxones presentes) y la abundancia relativa (%). Después de transformar los datos en raíces cuadradas, utilizamos un análisis de la varianza multivariado basado en permutaciones de 2 factores (PERMANDEVA; momento de muestreo = mes; zona de playa = zona) para comparar comunidades. Usamos el coeficiente de similitud de Bray-Curtis de las comunidades de meiofauna para realizar un análisis de escalamiento multidimensional no métrico (EMDn) y usamos el mismo procedimiento para la comunidad de nematodos (media de las réplicas). Usamos una rutina de porcentaje de similitud (SIMPER) para evaluar la contribución de cada taxón a la disimilitud de la comunidad (>50%). Realizamos un análisis BEST-BioEnv utilizando el coeficiente de correlación de Spearman para analizar la influencia de la granulometría en la distribución de la meiofauna. Todos los análisis se realizaron en Primer v.6.1. (Clarke y Gorley 2006).
RESULTADOS
En septiembre y diciembre de 2014, el sedimento varió de arena fina a media tanto en el mesolitoral inferior como en el infralitoral. El tamaño de grano promedio varió de 0.18 a 0.83 mm, y no hubo diferencias significativas entre meses (PERMANDEVA: t = 1.44; P = 0.08) o zonas de playa (PERMANDEVA: t = 1.03; P = 0.38). El análisis BEST-BioEnv no indicó correlaciones significativas entre las características granulométricas y las comunidades de meiofauna (P = 0.55) o nematofauna (P = 0.07). Sin embargo, el análisis BEST-BVSTEP reveló correlaciones significativas entre las comunidades de meiofauna y los parámetros granulométricos (valor de Rho = 0.958; P = 0.01), aunque no se observó lo mismo para las comunidades de nematofauna (valor de Rho = 0.455; P = 0.94).
No se presentó meiofauna en las muestras recolectadas durante diciembre (mes seco) en la zona mesolitoral superior ni en la mitad de las muestras recolectadas en septiembre (mes lluvioso). El PERMANDEVA indicó que había una diferencia significativa (R = 0.31, P = 0.007, globales) entre la zona del mesolitoral superior y las otras 2 zonas de playa (mesolitoral inferior e infralitoral), que formaban un grupo. Las zonas mesolitoral inferior e infralitoral se volvieron a analizar posteriormente excluyendo la zona mesolitoral superior.
Después de eliminar las muestras del mesolitoral superior, el PERMANDEVA reveló una diferencia significativa en las comunidades de meiofauna entre los periodos de muestreo (mes lluvioso y seco; t = 2.16; P = 0.002). Este resultado se puede ver en el análisis EMDn (Fig. 3), aunque no hubo diferencia significativa entre las comunidades de las zonas mesolitoral inferior e infralitoral (t = 1.18; P = 0.178). El PERMANDEVA también indicó una diferencia significativa en las comunidades de nematofauna entre el mes seco y el lluvioso (t = 1.89; P = 0.001; Fig. 4), aunque no hubo diferencia significativa entre las comunidades del mesolitoral inferior y las zonas de playa infralitoral (t = 1.19; P = 0.204).

Figura 3 Análisis de escalamiento multidimensional (MDS) de las comunidades de meiofauna de la playa de Gaibu por periodo de muestreo.
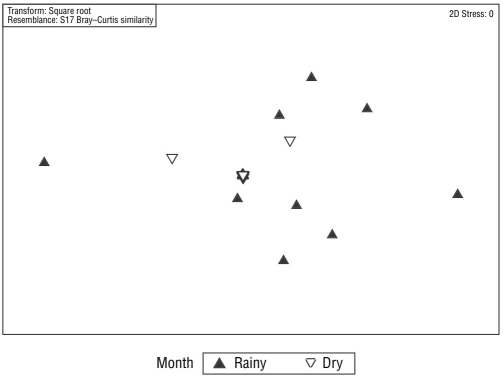
Figura 4 Análisis de escalamiento multidimensional (MDS) de las comunidades de nematodos de la playa de Gaibu por periodo de muestreo.
La densidad media de la meiofauna varió de 19.27 a 527.86 ind.·10 cm-2 en el mes lluvioso de septiembre y de 13.8 a 1,556.77 ind.·10 cm-2 en el mes seco de diciembre. La meiofauna incluyó 8 taxones y 6 filos: Nematoda, Arthropoda (Copepoda y Ostracoda), Tardigrada, Annelida (Oligochaeta y Polychaeta), Platyhelminthes (Turbellaria) y Mollusca (Bivalvia). La riqueza de la comunidad basada en estos taxones varió de 3 a 5 grupos en septiembre y de 3 a 7 grupos en diciembre (Fig. 5). Nematoda fue el taxón dominante en todas las muestras (Fig. 6). El análisis SIMPER mostró que Nematoda y Copepoda fueron responsables por más del 60% de la disimilitud entre las comunidades (Tabla 1).
Tabla 1 Análisis de similitud porcentual de la comunidad de meiofauna de la playa de Gaibu. Av. Diss. = disimilitud promedio; Av. Abund. = abundancia media; Diss. = disimilitud; SD = desviación estándar; Contrib. = contribución; Cum. = acumulativo.
| Rainy and dry groups | ||||||
| Av. Diss. = 68.63 | ||||||
| Rainy group | Dry group | |||||
| Species | Av. Abund | Av. Abund | Av. Diss. | Diss./SD | Contrib.% | Cum. % |
| Nematoda | 7.21 | 17.50 | 29.28 | 1.44 | 42.66 | 42.66 |
| Copepoda | 3.84 | 8.35 | 12.04 | 1.04 | 17.54 | 60.21 |
| Tardigrada | 3.14 | 0.68 | 7.29 | 0.63 | 10.62 | 70.83 |
| Turbellaria | 0.44 | 2.46 | 5.30 | 1.14 | 7.73 | 78.55 |
| Kinorhyncha | 2.08 | 0.00 | 4.79 | 0.51 | 6.98 | 85.53 |
| Oligochaeta | 1.96 | 1.01 | 4.15 | 1.03 | 6.04 | 91.57 |
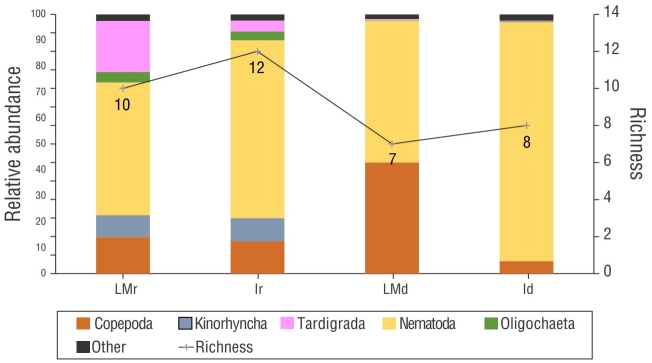
Figura 5 Riqueza y abundancia relativa de las comunidades de meiofauna de la playa de Gaibu en 2 periodos de muestreo (septiembre y diciembre de 2014). LMr = mesolitoral inferior en el mes lluvioso. Ir = infralitoral en el mes lluvioso. LMd = mesolitoral inferior en el mes seco. Id = infralitoral en el mes lluvioso.
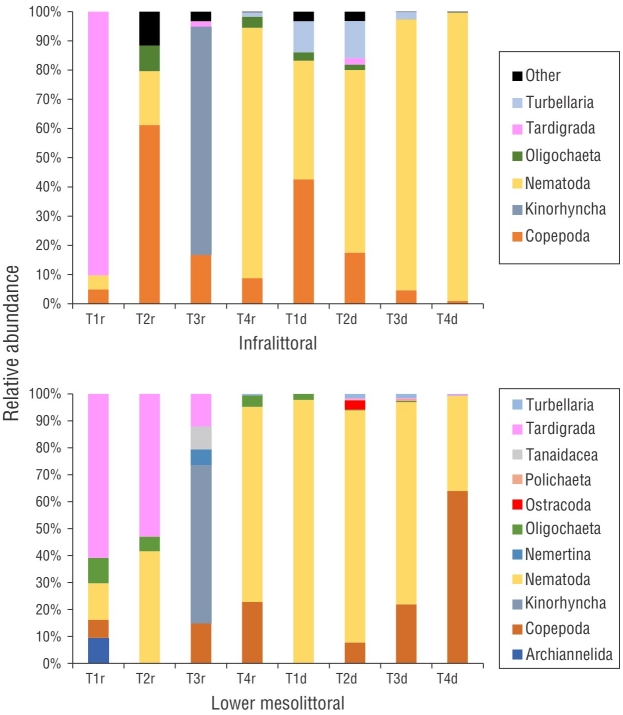
Figura 6 (a) Abundancia relativa de taxones de meiofauna de la zona infralitoral; (b) abundancia relativa de los taxones de meiofauna de la zona mesolitoral inferior. T = transecto; r = mes lluvioso (septiembre); d = mes seco (diciembre).
La densidad de nematofauna de la playa de Gaibu osciló entre 1.04 y 443.49 ind.·10 cm-2 en septiembre y entre 13.22 y 1,296.09 ind.·10 cm-2 en diciembre. La nematofauna estuvo compuesta por 5 órdenes, 16 familias y 45 géneros (Tabla 2). Dentro de las 16 familias identificadas, Xyalidae presentó el mayor número de géneros (8), seguido de Comesomatidae y Thoracostomopsidae (5 cada uno).
Tabla 2 Géneros de nematodos registrados en la playa de Gaibu (Pernambuco, Brasil).
| Order | Family | Genus |
| Chromadorida Chitwood, 1933 | Chromadoridae Filipjev, 1917 | Neochromadora Micoletzky, 1924 |
| Actinonema, Cobb, 1920 | ||
| Endeolophos Boucher, 1976 | ||
| Cyatholaimidae Filipjev, 1918 | Marylynnia (Hopper, 1972) Hopper, 1977 | |
| Paracanthonchus Micoletzky, 1924 | ||
| Paracyatholaimus Micoletzky, 1922 | ||
| Pomponema Cobb, 1917 | ||
| Selachinematidae Cobb, 1915 | Gammanema Cobb, 1920 | |
| Latronema Wieser, 1954 | ||
| Synonchiella Cobb, 1933 | ||
| Araeolaimida Coninck& Schuurmans Stekhoven, 1933 | Axonolaimidae Filipjev, 1918 | Axonolaimus De Man, 1889 |
| Odontophora Bütschli, 1874 | ||
| Synodontium Cobb, 1920 | ||
| Comesomatidae Filipjev, 1918 | Comesoma Bastian, 1865 | |
| Paracomesoma SchuurmansStekhoven, 1950 | ||
| Hopperia Vitiello, 1969 | ||
| Paramesonchium Hopper, 1967 | ||
| Sabatieria Rouville, 1903 | ||
| Desmodorida De Coninck, 1965 | Desmodoridae Filipjev, 1922 | Molgolaimus Ditlevsen, 1921 |
| Metachromadora Filipjev, 1918 | ||
| Polysigma Cobb, 1920 | ||
| Epsilonematidae Steiner, 1927 | Epsilonema Steiner, 1927 | |
| Microlaimidae Micoletzky, 1922 | Bolbolaimus Cobb, 1920 | |
| Microlaimus De Man, 1880 | ||
| Monoposthiidae Filipjev, 1934 | Monoposthia De Man, 1889 | |
| Monhysterida Filipjev, 1929 | Xyalidae Chitwood, 111951 | Cobbia De Man, 1907 |
| Daptonema Cobb, 1920 | ||
| Paramonhystera Steiner, 1916 | ||
| Promonhystera Wieser, 1956 | ||
| Pseudosteineria Wieser, 1956 | ||
| Rhynchonema Cobb, 1920 | ||
| Theristus Bastian, 1865 | ||
| Xyala Cobb, 1920 | ||
| Linhomoeidae Filipjev, 1922 | Eleutherolaimus Filipjev, 1922 | |
| Terschellingia De Man, 1888 | ||
| Enoplida Filipjev, 1929 | Thoracostomopsidae Filipjev, 1927 | Enoploides Ssaweljev, 1912 |
| Enoplolaimus De Man, 1893 | ||
| Epacanthion Wieser, 1953 | ||
| Mesacanthion Filipjev, 1927 | ||
| Paramesacanthion Wieser, 1953 | ||
| Ironidae de Man, 1876 | Thalassironus de Man, 1889 | |
| Oxystominidae Chitwood, 1935 | Halalimus de Man, 1888 | |
| Enchelidiidae Filipjev, 1918 | Eurystomina Filipjev, 1921 | |
| Oncholaimidae Filipjev, 1916 | Metoncholaimus Filipjev, 1918 | |
| Oncholaimus Dujardin, 1845 |
En septiembre, los géneros de nematofauna más abundantes en la zona mesolitoral inferior fueron Daptonema Cobb, 1920 (27%) y Theristus Bastian, 1865 (20%). Los géneros más abundantes en la zona infralitoral fueron Bolbolaimus (21%) y Theristus (19%). En diciembre, Mesacanthion dominó la zona mesolitoral inferior (30%) junto con la presencia notable de Theristus y Neochromadora Micoletzky, 1924. En la zona mesolitoral inferior, Theristus y Neochromadora conformaron el 17% de la comunidad, mientras que en la zona infralitoral, Theristus y Neochromadora comprendía el 23% y el 35% de la comunidad, respectivamente (Fig. 7). El análisis SIMPER indicó que Theristus; Neocromadora; Metacromatadora Filipjev, 1918; Daptonema; y Eleutherolaimus Filipjev, 1922 representaron más del 50% de las diferencias entre las comunidades (Tabla 3).
Tabla 3 Análisis de similitud porcentual de la comunidad de nematofauna de la playa de Gaibu entre el mes lluvioso (septiembre) y el seco (diciembre). Av. Diss. = disimilitud promedio; Av. Abund. = abundancia media; Av. Sim. = similitud promedio; Diss. = disimilitud; SD = desviación estándar; Contrib. = contribución; Cum. = acumulativo.
| Rainy (September) and Dry (December) Groups | ||||||
| Av. Diss. = 84.28 | ||||||
| Rainy group | Dry group | |||||
| Species | Av. Abund | Av. Abund. | Av. Sim. | Diss./SD | Contrib. % | Cum.% |
| Theristus | 1.10 | 2.83 | 13.35 | 1.15 | 15.85 | 15.85 |
| Neochromadora | 0.83 | 1.83 | 10.06 | 0.76 | 11.93 | 27.78 |
| Metachromadora | 0.04 | 1.93 | 7.97 | 0.98 | 9.46 | 37.24 |
| Daptonema | 1.11 | 1.08 | 6.76 | 1.00 | 8.03 | 45.26 |
| Eleutherolaimus | 0.44 | 1.04 | 4.68 | 1.23 | 5.55 | 50.81 |
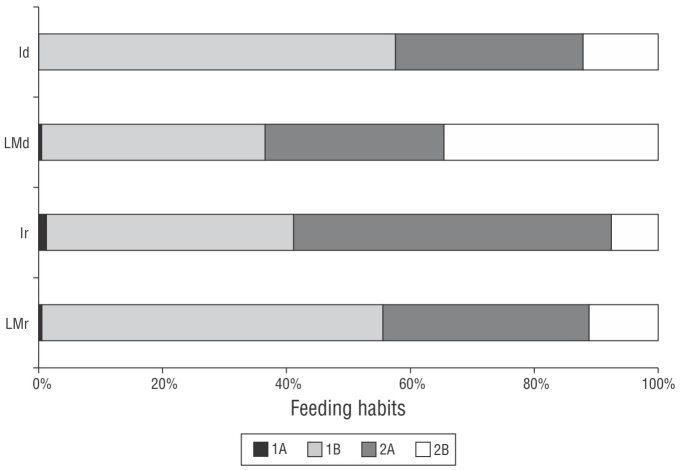
Figura 7 Estructura trófica de la comunidad de nematofauna de la playa de Gaibu en 2 periodos de muestreo (septiembre y diciembre de 2014). LMr = mesolitoral inferior en el mes lluvioso. Ir = infralitoral en el mes lluvioso. LMd = mesolitoral inferior en el mes seco. Id = infralitoral en el mes seco. 1A: alimentadores de depósitos selectivos; 1B: alimentadores de depósito no selectivos; 2A: alimentadores de superficie; 2B: depredadores/omnívoros.
La estructura trófica de la comunidad de nematofauna incluyó 4 grupos de alimentación. Se observó codominancia (>50%) de alimentadores de depósito no selectivos (1B), en la zona infralitoral en diciembre y en la zona mesolitoral inferior en septiembre, junto con alimentadores de superficie (2A, >50%) en la zona infralitoral en septiembre. La mayor abundancia de depredadores/omnívoros (2B) se observó en la zona mesolitoral inferior en diciembre. Los alimentadores de depósitos selectivos (1A) estuvieron presentes en la zona infralitoral en septiembre, pero ausentes de esta zona en diciembre (Fig. 8).
DISCUSIÓN
A pesar de la heterogeneidad ambiental del área de estudio, la meiofauna estuvo ausente en la mayoría de las muestras del mesolitoral. El uso desordenado de la playa de Gaibu por visitantes, vendedores y construcciones observadas durante los viajes de muestreo sugiere que los factores antropogénicos pueden haber contribuido a la ausencia de una comunidad de meiofauna en la zona mesolitoral superior del área de estudio. Como se ha reportado en estudios anteriores, los movimientos de vehículos y el pisoteo intenso, especialmente en las zonas litoral superior y supralitoral, interfieren con los ciclos de vida de las especies e incluso pueden provocar la pérdida de especies de la comunidad (dos Santos-Reis y Rizzo 2019, Santos et al. 2021).
La meiofauna de la playa de Gaibu siguió los patrones cuantitativos que se han descrito en otras playas tropicales arenosas en la costa nororiental de Pernambuco (Castro et al. 1999, Souza-Santos et al. 2003, Pinto y Santos 2006, Guilherme et al. 2016). Las densidades de meiofauna en este estudio fueron similares a las encontradas en playa Tamandaré (Souza-Santos et al. 2003) y playa Guadalupe (Guilherme et al. 2016), también ubicadas en la costa sur de Pernambuco. Sin embargo, las densidades de meiofauna en este estudio fueron más bajas que las encontradas en otros sitios en las costas del sur (Castro et al. 1999) y norte de Pernambuco (Pinto y Santos 2006), las cuales están relativamente aisladas, moderadamente conservadas y asociadas a ambientes estuarinos, lo cual puede influir en sus características sedimentarias y, en consecuencia, en las densidades de sus comunidades de meiofauna.
La densidad de meiofauna de la playa de Gaibu reportada en este estudio concuerda con lo descrito por Kotwicki et al. (2005), quienes esperaban densidades de 538 ± 137 ind·10 cm-2 para playas arenosas tropicales. La descarga de aguas residuales que fluye directamente al mar cerca de T4 puede estar causando eutrofización en el área (Bongers y Ferris 1999), lo que intensifica el crecimiento de algas y la proliferación de biota y, en consecuencia, puede aumentar la densidad de nematodos (Moreno et al. 2011).
Las relaciones entre la meiofauna y las características granulométricas son bien conocidas, por lo que estos temas a menudo se estudian juntos. Sin embargo, estas relaciones no son las únicas cosas que determinan la estructura de la comunidad de nematofauna, y otras variables más allá de las características granulométricas pueden ser fuertes impulsores de la estructura de la comunidad. En este estudio, la ausencia de correlaciones significativas entre la comunidad de nematofauna y las características granulométricas sugiere que otros factores afectan la estructura de estas comunidades bentónicas. De hecho, Fonseca et al. (2014) no encontraron correlaciones significativas entre la riqueza de nematofauna y las características sedimentarias y concluyeron que otros factores interactúan con las características granulométricas para determinar la estructura de la comunidad.
El periodo de tiempo considerado en este estudio incluyó un cambio de la estación lluviosa a la seca, y se encontraron diferencias significativas en las comunidades de meiofauna entre estaciones. En el mes lluvioso de septiembre, la riqueza y densidad de meiofauna fue menor que en el mes seco de diciembre. Estos resultados concuerdan con lo reportado en otros estudios. Por ejemplo, Alongi (1990) y Souza-Santos et al. (2003) indicaron que, durante la temporada de lluvias, cuando la salinidad disminuye, la erosión de los sedimentos superficiales puede reducir la densidad de la meiofauna.
Nematoda y Copepoda fueron los principales taxones responsables de las disimilitudes entre las comunidades de meiofauna. Según Coull (2009), Nematoda es el grupo más abundante en los sedimentos y constituye 60-90% de las comunidades de meiofauna, seguido por Copepoda, que constituye 10-40% de estas comunidades, por lo que se preveía la dominancia de estos taxones en este estudio. La alta abundancia de Tardigrada en nuestro estudio durante el mes lluvioso puede deberse a la presencia de rocas de playa en T1, que probablemente modulan las características hidrodinámicas del transecto. Los tardígrados constituyen un componente permanente de la comunidad meiofaunal y también se ha encontrado que abundan en sedimentos en otros estudios (Albuquerque et al. 2007, Verçosa et al. 2009).
Entre las 16 familias de nematodos identificadas en este estudio, Xyalidae fue la más abundante y diversa, lo que concuerda con lo informado para la costa noreste de Brasil (Venekey et al. 2010). Theristus fue dominante en el mes lluvioso y el seco y, en las zonas de playa, contribuyó más a la variación temporal observada en la estructura de la comunidad meiofaunal según el análisis SIMPER. Fonseca et al. (2014) afirmaron que Theristus mostró una distribución amplia que se correlacionó con el tamaño de grano promedio. La alta abundancia de Daptonema en este estudio concuerda con lo reportado previamente e indica que, comúnmente, este género es un taxón de nematofauna abundante presente en diversos ambientes, especialmente en playas arenosas (Pereira-Gomes de Melo et al. 2013) con arenas bien seleccionadas (Moreno et al. 2008) o arena fina (Corbisier et al. 2008).
Se identificaron 4 tipos tróficos en ambos periodos de muestreo, aunque los alimentadores de depósitos selectivos constituyeron menos del 2% de la comunidad de meiofauna. En contraste, los alimentadores de depósito no selectivos dominaron la comunidad seguidos por los alimentadores de superficie, lo que concuerda con lo reportado por Pereira-Gomes de Melo et al. (2013). La alta representatividad de los alimentadores de depósito no selectivos en la playa de Gaibu concuerda con lo reportado por Alongi (1990), quien afirmó que este grupo es dominante durante los meses cálidos debido la presencia elevada de bacterias, protozoos y microfitobentos. En este estudio, la mayor abundancia de los alimentadores de depósito no selectivos en la playa de Gaibu ocurrió en el mes seco de diciembre. Aunque no medimos el contenido de materia orgánica en el sedimento, el predominio de los alimentadores de depósito no selectivos sugiere que los sedimentos en el área de estudio tienen altas cargas orgánicas (Danovaro y Gambi 2002).
La baja representatividad de depredadores puede estar relacionada con los tipos de sedimentos que se encuentran en la playa de Gaibu. Según Gallucci et al. (2005), estos depredadores aumentan su dominio en ambientes con tamaños de grano relativamente grandes y, en consecuencia, una permeabilidad relativamente alta. Además, los impactos antropogénicos en la playa también pueden desempeñar un papel importante en la determinación de la estructura de las comunidades de meiofauna, ya que los depredadores de nematodos son muy sensibles a las perturbaciones ambientales (Bongers y Ferris 1999).
Los datos abióticos, como la salinidad, la materia orgánica y las mediciones de clorofila A, no se recolectaron en este estudio, ya que nuestro objetivo era caracterizar la comunidad de meiofauna de la playa de Gaibu y su relación con el sedimento presente. Por lo tanto, se necesitan estudios adicionales y evaluaciones de impacto ambiental para evaluar las interacciones entre los principales factores ambientales estresantes presentes en la playa de Gaibu y su influencia en la comunidad de meiofauna tanto a corto como a largo plazo. Braga et al. (2003) consideran la degradación de las playas por la minería, la contaminación por aguas residuales, las inundaciones de la planicie costera y el daño a las áreas protegidas como los principales problemas ambientales presentes en la zona. Estos problemas fueron observados durante nuestro estudio y deben ser evaluados con base en los indicadores de calidad ambiental de las playas recreativas de Barbosa de Araújo y Costa (2008), considerando específicamente los indicadores de efluentes domésticos, áreas de baño protegidas por arrecifes, expansión urbana y uso de mareas para actividades de ocio.
En conclusión, hubo variación estacional en la comunidad de meiofauna de la playa de Gaibu. Los nematodos fueron dominantes en el mes seco de diciembre, mientras que una comunidad de meiofauna más diversa estuvo presente en el mes lluvioso de septiembre con predominio de otros taxones. También hubo diferencias entre comunidades entre transectos (en la misma zona de playa y temporada), lo que sugiere que varios factores abióticos afectan la estructura de la comunidad más allá de las características granulométricas. Se necesitan más estudios urgentemente sobre la biodiversidad de la meiofauna presente en las playas de arena del noreste de Brasil debido a la insuficiencia de los datos disponibles para estos ambientes y al estrés antropogénico y natural extremo al que se enfrentan actualmente estas playas.
AGRADECIMIENTOS
Paula AS Chadaad recibió una beca de investigación de grado durante el presente estudio otorgada por el Programa de Iniciación Científica de la Universidad Federal Rural de Pernambuco (UFRPE)-Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq; Brasil). Los autores agradecen a Camila Gomes Rito (UFRPE) y Priscila Silva (UFRPE) por su asistencia en campo y laboratorio.
REFERENCIAS
Albuquerque, EF, Brandão-Pinto, AP, Queiroz-Perez, Ad’A, Gomes-Veloso, V. 2007. Spatial and temporal changes in interstitial meiofauna on a sandy ocean beach of South America. Braz J Oceanogr. 55(2):121-131. https://doi.org/10.1590/s1679-87592007000200005 [ Links ]
Alongi, DM. 1990. Community dynamics of free-living nematodes in some tropical mangrove and sandflats. Bull Mar Sci. 46:358-373. [ Links ]
[APAC] Agência Pernambucana de Águas e Clima. 2014. Boletim do Clima, síntese climática. Recife (Brazil): APAC; accessed 2021 June. http://www.apac.pe.gov.br [ Links ]
Barbosa de Araújo, MC, Ferreira-da-Costa, M. 2008. Environmental quality indicators for recreational beaches classification. J Coast Res. 246:1439-1449. https://doi.org/10.2112/06-0901.1 [ Links ]
Bongers, T, Ferris, H. 1999. Nematode community structure as a bioindicator in environmental monitoring. Trends Ecol Evol. 14(6):224-228. https://doi.org/10.1016/s0169-5347(98)01583-3 [ Links ]
Braga, RAP, Cabral, JJSP, Gusmão, PT, Paiva, ALR. 2003. Microbacias Costeiras do Cabo de Santo Agostinho-PE: Parte 1 - Conflitos Ambientais [Coastal Microbasins of Cabo de Santo Agostinho-PE: Part 1 - Environmental Conflicts]. In: Anais do II Congresso sobre Planejamento e Gestão da Zona Costeira dos Países de Expressão Portuguesa [Abstract book of the II Congress on Planning and Management of the Coastal Zone of Portuguese-speaking Countries; 12-19 Oct 2003, Recife, Brazil. Porto Alegre (Brazil): Associação Portuguesa de Recursos Hídricos e Associação Brasileira de Recursos Hídricos 1. p. 1-5. [ Links ]
Buchanan, JB, Holme, NA, McIntyre, AD. 1984. Sediment analysis. In: Holme, N.A., McIntyre, A.D. (eds.), Methods for the Study of Marine Benthos. Oxford (United Kingdom): Oxford Blackwell. p. 41-65. [ Links ]
Camargo, MG. 2006. Sysgran: Um Sistema de Código Aberto para Análises Granulométricas do Sedimento. Revista Brasileira de Geociências. 36:371-378. [ Links ]
Castro, FJV, Fonseca-Genevois, V, Lira, L, Cavalcanti-da-Rocha, CM. 1999. Efeito da sedimentação sobre a distribuição de Battilipes pennaki Marcus, (1946) em zona tropical típica: Restinga do Paiva, Pernambuco, Brasil = The effects of morphodynamic processes on Batillipes pennaki Marcus (1946) abundance and distribution in tropical Regions: The Paiva sandbank, Pernambuco, Brazil. Trop Oceanogr. 27(2):89-102. https://doi.org/10.5914/tropocean.v27i2.2820 [ Links ]
Clarke, KR, Gorley, RN. 2006. PRIMER V6: User Manual/Tutorial. PRIMER-E, Plymouth (UK): Playmouth Marine Laboratory. 192 p. [ Links ]
Corbisier, TN, Moellman, AM, Curvelo, RR. 2008. Meiofauna In: Pires-Vanin, AM (ed.), Oceanografia de um Ecossistema Tropical: Plataforma Interna de São Sebastião Parte IV - Sistema Bentônico. São Paulo (Brazil): Universidade de São Paulo. Imprensa oficial do estado. p. 10. [ Links ]
Coull, BC. 2009. Role of meiofauna in estuarine soft-bottom habitats. Australian J Ecol. 24(4):327-343. https://doi.org/10.1046/j.1442-9993.1999.00979.x [ Links ]
Danovaro, R, Gambi, C. 2002. Biodiversity and trophic structure of nematode assemblages in seagrass systems: evidence for a coupling with changes in food availability. Mar Biol. 141(4):667-677. https://doi.org/10.1007/s00227-002-0857-y [ Links ]
De Araújo, ME, Ramalho, CWN, de-Melo, PW. 2020. Artisanal fishers, consumers and the environment: immediate consequences of the oil spill in Pernambuco, Northeast Brazil. Cad Saúde Pública. 36(1):e00230319. https://doi.org/10.1590/0102-311X00230319 [ Links ]
De Grisse, AT. 1969. Redescription ou modification de quelques techniques utilises dans l’étudedes nematodes phytoparasitaires. Mededelingen Rijks Fakulteit Landbouwwetenschappen Gent. 34:251-369. [ Links ]
De Santana-Campelo, RP, Mello-de-Lima, CD, Severino-de-Santana, C, da-Silva, AJ, Neumann-Leitão, S, Padovanni-Ferreira, B, de-Oliveira-Soares, M, de-Melo-Júnior, M, Mendes-de-Castro, Melo PA. 2021. Oil spills: The invisible impact on the base of tropical marine food webs. Mar Poll Bull. 167:112281. https://doi.org/10.1016/j.marpolbul.2021.112281 [ Links ]
Dos santos-Reis, R, Rizzo, AE. 2019. Human trampling effect on benthic fauna of sandy beaches with different intensities of use in Rio de Janeiro, Brazil. Oecol Austr. 23(1):28-38. https://doi.org/10.4257/oeco.2019.2301.03 [ Links ]
Elmgren, R. 1976. Baltic benthos communities and the role of meiofauna. Contribution from the Askö Laboratory. 14:1-31. [ Links ]
Fabricio-Maria, T, Pereira-Wandeness, A, Morgado-Esteves, A. 2016. State of the art of the meiofauna of Brazilian Sandy beaches. Braz J Oceanog. 64(sp2):17-26. https://doi.org/10.1590/S1679-875920160946064sp2 [ Links ]
Ferris, H, Bongers, T. 2006. Nematode indicators of organic enrichment. J nematol. 38(1):3-12. [ Links ]
Folk, RL, Ward, WC. 1957. Brazos River bar: a study in the significance of grain size parameters. J Sediment Petrol. 27(1):3-26. https://doi.org/10.1306/74D70646-2B21-11D7-8648000102C1865D [ Links ]
Fonseca, G, Maria, TF, Kandratavicius, N, Venekey, V, Gheller, PF, Gallucci, F. 2014. Testing for nematode - granulometry relationships. Mar Biodivers. 44:435-443. [ Links ]
Gallucci, F, Steyaert, M, Moens, T. 2005. Can field distributions of marine predacious nematodes be explained by sediment constraints on their foraging success? Mar Ecol Prog Ser. 304:167-178. https://doi.org/10.3354/meps304167 [ Links ]
Guilherme, BC, Alves, PS, Cavalcanti, MF. 2016. Structural variation of the meiofauna community from Guadalupe beach (Pernambuco - Brazil). Rev Nordestina Zool. 10(1):1-14. [ Links ]
Kotwicki, L, Szymelfenig, M, De-Troch, M, Urban-Malinga, B, Węsławski, JM. 2005. Latitudinal biodiversity patterns of meiofauna from sandy littoral beaches. Biodiver Conserv. 14(2):461-474. https://doi.org/10.1007/10531-004-6272-6 [ Links ]
Manso, VAV, Coutinho, PN, Guerra, NC, Soares-Junior, CFA. 2006. Pernambuco. In: Muehe, D (coord.), Erosão e Progradação no Litoral Brasileiro. 2nd ed. Brasília (Brazil): Ministério do Meio Ambiente. p. 180-196. [ Links ]
Moens, T, Braeckman, U, Derycke, S, Fonseca, G, Gallucci, F, Gingold, R, Guilini, K, Ingels, J, Leduc, D, Vanaverbeke, J, et al. 2013. Ecology of free-living marine nematodes. In: Schmidt-Rhaesa, A (ed.), Nematoda, Vol. 2: Nematoda. Berlin (Germany): De Gruyter. p. 109-152. https://doi.org/10.1515/9783110274257.109 [ Links ]
Moens, T, Vincx, M. 1997. Observations on the feeding ecology of estuarine nematodes. J Mar Biol Assos UK. 77(1):211-227. https://doi.org/10.1017/S0025315400033889 [ Links ]
Moreno, M, Ferrero, TJ, Gallizia, I, Vezzulli, L, Albertelli, G, Fabiano, M. 2008. An assessment of the spatial heterogeneity of environmental disturbance within an enclosed harbour through the analysis of meiofauna and nematode assemblages. Estuar Coast Shelf Sci. 77:565-576. [ Links ]
Moreno, M, Semprucci, F, Vezzulli, L, Balsamo, M, Fabiano, M, Albertelli, G. 2011. The use of nematodes in assessing ecological quality status in the Mediterranean coastal ecosystems. Ecol Indic. 11(2):328-336. https://doi.org/10.1016/j.ecolind.2010.05.011 [ Links ]
Nemys. 2002. Nemys: World Database of Nematodes. Belgium: University of Gent; accessed 2021 June. http://nemys.ugent.be . https//doi.org/10.14284/366 [ Links ]
Pereira, SMB, Oliveira-Carvalho, MF, Angeiras, JAP, Oliveira, NMB, Torres, J, Gestinari, LMS, Bandeira-Pedrosa, ME, Cocentino, ALM, Santos, MD, Nascimento, PRF et al. 2002. Algas Marinhas Bentônicas do Estado de Pernambuco [Benthic Marine Algae of the State of Pernambuco]. In: Tabarelli, M, Silva, JMC (eds.), Diagnóstico da Biodiversidade de Pernambuco [Diagnosis of the Biodiversity of Pernambuco]. Recife (Brazil): Secretaria de Ciência, Tecnologia e Meio Ambiente. p. 97-124. [ Links ]
Pereira-Gomes, de-Melo-T, Rosa-Fiho, JS, Venekey, V. 2013. Marine Nematoda from Ajuruteua Beach, Amazon Coast, Brazil. Rev Atlântica. 35(1):67-70. https://doi.org/10.5088/2013.35.1.67 [ Links ]
Pinto, TKO, Santos, PJP dos. 2006. Meiofauna community structure variability in a brazilian tropical sandy beach. Rev Atlântica. [accessed 2021 February]; 28(2):117-127. http://repositorio.furg.br/handle/1/695 . [ Links ]
Santos, TMT, Petracco, M, Venekey, V. 2021. Recreational activities trigger changes in meiofauna and free-living nematodes on Amazonian macrotidal sandy beaches. Mar Environ Res. 167(105289):1-14. https://doi.org/10.1016/j.marenvres.2021.105289 [ Links ]
Schlacher, TA, Dugan, J, Schoeman, DS, Lastra, M, Jones, A, Scapini, F, McLachlan, A, Defeo, O. 2007. Sandy beaches at the brink. Divers Distrib. 13(5):556-560. https://doi.org/10.1111/j.1472-4642.2007.00363.x [ Links ]
Schratzberger, M, Ingels, J. 2018. Meiofauna matters: the roles of meiofauna in benthic ecosystems. J Exp Mar Biol Ecol. 502:12-25. https://doi.org/10.1016/j.jembe.2017.01.007 [ Links ]
Short, AD, Klein, AH. da F., 2016. Brazilian Beach Systems: Review and Overview. In: Short, AD, Klein, AH. da F. (eds.), Brazilian Beach Systems. Coastal Research Library, vol 17. [place unknown]: Springer, Cham. p.573-608. https://doi.org/10.1007/978-3-319-30394-9_20 [ Links ]
Souza-Santos, LP, Ribeiro, VSS, Santos, PJP, Fonseca-Genevois, V. 2003. Seasonality of intertidal meiofauna on a tropical sandy beach in Tamandare Bay (Northeast Brazil). J Coast Res. 35(SI):369-377. https://www.jstor.org/stable/40928784 [ Links ]
Suguio, K. 1973. Geologia Sedimentar. São Paulo (Brazil): Edgard Blücher ltda/EDUSP. 400 p. [ Links ]
Venekey, V, Fonseca-Genevois, VG, Santos, PJP. 2010. Biodiversity of free-living marine nematodes on the coast of Brazil: a review. Zootaxa (Auckland). 2568(1):39-66. https://doi.org/10.11646/zootaxa.2568.1.2 [ Links ]
Verçosa, MM, Santos, ECL, Souza, JRB, Rocha, CMCD. 2009. Distribuição de Stygactus bradypus Schulz, 1951 (Tardigrada, Heterotardigrada) na margem sul da ilha de Itamaracá (PE, Brasil) = Distribution of Stygactus bradypus Schulz, 1951 (Tardigrada, Heterotardigrada) on the south bank of Itamaracá Island (PE, Brazil). Rev Atlântica. [accessed 2021 February]; 31(1):25-33. http://repositorio.furg.br/handle/1/553 . [ Links ]
Warwick, RM, Platt, HM, Somerfield, PJ. 1998. Free-living marine nematodes. Part III. Monhysterids. Synopsis of the British fauna (new series) N 53. Shrewsbury (UK): Field Studies Council. 296 p. [ Links ]
Wieser, W. 1953. Die Beziehungzwischen Mundh ö hlengestalt, Ern ä hrungsweise und Vorkommenbei freileben den marinen Nematoden. Ark Zoo. 4:439-484. [ Links ]
Wieser, W. 1960. Benthic studies in Buzzards Bay. 2. The meiofauna. Limnol Oceanogr. 5(2):121-137. https://doi.org/10.4319/lo.1960.5.2.0121 [ Links ]
Zacagnini-Amaral, AC, Nascimento-Corte, G, Rosa-Filho, JS, Denadai, MR, Colling, LA, Borzone, C, Veloso, V, Pessoa-Omena, E, Rosental-Zalmon, I, Rocha-Barreira, CA, et al. 2016. Brazilian sandy beaches: characteristics, ecosystem services, impacts, knowledge and priorities. Braz J Oceanogr. 64(spe2):5-16. https://doi.org/10.1590/S1679-875920160933064sp2 [ Links ]
Recibido: 21 de Junio de 2021; Aprobado: 20 de Agosto de 2022











 texto em
texto em 





