Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.49 Ensenada Jan./Dec. 2023 Epub Dec 08, 2023
https://doi.org/10.7773/cm.y2023.3296
Artículos
Efecto del estrés térmico causado por el evento El Niño 2015-2016 sobre la composición bioquímica, la estructura del exoesqueleto y la densidad de simbiontes del coral de fuego Millepora alcicornis
1Posgrado en Ciencias Químico-Biológicas. Facultad de Química, Universidad Autónoma de Querétaro, 76010 Querétaro, Mexico.
2División Química y Energías Renovables. Universidad Tecnológica de San Juan del Río, 76800, San Juan del Río, Querétaro, Mexico.
3Laboratorio de Investigación Química y Farmacológica de Productos Naturales, Facultad de Química, Universidad Autónoma de Querétaro, 76010 Querétaro, Mexico.
4C.A Ingeniería de Biosistemas. Facultad de Ingeniería-Campus Amazcala, 76265 El Marqués, Querétaro, Mexico.
Los cnidarios formadores de arrecifes son esenciales en la ecología marina. Desafortunadamente, están amenazados por el fenómeno de blanqueamiento, el cual rompe la simbiosis mutualista entre algas de la familia Symbiodiniaceae y sus hospederos coralinos. El blanqueamiento causa un alto índice de mortalidad de corales y un rápido deterioro de las estructuras arrecifales. Los estudios dirigidos a explicar causas, mecanismos y consecuencias del blanqueamiento se han realizado principalmente con antozoos, mientras que los impactos del blanqueamiento de corales se han estudiado escasamente en especies de Millepora (phylum Cnidaria, clase Hydrozoa), que son los segundos constructores de arrecifes más importantes. En el presente estudio se analizó el efecto del estrés térmico causado por el evento El Niño 2015-2016 sobre la abundancia de simbiontes, la estructura del exoesqueleto y la composición bioquímica de Millepora alcicornis. Los especímenes sin blanquear de M. alcicornis contenían una mayor abundancia de especies de Breviolum y Durisdinium, lo que sugiere que las colonias de hidrocorales sin blanquear podrían estar contrarrestando el estrés térmico al albergar simbiontes termotolerantes del género Durisdinium. Los hidrocorales blanqueados mostraron niveles más bajos de calcificación y cambios en la microestructura de zooides y trabéculas. En contraste, el estrés térmico no modificó el contenido total de carbonato de calcio y carbohidratos en los hidrocorales. Los tejidos blanqueados mostraron niveles significativamente más altos de proteína y material refractario, mientras que su contenido de lípidos disminuyó considerablemente. El presente estudio muestra que las colonias blanqueadas de M. alcicornis sufrieron una disminución en la calcificación y cambios en la estructura de su exoesqueleto después de estar expuestas al estrés térmico provocado por el evento El Niño 2015-2016. La disminución significativa en el contenido de lípidos sugiere que M. alcicornis está utilizando sus reservas de energía principalmente para mantener sus procesos celulares vitales a expensas de la calcificación.
Palabras clave: blanqueamiento; Millepora alcicornis; composición bioquímica; estructura del exoesqueleto; simbionte
Reef-forming cnidarians are essential for maintaining ecological balance. Unfortunately, coral reefs are endangered due to coral bleaching, which interrupts mutualistic symbiosis between Symbiodiniaceae algae and their coral hosts. Bleaching events result in very high coral mortality and the rapid deterioration of reef structures. Studies aimed at explaining the causes, mechanisms, and consequences of coral bleaching have been mainly conducted with anthozoans, while the impacts of thermal stress responsible for coral bleaching have been scarcely studied in hydrozoans, such as Millepora species (phylum Cnidaria, class Hydrozoa), which are the second most important reef-forming cnidarians. In the present study, the effects of thermal stress caused by the 2015-2016 El Niño on symbiont abundance, exoskeleton structure, and the biochemical composition of Millepora alcicornis were analyzed. Unbleached M. alcicornis specimens exhibited a higher abundance of Breviolum and Durisdinium species, which suggests that unbleached hydrocoral colonies might counteract thermal stress by hosting thermotolerant symbionts of the Durisdinium genus. Bleached hydrocorals exhibited lower levels of calcification than unbleached hydrocorals as well as changes in the microstructure of trabeculae and zooid pores. In contrast, thermal stress did not affect total calcium carbonate and carbohydrate content. Bleached tissues showed significantly higher levels of protein and refractory material, whereas their lipid content decreased considerably. The present study provides evidence that bleached M. alcicornis colonies suffered a decline in calcification and changes in the structure of their exoskeletons after being exposed to the 2015-2016 El Niño. The significant decrease in lipid content suggests that M. alcicornis primarily uses energy stores to maintain vital cellular processes at the expense of calcification.
Key words: bleaching; Millepora alcicornis; biochemical composition; exoskeleton structure; symbiont
INTRODUCCIÓN
Los arrecifes de coral son algunos de los ecosistemas más ricos y son esenciales para mantener el equilibrio ecológico (Anthony et al. 2020). Las especies del género Millepora (phylum Cnidaria, clase Hydrozoa), reconocidas como los segundos organismos formadores de arrecifes más importantes, están ampliamente distribuidas en el Caribe, donde se encuentra la segunda barrera arrecifal más grande del mundo, el Arrecife Mesoamericano (Rojas-Molina et al. 2012). Los organismos formadores de arrecifes mantienen una simbiosis mutualista con las algas dinoflageladas unicelulares de la familia Symbiodiniaceae, que es fundamental para la formación de estructuras de arrecifes de coral (Fransolet et al. 2012).
Desafortunadamente, los arrecifes de coral están seriamente amenazados por estresores ambientales, principalmente el calentamiento global y la acidificación de los océanos. Estos estresores provocan eventos de blanqueamiento en los cuales los tejidos de los corales y los hidrocorales pierden sus simbiontes o pigmentos, lo que expone el exoesqueleto blanco de carbonato de calcio (McLachlan et al. 2020). En los últimos años se ha incrementado la frecuencia y severidad de eventos de blanqueamiento y se han documentado eventos masivos de blanqueamiento en todas las regiones tropicales del mundo (Suggett y Smith 2020). Notablemente, el nivel de estrés térmico durante el evento El Niño 2015-2016 no tuvo precedentes durante el periodo 1871-2017 en la región del Caribe. De hecho, 2017 fue el año sin un evento El Niño más cálido que se ha registrado, lo que resultó en un alto índice de mortalidad de corales en muchos arrecifes, un rápido deterioro de las estructuras de los arrecifes e impactos ambientales de gran alcance (Hughes et al. 2018, Lough et al. 2018, Eakin et al. 2019).
Los eventos de blanqueamiento provocados por el estrés térmico han causado daños a escala mundial en los arrecifes de coral, con graves efectos en el mantenimiento de la biodiversidad en las regiones marinas tropicales (Foster y Attrill 2021). Un gran número de estudios han evaluado las consecuencias del estrés térmico y el blanqueamiento y la resiliencia y tolerancia de los antozoos formadores de arrecifes (Bay y Palumbi 2015; Ainsworth et al. 2016; Ricaurte et al. 2016; Hillyer et al. 2017, 2018; Oakley et al. 2017; Ruiz-Jones y Palumbi 2017; Mayfield et al. 2018). Los resultados obtenidos de dichas investigaciones han relacionado la tolerancia y capacidad de recuperación tras un evento de blanqueamiento con la cantidad de reservas energéticas de los cnidarios (Grottoli et al. 2014, Schoepf et al. 2015, Aichelman et al. 2016, Levas et al. 2016, Tremblay et al. 2016) y su capacidad de albergar algas más termotolerantes, antes o durante el evento de blanqueamiento (Sampayo et al. 2008, Baker et al. 2017, Swain et al. 2018). Sin embargo, existe muy poca investigación sobre las consecuencias del estrés térmico en los organismos formadores de arrecifes de la clase Hydrozoa (García-Arredondo et al. 2011, Hernández-Elizárraga et al. 2019, Olguín-López et al. 2019). Por lo tanto, el objetivo del presente estudio fue llevar a cabo un análisis comparativo de la composición bioquímica, la estructura del exoesqueleto y la densidad de simbiontes de colonias sin blanquear y blanqueadas de Millepora alcicornis, un coral de fuego, afectadas por el evento El Niño 2015-2016 en el Caribe mexicano.
MATERIALES Y MÉTODOS
Recolección de las muestras
Se colectaron fragmentos de M. alcicornis de 3 colonias sin blanquear y 3 colonias blanqueadas a profundidades de 4 a 10 metros mediante buceo autónomo. Para reducir la posibilidad de muestrear clones genéticos, al menos 10 m separaron los fragmentos que se recolectaron. El muestreo se llevó a cabo en noviembre de 2016 durante el tercer evento más grande de blanqueamiento masivo a gran escala que se ha documentado (Hughes et al. 2018) en el área conocida como “La Bocana Chica” en el Parque Nacional Arrecife de Puerto Morelos (Quintana Roo, México). Un permiso de campo (PPF/DGOPA-139/15) fue otorgado por la Secretaría de Agricultura, Desarrollo Rural, Pesca y Alimentación (SAGARPA) para la recolección de especímenes. Los especímenes fueron congelados en nitrógeno líquido y transportados a nuestro laboratorio de la Universidad Autónoma de Querétaro.
Identificación genética de algas de la familia Symbiodiniaceae
Las muestras de ADN total se obtuvieron de los tejidos de los hidrocorales utilizando un buffer de extracción con la siguiente composición: 100 mM Tris-HCl pH 8, 2% CTAB, 200 mM EDTA y 1.4 M NaCl (Salgado et al. 2007). Los diferentes géneros de simbiontes hospedados por los hidrocorales fueron identificados por PCR. Se obtuvieron los cebadores específicos dirigidos a la región espaciadora transcrita interna ITS1 o al dominio 2 de la subunidad grande del ADNr de los géneros Symbiodiniaceae (Symbiodinium [anteriormente Clado A], Breviolum [anteriormente Clado B], Cladocopium [anteriormente Clado C] y Durisdinium [anteriormente Clado D]) (Tabla 1; Mieog et al. 2007, Correa et al. 2009). La mezcla de reacción de PCR (20 μL) contenía 7.5 μL de agua estéril, 2.0 μL de buffer (10×), 1.0 μL MgCl2, 2.0 μL DNA, 2.5 μL de cada primer (25 mM), 1.0 μL DNTp mix (2 mM) y 0.5 U de Taq polimerasa (Taq DNA Polymerase Recombinant, Thermo Fisher Scientific, Waltham, MA, EE. UU.). Las amplificaciones se realizaron en un termociclador iCycler (Bio-Rad Laboratories, Hercules, CA, EE. UU.). Los productos de PCR fueron analizados en geles de agarosa al 2% y visualizados en ChemiDoc MP (Bio-Rad Laboratories). Se utilizó como marcador de peso molecular 1 Kb Plus DNA Ladder (Invitrogen, Carlsbad, CA, EE. UU.). Las bandas dominantes en el gel se escindieron y secuenciaron utilizando el kit de secuenciación de ciclo BigDye Terminator v.3.1 (Thermo Fisher Scientific) y un Analizador Genético 3130XL (Applied Biosystems, Waltham, MA, EE. UU.). Se cuantificaron las densidades de la proporción de células simbiontes a partir de cada muestra de ADN mediante qPCR. Se utilizaron como controles cebadores y sondas para ensayos de qPCR específicos para β-actina de M. alcicornis, Symbiodinium sp., Breviolum sp., Cladocopium sp. y Durisdinium sp. La amplificación de qPCR se realizó por triplicado para cada muestra en un sistema CFX96 Touch de detección de PCR en tiempo real (Bio-Rad Laboratories, Tabla 1).
Tabla 1 Cebadores usados en la identificación por PCR de algas de la familia Symbiodiniaceae (Mieog et al. 2007, Correa et al. 2009).
| Primer | Sequence |
| ITS A-specific forward | 5’-CCTCTTGGACCTTCCACAAC-3’ |
| ITS A-specific reverse | 5’-GCATGCAGCAACACTGCTC -3’ |
| LSU-28S B-specific forward | 5’-GTCTTTGTGAGCCTTGAGC-3’ |
| LSU-28S B-specific reverse | 5’-GCACACTAACAAGTGTACCATG-3’ |
| nITS1 universal forward | 5′-AGGAGAAGTCGTAACAAGGTTTCC-3′ |
| nITS1 C-specific reverse | 5′-AAGCATCCCTCACAGCCAAA-3′ |
| nITS1 D-specific reverse | 5′-CACCGTAGTGGTTCACGTGTAATAG-3′ |
Tinción con rojo alizarina S
Fragmentos sin blanquear y blanqueados de M. alcicornis recolectados de diferentes colonias fueron teñidos con rojo alizarina S. La captación e incorporación de rojo alizarina S en los esqueletos de hidrocorales, lo que da como resultado áreas de color rosa-rojo, es proporcional a la tasa de calcificación y, en consecuencia, está altamente correlacionada con las zonas recién calcificadas (Le Tissier 1990, 1991; Frank et al. 1995; Tambutté et al. 2012). Se colocaron fragmentos de hidrocoral en agua de mar que contenía 10-15 mg de colorante rojo alizarina S durante 12 h. Posteriormente, los esqueletos se limpiaron de tejidos suprayacentes en una solución de hipoclorito de sodio al 5% durante 30 min, se enjuagaron con agua destilada (12 h) y se secaron al aire. Las áreas del exoesqueleto de hidrocoral que se tiñeron indicaron zonas donde se había producido la deposición de carbonato de calcio.
Microscopía electrónica de barrido
Tres fragmentos de colonias sin blanquear y 3 fragmentos de colonias blanqueadas de M. alcicornis recolectados en noviembre de 2016 fueron limpiados de tejidos suprayacentes. Las secciones transversales de los fragmentos de hidrocoral se obtuvieron empleando una lijadora de 0.5 cm y la microestructura del exoesqueleto se examinó mediante escaneos de microscopía electrónica de barrido bajo vacío (30 Pa; Jeol JSM 6060LV, Tokio, Japón).
Composición bioquímica
Se liofilizaron fragmentos (aproximadamente 1 cm2) de M. alcicornis sin blanquear y blanqueadas y se determinó su contenido de proteínas solubles, lípidos, carbohidratos y material refractario. Para determinar el contenido de carbonato de calcio, los fragmentos de hidrocoral se secaron durante 24 h en un horno a 60 °C. Para estimar el contenido de materia orgánica, al peso seco (PS) de carbonato de calcio se le restó el PS de los escleritos. Los valores de cada componente bioquímico de cada muestra se expresaron como porcentaje del PS total (% g PS) y como porcentaje de la cantidad total de materia orgánica (% g MO). El carbonato de calcio, lípidos, carbohidratos y material refractario (contenido de proteína insoluble) se extrajeron y se cuantificaron de los fragmentos liofilizados de M. alcicornis utilizando el método descrito por Shirur et al. (2014).
Análisis estadístico
Los resultados fueron expresados como el promedio ± error estándar de la media (SEM; n = 3; densidad de simbiontes y composición bioquímica). El análisis estadístico se realizó en GraphPad Prism v.6.0 (GraphPad Software, San Diego, CA, EE. UU.). Los promedios ± SEM obtenidos se compararon mediante una prueba t de Student para datos no pareados. En todos los casos se utilizó un nivel de significancia del 95% (α = 0.05).
RESULTADOS
Los fragmentos de M. alcicornis sin blanquear y blanqueados colectados en el Caribe Mexicano durante noviembre de 2016 se muestran en la Figura 1a y 1b, respectivamente. En la Figura 1c y 1d se muestran los fragmentos sin blanquear y blanqueados de M. alcicornis que fueron teñidos con rojo de alizarina. Los corales sin blanquear muestran un color rosa-rojo (valor de saturación del tono [HSV]: 346%, 45% y 66%), mientras que los fragmentos blanqueados muestran un color blanco-rojo (HSV: 355%, 15% y 96%), lo que indica una mayor tasa de calcificación. En los fragmentos de M. alcicornis sin blanquear y blanqueados se encontraron Symbiodinium sp., Breviolum sp., Cladocopium sp. y Durisdinium sp. Los especímenes sin blanquear de M. alcicornis mostraron una mayor distribución de Breviolum sp. y Durisdiniumen sp. en comparación con los de especímenes blanqueados, que mostraron distribuciones similares de simbiontes (Fig. 2).

Figura 1 Fragmentos sin blanquear (a) y blanqueados (b) de Millepora alcicornis recolectados en 2016 en el Caribe Mexicano. Fragmentos blanqueados (c) y sin blanquear (d) de M. alcicornis teñidos con colorante rojo alizarina S.
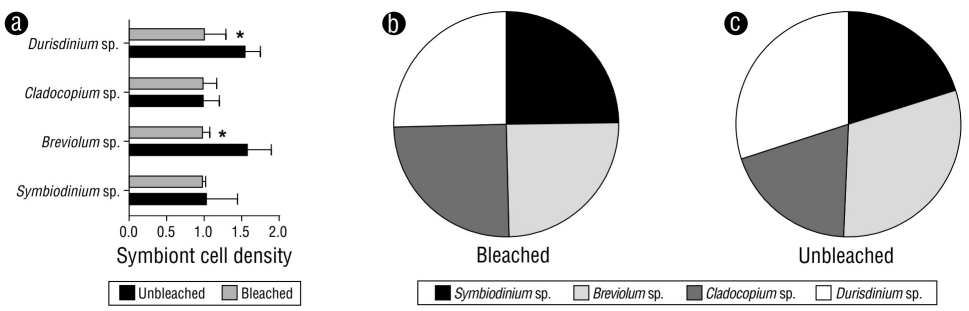
Figura 2 (a) Densidades de la proporción celular de simbiontes en colonias de Millepora alcicornis sin blanquear y blanqueadas. Los valores son reportados como promedio ± error estándar de la media (SEM). Distribución de simbiontes en especímenes blanqueados (b) y sin blanquear (c).
Las propiedades microestructurales de la estructura del exoesqueleto de especímenes sin blanquear y blanqueados de M. alcicornis se muestran en la Figura 3 y la Tabla 2. Estas propiedades incluían gastroporos y dactiloporos en la superficie del esqueleto, poros zooides individuales, trabéculas y cristales de pilares. No se observaron diferencias significativas en el número o tamaño de los gastroporos, dactiloporos o poros de la microestructura del exoesqueleto entre los hidrocorales sin blanquear (Fig. 3a) y blanqueados (Fig. 3e). Sin embargo, las imágenes obtenidas de los poros zooides individuales indicaron que estos eran significativamente más pequeños en los exoesqueletos de especímenes blanqueados en comparación con los de los especímenes no blanqueados (Fig. 3), y sus formas diferían de las de los hidrocorales no blanqueados (Fig. 3b). Además, el grosor trabecular (pared) en los exoesqueletos de colonias sin blanquear de M. alcicornis (Fig. 3c) fue mayor que el de los organismos blanqueados (Fig. 3g). Comparamos las barras de especímenes sin blanquear y blanqueados de M. alcicornis mediante el ancho de un lado de la barra. No se observaron diferencias en la interconexión regular de las barras sólidas y los soportes de aragonita entre los exoesqueletos de los especímenes sin blanquear (Fig. 3d) y blanqueados (Fig. 3h).
Tabla 2 Medidas (μm) de características de la estructura del exoesqueleto de especímenes de Millepora alcicornis blanqueados y sin blanquear.
| Unbleached | Bleached | P value | |
| Gastropore | 325.000 | 350.000 | 0.3508 |
| Dactylopores | 166.700 | 178.600 | 0.4486 |
| Zooide | 90.150 | 79.120* | 0.0212 |
| Trabecular (wall) thickness | 24.700 | 14.480* | 0.0047 |
| Cross-linking of solid bars and aragonite supports | 1.085 | 1.088 | 0.9607 |
Each value is expressed as the mean ± standard error of the mean (n = 3). *P < 0.05 compared to control by student’s t-test.

Figura 3 Imágenes representativas de las micrografías electrónicas de barrido (1: gastróporo; 2: dactilóporo) de la superficie del exoesqueleto (a), poros zooides individuales (b), trabéculas (c) y cristales (d) de fragmentos sin blanquear de Millepora alcicornis. Imágenes de microscopio electrónico de barrido de la superficie del exoesqueleto (e), poros zooides individuales (f), trabéculas (g) y pilares (h) de M. alcicornis blanqueados.
La Figura 4 muestra la composición bioquímica (carbonato de calcio, material refractario y otros orgánicos) del tejido seco de especímenes sin blanquear y blanqueados de M. alcicornis. No se observaron diferencias significativas en la composición entre los especímenes sin blanquear y blanqueados. El componente principal del tejido seco del hidrocoral es carbonato de calcio, que constituyó aproximadamente el 90% del PS de las muestras sin blanquear y blanqueadas. Además, 6-7% y el 2% del PS de las muestras era material refractario y otros compuestos orgánicos, respectivamente (Tabla 3).
Tabla 3 Composición bioquímica del tejido seco de especímenes de Millepora alcicornis blanqueados y sin blanquear. Los valores son reportados como promedio ± error estándar de la media (SEM).
| Parameter (% g DW) | uMa | bMa | P value |
| Calcium carbonate | 91.23 ± 1.56 | 90.62 ± 1.67 | 0.8028 |
| Refractory material | 6.64 ± 1.12 | 7.987 ± 1.36 | 0.4881 |
| Protein | 0.27 ± 0.03 | 0.52 ± 0.10 | 0.0708 |
| Lipid | 1.31 ± 0.28 | 0.27 ± 0.04* | 0.0208 |
| Carbohydrate | 0.55 ± 0.16 | 0.59 ± 0.17 | 0.8517 |
Each value is expressed as the mean ± standard error of the mean (n = 3). *P < 0.05 compared to control by student’s t-test.
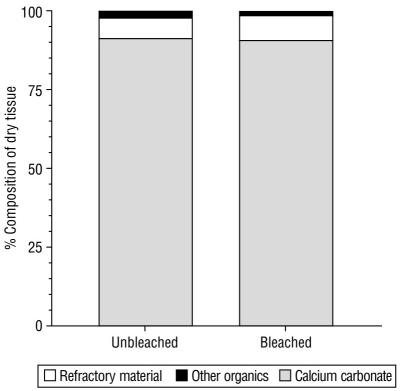
Figura 4 Composición bioquímica de los tejidos de ejemplares de Millepora alcicornis no blanqueados (uMa) y blanqueados (bMa). El carbonato de calcio (CaCO3), el material refractario (proteínas insolubles) y otros constituyentes orgánicos (proteínas solubles, lípidos y carbohidratos) se estandarizan al porcentaje de peso seco (PS).
La composición bioquímica de la materia orgánica (i.e., el porcentaje que representa la diferencia entre el carbonato de calcio y el PS total) de hidrocorales sin blanquear y blanqueados se presenta en la Figura 5. El porcentaje más alto correspondió al material refractario (proteínas insolubles), el cual fue significativamente mayor en las muestras blanqueadas que en las muestras sin blanquear, al igual que ocurrió con el porcentaje de proteínas solubles. En contraste, el porcentaje de lípidos fue significativamente menor en las muestras blanqueadas que en las muestras no blanqueadas. El porcentaje de carbohidratos no cambió como resultado del blanqueamiento (Tabla 4).
Tabla 4 Composición bioquímica del material orgánico (OM) de tejidos liofilizados de especímenes de Millepora alcicornis blanqueados y sin blanquear. Los valores son reportados como promedio ± error estándar de la media (SEM).
| Parameter (% g DW) | uMa | bMa | P value |
| Refractory material | 75.90 ± 0.89 | 85.39 ± 0.71* | 0.0012 |
| Protein | 3.23 ± 0.61 | 5.57 ± 0.39* | 0.0323 |
| Lipid | 14.77 ± 0.48 | 2.92 ± 0.11* | 0.0001 |
| Carbohydrate | 6.09 ± 0.76 | 6.11 ± 0.94 | 0.9820 |
Each value is expressed as the mean ± standard error of the mean (n = 3). *P < 0.05 compared to control by student’s t-test.

Figura 5 Composición bioquímica de la materia orgánica (OM) de especímenes de Millepora alcicornis sin blanquear (uMa) y blanqueados (bMa). Los gráficos muestran (a) material refractario, (b) proteína soluble en NaOH, (c) lípidos y (d) contenido de carbohidratos. Las variables están estandarizadas según el peso seco (PS) de la materia orgánica (% g OM) dentro de los fragmentos. Los valores son reportados como promedio ± error estándar de la media (SEM).
DISCUSIÓN
En los últimos años, la ocurrencia de eventos de blanqueamiento masivo ha aumentado en intensidad y frecuencia, lo que ha resultado en una disminución de la cobertura de coral en todo el mundo (Anthony et al. 2020), con algunos de los efectos más severos observados en los arrecifes de coral del Caribe. Los hidrocorales son especialmente vulnerables al estrés térmico (Pereira-Dias y Gondim 2016). Por ejemplo, M. alcicornis ha experimentado episodios severos de blanqueamiento en diferentes periodos y lugares, incluyendo verano de 2005 en la Gran Barrera de coral (Marshall y Baird 2000), los veranos de 2006 y 2007 en el arrecife de los Cayos de la Florida (Wagner et al. 2010) y en 1987, 1993, 1995, 1998, 2003, 2005, 2009, 2010 y 2014-2017 en Puerto Rico y el Caribe (Pereira-Dias y Gondim 2016, Eakin et al. 2019).
Los géneros de Symbiodiniaceae Symbiobinium, Breviolum, Cladocopium y Durisdinium han sido identificados previamente en otras especies del género Millepora (Rodríguez et al. 2019) y corales escleractinios en el mar Caribe (LaJeunesse 2002, Santos et al. 2004). Las species de Cladocopium son los simbiontes más comunes que se encuentran en los corales formadores de arrecifes, y las especies de Breviolum se encuentran entre los simbiontes más dominantes asociados con los cnidarios formadores de arrecifes en el mar Caribe (LaJeunesse 2004). En contraste, especies de Symbiodinium y Durisdinium son considerablemente menos comunes, aunque ciertas especies parecen estar adaptadas a condiciones de altos niveles de irradiancia y temperatura (Jones et al. 2008, Reynolds et al. 2008).
Se ha documentado ampliamente que las algas de la familia Symbiodiniaceae brindan diferentes beneficios fisiológicos a sus hospederos de coral. Silverstein et al. (2015) descubrió que las colonias de Montastraea cavernosa dominadas por Symbiodinium D1a experimentaron menos fotodaño y pérdida de simbiontes en comparación con los corales que albergan solo simbiontes sensibles al estrés (Symbiodinium C3). También se ha demostrado que la distribución de Symbiodiniaceae puede cambiar después de eventos de blanqueamiento debido a un cambio en la dominancia de simbiontes (Jones et al. 2008, Sampayo et al. 2008, Silverstein et al. 2015). Además, el cambio de simbiontes también se ha observado antes e incluso durante el blanqueamiento (LaJeunesse et al. 2009).
En un estudio previo realizado por nuestro grupo de investigación, encontramos que los especímenes de M. alcicornis mostraron una disminución del 40% en la densidad de simbiontes por centímetro cuadrado después del evento El Niño 2015-2016 (Olguín-López et al. 2019), lo que corresponde a un “blanqueamiento moderado” según las categorías definidas por ReefBase (Oliver et al. 2019). Cabe mencionar que los ejemplares de M. alcicornis que se utilizaron en la presente investigación fueron seleccionados de las muestras de hidrocorales colectadas por Oliver et al. (2019). En este estudio encontramos qué, aunque tanto los especímenes de M. alcicornis sin blanquear como los blanqueados albergaban simbiontes de los géneros Symbiobinium, Breviolum, Cladocopium y Durisdinium, la abundancia de las especies termotolerante de Durisdinium fue mayor en los especímenes de M. alcicornis sin blanquear que en los especímenes blanqueados.
Las especies de Durisdinium, que son relativamente raras pero distribuidas globalmente, han atraído un creciente interés en las últimas décadas, ya que aumentan la tolerancia térmica de sus hospederos de coral (Oliver y Palumbi 2011, Kennedy et al. 2015). Similar a lo que encontramos en M. alcicornis sin blanquear en este estudio, una mayor abundancia de Durisdinium spp. también se ha observado en Orbicella faveolata después de un evento de blanqueamiento (Kemp et al. 2014). Por lo tanto, nuestros resultados nos permiten hipotetizar que M. alcicornis podría estar adquiriendo un cierto grado de termotolerancia relacionada con la presencia de simbiontes termotolerantes. De hecho, nuestros resultados nos permiten hipotetizar que las colonias de M. alcicornis que no se blanquearon por el efecto del evento El Niño 2015-2016 en el Caribe mexicano eran más termotolerantes debido a sus asociaciones con las algas Durisdinium.
En el presente estudio, se utilizó la tinción con rojo de alizarina S para evaluar la calcificación de especímenes de M. alcicornis blanqueados y sin blanquear. Los hidrocorales sin blanquear exhibieron mayores niveles de calcificación que los especímenes blanqueados dada la intensidad de incorporación del rojo alizarina S. Estos resultados eran esperados, ya que los productos de la fotosíntesis llevada a cabo por las algas de la familia Symbiodiniaceae juegan un papel crítico en el proceso de calcificación, y la reserva de carbono fijada fotosintéticamente suministrada al coral disminuye significativamente después de eventos de blanqueamiento (Colombo-Pallotta et al. 2010, Muller-Parker et al. 2015, D’Olivo y McCulloch 2017). Como se ha observado con los antozoos, nuestros resultados sugieren que el estrés térmico que provoca el blanqueamiento también afecta la calcificación de los hidrocorales.
Con el fin de determinar si una disminución en los niveles de calcificación se reflejaba en cambios en la microestructura del exoesqueleto de hidrocorales, se analizaron muestras de hidrocorales blanqueados y sin blanquear mediante microscopía electrónica de barrido. No se detectaron diferencias aparentes en el número o tamaño de gastróporos o dactilóporos, los cuales están relacionados con el número de pólipos especializados en la captura de presas y alimentación heterótrofa, entre las muestras blanqueadas y sin blanquear. Sin embargo, al analizar los poros zooides individuales, se observó una reducción en la profundidad, el tamaño y el espesor trabecular en el exoesqueleto de los hidrocorales blanqueados, lo que sugiere una disminución en la deposición de carbonato de calcio. No sorprendió el hecho de que el exoesqueleto de especímenes blanqueados no mostró cambios evidentes en el entrecruzamiento regular de barras sólidas y cristales de aragonita, ya que se esperaba observar modificaciones en el proceso de calcificación en los primeros centros de mineralización, no en los cristales fibrosos de aragonita ya formados.
Está bien demostrado que el estrés térmico reduce la calcificación y provoca una expresión diferencial de genes y proteínas involucradas en vías reguladoras asociadas con la biomineralización de los exoesqueletos de coral en Acropora palmata, Montastraea faveolata, Acropora Millepora, Galaxea astreata, Porites astreoides, Porites divaricata y O. faveolata (Desalvo et al. 2008, Rodriguez‐Lanetty et al. 2009, De Salvo et al. 2010, Moya et al. 2012, Ricaurte et al. 2016, D’Olivo y McCulloch 2017, Huang et al. 2018, Levas et al. 2018). El carbonato de calcio constituyó la mayor parte del exoesqueleto (PS) de los especímenes de M. alcicornis, tanto los blanqueados y los sin blanquear. El material refractario (proteínas insolubles) representó aproximadamente el 7% del tejido de los hidrocorales (PS). No se observaron diferencias significativas en los contenidos de ambos componentes entre los fragmentos blanqueados y sin blanquear.
Considerando que las algas Symbiodinaceae realizan la fotosíntesis y transfieren más del 50% de sus productos fotosintéticos a sus hospederos cnidarios (Venn et al. 2008, Yellowlees et al. 2008, Davy et al. 2012, Fransolet et al. 2012), exploramos si la disminución en la densidad de simbiontes provocó un incremento en el consumo de fuentes de energía, incluidas las reservas de carbohidratos, lípidos y proteínas. El contenido de carbohidratos no se modificó en los especímenes blanqueados de M. alcicornis, lo que sugiere que el déficit de carbohidratos provocado por la pérdida de los simbiontes podría atenuarse por un aumento en la alimentación heterótrofa. Este resultado apoya nuestra observación anterior de que la actividad hemolítica y proteolítica y la actividad de la fosfolipasa A2 en el proteoma soluble de M. alcicornis no se modificaron, siendo los especímenes blanqueados los que mostraron una mayor expresión de toxinas citolíticas potencialmente involucradas en la captura y digestión de presas en comparación con los especímenes no blanqueados (Olguín-López et al. 2019). Además, los estudios realizados en corales escleractinios han demostrado que algunos corales pueden recuperarse de un evento de blanqueamiento aumentando su tasa de alimentación heterótrofa y el porcentaje de contribución de carbono adquirido heterótrofamente a la respiración animal diaria (CHAR, por sus siglas en inglés; Grottoli et al. 2006, Aichelman et al. 2016).
Los lípidos fueron los segundos compuestos orgánicos más abundantes en los tejidos de M. alcicornis sin blanquear (aproximadamente 14.7%), mientras que el porcentaje de lípidos en las muestras blanqueadas fue solo 2.9%. El porcentaje de lípidos en tejidos secos de corales escleractinios sin blanquear varía del 12% en Porites porites al 30% en Orbicella annularis (Harland et al. 1992). Como en el caso de M. alcicornis, los niveles de lípidos fueron significativamente más bajos en las muestras de Porites divaricate y Porites compressa blanqueadas en comparación con los niveles en las muestras no blanqueadas (Grottoli et al. 2004, Levas et al. 2018). Los altos niveles de reservas de energía podrían juegan un papel central en la recuperación a largo plazo del blanqueamiento, ya que las especies de coral que poseen altas reservas de energía tienen mejores posibilidades de superar un evento de blanqueamiento (Schoepf et al. 2015). Por lo tanto, nuestros resultados sugieren que M. alcicornis blanqueada compensa su deficiencia nutricional utilizando sus reservas de lípidos.
Tanto el contenido de material refractario (proteínas insolubles) como el contenido de proteínas solubles fueron significativamente mayores en los especímenes blanqueados de M. alcicornis que en las muestras no blanqueadas. Estudios previos que han empleado enfoques proteómicos y transcriptómicos han demostrado que los corales muestran una alteración en la síntesis y plegamiento de proteínas después de haber sido expuestos a un evento de blanqueamiento (Ricaurte et al. 2016, Hou et al. 2018, Mayfield et al. 2018). Sin embargo, los resultados obtenidos hasta la fecha relacionados con el efecto del estrés térmico sobre el contenido de proteínas en cnidarios formadores de arrecifes no son concluyentes. Por ejemplo, Aiptasia pallida mostró una acumulación de aminoácidos y sus intermediarios después de estar expuesta a estrés térmico. Sin embargo, los especímenes blanqueados de Acropora aspera mostraron una disminución en los niveles de este tipo de metabolitos (Hillyer et al. 2017, 2016). En el caso del presente estudio, la importancia de los niveles altos de proteína en los hidrocorales blanqueados no fue clara.
Si la resiliencia y la recuperación de eventos de blanqueamiento se basan en la plasticidad heterótrofa, los cambios en el tipo de endosimbionte y los niveles de reservas de energía (Grottoli et al. 2006, 2014; Anthony et al. 2009; Connolly et al. 2012), es posible hipotetizar que un aumento en la alimentación heterótrofa y en uso de reservas energéticas y una mayor abundancia de simbiontes termotolerantes del género Durisdinium son algunos de los mecanismos de resiliencia que está desarrollando M. alcicornis para contrarrestar los efectos de calentamiento global.
El presente estudio proporciona evidencia de que el evento El Niño 2015-2016 indujo una disminución en la calcificación y cambios en la microestructura del exoesqueleto de especímenes de M. alcicornis pertenecientes a colonias que habitan el Caribe mexicano. El aumento de la temperatura del mar modificó la composición bioquímica de estos organismos y provocó una importante disminución de los niveles de lípidos, lo que sugiere que los hidrocorales blanqueados están utilizando sus reservas metabólicas para mantener la actividad celular necesaria para su supervivencia, incluso a costa de limitar procesos importantes, como la calcificación. Las especies de Symbiodinium, Breviolum, Cladocopium y Durisdinium se encontraron tanto en especímenes no blanqueados como en especímenes blanqueados. La mayor abundancia de especies de Durisdinium en especímenes de M. alcicornis sin blanquear sugiere que las colonias sin blanquear eran más termotolerantes debido a sus asociaciones con estos simbiontes, los cuales son tolerantes al estrés térmico.
REFERENCES
Aichelman, HE, Townsend, JE, Courtney, TA, Baumann, JH, Davies, SW, Castillo, KD. 2016. Heterotrophy mitigates the response of the temperate coral Oculina arbuscula to temperature stress. Ecol Evol. 6(18):6758-6769. https://doi.org/10.1002/ece3.2399 [ Links ]
Ainsworth, TD, Heron, SF, Ortiz, JC, Mumby, PJ, Grech, A, Ogawa, D, Eakin, CM, Leggat, W. 2016. Climate change disables coral bleaching protection on the Great Barrier Reef. Science. 352(6283):338-342. https://doi.org/10.1126/science.aac7125 [ Links ]
Anthony, KRN, Helmstedt, KJ, Bay, LK, Fidelman, P, Hussey, KE, Lundgren, P, Mead, D, McLeod, IM, Mumby, PJ, Newlands, M, et al. 2020. Interventions to help coral reefs under global change-A complex decision challenge. Plos one. 15:e0236399. https://doi.org/10.1371/journal.pone.0236399 [ Links ]
Anthony, KRN, Hoogenboom, MO, Maynard, JA, Grottoli, AG, Middlebrook, R. 2009. Energetics approach to predicting mortality risk from environmental stress: a case study of coral bleaching. Funct Ecol. 23(3):539-550. https://doi.org/10.1111/j.1365-2435.2008.01531.x [ Links ]
Baker, AC, Correa, AMS, Cunning, R. 2017. Chapter 13-Diversity, distribution and stability of Symbiodinium reef corals of the Eastern Tropical Pacific, Persistance and Loss in a Dynamic Environment. In: Glynn, PW, Manzello, DP, Enochs, IC (eds.), Coral Reefs of the Eastern Tropical Pacific, Coral Reefs of the World. Netherlands: Springer. p. 405-420. https://doi.org/10.1007/978-94-017-7499-4 [ Links ]
Bay, RA, Palumbi, SR. 2015. Rapid acclimation ability mediated by transcriptome changes in reef-building corals. GBE. 7(6):1602-1612. https://doi.org/10.1093/gbe/evv085 [ Links ]
Colombo-Pallotta, MF, Rodríguez-Román, A, Iglesias-Prieto, R. 2010. Calcification in bleached and unbleached Montastraea faveolata: evaluating the role of oxygen and glycerol. Coral Reefs. 29:899-907. https://doi.org/10.1007/s00338-010-0638-x [ Links ]
Connolly, SR, Lopez-Yglesias, MA, Anthony, KRN. 2012. Food availability promotes rapid recovery from thermal stress in a scleractinian coral. Coral Reefs. 31:951-960. https://doi.org/10.1007/s00338-012-0925-9 [ Links ]
Correa, AMS, McDonald, MD, Baker, AC. 2009. Development of clade-specific Symbiodinium primers for quantitative PCR (qPCR) and their application to detecting clade D symbionts in Caribbean corals. Mar Biol. 156:2403-2411. https://doi.org/10.1007/s00227-009-1263-5 [ Links ]
Davy, SK, Allemand, D, Weis, VM. 2012. Cell biology of cnidarian-dinoflagellate symbiosis. Microbiol Mol Biol Rev. 76(2):229-261. https://doi.org/10.1128/MMBR.05014-11 [ Links ]
De Salvo, MK, Sunagawa, S, Voolstra, CR, Medina, M. 2010. Transcriptomic responses to heat stress and bleaching in the elkhorn coral Acropora palmata. Mar Ecol Prog Ser. 402:97-113. https://doi.org/10.3354/meps08372 [ Links ]
Desalvo, MK, Voolstra, CR, Sunagawa, S, Schwarz, JA, Stillman, JH, Coffroth, MA, Szmant, AM, Medina, M. 2008. Differential gene expression during thermal stress and bleaching in the Caribbean coral Montastraea faveolata. Mol Ecol. 17(17):3952-3971. https://doi.org/10.1111/j.1365-294X.2008.03879.x [ Links ]
D’Olivo, JP, McCulloch, MT. 2017. Response of coral calcification and calcifying fluid composition to thermally induced bleaching stress. Sci Rep. 7:2207. https://doi.org/10.1038/s41598-017-02306-x [ Links ]
Eakin, CM, Sweatman HPA, Brainard RE. 2019. The 2014-2017 global-scale coral bleaching event: insights and impacts. Coral Reefs. 38:539-545. https://doi.org/10.1007/s00338-019-01844-2 [ Links ]
Foster, NL, Attrill, MJ. 2021. Chapter 20 - Changes in coral reef ecosystems as an indication of climate and global change. In: Letcher, TM (ed.), Climate Change, Observed Impacts on Planet Earth. 3rd ed. Amsterdam (The Netherlands): Elsevier. p. 427-443. https://doi.org/10.1016/B978-0-12-821575-3.00020-7 [ Links ]
Frank, U, Brickner, I, Rinkevich, B, Loya, Y, Bak, RPM, Achituv, Y, Ilan, M. 1995. Allogeneic and xenogeneic interactions in reef-building corals may induce tissue growth without calcification. Mar Ecol Prog Ser. 124:181-188. https://doi.org/10.3354/meps124181 [ Links ]
Fransolet, D, Roberty, S, Plumier, JC. 2012. Establishment of endosymbiosis: The case of cnidarians and Symbiodinium. J Exp Mar Biol Ecol. 420-421:1-7. https://doi.org/10.1016/j.jembe.2012.03.015 [ Links ]
García-Arredondo, A, Rojas-Molina, A, Ibarra-Alvarado, C, Iglesias-Prieto, R. 2011. Effects of bleaching on the pharmacological and toxicological activities elicited by the aqueous extracts prepared from two “fire corals” collected in the Mexican Caribbean. J Exp Mar Biol Ecol. 396(2):171-176. https://doi.org/10.1016/j.jembe.2010.10.021 [ Links ]
Grottoli, AG, Rodrigues, LJ, Juarez, C. 2004. Lipids and stable carbon isotopes in two species of Hawaiian corals, Porites compressa and Montipora verrucosa, following a bleaching event. Mar Biol. 145:621-631. https://doi.org/10.1007/s00227-004-1337-3 [ Links ]
Grottoli, AG, Rodrigues, LJ, Palardy, JE. 2006. Heterotrophic plasticity and resilience in bleached corals. Nature. 440:1186-1189. https://doi.org/10.1038/nature04565 [ Links ]
Grottoli, AG, Warner, ME, Levas, SJ, Aschaffenburg, MD, Schoepf, V, McGinley, M, Baumann, J, Matsui, Y. 2014. The cumulative impact of annual coral bleaching can turn some coral species winners into losers. Glob Chang Biol. 20(12):3823-3833. https://doi.org/10.1111/gcb.12658 [ Links ]
Harland, AD, Davies, PS, Fixter, LM. 1992. Lipid content of some Caribbean corals in relation to depth and light. Mar Biol. 113:357-361. https://doi.org/10.1007/BF00349159 [ Links ]
Hernández-Elizárraga, VH, Olguín-López, N, Hernández-Matehuala, R, Ocharán-Mercado, A, Cruz-Hernández, A, Guevara-González, RG, Caballero-Pérez, J, Ibarra-Alvarado, C, Sánchez-Rodríguez, J, Rojas-Molina, A. 2019. Comparative analysis of the soluble proteome and the cytolytic activity of unbleached and bleached Millepora complanata (“Fire Coral”) from the Mexican Caribbean. Mar drugs. 17(7):393. https://doi.org/10.3390/md17070393 [ Links ]
Hillyer, KE, Dias, D, Lutz, A, Roessner, U, Davy, SK. 2018. 13C metabolomics reveals widespread change in carbon fate during coral bleaching. Metabolomics. 14:12. https://doi.org/10.1007/s11306-017-1306-8 [ Links ]
Hillyer, KE, Dias, DA, Lutz, A, Wilkinson, SP, Roessner, U, Davy, SK. 2017. Metabolite profiling of symbiont and host during thermal stress and bleaching in the coral Acropora aspera. Coral Reefs. 36:105-118. https://doi.org/10.1007/s00338-016-1508-y [ Links ]
Hillyer, KE, Tumanov, S, Villas-Bôas, S, Davy, SK. 2016. Metabolite profiling of symbiont and host during thermal stress and bleaching in a model cnidarian-dinoflagellate symbiosis. J Exp Biol. 219(4):516-527. https://doi.org/10.1242/jeb.128660 [ Links ]
Hou, J, Xu, T, Su, D, Wu, Y, Cheng, L, Wang, J, Zhou, Z, Wang, Y. 2018. RNA-Seq reveals extensive transcriptional response to heat stress in the stony coral Galaxea fascicularis. Front Genet. 9:37. https://doi.org/10.3389/fgene.2018.00037 [ Links ]
Huang, Y, Yuan, J, Zhang, Y, Peng, H, Liu, L. 2018. Molecular cloning and characterization of calmodulin-like protein CaLP from the Scleractinian coral Galaxea astreata. Cell Stress Chaperon. 23(6):1329-1335. https://doi.org/10.1007/s12192-018-0907-0 [ Links ]
Hughes, TP, Anderson, KD, Connolly, SR, Heron, SF, Kerry, JT, Lough, JM, Baird, AH, Baum, JK, Berumen, ML, Bridge, TC, et al. 2018. Spatial and temporal patterns of mass bleaching of corals in the Anthropocene. Science. 359(6371):80-83. https://doi.org/10.1126/science.aan8048 [ Links ]
Jones, AM, Berkelmans, R, van-Oppen, MJH, Mieog, JC, Sinclair, W. 2008. A community change in the algal endosymbionts of a scleractinian coral following a natural bleaching event: field evidence of acclimatization. Proc Royal Soc B Biol Sci. 275:1359-1365. https://doi.org/10.1098/rspb.2008.0069 [ Links ]
Kemp, DW, Hernandez-Pech, X, Iglesias-Prieto, R, Fitt, WK, Schmidt, GW. 2014. Community dynamics and physiology of Symbiodinium spp. before, during, and after a coral bleaching event. Limnol Oceanogr. 59(3):788-797. https://doi.org/10.4319/lo.2014.59.3.0788 [ Links ]
Kennedy, EV, Foster, NL, Mumby, PJ, Stevens, JR. 2015. Widespread prevalence of cryptic Symbiodinium D in the key Caribbean reef builder, Orbicella annularis. Coral Reefs. 34:519-531. https://doi.org/10.1007/s00338-015-1264-4 [ Links ]
LaJeunesse, TC. 2002. Diversity and community structure of symbiotic dinoflagellates from Caribbean coral reefs. Mar Biol. 141:387-400. https://doi.org/10.1007/s00227-002-0829-2 [ Links ]
LaJeunesse, TC. 2004. “Species” radiations of symbiotic dinoflagellates in the Atlantic and Indo-Pacific since the Miocene-Pliocene transition. Mol Biol Evol. 22(3):570-581. https://doi.org/10.1093/molbev/msi042 [ Links ]
LaJeunesse, TC, Smith, RT, Finney, J, Oxenford, H. 2009. Outbreak and persistence of opportunistic symbiotic dinoflagellates during the 2005 Caribbean mass coral ‘bleaching’ event. Proc Royal Soc B Biol Sci. 276:4139-4148. https://doi.org/10.1098/rspb.2009.1405 [ Links ]
Le Tissier, MDA. 1990. The ultrastructure of the skeleton and skeletogenic tissues of the temperate coral Caryophyllia smithii. J Mar Biol Assoc UK. 70(2):295-310. https://doi.org/10.1017/S0025315400035414 [ Links ]
Le Tissier, MDA. 1991. The nature of the skeleton and skeletogenic tissues in the Cnidaria. Hydrobiologia. 216(1):397-402. https://doi.org/10.1007/BF00026492 [ Links ]
Levas, S, Grottoli, AG, Schoepf, V, Aschaffenburg, M, Baumann, J, Bauer, JE, Warner, ME. 2016. Can heterotrophic uptake of dissolved organic carbon and zooplankton mitigate carbon budget deficits in annually bleached corals? Coral Reefs. 35:495-506. https://doi.org/10.1007/s00338-015-1390-z [ Links ]
Levas, S, Schoepf, V, Warner, ME, Aschaffenburg, M, Baumann, J, Grottoli, AG. 2018. Long-term recovery of Caribbean corals from bleaching. J Exp Mar Biol Ecol. 506:124-134. https://doi.org/10.1016/j.jembe.2018.06.003 [ Links ]
Lough, JM, Anderson, KD, Hughes, TP. 2018. Increasing thermal stress for tropical coral reefs: 1871-2017. Sci Rep. 8:6079. https://doi.org/10.1038/s41598-018-24530-9 [ Links ]
Marshall, PA, Baird, AH. 2000. Bleaching of corals on the Great Barrier Reef: differential susceptibilities among taxa. Coral Reefs. 19:155-163. https://doi.org/10.1007/s003380000086 [ Links ]
Mayfield, AB, Chen, YJ, Lu, CY, Chen, CS. 2018. The proteomic response of the reef coral Pocillopora acuta to experimentally elevated temperatures. Plos one. 13:e0192001. https://doi.org/10.1371/journal.pone.0192001 [ Links ]
McLachlan, RH, Price, JT, Solomon, SL, Grottoli, AG. 2020. Thirty years of coral heat-stress experiments: a review of methods. Coral Reefs. 39:885-902. https://doi.org/10.1007/s00338-020-01931-9 [ Links ]
Mieog, JC, van-Oppen, MJH, Cantin, NE, Stam, WT, Olsen, JL. 2007. Real-time PCR reveals a high incidence of Symbiodinium clade D at low levels in four scleractinian corals across the Great Barrier Reef: implications for symbiont shuffling. Coral Reefs. 26:449-457. https://doi.org/10.1007/s00338-007-0244-8 [ Links ]
Moya, A, Ganot, P, Furla, P, Sabourault, C. 2012. The transcriptomic response to thermal stress is immediate, transient and potentiated by ultraviolet radiation in the sea anemone Anemonia viridis. Mol Ecol. 21(5):1158-1174. https://doi.org/10.1111/j.1365-294X.2012.05458.x [ Links ]
Muller-Parker, G, D’Elia, CF, Cook, CB. 2015. Interactions between corals and their symbiotic algae. In: Birkeland, C (ed.), Coral Reefs in the Anthropocene. Dordrecht (Netherlands): Springer. p. 99-116. https://doi.org/10.1007/978-94-017-7249-5_5 [ Links ]
Oakley, CA, Durand, E, Wilkinson, SP, Peng, L, Weis, VM, Grossman, AR, Davy, SK. 2017. Thermal shock induces host proteostasis disruption and endoplasmic reticulum stress in the model symbiotic cnidarian Aiptasia. J Proteome Res. 16(6):2121-2134. https://doi.org/10.1021/acs.jproteome.6b00797 [ Links ]
Olguín-López, N., Hérnandez-Elizárraga, VH., Hernández-Matehuala, R., Cruz-Hernández, A., Guevara-González, R., Caballero-Pérez, J., Ibarra-Alvarado, C., Rojas-Molina, A. 2019. Impact of El Niño-Southern Oscillation 2015-2016 on the soluble proteomic profile and cytolytic activity of Millepora alcicornis (“fire coral”) from the Mexican Caribbean. PeerJ Aquat Biol. 7:e6593. https://doi.org/10.7717/peerj.6593/supp-1 [ Links ]
Oliver, JK, Berkelmans, R, Eakin, CM. 2009. Coral bleaching in space and time. In: van-Oppen, MJH., Lough, J.M. (eds.), Coral Bleaching. Berlin, Heidelberg (Germany): Springer. p. 21-39. https://doi.org/10.1007/978-3-540-69775-6_3 [ Links ]
Oliver, TA, Palumbi, SR. 2011. Many corals host thermally resistant symbionts in high-temperature habitat. Coral Reefs. 30:241-250. https://doi.org/10.1007/s00338-010-0696-0 [ Links ]
Pereira-Dias, TL, Gondim, AI. 2016. Bleaching in scleractinians, hydrocorals, and octocorals during thermal stress in a northeastern Brazilian reef. Mar Biodivers. 46:303-307. https://doi.org/10.1007/s12526-015-0342-8 [ Links ]
Reynolds, JM, Bruns, BU, Fitt, WK, Schmidt, GW. 2008. Enhanced photoprotection pathways in symbiotic dinoflagellates of shallow-water corals and other cnidarians. PNAS. 105(36):13674-13678. https://doi.org/10.1073/pnas.0805187105 [ Links ]
Ricaurte, M, Schizas, NV, Ciborowski, P, Boukli, NM. 2016. Proteomic analysis of bleached and unbleached Acropora palmata, a threatened coral species of the Caribbean. Mar Poll Bull. 107(1):224-232. https://doi.org/10.1016/j.marpolbul.2016.03.068 [ Links ]
Rodriguez‐Lanetty, M, Harii, S, Hoegh‐Guldberg, O. 2009. Early molecular responses of coral larvae to hyperthermal stress. Mol Ecol. 18(24):5101-5114. https://doi.org/10.1111/j.1365-294X.2009.04419.x [ Links ]
Rodríguez, L, López, C, Casado-Amezua, P, Ruiz-Ramos, DV, Martínez, B, Banaszak, A, Tuya, F, García-Fernández, A, Hernández, M. 2019. Genetic relationships of the hydrocoral Millepora alcicornis and its symbionts within and between locations across the Atlantic. Coral Reefs. 38:255-268. https://doi.org/10.1007/s00338-019-01772-1 [ Links ]
Rojas-Molina, A, García-Arredondo, A, Ibarra-Alvarado, C, Bah, MM. 2012. Millepora (“fire corals”) species: toxinological studies until 2011. Adv Env Res. 26:133-48. [ Links ]
Ruiz-Jones, LJ, Palumbi, SR. 2017. Tidal heat pulses on a reef trigger a fine-tuned transcriptional response in corals to maintain homeostasis. Sci Adv. 3(3):e1601298. https://doi.org/10.1126/sciadv.1601298 [ Links ]
Salgado, A, Vieiralves, T, Lamarão, FR, Assumpção, LL, Gomes, D, Jascone, L, Valadão, AL, Albano, RM, Lôbo-Hajdu, G. 2007. Field preservation and optimization of a DNA extraction method for Porifera. In: Custodio, M.R., LôboHajdu, G., Hajdu, E, Muricy, G. (eds.), Porifera research: biodiversity, innovation and sustainability. Rio de Janeiro (Brazil): Série Livros 28, Museu Nacional. p. 555-560. [ Links ]
Sampayo, EM, Ridgway, T, Bongaerts, P, Hoegh-Guldberg, O. 2008. Bleaching susceptibility and mortality of corals are determined by fine-scale differences in symbiont type. PNAS. 105(30):10444-10449. https://doi.org/10.1073/pnas.0708049105 [ Links ]
Santos, SR, Shearer, TL, Hannes, AR, Coffroth, MA. 2004. Fine-scale diversity and specificity in the most prevalent lineage of symbiotic dinoflagellates (Symbiodinium, Dinophyceae) of the Caribbean. Mol Ecol. 13(2):459-469. https://doi.org/10.1046/j.1365-294x.2003.02058.x [ Links ]
Schoepf, V, Grottoli, AG, Levas, SJ, Aschaffenburg, MD, Baumann, JH, Matsui, Y, Warner, ME. 2015. Annual coral bleaching and the long-term recovery capacity of coral. Proc R Soc B. 282:20151887. https://doi.org/10.1098/rspb.2015.1887 [ Links ]
Shirur, KP, Ramsby, BD, Iglesias-Prieto, R, Goulet, TL. 2014. Biochemical composition of Caribbean gorgonians: Implications for gorgonian - Symbiodinium symbiosis and ecology. J Exp Mar Biol Ecol. 461:275-285. https://doi.org/10.1016/j.jembe.2014.08.016 [ Links ]
Silverstein, RN, Cunning, R, Baker, AC. 2015. Change in algal symbiont communities after bleaching, not prior heat exposure, increases heat tolerance of reef corals. Glob Chang Biol. 21(1):236-249. https://doi.org/10.1111/gcb.12706 [ Links ]
Suggett, DJ, Smith, DJ. 2020. Coral bleaching patterns are the outcome of complex biological and environmental networking. Glob Chang Biol. 26(1):68-79. https://doi.org/10.1111/gcb.14871 [ Links ]
Swain, TD, Westneat, MW, Backman, V, Marcelino, LA. 2018. Phylogenetic analysis of symbiont transmission mechanisms reveal evolutionary patterns in thermotolerance and host specificity that enhance bleaching resistance among vertically transmitted Symbiodinium. Eur J Phycol. 53(4):443-459. https://doi.org/10.1080/09670262.2018.1466200 [ Links ]
Tambutté, E, Tambutté, S, Segonds, N, Zoccola, D, Venn, A, Erez, J, Allemand, D. 2012. Calcein labelling and electrophysiology: insights on coral tissue permeability and calcification. Proc Royal Soc B Biol Sci. 279:19-27. https://doi.org/10.1098/rspb.2011.0733 [ Links ]
Tremblay, P, Gori, A, Maguer, JF, Hoogenboom, M, Ferrier-Pagès, C. 2016. Heterotrophy promotes the re-establishment of photosynthate translocation in a symbiotic coral after heat stress. Sci Rep. 6:srep38112. https://doi.org/10.1038/srep38112 [ Links ]
Venn, AA, Loram, JE, Douglas, AE. 2008. Photosynthetic symbioses in animals. J Exp Bot. 59(5):1069-1080. https://doi.org/10.1093/jxb/erm328 [ Links ]
Wagner, DE, Kramer, P, van-Woesik, R. 2010. Species composition, habitat, and water quality influence coral bleaching in southern Florida. Mar Ecol Prog Ser. 408:65-78. https://doi.org/10.3354/meps08584 [ Links ]
Yellowlees, D, Rees, TAV, Leggat, W. 2008. Metabolic interactions between algal symbionts and invertebrate hosts. Plant Cell Environ. 31(5):679-694. https://doi.org/10.1111/j.1365-3040.2008.01802.x [ Links ]
Recibido: 30 de Junio de 2021; Aprobado: 18 de Septiembre de 2022











 text in
text in 



