Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.49 Ensenada Jan./Dec. 2023 Epub Dec 08, 2023
https://doi.org/10.7773/cm.y2023.3355
Artículos
Composición y diversidad espaciotemporal de la comunidad de aves acuáticas en la laguna de las Ilusiones, Tabasco, México
1Universidad Juárez Autónoma de Tabasco, División Académica de Ciencias Biológicas, Laboratorio de Vertebrados, 86039 Villahermosa, Tabasco, Mexico.
2Universidad Autónoma de Baja California, Facultad de Ciencias, 22860 Ensenada, Baja California, Mexico.
3Universidad Juárez Autónoma de Tabasco, División Académica de Ciencias Biológicas, Laboratorio de Ecología del Paisaje y Cambio Global, 86039 Villahermosa, Tabasco, Mexico.
4Universidad Juárez Autónoma de Tabasco, División Académica de Ciencias Biológicas, Laboratorio de Diagnóstico y Manejo de Humedales Tropicales, 86039 Villahermosa, Tabasco, Mexico.
En la laguna de las Ilusiones, Villahermosa, Tabasco, México, las especies de aves interactúan con elementos antrópicos del paisaje. Se realizaron avistamientos de aves acuáticas con el método de conteo por punto fijo durante la temporada de secas y de lluvias del año 2020 en 12 sitios de muestreo en la laguna. Se registraron variables urbanísticas, físicoquímicas del agua, de vegetación y de macrohábitats para evaluar su influencia en las aves acuáticas. Se registró un total de 1,134 individuos pertenecientes a 8 órdenes, 12 familias y 25 especies. Las especies más avistadas fueron Ardea alba, Egretta thula y Butorides virescens. La diversidad de especies (índice de Shannon) fue mayor en la temporada de secas (H = 2.40 bits) y menor en la temporada de lluvias (H = 1.89 bits). El análisis canónico demostró que la riqueza de especies disminuyó a medida que incrementó el porcentaje de urbanización en las inmediaciones de los sitios de muestreo.
Palabras clave: humedal urbano; especies indicadoras; macrohábitat de dosel arbóreo-pasto; urbanización del paisaje; vegetación ribereña
In Laguna de las Ilusiones, Villahermosa, Tabasco, Mexico, bird species interact with the anthropic elements of the landscape. Waterfowl sightings were made with the fixed-point counting method during the dry and rainy seasons of the year 2020 at 12 sampling sites in the lagoon. Urban, water physicochemical, vegetation, and macrohabitat variables were recorded at these sites to assess their influence on waterfowl. A total of 1,134 individuals belonging to 8 orders, 12 families, and 25 species were recorded. The most sighted species were Ardea alba, Egretta thula, and Butorides virescens. Species diversity (Shannon index) was higher in the dry season (H = 2.40 bits) and lower in the rainy season (H = 1.89 bits). The canonical analysis showed that species richness decreased as the percentage of urbanization in the vicinity of the sampling sites increased.
Key words: urban wetland; indicator species; canopy-grass macrohabitat; landscape urbanization; riparian vegetation
INTRODUCCIÓN
Pese a sufrir un alto grado de perturbación, los humedales urbanos en México aún brindan refugio a una gran variedad de especies de aves (Berlanga et al. 2019).
En el estado de Tabasco, México, se encuentran registradas 326 especies de aves (CONABIO 2021), aproximadamente un tercio de las existentes en todo el país, y una cuarta parte corresponde a especies con afinidad acuática que depende de los humedales para su supervivencia (Ruiz-Campos et al. 2005, Mera-Ortiz et al. 2016). En el municipio de Centro, Tabasco, el 35.9% de la superficie pertenece a algún tipo de humedal (López 2019), pero muchos de los humedales han sido rodeados por la urbanización acelerada en las últimas décadas. Uno de estos humedales es la laguna de las Ilusiones, que fue decretada Área Natural Protegida en 1995 y está localizada en el interior de la ciudad de Villahermosa (Ricárdez-de la Cruz et al. 2016, Secretaría de Gobierno 2019). Sin embargo, las condiciones ecológicas de la laguna ya se habían comenzado a modificar fuertemente a partir de 1982 con el vertimiento de aguas residuales domésticas de las zonas aledañas, que afectaron la calidad del agua y generaron asolvamiento lacustre (Ricárdez-de la Cruz et al. 2016); esta situación no ha cambiado pese a su estatus de Área Natural Protegida. Su plan de manejo apenas fue publicado en el Periódico Oficial en 2019, donde se establecen los estudios necesarios para poder establecer acciones para su conservación que aún no se han hecho.
El incremento de la urbanización y el aislamiento de la laguna de su tributario río Carrizal han favorecido condiciones hipereutróficas por la entrada de contaminantes orgánicos e inorgánicos, así como la introducción de especies oportunistas (Sánchez et al. 2019, Salcedo et al. 2022). Aunado a lo anterior, cambios hidrológicos en la laguna pueden modificar la composición de las aves acuáticas, dado que niveles altos de inundación generan restricciones morfológicas en las aves vadeadoras para el éxito de alimentación (Castro-Tavares et al. 2015) o bien dificultan el forrajeo de las especies buceadoras que tienden a evitar las aguas profundas debido al riesgo de depredación (Castro-Tavares et al. 2015). Todas estas alteraciones antropogénicas en la laguna no han sido documentadas, y es importante evaluar su relación con la composición y la diversidad de las aves acuáticas a escala espaciotemporal.
MATERIALES Y MÉTODOS
Área de estudio
La laguna de las Ilusiones (Fig. 1) se localiza en la zona centro-norte de la ciudad de Villahermosa, Tabasco (Secretaría de Gobierno 2019), en la zona metropolitana de Villahermosa (Hansen et al. 2007). Esta laguna se ubica en la planicie del río Grijalva (Secretaría de Gobierno 2019) y su área corresponde a 259.2 ha, con un perímetro de 41.0 km, aproximadamente (Magaña 1988, Ricárdez-de la Cruz et al. 2016). Predomina el clima cálido-húmedo, con temperatura y precipitación media anual de 28.1 °C y 233.8 mm, respectivamente (Secretaría de Gobierno 2019). Temporalmente, se distinguen 3 periodos: lluvias (junio-noviembre), nortes (diciembre-marzo) y secas (abril-junio) (van Der Wal et al. 2012). El presente estudio se realizó en 2020, y durante los meses de cuarentena estricta por la pandemia (abril, mayo, junio y julio), no se pudieron realizar los muestreos necesarios, por lo que los monitoreos se redujeron a 2 temporadas: secas (enero, febrero y marzo) y lluvias (agosto, septiembre, octubre, noviembre y diciembre).

Figura 1 Mapa de la localización de la laguna de las Ilusiones, Villahermosa, Tabasco, México, donde se ubican los 12 sitios de monitoreo. El color negro indica los sitios no urbanizados (1, 3, 7 y 12), y el color blanco, los sitios urbanizados (2, 4, 5, 6, 8, 9, 10 y 11).
Las principales fuentes de agua son el escurrimiento y la precipitación debido al aislamiento con su tributario, el río Carrizal (Hansen et al. 2007, Sánchez et al. 2019). La profundidad determinada en este estudio varió de 0.50 a 2.80 m (promedio 1.86 m). Los parámetros físicoquímicos se tomaron a menos de 0.50 m de profundidad. El vaso Cencali, que se encuentra dentro de la laguna de las Ilusiones, es una de las zonas más afectadas por los escurrimientos urbanos y las descargas de aguas residuales (Hansen et al. 2007), donde según estudios ecotoxicológicos de los sedimentos, la vida acuática del ecosistema está afectada en más del 65% (Hansen et al. 2007).
De la vegetación ribereña, destacan las especies arbóreas Andira galeottiana Standl., Inga vera Willd. y Ceiba pentandra (L.) Gaertn. La vegetación hidrófila está dominada por Typha latifolia L., Pontederia sagittata C. Presl y Phragmites australis (Cav.) Trin. ex Steud. La vegetación secundaria se compone principalmente de Hampea rovirosae Standl., Tabernaemontana alba Mill. y Malvaviscus arboreus Cav. Entre las especies introducidas, sobresale Cocos nucifera L. (Secretaría de Gobierno 2019); también se encuentran especies de pastizal como Panicum maximum Jacq. y Paspalum virgatum L. (Magaña 1988). La fauna acuática representativa de la laguna incluye el manatí (Trichechus manatus Linnaeus) y el cocodrilo de pantano (Crocodylus moreletii Duméril y Bibron) (Secretaría de Gobierno 2019), así como la mojarra colorada (Vieja bifasciata Steindachner) y la mojarrita boca de fuego (Thorichthys meeki Brind) (Sánchez et al. 2019).
Muestreo de aves
Se seleccionaron 12 sitios de muestreo de aves de acuerdo con su disponibilidad de acceso alrededor de la laguna, mismos que estuvieron separados entre sí por una distancia aproximada de 500.0 m (Ralph et al. 1996). Los avistamientos se realizaron 2 días consecutivos por mes y se cubrieron 2 temporadas climáticas contrastantes, la de secas (enero, febrero y marzo de 2020) y la de lluvias (agosto, septiembre, octubre, noviembre y diciembre de 2020).
Se usó el método de conteo por punto fijo (Ralph et al. 1996). En cada sitio se estableció un punto de conteo sin prefijar un radio, en donde se registraron todos los individuos de cada especie vista durante 15 min. Sólo se registraron las aves posadas sobre alguna superficie del hábitat (elemento natural, superficie del agua o estructura urbana), y no se consideraron las aves en vuelo (Salido 2000). El horario de muestreo fue entre las 6:00 A.M. y las 11:00 A.M., y se utilizaron binoculares (10 × 42 mm) para la ayuda en la identificación de las aves.
En la identificación de los organismos registrados se usó el apoyo de las guías de Howell y Webb (1995), National Geographic (Dunn 2006) y Peterson y Chalif (2008). La nomenclatura y el arreglo sistemático de las especies se determinaron de acuerdo con la AOU (1998), actualmente American Ornithological Society, y los suplementos publicados en The Auk: An International Journal of Ornithology, como el 62 (Chesser 2021), 2009-C-2, 2010-C-9 y 2013-C-4. La clasificación de los gremios alimenticios de las especies registradas se basó en Arriaga-Weiss et al. (2008) y Wilman et al. (2014). El estatus de conservación de las especies fue basado en la NOM-059-SEMARNAT-2010 (SEMARNAT 2010). La temporalidad de las especies fue descrita de acuerdo con Ruiz-Campos et al. (2005).
Los atributos de la comunidad considerados fueron calculados mediante varios índices ecológicos. Para la diversidad alfa, se emplearon el índice Chao2, que tiene un sesgo mínimo con muestras pequeñas (Moreno 2001), y los índices de dominancia de Simpson (Moreno 2001). Para la diversidad beta, se empleó el índice de similitud de especies de Bray-Curtis, tanto entre sitios como entre meses de muestreo. Para determinar las especies que tipifican la comunidad aviar, se utilizó el índice de valor biológico propuesto por Sanders (1960), el cual considera la importancia de las especies en términos de abundancia y frecuencia espaciotemporal de las especies.
En cada sitio se caracterizaron variables de urbanización del paisaje, parámetros fisicoquímicos de la laguna y el tipo de vegetación en el mismo horario de los avistamientos de aves, pero con un día de diferencia (Bolduc y Afton 2004). Las variables de urbanización estimadas fueron las siguientes: número de personas en tránsito por minuto (Germain et al. 2008), número de autos en circulación por minuto (Germain et al. 2008), número y altura de edificios aledaños en un radio de 20.0 m (Traut y Hostetler 2004), número de calles aledañas (Rojas et al. 2015) y su distancia al sitio. La categorización de variables de urbanización del paisaje se verificó en campo y se representó mediante el software QGIS v.3.16.13 (QGIS 2021). Asimismo, se determinó el porcentaje de urbanización de cada sitio con estas 6 variables y el número de árboles, el número de arbustos y la cobertura (Fig. 1).
Se registró la vegetación terrestre y la vegetación acuática en un radio de 5.0 m desde la orilla, y se estimó en porcentaje. Asimismo, se contabilizaron los árboles y se midió el porcentaje de cobertura arbórea en un radio de 20.0 m (Germain et al. 2008), con un densiómetro GRS y uno esférico. La vegetación terrestre se clasificó en dosel arbóreo (solo dosel de aquí en adelante, >3.0 m de altura), sotobosque (<0.5 m de altura) o pasto (área con pasto nativo o inducido) (Traut y Hostetler 2004). Además, se cuantificaron cada uno de los árboles y arbustos; para el pasto, se calculó su proporción de acuerdo con el área en un radio de 20.0 m alrededor del sitio. La vegetación acuática se clasificó en tipo flotante, alta emergente (>1.0 m de alto) y baja emergente (<1.0 m de alto) (Traut y Hostetler 2004). Por último, se registró el tipo de sustrato (estructura o elemento del hábitat) en que se encontró cada ave.
Los macrohábitats del paisaje adyacentes a los sitios de muestreo fueron considerados con base en el criterio siguiente: las características distintivas de las asociaciones de vegetación del área de estudio representan las unidades del paisaje (Murrieta-Galindo et al. 2013). Con base en lo anterior, se distinguieron 3 macrohábitats: (a) sotobosque (sitios con valores promedio mayores que el 70% de área cubierta por sotobosque); (b) borde entre arbolado y pasto (sitios con valores promedio mayores que el 30% de dosel, mayores que el 10% de pasto, menores que el 70% de sotobosque y menores que el 70% de vegetación acuática); y (c) vegetación acuática (sitios con valores promedio mayores que el 70% de vegetación acuática).
El registro in situ de las variables fisicoquímicas del agua de la laguna se realizó una vez por temporada (secas: enero de 2020; lluvias: diciembre de 2020). Para la medición de la profundidad en metros, se empleó una ecosonda marca Hondex PS-7. El potencial de hidrógeno (pH) se midió con un potenciómetro portátil Hanna modelo HI98107. La temperatura del agua fue registrada en grados centígrados con un termómetro de mercurio, y la transparencia del agua fue registrada en metros con un disco de Secchi (INVEMAR 2003). Las anteriores mediciones fueron realizadas a 1.0 m de la orilla de la laguna, aproximadamente. La recolecta de muestras del sedimento se realizó con ayuda de una draga tipo Petersen y desde una lancha; para la cuantificación de su clase textural, se empleó el método de Bouyoucos (Barbeito y Bono 2006).
Análisis de datos
Para determinar la relación de las variables antropogénicas, de vegetación y fisicoquímicas en la abundancia total de especies por macrohábitat, los gremios tróficos y el número de especies por macrohábitat en las 2 temporadas, se utilizó un análisis canónico (Badii et al. 2007) con el paquete estadístico PAST v.3.25 (Hammer et al. 2001).
RESULTADOS
Durante los meses de monitoreo, se registró un total de 1,134 individuos de 25 especies de aves acuáticas pertenecientes a 12 familias y 8 órdenes. De las especies observadas, 17 son residentes permanentes y 8 son visitantes estacionales (Tabla 1). Las especies con mayor frecuencia de avistamiento fueron Ardea alba, con 422 individuos; Egretta thula, con 180 individuos; y Butorides virescens, con 163 individuos. Spatula discors, Aramus guarauna y Thalasseus maximus fueron las especies menos comunes, con 2 individuos cada una (Tabla 2).
Tabla 1 Registro de aves acuáticas de la laguna de las Ilusiones durante la época de secas y la época de lluvias de 2020, donde la columna de abundancia indica el número de individuos registrados por cada especie. Los registros indican el número de meses en los que se registró cada especie. La estacionalidad está clasificada como Rp = residente permanente y Ve = visitante estacional; la clasificación de la NOM-059 es A = amenazada y Pr = sujeta a protección especial. La última columna indica la clasificación de la lista roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN R.L., por sus singlas en inglés), donde todas las especies se encuentran dentro de la categoría LC = preocupación menor.
| Order | Family | Species | AOS name |
Abundance | Records | Food guild |
Seasonality | NOM-059 | IUCN R.L. |
| Anseriformes | Anatidae | Dendrocygna autumnalis | Black-bellied W histling-duck | 25 | 6 | Omnivore | Rp | LC | |
| Anseriformes | Anatidae | Spatula discors | Blue-winged Teal | 2 | 1 | Omnivore | Ve | LC | |
| Ciconiiformes | Ciconiidae | Mycteria americana | Wood Stork | 3 | 2 | Piscivore | Ve | Pr | LC |
| Suliformes | Phalacrocoracidae | Nannopterum brasilianum | Neotropic Cormorant | 54 | 8 | Piscivore | Rp | LC | |
| Suliformes | Anhingidae | Anhinga anhinga | Anhinga | 24 | 6 | Piscivore | Rp | LC | |
| Pelecaniformes | Pelecanidae | Pelecanus occidentalis | Brown Pelican | 6 | 2 | Piscivore | Ve | LC | |
| Pelecaniformes | Ardeidae | Ardea herodias | Great Blue Heron | 22 | 7 | Piscivore | Rp | LC | |
| Pelecaniformes | Ardeidae | Ardea alba | Great Egret | 422 | 8 | Piscivore | Rp | LC | |
| Pelecaniformes | Ardeidae | Egretta thula | Snowy Egret | 180 | 8 | Omnivore | Rp | LC | |
| Pelecaniformes | Ardeidae | Egretta caerulea | Little Blue Heron | 12 | 5 | Piscivore | Rp | LC | |
| Pelecaniformes | Ardeidae | Egretta tricolor | Tricoloured Heron | 17 | 5 | Piscivore | Rp | LC | |
| Pelecaniformes | Ardeidae | Butorides virescens | Green Heron | 163 | 8 | Piscivore | Rp | LC | |
| Pelecaniformes | Ardeidae | Nycticorax nycticorax | Little Blue Heron | 54 | 8 | Piscivore | Rp | LC | |
| Pelecaniformes | Ardeidae | Nyctanassa violacea | Yellow-crowned Night-heron | 2 | 2 | Piscivore | Ve | LC | |
| Accipitriformes | Pandionidae | Pandion haliaetus | Osprey | 2 | 2 | Piscivore | Ve | LC | |
| Gruiformes | Aramidae | Aramus guarauna | Limpkin | 2 | 1 | Omnivore | Rp | A | LC |
| Charadriiformes | Jacanidae | Jacana spinosa | Northern Jacana | 22 | 7 | Omnivore | Rp | LC | |
| Charadriiformes | Scolopacidae | Actitis macularius | Spotted Sandpiper | 12 | 6 | Piscivore | Rp | LC | |
| Charadriiformes | Scolopacidae | Calidris minutilla | Least Sandpiper | 3 | 3 | Piscivore | Ve | LC | |
| Charadriiformes | Laridae | Leucophaeus atricilla | Laughing Gull | 27 | 5 | Piscivore | Rp | LC | |
| Charadriiformes | Laridae | Hydroprogne caspia | Caspian Tern | 16 | 3 | Piscivore | Ve | LC | |
| Charadriiformes | Laridae | Thalasseus maximus | Royal Tern | 2 | 1 | Piscivore | Ve | LC | |
| Coraciiformes | Alcedinidae | Megaceryle torquata | Ringed Kingfisher | 18 | 6 | Piscivore | Rp | LC | |
| Coraciiformes | Alcedinidae | Chloroceryle amazona | Amazon Kingfisher | 17 | 5 | omnivore | Rp | LC | |
| Coraciiformes | Alcedinidae | Chloroceryle americana | Green Kingfisher | 27 | 7 | Piscivore | Rp | LC |
Tabla 2 Puntajes obtenidos del índice de valor biológico (BVI) entre los 8 meses de monitoreo (época de secas y lluvias) de las aves acuáticas de la laguna de las Ilusiones. IMP/BVI corresponde al orden de importancia de acuerdo con el puntaje de BVI; IMB/ABT, al orden de importancia de acuerdo con el valor de abundancia total; y ABT, la abundancia total por especie.
| Score matrix | IMP | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |||||
| Species | January | February | March | August | September | October | November | December | BVI | IBVI | ABT | ABT |
| Ardea alba | 9 | 11 | 6 | 5 | 6 | 6 | 9 | 3 | 55 | 1 | 1 | 422 |
| Egretta thula | 8 | 10 | 5 | 4 | 5 | 5 | 8 | 2 | 47 | 2 | 2 | 180 |
| Butorides virescens | 7 | 9 | 4 | 3 | 4 | 4 | 7 | 1 | 39 | 3 | 3 | 163 |
| Nannopterum brasilianum | 6 | 8 | 3 | 2 | 3 | 3 | 6 | 0 | 31 | 4 | 4 | 54 |
| Nycticorax nycticorax | 5 | 7 | 2 | 1 | 2 | 2 | 5 | 0 | 24 | 5 | 4 | 54 |
| Leucophaeus atricilla | 5 | 6 | 1 | 0 | 1 | 2 | 5 | 0 | 20 | 6 | 5 | 27 |
Con respecto a su estatus de conservación, 2 especies están catalogadas en la NOM-059-SEMARNAT-2010 (SEMARNAT 2010); Aramus guarauna está catalogada como amenazada y Mycteria americana está sujeta a protección especial (Tabla 1). El resto de las especies no se encuentra catalogado dentro de esta norma oficial.
El mayor número de avistamientos (n = 251), que en su mayoría fueron de especies residentes, se registró en diciembre de 2020, seguido de febrero y marzo, con 155 y 152 avistamientos, respectivamente (Fig. 2). Diciembre correspondió a la temporada de lluvias; no obstante, en la temporada de lluvias se registró la menor cantidad de avistamientos (octubre, n = 87). En los avistamientos por sitio de muestreo (Fig. 3), destacó el sitio 4 por su mayor cantidad (n = 246), seguido del sitio 12 (n = 147); el sitio 11 presentó el menor número de avistamientos (n = 21). El total de esfuerzo de muestreo invertido en los 8 meses de estudio representó el 96.0% de acumulación de especies registradas de acuerdo con el estimador Chao 2 (Fig. 4).

Figura 2 Avistamientos de aves acuáticas dentro de la laguna de las Ilusiones, donde el eje x muestra los meses de monitoreo de aves, y el eje y, el número de avistamientos de aves acuáticas observadas durante 2020 (n = 1,134).

Figura 3 Avistamientos de aves acuáticas dentro de la laguna de las Ilusiones, donde el eje x muestra los sitios de monitoreo de aves, y el eje y, el número de avistamientos de aves acuáticas observadas durante 2020 (n = 1,134).

Figura 4 Curva de acumulación de especies. Se muestran los datos calculados y los datos esperados, de acuerdo con el estimador Chao 2, sobre las aves acuáticas de la laguna de las Ilusiones, monitoreadas durante la época de secas y de lluvias de 2020.
Los gremios tróficos de las especies de aves destacados fueron 2, los piscívoros (n = 19 especies) y los omnívoros (n = 6 especies). El gremio de los piscívoros estuvo representado principalmente por miembros de las familias Pelecanidae, Gruidae, Accipitridae y Ciconiidae, mientras que el de los omnívoros estuvo representado por miembros de las familias Ardeidae y Anatidae (Tabla 1).
De acuerdo con los resultados obtenidos con el índice de Shannon, la comunidad de aves acuáticas presentó una diversidad media de especies (H = 2.18 bits), mientras que el índice de Simpson indicó una dominancia escasa de especies (D = 0.19). La diversidad de especies para cada temporada resultó en una diversidad media para la temporada de secas y una escasa diversidad de especies para la temporada de lluvias.
Para la diversidad de especies en cada sitio de monitoreo, el sitio 12 presentó la diversidad de especies mayor en comparación con los restantes sitios de muestreo. El sitio 4 resultó con la menor diversidad en contraste con todos los sitios de muestreo (Fig. 5). La similitud de especies fue mayor entre los sitios 6 y 7, ubicados en la porción este de la laguna, con un valor del 76.0% (Fig. 6). Las parejas de los sitios 5-9 y 6-10 registraron valores del 69.0% y 68.0%, respectivamente. En términos temporales, la temporada de lluvias registró la similitud mayor de especies, pues se obtuvo una similitud mayor entre noviembre y octubre (78.0%), seguido de septiembre y agosto (77.7%) y de octubre y septiembre (77.3%) (Fig. 7).
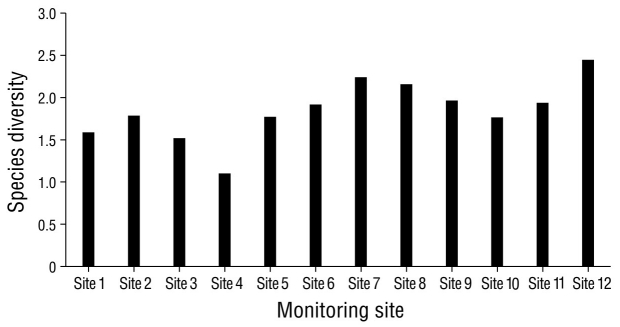
Figura 5 Diversidad de especies de aves acuáticas dentro de la laguna de las Ilusiones en los 12 sitios monitoreados durante el año 2020.
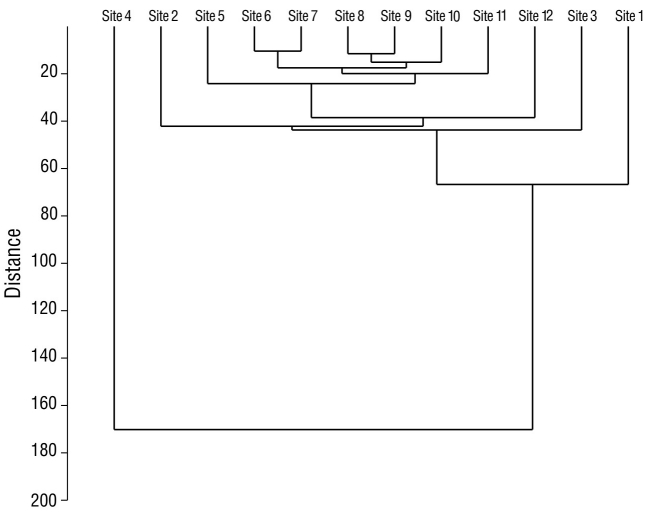
Figura 6 Similitud entre sitios de monitoreo de aves acuáticas de la laguna de las Ilusiones, dentro de los puntos de monitoreo, durante la época de secas y la época de lluvias en 2020.

Figura 7 Similitud entre meses de monitoreo de aves acuáticas de la laguna de las Ilusiones durante la época de secas y la época de lluvias.
Con base en el índice de valor biológico, las 6 especies más representativas, tanto en abundancia como en su presencia temporal (secas y lluvias), fueron Ardea alba, E. thula, B. virescens, Nannopterum brasilianum, Nycticorax nycticorax y Leucophaeus atricilla (Tabla 2). La abundancia de Ardea alba destacó con el primer lugar en diciembre (69.3%), seguida de la abundancia de E. thula en marzo (32.2%) y B. virescens en noviembre (23.3%).
De acuerdo con las variables urbanísticas registradas, en el sitio 3 transitó el mayor número de personas (9 personas·min-1). La mayor cantidad de tránsito de autos se registró para el sitio 6 (51 autos·min-1). La mayor distancia de calles aledañas se observó en el sitio 12 (250.0 m). Los sitios que presentaron un mayor porcentaje de cobertura arbórea fueron el 2 y el 12 (91.6%). El sitio 11 tuvo la mayor cantidad de edificios (15). El 8.3% de la cobertura correspondió a casas con una altura menor que 5.0 m; el 75.0% de la cobertura correspondió a casas con una altura mayor que 5.0 m; y el 16.5% de la cobertura restante no presentó edificios a su alrededor. Del total de sitios monitoreados, los sitios 1, 3, 7 y 12 presentaron un porcentaje de urbanización menor que el 50.0%, mientras que los sitios 2, 4-6 y 8-11 sumaron más del 50.0% de urbanización.
La vegetación terrestre en los sitios 3 y 10 resultó con la mayor representación del dosel (80.0%). En el sitio 3 hubo una mayor representación del sotobosque (30.0%). El sitio 12 tuvo el mayor porcentaje de pasto, con un 65.0%. Respecto a la vegetación acuática, el sitio 12 fue el único que presentó hojas flotantes y vegetación alta emergente, con el 10.0% de ambos tipos de hidrófitas. El sitio 12 también presentó el mayor porcentaje de vegetación baja emergente (10.0%), seguido del sitio 6 (5.0%) y el sitio 3 (3.0%), mientras que los sitios restantes no presentaron ningún tipo de vegetación acuática. El sitio 4 presentó la mayor cantidad de árboles (40 árboles), en contraste con el sitio 3, el cual presentó la mayor cantidad de arbustos (30 arbustos).
El macrohábitat que presentó los mayores registros de especies (17) correspondió al de la vegetación acuática (sitio 12), mismo sitio con características de urbanización menores en contraste con los restantes sitios de muestreo. Sin embargo, en el macrohábitat dosel-pasto (sitios 1-2 y 4-11) se obtuvo el mayor registro de individuos (877) (Fig. 8). En el macrohábitat de sotobosque (sitio 3), la mayoría de los individuos registrados usaron sustratos artificiales, y en el macrohábitat de vegetación acuática (sitio 12), la mayoría de los individuos hicieron mayor uso de sustratos naturales (Fig. 8). En el macrohábitat de vegetación acuática (sitio 12) fue registrada la mayor cantidad de especies que hacen uso de sustratos naturales; igualmente, el macrohábitat de dosel-pasto cuenta con una mayor presencia de aves con preferencia al sustrato natural y una escasa profundidad del agua (Fig. 9). En el macrohábitat de sotobosque la mayoría de las especies de aves prefieren usar el sustrato artificial (Fig. 9).
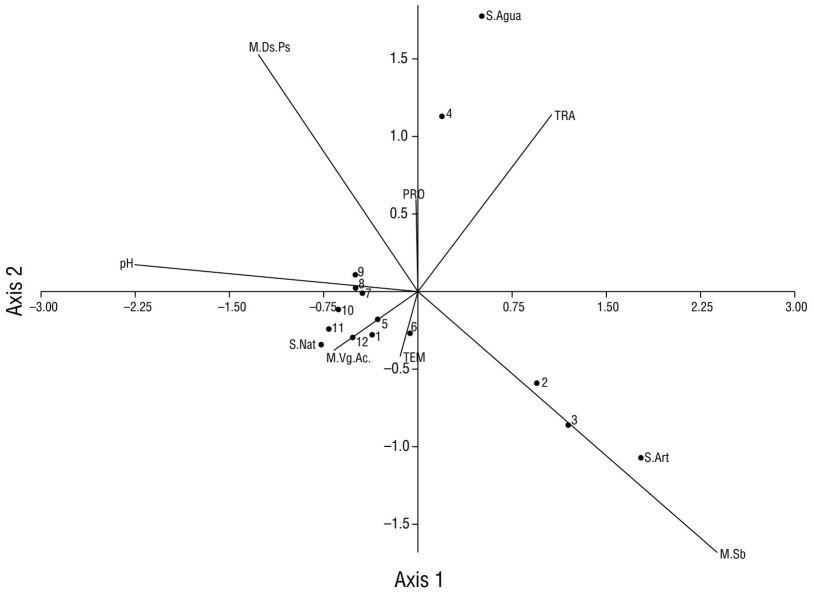
Figura 8 Gráfico de dispersión de la correlación canónica entre los tipos de macrohábitats registrados en la laguna de las Ilusiones (letras con la inicial M), los parámetros fisicoquímicos (letras mayúsculas) y el número de individuos de aves acuáticas en cada tipo de sustrato (letras con la inicial S) registrado en cada sitio de monitoreo (números del 1 al 12). M.Ds.Ps: macrohábitat de dosel-pasto; S.Agua: sustrato de agua; TRA: transparencia del agua; PRO: profundidad del agua; TEM: temperatura; S.Nat: sustrato natural; M.VgAc: macrohábitat de vegetación acuática; M.Sb: macrohábitat de sotobosque.

Figura 9 Gráfico de dispersión de la correlación canónica entre los tipos de macrohábitats registrados en la laguna de las Ilusiones (letras con la inicial M), los parámetros físico-químicos (letras mayúsculas) y el número de especies de aves acuáticas en cada tipo de sustrato (letras con la inicial S) registrado en cada sitio de monitoreo (números del 1 al 12). M.Ds.Ps: macrohábitat de dosel-pasto; S.Agua: sustrato de agua; TRA: transparencia; PRO: profundidad; TEM: temperatura; S.Art: sustrato artificial; S.Nat: sustrato natural; M.VgAc: macrohábitat de vegetación acuática; M.Sb: macrohábitat de sotobosque.
Respecto a los parámetros fisicoquímicos, el pH del agua se mantuvo de ligeramente básico a básico (7.7-8.9) en todos los sitios de monitoreo, así como en ambas temporadas. Durante la época de secas, la temperatura más alta del agua de la laguna fue registrada en el sitio 5 (25.90 °C); mientras que la mayor transparencia se registró en el sitio 6 (0.47 m), el sitio 7 fue el más profundo (2.80 m). Durante la época de lluvias, la temperatura mayor se registró en los sitios 5 y 7 (25.00 °C); en cuanto a la transparencia, en los sitios 4 y 7 se obtuvo la medida más alta (0.60 m), y la profundidad fue mayor en el sitio 7 (2.60 m) y la menor en el sitio 1 (0.50 m).
De acuerdo con el análisis de correlación canónica, los datos se ajustaron al modelo de correlación en un 100%. Este análisis resultó en que los sitios 1, 2, 4, 5, 7, 8, 9 y 11 están más relacionados a las aves piscívoras y asociados con el porcentaje de urbanización alto (>39.0%) (Fig. 10). El gremio de las aves omnívoras presentes en los sitios 3, 6, 10 y 12 resultaron con una asociación mayor con la vegetación terrestre (100%), con la mayor cobertura de vegetación acuática (>3.0%) y profundidad media (1.80-2.10 m). El sitio 12 registró la mayor relación con el pH básico (8.9), el menor porcentaje de urbanización y la mayor diversidad de especies (Fig. 10).
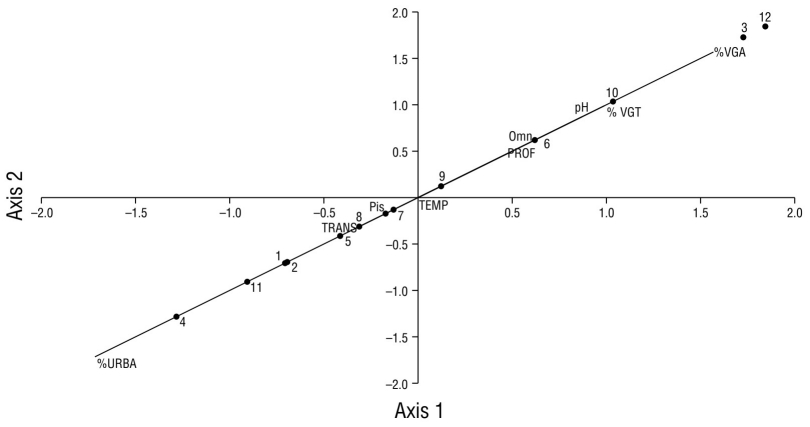
Figura 10 Gráfico de dispersión de la correlación canónica entre variables (mayúsculas), gremios de aves acuáticas (Pis = piscívoras, Omn = omnívoras), en la laguna de las Ilusiones y sitios de monitoreo (números). TEMP: temperatura del agua; %VGA: porcentaje de vegetación acuática; %VGT: porcentaje de vegetación terrestre; PROF: profundidad del agua; TRANS: transparencia del agua; URBA: porcentaje de urbanización.
DISCUSIÓN
En la comunidad avifaunística de la laguna de las Ilusiones, las especies más abundantes durante un ciclo anual en los sitios urbanizados y sin urbanización fueron Ardea alba, E. thula y B. virescens, especies con hábitos generalistas y residentes. En otros 3 hábitats lacustres del estado (Valdez-Leal et al. 2015), también se ha reportado a la especie Ardea alba entre las más comunes.
El 8.0% de las especies registradas en este estudio están dentro de la Norma Oficial Mexicana 059 (SEMARNAT 2010), donde destaca en la categoría de amenazada Aramus guarauna y en la categoría de sujeta a protección especial Mycteria americana; el resto de las especies se encuentra en el estatus de preocupación menor dentro de la lista roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN 2021).
La laguna es un ejemplo de la pérdida de conectividad permanente con los ríos de un cuerpo lagunar ocasionada por la expansión urbana (Palomeque-de la Cruz et al. 2017, Sánchez et al. 2019). Esta situación propició la hipereutrofización del sitio, favoreció la presencia de especies invasoras y ocasionó la pérdida de diversidad de especies de peces, que son alimento principal de las aves acuáticas piscívoras (Hansen et al. 2007, Sánchez et al. 2019, Salcedo et al. 2022). Dentro de los 2 gremios tróficos registrados, las especies de aves piscívoras fueron más abundantes (19) que las omnívoras (6). Esta condición podría deberse a una mayor disponibilidad del componente íctico, principalmente en la zona lacustre litoral, a pesar de que las poblaciones de peces en esta laguna están más afectadas por cambios en su ecosistema (Gurnellet et al. 2014, Sánchez et al. 2019).
En los sitios 3, 6, 10 y 12 se observó una mayor asociación de las aves omnívoras (e.g., Ardea alba, B. virescens, Nannopterum brasilianum y Nycticorax nycticorax). En estos sitios se registró una profundidad intermedia. Esto fue similar a los resultados del estudio de Castro-Tavares et al. (2015), en el cual se observó que la mayoría de los gremios presentaron una disminución de la abundancia con el aumento en la profundidad del agua.
Las aves piscívoras (e.g., E. thula, Jacana spinosa y Chloroceryle amazona) fueron más abundantes en los sitios 1, 2 y 4. Lo anterior fue asociado con un porcentaje de urbanización medio (50.0%) y una profundidad media (0.50-2.15 m); sin embargo, también se puede asociar con la mortandad alta de peces, que ocurre de forma recurrente en estos sitios (Hansen et al. 2007) y puede atraer a un mayor número de individuos de este gremio. Esta accesibilidad de alimento por los individuos muertos se puede atribuir a las condiciones hipertróficas y los contaminantes (Salcedo et al. 2022).
Los resultados obtenidos en la presente investigación fueron similares a los estudios de Ruiz-Campos et al. (2005) y Sánchez-Bon et al. (2010) realizados en humedales costeros del noroeste de México, donde se reportó un mayor número de especies de aves acuáticas en los meses de invierno debido al arribo de especies migratorias. En el presente estudio, los meses de invierno (enero a marzo) correspondieron a la temporada de secas. La similitud de especies entre meses fue mayor durante la temporada de lluvias debido a que la mayoría de las especies registradas durante esta temporada fueron residentes permanentes, a diferencia de la temporada de secas, donde hubo un mayor dinamismo de especies por migración.
La laguna presentó una diversidad media de especies y una baja dominancia, no obstante que las 3 especies más avistadas representaron el 67.1% de todas las especies presentes en la comunidad aviar. También fueron las especies más comunes y representativas del lugar, de acuerdo con el índice de valor biológico de Sanders.
La mayor similitud de especies registrada por el índice de Bray-Curtis (sitios 6 y 7) puede deberse a que estas especies prefieren visitar sitios cercanos, puesto que no comparten características físicoquímicas ni de urbanización. A diferencia de los sitios 6 y 7, los sitios 5 y 9 también mostraron una alta similitud, lo cual se podría deber a que mantienen variables similares y están influenciados por el porcentaje de urbanización alto y por la baja transparencia del agua, al igual que los sitios 6 y 10, donde las especies pueden verse influenciadas por características más allá de la cercanía, como un porcentaje de vegetación terrestre alto, porcentaje alto de vegetación acuática, pH medianamente alcalino, profundidad media y baja temperatura del agua (Andrade et al. 2018).
Durante ambas temporadas (lluvias y secas) 12 especies aportaron el 80.0% de la abundancia de individuos en la comunidad ornitológica, y de estas, las más importantes fueron Ardea alba, E. thula y B. virescens.
En febrero se presentó el mayor número de individuos debido a la adición de algunas especies visitantes estacionales, como Nyctanassa violacea, Pelecanus occidentalis y Mycteria americana, las cuales se observaron en sitios asociados a zonas urbanas (sitios 8 y 9) y no urbanizadas (sitio 12). Tanto Donaldson et al. (2007) como Burton (2007) señalaron que algunas especies prefieren lugares urbanizados por presentar una mayor disponibilidad de alimento o de cobertura vegetal para refugio o anidación. En ese sentido, la mayoría de las especies de aves en ambientes urbanos han desarrollado una mayor plasticidad ecológica, que las hace más tolerantes a los cambios ambientales (Abilhoa y Amorin 2017). Sin embargo, las zonas no urbanizadas en la laguna pueden representar refugios y nichos de reproducción para especies sensibles, particularmente durante el periodo de migración e invernada, debido a la ubicación del humedal (Berlanga et al. 2019). En el sitio 12, se observó una mayor diversidad de especies; este sitio se caracterizó por un menor grado de urbanización y una mayor cobertura de vegetación ribereña (100%) y vegetación acuática litoral flotante (30.0%).
Dentro de los sitios de muestreo, se registró un mayor número de avistamientos de especies generalistas en el sitio 1, debido a que algunas especies responden positivamente a la urbanización y a las descargas de aguas residuales (Rosa et al. 2003), ya que presentan menor transparencia y profundidad del agua. En este sentido, Kusch et al. (2008) señalaron que la diversidad de aves acuáticas en humedales está relacionada con las fluctuaciones del nivel de agua.
Se observó que, conforme disminuyó la cercanía de las calles y hubo una edificación mayor adyacente a los sitios de muestreo, disminuyó la riqueza de especies de aves, lo que concuerda con lo mencionado por Abilhoa y Amorin (2017). En este estudio, el sitio 11, ubicado en la zona noroeste de la laguna, se distingue por un alto porcentaje de urbanización (55.0%) y por el menor número de especies (11) y de avistamientos (21).
De manera opuesta al sitio 11, el sitio 12, ubicado en la zona noreste de la laguna, presentó la mayor cantidad de especies (17), lo que se puede asociar con la mayor cobertura de la vegetación acuática, el pastizal inundado y la presencia de estructuras artificiales menores. Esto, a su vez, se puede relacionar con el hecho de que la vegetación hidrófita brinda una mayor disponibilidad de alimento, refugio y anidación para las especies de hábitos limícolas o vadeadoras (Ruiz-Campos y Rodríguez-Meraz 1993).
La mayor parte de la orilla de la laguna destacó por la cubierta con pasto o árboles, por lo cual se relacionó con una mayor cantidad de sitios propios del macrohábitat de arbolado y pasto. En este contexto, el macrohábitat arbolado y pasto obtuvo el mayor registro de individuos, puesto que la mayoría de los sitios pertenecen a este.
En el macrohábitat de sotobosque en el sitio 3, la mayoría de las aves usaron los elementos artificiales. En el macrohábitat de vegetación acuática en el sitio 12, se registró la mayor cantidad de especies; es una zona con valor para las especies migratorias y residentes, pues las aves usan estos elementos naturales y aún no ha sido afectada por la urbanización.
Los estudios realizados en las lagunas de Villahermosa indican que las poblaciones de aves acuáticas disminuyen debido a las actividades antropogénicas (Rosado 2008). Sin embargo, no existen estudios previos para la laguna de las Ilusiones en este sentido, lo que destaca la presente contribución, puesto que el plan de manejo de la reserva ecológica no contiene suficiente información acerca de la fauna avícola.
Los resultados brindados por el presente estudio resaltan la importancia de la laguna como un ecosistema clave dentro de la ciudad de Villahermosa, ya que a pesar del desarrollo urbano que la rodea, todavía presenta sitios con un menor porcentaje de urbanización y escasa alteración de la vegetación hidrófita asociados a una mayor diversidad de especies. Lo anterior se observó en el sitio 12, donde se presentan alteraciones antropogénicas menores, mayor diversidad de especies y escasa presencia de especies generalistas. Contrariamente, tanto el mayor registro de especies generalistas como el mayor número de individuos registrados en los sitios 1 y 4, respectivamente, pueden estar asociados a la mortandad cíclica de peces, lo cual disminuye la competencia por alimento. Asimismo, el mayor uso de elementos artificiales registrados en los sitios 2 y 3 puede limitar a las aves acuáticas en el forrajeo y en la búsqueda de sitios de percha.
Ante este escenario, es relevante realizar acciones a corto, mediano y largo plazo para la conservación de este humedal urbano y de las especies registradas. Se debe impulsar el aviturismo, realizar más estudios de la avifauna y llevar a cabo las acciones sugeridas en el Programa de Manejo y Conservación de la Reserva Ecológica Laguna de las Ilusiones (Secretaría de Gobierno 2019, Ricárdez-de la Cruz et al. 2016) para detener el crecimiento urbano en la laguna y, así, asegurar la conservación de las especies registradas.
AGRADECIMIENTOS
Se agradece al Consejo Nacional de Ciencia y Tecnología (México) la beca otorgada para la elaboración del presente estudio (No. 741834); al programa de Maestría en Ciencias Ambientales de la Universidad Juárez Autónoma de Tabasco la formación académica impartida durante la realización del posgrado; al comité sinodal su contribución y apoyo; al propietario y los trabajadores del Rancho El Espejo su cooperación para acceder a su terreno; al laboratorio de sedimentos de la División Académica de Ciencias Biológicas de la Universidad Juárez Autónoma de Tabasco el análisis textural de las muestras de sedimento; y a la Secretaría de Bienestar, Sustentabilidad y Cambio Climático del estado de Tabasco el apoyo de una lancha para la recolecta de muestras de sedimento.
REFERENCIAS
Abilhoa, V, Amorin, R. 2017. Effects of urbanization on the avian community in a southern Brazilian city. Rev Bras Ornitol. 25(1):31-39. https://doi.org/10.1007/bf03544374 [ Links ]
Andrade, R, Bateman, HL, Franklin, J, Allen, D. 2018. Waterbird community composition, abundance, and diversity along an urban gradient. Landsc Urban Plan. 170(1):103-111. https://doi.org/10.1016/j.landurbplan.2017.11.003 [ Links ]
[AOU] American Ornithologists’ Union. 1998. Check-list of North American Birds. 7th ed. Washington DC (VA): Am Ornithol Union. 829 p. [ Links ]
Arriaga-Weiss, SL, Calmé, S, Kampichler, C. 2008. Bird communities in rainforest fragments: guild responses to habitat variables in Tabasco, Mexico. Biodivers Conserv. 17(1):173-190. https://doi.org/10.1007/s10531-007-9238-7 [ Links ]
Badii, MH, Castillo, J, Cortez, K, Wong, A, Villalpando, P. 2007. Análisis de correlación canónica (ACC) e investigación científica = Canonical correlation analysis and scientific research. Innovaciones Neg. 4(2):405-422. http://eprints.uanl.mx/12486/1/A9 %281%29.pdf. [ Links ]
Barbeito, V, Bono, A. 2006. Determinación de fracciones texturales para suelos de la región semiárida Pampeana usando variaciones al Método de Bouyoucos [Determination of textural fractions for soils of the semi-arid Pampean region using variations to the Bouyoucos Method]. Aspectos de la evaluación y el manejo de los suelos en la región semiárida Pampeana. La Pampa, Argentina: [publisher unknown]; accessed 01 Apr 2020. p. 1-14. https://inta.gob.ar/sites/default/files/script-tmp-publi66(1).pdf . [ Links ]
Berlanga, H, Gómez-de-Silva, H, Vargas-Canales, VM, Rodríguez-Contreras, V, Sánchez-González, LA, Ortega-Álvarez, R, Calderón-Parra, R. 2019. Aves de México: Lista actualizada de especies y nombres comunes [Birds of Mexico: Updated list of species and common names]. Mexico City (Mexico): Comisión Nacional para el Conocimiento y Uso de la Biodiversidad; accessed 28 Aug 2019. https://www.biodiversidad.gob.mx/media/1/ciencia-ciudadana/documentos/Lista_actualizada_aos_2019.pdf . [ Links ]
Bolduc, F, Afton, AD. 2004. Relationships between wintering waterbirds and invertebrates, sediments and hydrology of coastal marsh ponds. Waterbirds. 27(3):333-341. https://doi.org/10.1675/1524-4695(2004)027[0333:RBWWAI]2.0.CO;2 [ Links ]
Burton, NHK. 2007. Landscape approaches to studying the effects of disturbance on waterbirds. Ibis (Lond. 1859). 149(s1):95-101. https://doi.org/10.1111/j.1474-919x.2007.00658.x [ Links ]
Castro-Tavares, D, Guadagnin, DL, de-Moura, JF, Siciliano, S, Merico, A. 2015. Environmental and anthropogenic factors structuring waterbird habitats of tropical coastal lagoons: Implications for management. Biol Conserv. 186:12-21. https://doi.org/10.1016/j.biocon.2015.02.027 [ Links ]
Chesser, RT, Billerman, SM, Burns, KJ, Cicero, C, Dunn, JL, Hernández-Baños, BE, Jiménez, RA, Kratter, AW, Mason, NA, Rasmussen, PC, et al. 2021. Check-list of North American Birds (online) [Lista de verificación de aves de América del Norte (en línea)]. [North America and Central America]: Amer Ornithol Society; accessed 03 Jun 2020. http://checklist.aou.org/taxa . [ Links ]
[CONABIO] Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. 2021. La biodiversidad en Tabasco: Estudio de Estado [Biodiversity in Tabasco: State Study]. [Mexico]: [publisher unknown]; accessed 10 Jan 2021. https://www.biodiversidad.gob.mx/region/EEB/estudios/ee_tabasco . [ Links ]
Donaldson, MR, Henein, KM, Runtz, MW. 2007. Assessing the effect of developed habitat on waterbird behaviour in an urban riparian system in Ottawa, Canada. Urban Ecosyst. 10(2):139-151. https://doi.org/10.1007/s11252-006-0015-2 [ Links ]
Dunn, JL. 2006. Field Guide to the Bird of North America. 5th ed. Washinton DC (VA): National Geographic Society. 591 p. [ Links ]
Germain, P, Cuevas, Y, Sanhueza, C, Tizón, FR, Loydi, A, de Villalobos, AE, Zapperi, G, Vázquez, B, Pompozzi, G, Piován, MJ. 2008. Ensamble de aves en zonas con diferente grado de urbanización en la ciudad de Bahía Blanca (Buenos Aires, Argentina) [Bird assemblage in areas with different degrees of urbanization in the city of Bahía Blanca (Buenos Aires, Argentina)]. BioScriba. 1(2):35-45. https://ri.conicet.gov.ar/bitstream/handle/11336/30436/CONICET_Digital_Nro.24205702-b31b-41da-bb20-b9d9b87c4c86_A.pdf?sequence=2. [ Links ]
Hammer, Ø, Harper, DAT, Ryan, PD. 2001. PAST: Paleontological Statistics software package for education and data analysis. Palaeontologia Electronica. 4(1):4. [ Links ]
Hansen, AM, Afferden, MV, Torres-Bejarano, F. 2007. Saneamiento del vaso Cencali, Villahermosa, Tabasco. I. Contaminación y reúso de sedimentos [Sanitation of the Cencali basin, Villahermosa, Tabasco. I. Contamination and reuse of sediments]. Ing Hidraul Mex. 22(4):87-102. [ Links ]
Howell, NG, Webb, S. 1995. A guide to the birds of Mexico and Northern Central America. New York (USA): Oxford University. 851 p. [ Links ]
[INVEMAR] Instituto de Investigaciones Marinas y Costeras. 2003. Manual de técnicas analíticas para la determinación de parámetros fisicoquímicos y contaminantes marinos (Aguas, sedimentos y organismos) [Manual of analytical techniques for the determination of physicochemical parameters and marine pollutants (Water, sediments and organisms)]. [Santa Marta (Colombia)]: Cargraphics; accessed 10 Jan 2021. https://www.invemar.org.co . [ Links ]
[IUCN] International Union for Conservation of Nature. 2021. The IUCN Red List of Threatened Species. Version 2021-3. Cambridge (United Kingdom): [publisher unknown]; accessed 10 Jan 2021. https://www.iucnredlist.org . [ Links ]
Kaufman, K. 2005. Guía de campo a las aves de Norteamérica. New York (USA): Houghton Mifflin Editions. 391 p. [ Links ]
Kusch, A, Cárcamo, J, Gómez, H. 2008. Aves acuáticas en el humedal urbano de Tres Puentes, Punta Arenas (53° S), Chile Austral = Waterbirds in the urban wetland Tres Puentes, Punta Arenas (53° S), Austral Chile. An Ins Patagon. 36(2):45-51. https://doi.org/10.4067/s0718-686x2008000200005 [ Links ]
López, LN. 2019. Tabasco es el edén de los humedales = Tabasco is the Eden of wetlands. Kuxulkab´. 25(52):39-51. https://doi.org/10.19136/kuxulkab.a25n52.2969 [ Links ]
Magaña, MA. 1988. La vegetación de la Laguna de las Ilusiones [The vegetation of the Laguna de las Ilusiones]. [Tabasco (Mexico)]: Universidad Juárez Autónoma de Tabasco. 67 p. [ Links ]
Mera-Ortiz,, G, Ruiz-Campos, G, Gómez-González, AE, Velázquez-Velázquez, E. 2016. Composición y abundancia estacional de aves acuáticas en tres paisajes de la laguna Mar Muerto, Oaxaca-Chiapas = Composition and seasonal abundance of aquatic birds in three landscapes of the Mar Muerto lagoon, Oaxaca-Chiapas. Huit Rev Mex Ornitol. 17(2):251-261. https://doi.org/10.28947/hrmo.2016.17.2.255 [ Links ]
Moreno, CE. 2001. Métodos para medir la biodiversidad [Methods for measuring biodiversity]. In: Moreno, CE, M&T-Manuales y Tesis SEA. Vol 1. Zaragoza (España): CYTED, ORCYT/UNESCO, Sociedad Entomológica Aragonesa SEA. 84 p. [ Links ]
Murrieta-Galindo, R, González-Romero, A, López-Barrera, F, Parra-Olea, G. 2013. Coffee agrosystems: an important refuge for amphibians in central Veracruz, Mexico. Agroforest Syst. 87(4):767-779. https://doi.org/10.1007/s10457-013-9595-z [ Links ]
Palomeque-de-la-Cruz, MA, Galindo-Alcántara, A, Sánchez, AJ, Escalona-Maurice, MJ. 2017. Pérdida de humedales y vegetación por urbanización en la cuenca del río Grijalva, México. Investigaciones Geográficas (España) 68: 151-172. https://doi.org/10.14198/INGEO2017.68.09 [ Links ]
Peterson, RT, Chalif, EL. 2008. Aves de México [Birds of Mexico]. Mexico City (Mexico): Editorial Diana. 473 p. [ Links ]
QGIS. 2021. QGIS: Geographic Information System. QGIS Association. [Place unknown]: [Publisher unknown]; accessed 02 Jan 2021. http://www.qgis.org . [ Links ]
Ralph, CJ, Geupel, GR, Pyle, P, Martin, TE, DeSante, DF, Milá, B. 1996. Manual de métodos de campo para el monitoreo de aves terrestres [Field methods manual for landbird monitoring]. Gen Tech Rep. PSW-GTR-159. Albany (CA): Pacific Southwest Research Station, Forest Service, U.S. Department of Agriculture. 46 p. https://doi.org/10.2737/psw-gtr-159 [ Links ]
Ricárdez-de-la-Cruz, G, López-Ocaña, G, Bautista-Margulis, RG, Torres-Calcázar, CA. 2016. Laguna de las Ilusiones y su entorno urbano: aguas residuales, urbanas y sedimentos = Laguna de las Ilusiones and its urban environment: sewage, urban water and sediments. Kuxulkab´. 22(43):27-38. https://doi.org/10.19136/kuxulkab.a22n43.1461 [ Links ]
Rojas, C, Sepúlveda-Zúñiga, E, Barbosa, O, Rojas, O, Martínez, C. 2015. Patrones de urbanización en la biodiversidad de humedales urbanos en Concepción metropolitano [Urbanization patterns in the biodiversity of urban wetlands in metropolitan Concepción]. Rev Geogr Norte Gd. 61:181-204. https://doi.org/10.4067/s0718-34022015000200010 [ Links ]
Rosa, S, Palmeirim, JM, Moreira, F. 2003. Factors affecting waterbird abundance and species richness in an increasingly urbanized area of the Tagus Estuary in Portugal. Waterbirds. 26(2):226-232. https://doi.org/10.1675/1524-4695(2003)026[0226:fawaas]2.0.co;2 [ Links ]
Rosado, AE. 2008. Avifauna acuática asociada al área de influencia del PICI en Tabasco [Waterfowl associated with the PICI area of influence in Tabasco] [BSc thesis]. [Tabasco (Mexico)]: Universidad Juárez Autónoma de Tabasco. 67 p. [ Links ]
Ruiz-Campos, G, Palacios, E, Castillo-Guerrero, JA, González-Guzmán, S, Batche-González, EH. 2005. Composición espacial y temporal de la avifauna de humedales pequeños costeros y hábitats adyacentes en el noroeste de Baja California, México = Spatial and temporal composition of the avifauna from small coastal wetlands and adjacent habitats in northwestern Baja California, Mexico. Cienc Mar. 31(3):553-576. http://doi.org/10.7773/cm.v31i3.42 [ Links ]
Ruiz-Campos, G, Rodríguez-Meraz, M. 1993. Notas ecológicas sobre la avifauna de la laguna El Rosario, Baja California, México [Ecological notes on the avifauna of Laguna El Rosario, Baja California, Mexico]. Southwest Nat. 38(1):59-64. https://doi.org/10.2307/3671646 [ Links ]
Salcedo, MA, Cruz-Ramírez, AK, Sánchez, AJ, Álvarez-Pliego, N, Florido, R, Ruiz-Carrera, V, Morales-Cuetos, SS. 2022. Water quality indicators in three surface hydraulic connection conditions in tropical floodplain lakes. Water. 14(23): 3931. https://doi.org/10.3390/w14233931 [ Links ]
Salido, RT. 2000. Diversidad de la comunidad de aves acuáticas y caracterización de sus hábitats en la laguna de Zapotlan, Jalisco, México [Diversity of the waterfowl community and characterization of their habitats in the Zapotlan lagoon, Jalisco, Mexico] [MSc thesis]. [Nuevo León (Mexico)]: Universidad Autónoma de Nuevo León. 83 p. http://eprints.uanl.mx/6328/1/1080095006.pdf. [ Links ]
Sánchez, AJ, Álvarez-Pliego, N, Espinosa-Pérez, H, Florido, R, Macossay-Cortez, A, Barba, E, Salcedo, MÁ, Garrido-Mora, A. 2019. Species richness of urban and rural fish assemblages in the Grijalva Basin floodplain, southern Gulf of Mexico. CYBIUM. 43(3):239-254. https://doi.org/10.26028/cybium/2019-433-005 [ Links ]
Sánchez-Bon, G, Fernández, G, Escobedo-Urías, D, Torres-Torner, J, Cid-Becerra, JA. 2010. Spatial and temporal composition of the avifauna from the barrier islands of the San Ignacio-Navachiste-Macapule lagoon complex, Sinaloa, Mexico = Composición espacial y temporal de la avifauna de las islas de barrera del complejo lagunar San Ignacio-Navachiste-Macapule, Sinaloa, México. Cienc Mar. 36(4):355-370. https://doi.org/10.7773/cm.v36i4.1683 [ Links ]
Sanders, HL. 1960. Benthic studies in Buzzard Bay III. The structure of the softbottom community. Limnol Oceanogr. 5(2):138-153. https://doi.org/10.4319/lo.1960.5.2.0138 [ Links ]
Secretaría de Gobierno (Tabasco, Mexico). 2019 Sep 25. Programa de Manejo y Conservación de la Reserva Ecológica Laguna de las Ilusiones [Laguna de las Ilusiones Ecological Reserve Management and Conservation Program]. Periódico Oficial. No. 1953, Época 7ª, Suplemento I, ed. 8040. https://tabasco.gob.mx/PeriodicoOficial/descargar/969. [ Links ]
[SEMARNAT] Secretaría del Medio Ambiente y Recursos Naturales. 2010 Dic 30. Norma Oficial Mexicana NOM-059-ECOL-2010, Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio. Lista de especies en riesgo. Mexico City (Mexico): Diario Oficial de la Federación. https://www.profepa.gob.mx/innovaportal/file/435/1/NOM_059_SEMARNAT_2010.pdf. [ Links ]
Traut, AH, Hostetler, ME. 2004. Urban lakes and waterbirds: effects of shoreline development on avian distribution. Landsc Urban Plan. 69(1):69-85. https://doi.org/10.1016/j.landurbplan.2003.08.009 [ Links ]
Valdez-Leal, JDD, Pacheco-Figueroa, CJ, Méndez-López, E, Rangel-Ruíz, LJ, Moguel-Ordoñez, EJ, Arriaga-Weiss, SL, Mata-Zayas, EE, Gama-Campillo, LM, Gordillo-Chávez, EJ, García-Morales, R, Luna-Ruíz, RDC. 2015. La comunidad de las aves en tres hábitats de la planicie de Tabasco, México = Bird communities in three habitats of the Tabasco plain, Mexico. Agroproductividad. 8(5):69-73. https://biblat.unam.mx/hevila/Agroproductividad/2015/vol8/no5/10.pdf. [ Links ]
Van der Wal, H, Peña-Álvarez, B, Arriaga-Weiss, SL, Hernández-Daumás, S. 2012. Species, functional groups, and habitat preferences of birds in five agroforestry classes in Tabasco, Mexico. Wilson J Ornithol. 124(3):558-571. https://doi.org/10.1676/10-111.1 [ Links ]
Wilman, H, Belmaker, J, Simpson, J, de-la-Rosa, C, Rivadeneira, MM, Jetz, W. 2014. EltonTraits 1.0: Species-level foraging attributes of the world’s birds and mammals. Ecol Soc Amer. 95(7):20-27. https://doi.org/10.1890/13-1917.1 [ Links ]
Recibido: 29 de Marzo de 2022; Aprobado: 24 de Noviembre de 2022











 text in
text in 



