Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.48 Ensenada Jan./Dec. 2022 Epub Nov 17, 2023
https://doi.org/10.7773/cm.y2022.3200
Artículos
Hábitos alimentarios del pargo Lutjanus peru en la porción central del golfo de California
1Departamento de Pesquerías y Biología Marina, Instituto Politécnico Nacional-Centro Interdisciplinario de Ciencias Marinas, La Paz, Baja California Sur, Mexico.
2Facultad de Ciencias del Mar, Consejo Nacional de Ciencia y Tecnología-Universidad Autónoma de Sinaloa, Mazatlán, Sinaloa, Mexico.
3Departamento de Ciencias Marinas y Costeras, Universidad Autónoma de Baja California Sur, La Paz, Baja California Sur, Mexico.
Como base de supervivencia y desarrollo, el alimento de los peces representa una línea base para investigaciones sobre aspectos ecológicos relacionados con la estructura y la función de comunidades marinas. El presente estudio se orientó hacia los hábitos alimentarios del huachinango del Pacífico, Lutjanus peru, en Santa Rosalía, Baja California sur (México), durante agosto de 2016 hasta octubre de 2017. Un total de 403 especímenes fueron analizados y categorizados de acuerdo con el sexo, la madurez sexual y la estación climática. El intervalo de tallas fue de 21 a 60 cm de longitud total, y el peso varió de 195 a 1,920 g. En total, se identificaron 29 especies presa, incluidos peces (13 ítems), crustáceos (11 ítems), moluscos (4 ítems) y tunicados (1 ítem). De acuerdo con el índice porcentual de importancia relativa, las principales presas fueron Sardinops sagax (47.65%), Nycthiphanes simplex (38.50%), Harengula thrissina (11.21%), Myctophidae (0.68%) y Benthosema panamense (0.52%). Las presas fueron consumidas en diferentes proporciones de acuerdo con el sexo (F = 2.01, P < 0.049), la madurez sexual (F = 4.99, P < 0.001) y la estación climática (F = 45.52, P < 0.001). La amplitud trófica fue estrecha (B i = 0.16); esta fue consistente con la gráfica de Costello, la cual mostró un consumo principal sobre presas gregarias de origen pelágico-costero y mesopelágico. El huachinango del Pacífico en Santa Rosalía fue un consumidor terciario. Su alimentación oportunista incluyó pocos, pero abundantes ítems presa, y la composición trófica fue distinta a la de L. peru en otras áreas del golfo de California y la costa mexicana del Pacífico.
Palabras clave: Lutjanidae; hábitos alimentarios; composición trófica; carnívoro demersal; oportunista
A biological basis for survival and development, the diet of fish represents a baseline for research on ecological aspects related to the structure and function of marine communities. This study focused on the feeding habits of the Pacific red snapper, Lutjanus peru, in Santa Rosalía, Baja California Sur (Mexico), during August 2016 through October 2017. A total of 403 specimens were analyzed and categorized by sex, sexual maturity, and season. The size interval ranged from 21 to 60 cm total length, and the weight ranged from 195 to 1,920 g. A total of 29 prey items were identified, including fish (13 items), crustaceans (11 items), mollusks (4 items), and tunicates (1 item). According to the index of relative importance, the main prey were Sardinops sagax (47.65%), Nycthiphanes simplex (38.50%), Harengula thrissina (11.21%), Myctophidae (0.68%), and Benthosema panamense (0.52%). Prey were consumed in different proportions according to sex (F = 2.01, P < 0.049), sexual maturity (F = 4.99, P < 0.001), and season (F = 45.52, P < 0.001). The trophic width was narrow (B i = 0.16); this was consistent with the Costello graph, which showed the consumption of mainly pelagic-coastal and mesopelagic gregarious prey. The Pacific red snapper in Santa Rosalía functioned as a tertiary consumer. Its opportunistic diet included few highly abundant prey items, and the diet composition differed from that of L. peru in other areas of the Gulf of California and the Pacific coast of Mexico.
Key words: Lutjanidae; feeding habits; trophic composition; demersal carnivore; opportunist
INTRODUCCIÓN
Los lutjanidos son peces teleósteos demersales que habitan en aguas tropicales, subtropicales y templadas (Allen 1985). Hay 10 especies de lutjanidos en la costa mexicana del Pacífico (Zárate-Becerra et al. 2014), de las cuales el huachinango del Pacífico, Lutjanus peru Nichols y Murphy, 1922, se distribuye desde México hasta Perú. Como juveniles, suelen formar pequeños grupos que habitan estuarios, desembocaduras de ríos y aguas someras. Posteriormente, realizan una corta migración a sustratos rocosos o arrecifes, donde alcanzan la etapa adulta y viven en agregaciones o como individuos solitarios (Allen 1985, Fischer et al. 1995, Gallardo-Cabello et al. 2010). Su distribución batimétrica varía desde áreas someras hasta profundidades de 80 m (Saucedo-Lozano et al. 1999, Espino-Barr et al. 2006, Gallardo-Cabello et al. 2010, Zárate-Becerra et al. 2014).
En México, la presión pesquera sobre juveniles y subadultos de Lutjanus spp. es alta (Díaz-Uribe 1994, Santamaría y Chavez 1999, Díaz-Uribe et al. 2004, Gallardo-Cabello et al. 2010). Las capturas pesqueras fluctúan según la abundancia de especies en el medio ambiente; sin embargo, L. peru generalmente se pesca durante todo el año y es socioeconómicamente importante dentro de la categoría de peces escamosos dada la alta calidad y el valor nutricional de su carne (Díaz-Uribe et al. 2004). Entre 1968 y 2010, los estados de Baja California Sur, Nayarit, Jalisco, Colima, Michoacán, Guerrero y Oaxaca concentraron el 90% de la producción pesquera de esta especie (Cruz-Romero et al. 2000, Zárate-Becerra et al. 2014).
Desde un punto de vista ecológico, el huachinango del Pacífico y sus congéneres participan en la dinámica bioenergética de la comunidad como importantes carnívoros que regulan la densidad de un amplio espectro de peces y crustáceos en el ambiente demersal (Allen 1985, Parrish 1987, Zárate-Becerra et al. 2014). Por tanto, representan el eslabón entre los niveles bajos y altos de la cadena trófica (Acero y Garzón 1985, Arreguín-Sánchez y Manickchand-Heileman 1998, Pérez-España 2003). Identificar presas con alta resolución taxonómica ayuda a definir relaciones tróficas, niveles tróficos, estrategias alimentarias y cambios tróficos ontogenéticos en la composición de la dieta (Musseau et al. 2015, Morales y García-Alzate 2016).
Se ha observado que los hábitos alimentarios de L. peru en la desembocadura del golfo de California y las zonas del sur de la costa mexicana del Pacífico cambian según la ontogenia, la reproducción y la estacionalidad (Díaz-Uribe 1994, Santamaría-Miranda et al. 2003, Rojas-Herrera et al. 2004, Moreno Sánchez et al. 2016). Estos cambios se han relacionado con diferentes requerimientos energéticos (Hobson 1968, Abitia-Cárdenas et al. 1997), la capacidad de caza (Hobson 1968) y la disponibilidad de presas (Rojas-Herrera et al. 2004). Se considera que este depredador no selecciona presas específicas y que su dieta se basa en la disponibilidad y abundancia de presas (Díaz-Uribe 1994, Saucedo-Lozano 1999, Rojas-Herrera et al. 2004). Este hecho es de suma importancia considerando el tipo de presas que constituyen su espectro trófico en el golfo de California y la costa mexicana del Pacífico.
Utilizando el índice de importancia relativa (IIR, %), Moreno-Sánchez et al. (2016) reportaron que la dieta de L. peru estuvo compuesta casi exclusivamente por crustáceos bentónicos en la costa continental de Sinaloa y por crustáceos pelágicos en la bahía de La Paz, Baja California Sur, en la costa de la península de Baja California; ambas regiones están ubicadas dentro del golfo de California. Por otro lado, Díaz-Uribe (1994) también utilizó el IIR y describió una dieta compuesta principalmente por colonias de urocordados y crustáceos bentónicos alrededor de las islas aledañas en la bahía de La Paz. En Guerrero, fuera del golfo de California, en aguas del Pacífico frente al sur de México, Santamaría-Miranda et al. (2003) y Rojas-Herrera et al. (2004) encontraron altos porcentajes de peces costeros pelágicos y crustáceos bentónicos.
Dadas las variaciones reportadas en los principales ítems presa consumidos por L. peru, el objetivo del presente estudio fue determinar los hábitos alimentarios del huachinango del Pacífico en la porción central del golfo de California, Santa Rosalía, Baja California Sur, y comparar nuestros resultados con lo que se ha reportado previamente para la especie. También corroboramos cambios en la dieta relacionados con el sexo, la ontogenia y la estacionalidad.
MATERIALES Y MÉTODOS
Debido a la batimetría, la latitud meridional y el sistema de surgencia, el golfo de California exhibe una alta biodiversidad y productividad primaria (Wilkinson et al. 2009). La batimetría del área consiste en una plataforma amplia y lagunas costeras al este, lo cual contrasta con la estrecha plataforma y las islas en el lado occidental de la península de Baja California (Cartron et al. 2005). Los eventos de surgencia estacionales predominan en la costa continental en el invierno (diciembre-mayo) y frente a la península en el verano (julio-octubre); junio y noviembre son meses de transición (Roden 1964, Badan-Dagon et al. 1985). Estos eventos favorecen la entrada de aguas subsuperficiales ricas en nutrientes, lo que conduce a la proliferación de fitoplancton y, por lo tanto, a grandes cantidades de alimento disponible para sustentar la cadena trófica (Roden 1964, Álvarez-Borrego 2008). Este proceso regula la abundancia, composición y distribución de peces pelágicos y mesopelágicos costeros, entre otros (Avendaño-Ibarra et al. 2013).
Se obtuvieron entre 20 y 40 especímenes de huachinango del Pacífico mensualmente desde agosto de 2016 hasta octubre de 2017 (Tabla S1) cerca del puerto de Santa Rosalía (27°19ʹ45.14ʺ N, 112°15ʹ13.40ʺ W) (Fig. 1). Los especímenes fueron capturados por la flota pesquera artesanal a 5-13 millas náuticas de la costa a profundidades de 10 a 30 m, mediante botes con motor fuera de borda y una red con luz de malla de 15 cm colocada por 10 a 12 h por la noche. Los especímenes fueron congelados y transportados al laboratorio de ecología de peces del Centro Interdisciplinario de Ciencias Marinas, donde fueron medidos (longitud total) con una tabla para medir peces (precisión de ±0.5 cm) y pesados (peso total) con una balanza digital (precisión de ±0.01 g).

Figura 1 Ubicación geográfica del área de estudio (Santa Rosalía, Baja California Sur, México). El área sombreada muestra dónde se capturaron los huachinangos del Pacífico, Lutjanus peru.
Los especímenes de huachinango del Pacífico se clasificaron de acuerdo con el sexo, la madurez sexual y la estación climática. El sexo se asignó de acuerdo con la escala morfocromática de Nikolsky (Nikolsky 1963). La categorización trófica basada en la madurez sexual se exploró con un análisis de conglomerados para detectar variaciones en la biomasa de las presas consumidas por cada clase de talla. Los datos no eran normales por el exceso de ceros; se utilizó la mediana como medida de distancia, y se usó una correlación para agrupar las variables. Este análisis se realizó con la biblioteca pvclust v.2.2-0 (Suzuki et al. 2019) en el entorno R (R Core Team 2020). Debido a que no se pudo detectar un patrón trófico claro entre las clases de talla y la biomasa de las presas (Fig. S1), decidimos discriminar entre peces maduros e inmaduros, según Díaz-Uribe et al. (2004): los organismos ≥33 cm de longitud total se clasificaron como maduros y los organismos más pequeños se clasificaron como inmaduros.
Para definir las estaciones climáticas, la temperatura superficial del mar (TSM) se obtuvo de imágenes satelitales MODIS-AQUA con resolución de 1.1 km, y se consideró el cuadrante de influencia de la flota pesquera artesanal que operó en el área de estudio de mayo de 2016 a diciembre de 2017, el cual se delimitó por 112.0° W a 112.4° W y 27.2° N a 27.4° N. Los datos de TSM se obtuvieron del servidor ERDDAP de la Oficina Nacional de Administración Oceánica y Atmosférica de los Estados Unidos de América (https://coastwatch.pfeg.noaa.gov/erddap/index.html).
Se tomaron datos mensuales de temperatura y se calculó la TSM promedio (25.8 °C); los meses por encima y por debajo del valor medio se consideraron cálidos y fríos, respectivamente. Se evidenciaron 2 estaciones climáticas: una estación fría (diciembre de 2016 y enero, febrero, marzo, abril, mayo y diciembre de 2017) y una estación cálida (julio, agosto, septiembre y octubre de 2016 y julio, agosto, septiembre y octubre de 2017).
La identificación de presas se realizó con un microscopio estereoscópico Zeiss Stemi 2000-C, y se utilizó literatura especializada para determinar cada grupo taxonómico. Para peces, se usaron las guías de Miller y Jorgensen (1973), Fischer et al. (1995), Díaz-Murillo (2006) y Lowry (2011). Para crustáceos y moluscos, se usaron los trabajos de Brusca (1980), Morris et al. (1980) y Salgado-Barragán y Hendrickx (2010).
Una vez identificadas las presas, se estimó un tamaño mínimo de muestra para asegurar que el número de estómagos analizados fuera suficiente para caracterizar la dieta general y la dieta por sexo, la madurez sexual y la estación climática. Se utilizó el programa EstimateS (Colwell 2009) para graficar las curvas de acumulación de la diversidad de presas, las cuales son una estimación de la variabilidad de presas por estómago con el índice de diversidad de Shannon-Wiener (Hʹ), con 100 permutaciones sin reemplazo. Las curvas alcanzaron gradualmente una asíntota en un número acumulado específico de estómagos, dado que la variabilidad de presas en los estómagos fue baja; esto coincidió con el punto donde el coeficiente de variación (CV) fue de 0.05 (Jiménez-Valverde y Hortal 2003, Moreno-Sánchez et al. 2016).
Considerando todos los estómagos muestreados, la importancia cuantitativa de cada
especie presa se evaluó con el índice numérico (%N), el gravimétrico (%W) y el
de frecuencia de ocurrencia (%FO) (Hyslop
1980). Se calcularon los mismos índices para cada categoría en
estudio (sexo, madurez sexual y estación climática). Para evitar sesgos en las
estimaciones, los índices se integraron en el IIR, IIR = (%N + %W) × %FO,
propuesto por Pinkas et al. (1971) y
expresado como porcentaje (Cortés 1997)
para facilitar las comparaciones con estudios previos sobre la dieta de
L. perú realizados en el golfo de California y la costa
mexicana del Pacífico:
Para probar diferencias basadas en el número de presas consumidas por huachinangos del Pacífico según el sexo (Nikolsky’s 1963), la madurez sexual (Díaz-Uribe et al. 2004) y la estación climática (imágenes de satélite de la TSM), y para probar posibles diferencias tróficas debido a las interacciones entre estas categorías, se realizó un análisis de la varianza multivariado basado en permutaciones (PERMANDEVA) con 100 permutaciones, con base en la métrica de disimilitud de Bray-Curtis, aplicando la función adonis de la biblioteca Vegan 2.2-1 (Oksanen et al. 2016) en el entorno R 3.0.1. PERMANDEVA es una técnica útil para evaluar las diferencias en los datos obtenidos de diferentes diseños experimentales, incluidos los conjuntos de datos con exceso de ceros (Anderson 2017), como es de esperarse en los análisis de contenido estomacal porque los diferentes tipos de presas no siempre están presentes en todos los estómagos. También permite el uso de datos no transformados, y también es bastante robusto cuando los datos no son paramétricos, como nuestros datos (Anderson 2017). El estadístico R (-1 > R < 1) que resulta de este análisis describe la similitud entre categorías. Valores cercanos a 0 indican que no hay diferencias y valores cercanos a 1 o -1 indican diferencias entre las categorías analizadas. Los valores de probabilidad creados por el estadístico R se consideraron significativos cuando P ≤ 0.05.
Se utilizó el índice de Levin (Krebs 1999) para evaluar la amplitud trófica del huachinango del Pacífico:
donde B i es la amplitud trófica del depredador i, p ij es la proporción de la presa j en la dieta del depredador i, y n es el número total de presas. Debido a la estandarización, este índice toma valores de 0 a 1 (Hurlbert 1978). Los valores por debajo de 0.60 están asociados con los depredadores especialistas (i.e., preferencia por pocas presas), mientras que los valores iguales o superiores a 0.60 indican que el depredador es generalista y consume una gran cantidad de especies presa (Krebs 1999).
La estrategia de alimentación se evaluó mediante las gráficas de Costello (1990) modificadas por Amundsen et al. (1996). Estos gráficos detallan la importancia y la contribución de cada ítem presa a la amplitud trófica en un plano bidimensional. El eje horizontal representa la frecuencia de ocurrencia de presas y el eje vertical representa la abundancia por número. Deducimos si el depredador consumía presas de forma homogénea (generalista), si mostraba preferencia por una o varias presas (especialista) o si el consumo era mixto, es decir, si se caracterizaba por individuos que consumían presas de forma generalista e individuos que mostraron especialización trófica (Amundsen et al. 1996).
Se utilizó la ecuación de Christensen y Pauly (1992) para calcular el nivel trófico (NT) del huachinango del Pacífico considerando las diferentes presas encontradas en el contenido estomacal:
donde DC ij es la proporción de la presa j en la dieta del depredador i, NT j es el NT de la presa j, y n es el número de grupos en el sistema. El NT para cada presa se obtuvo de Morales-Zárate et al. (2004) y Froese y Pauly (2019).
RESULTADOS
Se capturaron un total de 478 huachinangos del Pacífico, 75 (15.7%) de los cuales tenían el estómago vacío (los especímenes con el estómago vacío no se tomaron en cuenta para ninguno de los análisis). Los 403 especímenes restantes (84.3%) contenían al menos 1 ítem presa; estos midieron entre 21 y 60 cm de longitud total y pesaban entre 195 y 1,920 g.
Un total del 93% de las presas que compusieron el espectro trófico fueron identificadas a nivel de género y especie. La dieta comprendió 29 ítems presa, incluidos 13 peces, 11 crustáceos, 4 moluscos y 1 tunicado. La curva de acumulación de diversidad de presas, en la que se incluyeron todos los taxones identificados, mostró que la asíntota se alcanzó en 63 estómagos; esto demostró que el número de muestras analizadas fue estadísticamente suficiente para caracterizar la dieta del huachinango del Pacífico (CV ≤ 0.05). También se cumplió con el tamaño mínimo de muestra para caracterizar el espectro trófico por sexo (macho = 56, hembra = 54), madurez sexual (inmaduro = 53, maduro = 55) y estación climática (fría = 60, cálida = 43) (Fig. 2).
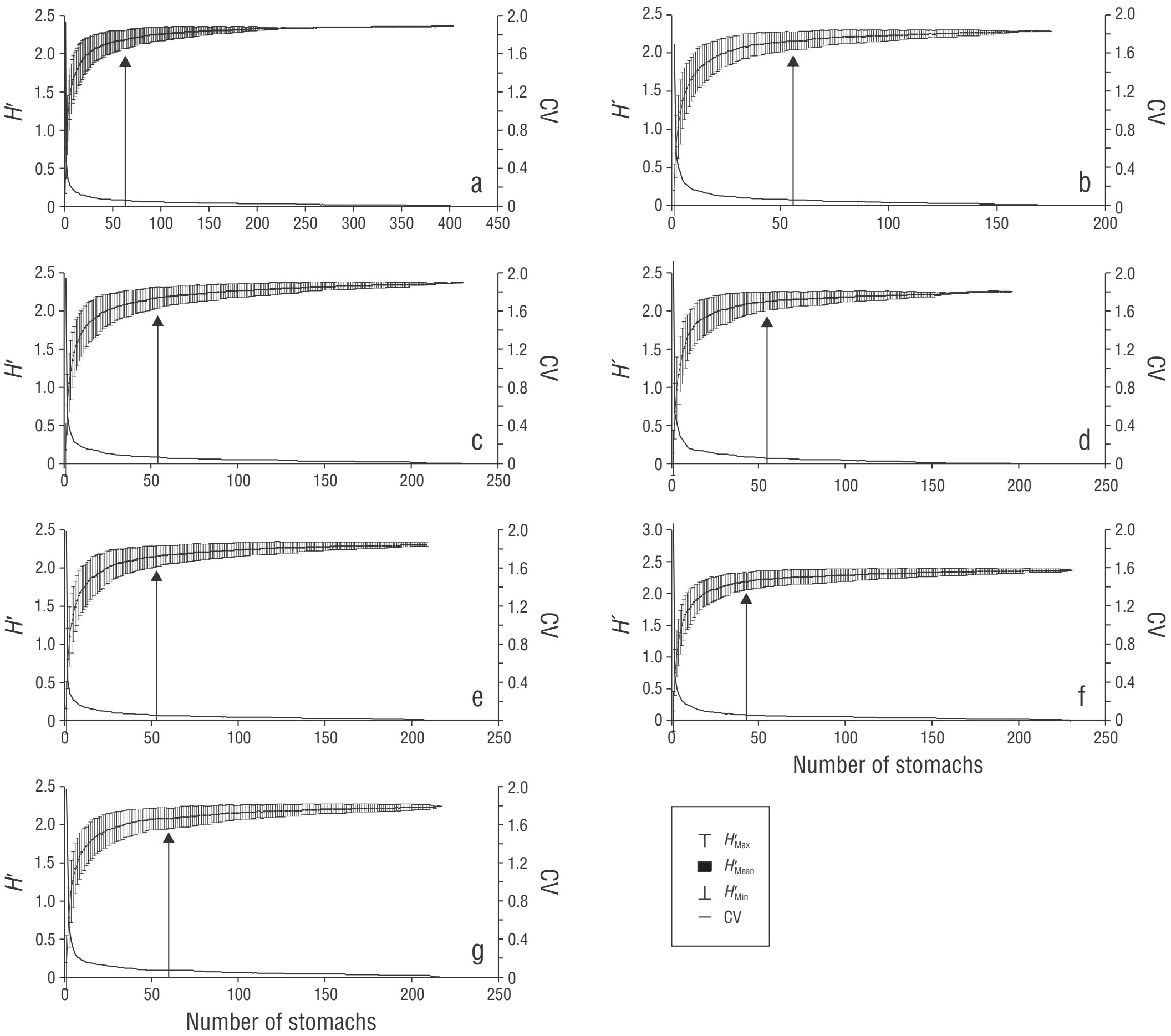
Figura 2 Número de estómagos utilizados para caracterizar los hábitos alimentarios de Lutjanus peru en general (a) y por machos (b), hembras (c), individuos maduros (d), individuos inmaduros (e), estación fría (f) y estación cálida (g). H′, diversidad de Shannon-Wiener; CV, coeficiente de variación. La flecha indica el número mínimo de estómagos donde la curva alcanzó la asíntota, que coincide con CV = 0.05.
En general, las presas más importantes en peso fueron los arenques Sardinops sagax (Jenyns, 1842) (%W = 53.32) y Harengula thrissina (Valenciennes, 1847) (%W = 18.59), mientras que las presas más importantes en número fueron el decápodo Nyctiphanes simplex (Hansen, 1911) (%N = 86.39) y S. sagax (%N = 3.68) (Tabla 1). Las presas más importantes por frecuencia de ocurrencia fueron los arenques S. sagax (%FO = 41.68) y H. thrissina (%FO = 26.79), y el crustáceo N. simplex (%FO = 21.09) (Tabla 1).
Tabla 1 Presas de Lutjanus peru en Santa Rosalía, México. Los valores aportados por cada presa en número (N), peso (W) y frecuencia de ocurrencia (FO) se expresan en valores absolutos y en porcentajes. Los resultados de estos métodos se integraron en el índice absoluto de importancia relativa (IRI, por sus siglas en inglés) y el índice porcentual de importancia relativa (%IRI). El nivel trófico de la presa (TL) se muestra al final.
| Species | N | W | FO | %N | %W | %FO | IRI | %IRI | TL |
| Mollusca | |||||||||
| Cephalopoda | |||||||||
| Loliginidae | |||||||||
| Loligo spp. | 12 | 39.0 | 9 | 0.23 | 2.08 | 2.23 | 5.16 | 0.10 | 2.9 |
| Octopodidae | |||||||||
| Octopus spp. | 1 | 1.0 | 1 | 0.02 | 0.05 | 0.25 | 0.02 | 0.00 | 3.8 |
| Bivalvia | |||||||||
| Veneridae | |||||||||
| Chione spp. | 1 | 0.5 | 1 | 0.02 | 0.03 | 0.25 | 0.01 | 0.00 | 2.4 |
| Gastropoda | |||||||||
| Columbellidae | |||||||||
| Parvanachis spp. | 1 | 0.5 | 1 | 0.02 | 0.03 | 0.25 | 0.01 | 0.00 | 2.0 |
| Crustacea | |||||||||
| Malacostraca | |||||||||
| Euphausiidae | |||||||||
| Nyctiphanes simplex | 4,463 | 87.0 | 85 | 86.39 | 4.64 | 21.09 | 1,919.92 | 38.50 | 2.2 |
| Munididae | |||||||||
| Munida tenella | 37 | 67.5 | 24 | 0.72 | 3.60 | 5.96 | 25.68 | 0.52 | 2.5 |
| Portunidae | |||||||||
| Portunus xantusii | 45 | 38.0 | 29 | 0.87 | 2.02 | 7.20 | 20.84 | 0.42 | 2.6 |
| Penaeidae | |||||||||
| Penaeus spp. (1) | 117 | 14.5 | 10 | 2.26 | 0.77 | 2.48 | 7.54 | 0.15 | 2.6 |
| Penaeus spp. (2) | 2 | 5.5 | 2 | 0.04 | 0.29 | 0.50 | 0.16 | 0.00 | 2.4 |
| Squillidae | |||||||||
| Squilla bigelowi | 2 | 6.0 | 2 | 0.04 | 0.32 | 0.50 | 0.18 | 0.00 | 3.3 |
| Squilla tiburonensis | 1 | 2.0 | 1 | 0.02 | 0.11 | 0.25 | 0.03 | 0.00 | 3.3 |
| Sicyoniidae | |||||||||
| Sicyonia disedwardsi | 2 | 5.0 | 2 | 0.04 | 0.27 | 0.50 | 0.15 | 0.00 | 2.5 |
| Munididae | |||||||||
| Pleuroncodes planipes | 1 | 0.5 | 1 | 0.02 | 0.03 | 0.25 | 0.01 | 0.00 | 2.6 |
| Cymothoidae | |||||||||
| Cymothoa exigua | 1 | 0.5 | 1 | 0.02 | 0.03 | 0.25 | 0.01 | 0.00 | |
| Amphipoda | 13 | 14.0 | 3 | 0.25 | 0.75 | 0.74 | 0.74 | 0.01 | 2.4 |
| Urochordata | |||||||||
| Thaliacea | |||||||||
| Salpidae | |||||||||
| Salpa spp. | 10 | 1.5 | 2 | 0.19 | 0.08 | 0.50 | 0.14 | 0.00 | 2.0 |
| Vertebrata | |||||||||
| Actinopterygii | |||||||||
| Clupeidae | |||||||||
| Sardinops sagax | 190 | 1,001.0 | 168 | 3.68 | 53.33 | 41.69 | 2,376.50 | 47.66 | 2.4 |
| Harengula thrissina | 117 | 349.0 | 108 | 2.26 | 18.59 | 26.80 | 558.98 | 11.21 | 2.9 |
| Opisthonema libertate | 5 | 6.0 | 1 | 0.10 | 0.32 | 0.25 | 0.10 | 0.00 | 2.9 |
| Myctophidae | 63 | 73.5 | 27 | 1.22 | 3.92 | 6.70 | 34.41 | 0.69 | 3.0 |
| Benthosema panamense | 46 | 82.0 | 20 | 0.89 | 4.37 | 4.96 | 26.10 | 0.52 | 3.0 |
| Triphoturus spp. | 24 | 31.0 | 13 | 0.46 | 1.65 | 3.23 | 6.83 | 0.14 | 3.3 |
| Diaphus spp. | 1 | 0.5 | 1 | 0.02 | 0.03 | 0.25 | 0.01 | 0.00 | 3.0 |
| Engraulidae | |||||||||
| Engraulis mordax | 3 | 15.0 | 3 | 0.06 | 0.80 | 0.74 | 0.64 | 0.01 | 2.7 |
| Mugilidae | |||||||||
| Mugil spp. | 2 | 19.5 | 2 | 0.04 | 1.04 | 0.50 | 0.53 | 0.01 | 2.0 |
| Cirrhitidae | |||||||||
| Cirrhitichthys spp. | 2 | 2.5 | 2 | 0.04 | 0.13 | 0.50 | 0.09 | 0.00 | 4.0 |
| Triglidae | |||||||||
| Prionotus spp. | 2 | 1.0 | 2 | 0.04 | 0.05 | 0.50 | 0.05 | 0.00 | 3.5 |
| Scombridae | |||||||||
| Scomber japonicus | 1 | 0.5 | 1 | 0.02 | 0.03 | 0.25 | 0.01 | 0.00 | 3.0 |
| Pomacentridae | |||||||||
| Chromis atrilobata | 1 | 0.5 | 1 | 0.02 | 0.03 | 0.25 | 0.01 | 0.00 | 3.4 |
| Crustacean remains | 0 | 10.5 | 11 | 0.00 | 0.56 | 2.73 | 1.53 | 0.03 | 2.5 |
| Fish remains | 0 | 1.5 | 3 | 0.00 | 0.08 | 0.74 | 0.06 | 0.00 | 3.0 |
| Total | 5,166 | 1,877.0 | 403 | 100.00 | 100.00 | 4,986.44 | 100.00 | 3.4 |
En cuanto al %IIR, las presas que aportaron más del 95% a la dieta fueron S. sagax (47.65%), N. simplex (38.50%), H. thrissina (11.21%), peces de la familia Myctophidae (0.68%) y Benthosema panamense (Tåning, 1932) (0.52%). El resto de los ítems (24) contribuyeron <5.00% a la dieta (Fig. 3).
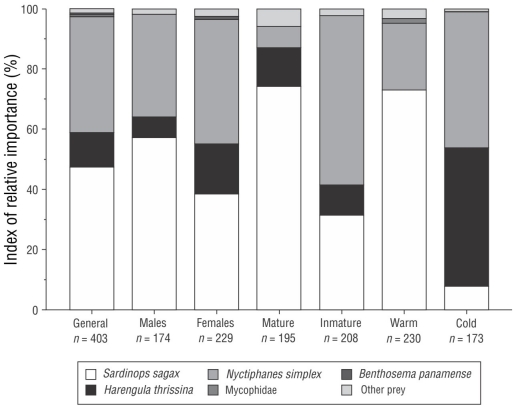
Figura 3 Índice de importancia relativa de las principales presas consumidas por Lutjanus peru en general y en función del sexo (macho o hembra), madurez sexual (maduro o inmaduro) y estación climática (cálida o fría) en Santa Rosalía, México.
Se analizaron un total de 174 estómagos de machos y 229 estómagos de hembras. El espectro trófico comprendió 22 ítems, los cuales tuvieron diferente importancia proporcional en los estómagos de los 2 sexos. Para los machos, las presas más importantes, según el %IIR, fueron S. sagax (57.27%), N. simplex (34.26%) y H. thrissina (6.61%), y las presas de importancia secundaria incluyeron Myctophidae (0.61%) y Munida tenella (Benedicto, 1902) (0.35%). En hembras las presas más importantes fueron N. simplex (41.63%), S. sagax (38.59%) y H. thrissina (16.24%), seguidas de B. panamense (0.92%) y Myctophidae (Gill, 1893) (2.62 %) (Fig. 3). Según el PERMANDEVA, hubo diferencias significativas en la dieta entre machos y hembras (PERMANDEVA F = 2.01, P < 0.049) (Tabla 2).
Tabla 2 Resultados del análisis de la varianza multivariado basado en permutaciones (PERMANDEVA) obtenidos de las permutaciones llevadas a cabo según las categorías y sus interacciones para probar si existían diferencias significativas en la dieta del huachinango del Pacífico, Lutjanus peru, en Santa Rosalía (Baja California Sur, México). F = prueba PERMANDEVA, r = similitud entre grupos, P = valores de probabilidad.
| Categories | F | r | P | Significance at 95% confidence |
| Sex | 2.01 | 0.004 | 0.049 | yes |
| Season | 45.52 | 0.100 | 0.001 | yes |
| Maturity | 4.99 | 0.011 | 0.001 | yes |
| Sex:season | 1.03 | 0.002 | 0.399 | no |
| Sex:maturity | 0.79 | 0.001 | 0.596 | no |
| Season:maturity | 1.65 | 0.003 | 0.099 | no |
| sex:season:maturity | 0.59 | 0.001 | 0.800 | no |
De todos los estómagos analizados, 195 pertenecieron a especímenes maduros. Según el %IIR, el espectro trófico comprendió 17 ítems presa; las especies presa más importantes fueron S. sagax (74.16%), H. thrissina (12.85%), N. simplex (7.14%), Myctophidae (2.71%) y B. panamense (1.34%). Se analizaron un total de 208 organismos inmaduros y se identificaron 22 ítems presa. Las presas más importantes según el %IIR fueron N. simplex (56.36%), S. sagax (31.44%), H. thrissina (9.97%), Portunus xantusii (Stimpson, 1860) (0.53%) y Triphoturus spp. (Paxton 1972) (0.37%) (Fig. 3). El PERMANDEVA mostró que hubo diferencias significativas en el espectro trófico entre organismos maduros e inmaduros (F = 4.99, P < 0.001) (Tabla 2).
Se obtuvieron un total de 230 estómagos durante la estación cálida y se identificaron 22 ítems presa. Los ítems más importantes según el %IIR fueron S. sagax (72.91%), N. simplex (22.29%), Myctophidae (1.50%), B. panamense (1.17%) y M. tenella (0.84%). Se obtuvieron un total de 173 estómagos durante la estación fría y se identificaron 16 ítems. Según el %IIR, las presas más importantes fueron H. thrissina (45.95%), N. simplex (45.24%), S. sagax (7.74%), Penaeus spp. (1) (Burukovsky, 1997) (0.40%) y Triphoturus spp. (0.26%) (Fig. 3). El huachinango del Pacífico se alimentó de presas significativamente diferentes en ambas estaciones climáticas (F = 45.52, P < 0.001). No hubo diferencias significativas en la dieta resultantes de la interacción sexo-estación climática (F = 1.03, P > 0.399), sexo-madurez (F = 0.79, P > 0.596), estación climática-madurez (F = 1.65, P > 0.099) o sexo-estación climática-madurez (F = 0.59, P > 0.800) (Tabla 2).
De acuerdo con el índice de Levin, el huachinango del Pacífico presentó una amplitud de nicho trófico estrecha (B i = 0.16). Este comportamiento se observó en machos (B i = 0.14), hembras (B i = 0.17), organismos maduros (B i = 0.12) y organismos inmaduros (B i = 0.17), y en la estación fría (B i = 0.08) y la estación cálida (B i = 0.11). Estos resultados fueron consistentes con la estrategia de alimentación representada en un plano bidimensional, que mostró que hubo un consumo alternado de un número reducido de presas en general (Fig. 4a) y por categoría (Fig. 4b-g), principalmente presas pelágico-costeras como como S. sagax, H. thrissina y N. simplex, y presas mesopelágicas como Myctophidae y B. panamense.

Figura 4 Gráficas de Costello, las cuales son representaciones bidimensionales de los recursos alimentarios, en general (a) y por machos (b), hembras (c), individuos maduros (d), individuos inmaduros (e), estación fría (f) y estación cálida (g). Las abreviaturas indican los primeros 5 ítems alimentarios y los más importantes: (Sg) Sardinops sagax, (Ns) Nyctiphanes simplex, (Hs) Harengula thrissina, (Mc) Myctophidae, (Bp) Benthosema panamense, (Mt) Munida tenella, (Po) Portunus xantusii, (P) Penaeus spp. (1) y (Tr) Triphoturus spp.
Los gráficos también mostraron la importante contribución de otras presas a la dieta, como los peces mictófidos Triphoturus spp. y los crustáceos M. tenella, Penaeus spp. (1) y P. xantusii. Hubo poca variación en el NT estimado para el huachinango del Pacífico (3.4); este valor fue consistente por sexo (machos = 3.5, hembras = 3.4), madurez sexual (inmaduros = 3.4, maduros = 3.5) y estación (fría = 3.4, cálida = 3.5).
DISCUSIÓN
El nivel de detalle obtenido aquí sobre las presas del huachinango del Pacífico (L. perú) en Santa Rosalía constituye una línea de base necesaria para detectar cambios en la composición trófica. También proporciona información de apoyo sobre los cambios en la dieta relacionados con la ontogenia, el sexo o la estacionalidad (Musseau et al. 2015, Morales y García-Alzate 2016).
Las principales presas identificadas en el espectro trófico (90% IIR) fueron peces costeros pelágicos como la sardina S. sagax, el arenque H. thrissina, el eufáusido N. simplex y peces mesopelágicos de la familia Myctophidae, en particular B. panamense. En Santa Rosalía, algunas de estas presas han constituido una parte importante del contenido estomacal de la cabrilla sardinera Mycteroperca rosacea (Moreno-Sánchez et al. 2019a). La distribución y abundancia de estas presas se ve afectada a lo largo del año por la temperatura del agua de mar y los procesos oceanográficos de mesoescala en el golfo de California (Gómez-Gutiérrez et al. 2010, Avendaño-Ibarra et al. 2013, Inda-Díaz et al. 2014, Contreras-Catala et al. 2015). Estos parámetros pueden afectar la composición del espectro trófico del huachinango del Pacífico y otros depredadores demersales en Santa Rosalía (Moreno-Sánchez et al. 2019a).
El contenido estomacal del huachinango del Pacífico podría brindar información sobre la abundancia y/o la presencia de presas en un hábitat determinado (Santamaría-Miranda et al. 2003). Estudios previos han demostrado que L. peru selecciona las presas más abundantes (Díaz-Uribe 1994, Saucedo-Lozano 1999, Rojas-Herrera et al. 2004). Este tipo de comportamiento significa que los peces oportunistas (Gerking 1994) son diferentes de los depredadores que seleccionan presas en función de la optimización energética, independientemente de la abundancia (Spitz et al. 2010). En el caso del huachinango del Pacífico, el consumo de presas abundantes y en su mayoría gregarias, como S. sagax, H. thrissina, B. panamense y N. simplex (Ladrón-de-Guevara et al. 2015, Moreno-Sánchez et al. 2019a), proporcionaría cantidades importantes de recursos tróficos con un gasto energético mínimo para su captura y consumo (Stephens y Krebs 1986, Moreno-Sánchez et al. 2016).
De acuerdo con varios reportes, los peces y los crustáceos son la principal fuente de alimento del huachinango en el golfo de California y otras zonas de la costa mexicana del Pacífico. Las especies presa que dominan la dieta del huachinango varían según la ubicación geográfica. La costa mexicana del Pacífico occidental se caracteriza por una amplia plataforma y arrecifes rocosos (Santamaría y Chávez 1999). Santamaría-Miranda et al. (2003) y Rojas Herrera et al. (2004) mostraron que, frente a las costas de Guerrero, este depredador se alimentaba de presas particularmente abundantes, como la anchoa pelágica Anchoa ischana y Anchoa lucida, y anfípodos del género Lembas spp. Estas presas pelágicas costeras son diferentes a las encontradas cerca de la península en el presente estudio, posiblemente debido a diferencias en los microhábitats (Moreno et al. 1979, Saucedo-Lozano et al. 1999, Acevedo-Cervantes et al. 2009) y a la afinidad biogeográfica de las especies (Avendaño-Ibarra et al. 2013).
Dentro del golfo de California, especialmente alrededor de las islas cercanas a Baja California Sur y en la zona costera adyacente a la bahía de La Paz, Díaz-Uribe (1994) reportó que el huachinango del Pacífico se alimentaba de grandes cantidades de urocordados (Doliolum spp. y Salpa spp.) y crustáceos (Squilla spp., Penaeus spp. y Callinectes spp.). En general, el sustrato rocoso y los arrecifes de coral aumentan la abundancia y la diversidad alrededor de las islas del golfo de California (Álvarez-Filip et al. 2006, Barjau et al. 2012). Los urocordados parecen ser presas importantes para varios depredadores en estos sitios (Díaz-Uribe 1994, Aguilar-Mora 2009).
Moreno-Sánchez et al. (2016) reportaron que había una gran proporción de crustáceos pelágicos (Penaeus californiensis, Pleuroncodes planipes, Myodocopida gen spp.) y una menor proporción de cefalópodos (Loligo spp.) en la dieta de L. peru en una zona costera de la bahía de La Paz. Estos autores también observaron que la dieta de este depredador difería entre los hábitats de La Paz (península) y Sinaloa (costa continental), debido a que en Sinaloa existe una plataforma amplia, sustrato arenoso, manglares y lagunas costeras, que son cruciales para la presencia de presas bentónicas, mientras que en la zona próxima a la península, la plataforma es estrecha, el sustrato es rocoso y existe surgencia estacional, lo que favorece a las presas pelágicas. Esto coincide con los resultados del presente estudio, ya que las presas más importantes en el espectro trófico fueron pelágicas.
También se detectaron variaciones significativas al tomar en cuenta el sexo, la ontogenia y la estacionalidad en Santa Rosalía. Considerando solo las presas principales, las hembras consumieron diferentes porcentajes (%IIR) de crustáceos (41.63%) y peces (56.57%) en comparación con los machos (crustáceos = 34.62%, peces = 64.49%). El contenido calórico por unidad de peso húmedo es menor en los crustáceos que en el pescado; sin embargo, el gasto energético por captura e ingestión de crustáceos es menor. Si los crustáceos se consumieran en grandes cantidades, esto compensaría su bajo contenido calórico (Díaz-Uribe 1994). En general, los estómagos de las hembras de huachinango del Pacífico (6,089 kg, 95 g) eran más pesados y contenían mayor biomasa de crustáceos que los de los machos (4,806 kg, 74 g). La mayor demanda de energía de las hembras de huachinango parece asociarse con la reproducción (Schwartzkopf y Cowan 2017).
Hubo un cambio importante en la dieta con la madurez sexual (Tabla 2). Estas diferencias no fueron evidentes en el análisis de conglomerados (Fig. S1), pero se observaron con el PERMANDEVA. Esto se debe a que el PERMANDEVA fue más eficiente y robusto para detectar diferencias entre matrices de datos con muchos ceros (Anderson 2017) y para detectar pequeñas diferencias en la proporción de biomasa de presas entre las clases de talla del huachinango del Pacífico. Aunque deberíamos haber observado un patrón de mayor biomasa de presas en los huachinangos de mayor tamaño, no fue el caso en este estudio (Fig. S1), posiblemente porque el grado de digestión de la presa (moderado a alto) fue similar en todas las categorías de talla. Esto también se ha reportado para otros depredadores carnívoros (Lagler et al. 1984, Moreno-Sánchez et al. 2019b).
Anteriormente, se han reportado diferencias tróficas entre las etapas de madurez para el huachinango del Pacífico. Este depredador ha mostrado un mayor consumo de crustáceos pequeños y abundantes en sus etapas tempranas de vida y de peces conforme incrementa de tamaño (Saucedo-Lozano et al. 1999, Rojas-Herrera y Chiappa-Carrara 2002, Santamaría et al. 2003, Moreno-Sánchez et al. 2016). Esta diferencia en la dieta se ha observado para las 2 etapas de madurez y para otros peces depredadores durante estas etapas de vida. Estos dirigen su esfuerzo a capturar presas específicas dependiendo de la morfología de su mandíbula, sus habilidades de caza, sus requerimientos energéticos y/o los cambios de hábitat (Hobson 1968, Gerking 1994, Abitia-Cárdenas et al. 1997, Musseau et al. 2015).
También hubo diferencias significativas en la alimentación entre estaciones climáticas. En particular, la surgencia estival (Cotero-Altamirano et al. 2015) y la cercanía de Santa Rosalía a importantes centros de productividad y de dispersión de presas, como las grandes islas del golfo de California (Martínez-Zavala et al. 2010), podrían influir en la abundancia de especies gregarias como S. sagax y B. panamense (Avendaño-Ibarra et al. 2013, Inda-Díaz et al. 2014, Cotero-Altamirano et al. 2015). La presencia de estas presas en el contenido estomacal de los huachinangos del Pacífico durante la estación cálida coincide con las mayores capturas comerciales (259,791 t para S. sagax) (Lanz et al. 2008, Martínez-Zavala et al. 2010, López-Serrano 2018) y abundancias máximas (20,954 individuos por 1,000 m3 para B. panamense) de estas especies (Santana-Iturrios et al. 2013). En el presente estudio, el peso en gramos de las presas del huachinango del Pacífico fue mayor en el verano, lo cual coincide con lo encontrado por Díaz-Uribe (1994) para la misma especie en la bahía de La Paz.
Durante la estación fría, los niveles de productividad primaria en el golfo de California son altos (Lavín y Marinone 2003, Álvarez-Borrego 2008), y se producen movimientos migratorios verticales de eufáusidos hacia la superficie de la columna de agua, donde forman densas agregaciones (Gómez-Gutiérrez et al. 2010). En particular, N. simplex juega un papel trofodinámico importante. Su abundancia calculada es >1,000 individuos por 1,000 m3 en las zonas productivas del golfo de California (Martínez-Gómez 2009), con valores máximos en invierno (Mendoza-Portillo 2013). Esto podría explicar la alta presencia de este tipo de presas en los estómagos del huachinango del Pacífico en la época de frío. Durante la misma estación climática, H. thrissina también fue un recurso trófico importante, al igual que Lutjanus argentiventris y M. rosacea en la parte sur de la península (Vázquez-Sánchez 2005, Moreno-Sánchez et al. 2019a).
En cuanto a la amplitud trófica, se identificaron 29 presas en el contenido estomacal del huachinango del Pacífico. Parrish (1987) describió al huachinango del Pacífico como un depredador generalista que tiene un espectro trófico más amplio que otras familias de peces demersales (e.g., serránidos). Sin embargo, aunque se pudieron identificar numerosas presas en el espectro trófico de este depredador, solo un reducido número de presas fueron consumidas en grandes cantidades en el golfo de California y la costa mexicana del Pacífico (Díaz-Uribe 1994, Santamaría-Miranda et al. 2003, Moreno-Sánchez et al. 2016). Este patrón también se observó en este estudio, con valores bajos del índice de Levin; también se reflejó en la representación bidimensional de la estrategia de alimentación (gráfica de Costello), donde 5 especies presa fueron los principales ítems en la dieta del huachinango del Pacífico y aportaron más del 90% (%IIR) a la dieta en general, por sexo, por madurez sexual y por estación climática. Toda esta evidencia sugiere un patrón oportunista en la dieta del huachinango del Pacífico, que cambia para aprovechar los recursos más abundantes y disponibles en un tiempo y hábitat dado. Este comportamiento ya ha sido reportado en otros estudios (Yáñez-Arancibia y Nugent 1977, Moreno-Sánchez et al. 2016).
De acuerdo con el NT obtenido para el huachinango del Pacífico en Santa Rosalía (NT = 3.4), esta especie podría clasificarse como un consumidor terciario, tal como se ha reportado para otras especies de huachinango en el golfo de México y el mar Caribe frente a Colombia (NT = 3.4-4.6). Si las poblaciones de estos depredadores de importancia ecológica se vieran afectadas, podría haber impactos inmediatos sobre el ecosistema dependiendo del NT que ocupen en los diferentes hábitats (Acero y Garzón 1985, Arreguín-Sánchez y Manickchand-Heileman 1998, Pérez-España 2003, García y Contreras 2011).
En general, concluimos que el huachinango del Pacífico en Santa Rosalía era un depredador carnívoro demersal oportunista, cuyo espectro trófico comprendió peces y crustáceos que eran abundantes en el área, particularmente especies pelágicas costeras (S. sagax, H. thrissina, N. simplex) y especies mesopelágicas (B. panamense y otros mictófidos). En comparación, la composición de este espectro trófico difiere del de los huachinangos en otras áreas del golfo de California y la costa mexicana del Pacífico.
AGRADECIMIENTOS
Todos los autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACYT, México), al Sistema Nacional de Investigadores y a la Secretaría de Investigación y Posgrado del Instituto Politécnico Nacional (IPN), y el financiamiento a través de los proyectos 20196721, 20201105 y 20200266. XGMS y LAAC agradecen el apoyo recibido del IPN a través de la Comisión de Operación y Fomento de Actividades Académicas y Estímulos al Desempeño de los Investigadores. EME agradece el apoyo recibido de CONACYT y la Facultad de Ciencias Marinas de la Universidad Autónoma de Sinaloa a través del programa Cátedras (proyecto No. 2137). MSIA agradece a la Universidad Autónoma de Baja California Sur la beca posdoctoral a través del proyecto “Estancias Posdoctorales por México 2021”. El autor de correspondencia declara en nombre de todos los autores que no existen conflictos de intereses.
REFERENCIAS
Abitia-Cárdenas, L.A., Galván-Magaña, F., Rodríguez-Romero, J. 1997. Food habits and energy values of prey of striped marlin Tetrapturus audax (Philipi, 1887) off the coast of México. Fish Bull. 95:360-368. [ Links ]
Acero, A.P., Garzón, J.F. 1985. Los pargos (Pisces: Perciformes: Lutjanidae) del Caribe colombiano. Actual Biol. 14(53):89-99. [ Links ]
Acevedo-Cervantes, A., López-Martínez, J., Herrera-Valdivia, E., Rodríguez-Romero, J. 2009. Análisis de la abundancia, dominancia y diversidad de la comunidad de peces demersales de profundidad de 90 a 540 metros en el Golfo de California, México. Interciencia. 34(9):660-665. [ Links ]
Aguilar-Mora, F. 2009. Dieta natural de Megathura crenulata (Sowerby, 1825) en arrecifes rocosos de la costa Pacífica de Baja California Sur, México [BSc thesis]. [Morelia, Mexico]: Universidad Michoacana de San Nicolás de Hidalgo. 63 p. [ Links ]
Allen, G. 1985. Snappers of the world an annotated and illustrated catalogue of lutjanid species known to date. FAO Fish. Synop. 125(6):1-208. [ Links ]
Álvarez-Borrego, S. 2008. Oceanografía de la región de las grandes islas. In: Danemann, G.D., Ezcurra, E. (eds.), Bahía de los Ángeles: recursos naturales and comunidad. Línea base 2007. San Diego (CA): SEMARNAT, INE, Pronatura Noroeste A.C., San Diego Natural History Museum. p. 45-65. [ Links ]
Alvarez-Filip, L., Reyes-Bonilla, H., Calderon-Aguilera, L.E. 2006. Community structure of fishes in Cabo Pulmo Reef, Gulf of California. Mar Ecol. 27(3):253-262. https://doi.org/10.1111/j.1439-0485.2006.00108.x [ Links ]
Amundsen, P.A., Gabler, H.M., Staldvik, F.J. 1996. A new approach to graphical analysis of feeding strategy from stomach contents data-modification of the Costello (1990) method. J Fish Biol. 48(4):607-614. http://doi.org/10.1111/j.1095-8649.1996.tb01455.x. [ Links ]
Anderson, M.J. 2017. Permutational multivariate analysis of variance (PERMANOVA). Chichester (UK): John Wiley & Sons, Ltdh. p.1-15. http://doi.org./10.1002/9781118445112.stat07841 [ Links ]
Arreguín-Sánchez, F., Manickchand-Heileman, S. 1998. The trophic role of lutjanid fish and impacts of their fisheries in two ecosystems in the Gulf of Mexico. J Fish Biol. 53(Suppl. A):143-153. https://dx.doi.org/10.1006/jfbi.1998.0802 [ Links ]
Avendaño-Ibarra, R., Godínez-Domínguez, E., Aceves-Medina, G., González-Rodríguez, E., Trasviña, A. 2013. Fish larvae response to biophysical changes in the Gulf of California, Mexico (winter-summer). J Mar Biol. 2013:1-17. https://doi.org/10.1155/2013/176760 [ Links ]
Badan-Dangon, A., Koblinsky, C.J., Baumgartner, T. 1985. Spring and summer in the Gulf of California: observations of surface thermal pattern. Oceanol Acta. 8(1):13-22. [ Links ]
Barjau, E., Rodríguez-Romero, J., Galván, F., Gutiérrez, F., López, J. 2012. Estructura temporal y espacial de la comunidad de peces arrecifales de la Isla San José, Golfo de California, México. Rev Biol Trop. 60(2):649-667. https://doi.org/10.15517/rbt.v60i2.3957 [ Links ]
Brusca, R.C. 1980. Common intertidal invertebrates of the Gulf of California. 2nd ed. Tucson (AZ): University of Arizona Press. 513 p. [ Links ]
Cartron, J.L., Ceballos, G., Felger, R.S. 2005. Biodiversity, ecosystems and conservation in northern México. Oxford (NY): Oxford University Press. p. 179-203. [ Links ]
Christensen, V., Pauly, D. 1992. Ecopath II - a software for balancing steady-state ecosystem models and calculating network characteristics. Ecol Model. 61:169-185. https://doi.org/10.1016/0304-3800(92)90016-8 [ Links ]
Colwell, R.K. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. V. 8.2. [place unknown]: [publisher unknown]; accessed 2019 Feb 01. http://viceroy.eeb.uconn.edu/estimates [ Links ]
Contreras-Catala, F., Sánchez-Velasco, L., Beier, E., Godínez, V.M. 2015. Efectos de un remolino de mesoescala sobre la distribución de larvas de peces mesopelágicas en el Golfo de California = Effects of a mesoscale eddy on the distribution of mesopelagic fish larvae in the Gulf of California. Rev Biol Mar Oceanogr. 50(3):575-582. https://doi.org/10.4067/s0718-19572015000400014 [ Links ]
Cortés, E. 1997. A critical review of methods of studying fish feeding based on analysis of stomach contents: application to elasmobranch fishes. Can J Fish Aquat Sci. 54(3):726-738. http://doi.org/10.1139/f96-316 [ Links ]
Costello, M.J. 1990. Predator feeding strategy and prey importance: a new graphical analysis. J Fish Biol. 36(2):261-263. http://doi.org/10.1111/j.1095-8649.1990.tb05601.x [ Links ]
Cotero-Altamirano, C.E., Valles-Ríos, H., Venegas, B. 2015. Biología reproductiva de la sardina del Pacífico Sardinops sagax de la costa occidental de Baja California, México. Cienc Pesq. 23(2):25-43. [ Links ]
Cruz-Romero, M., Espino-Barr, E., Del-Monte-Luna, P., García-Boa, A., Ayala-Cortés, A., González-Ruiz, J.J., Sánchez-González, S. 2000. Huachinango del Pacífico. In: Cisneros-Mata, M.Á., Beléndez, L.M. (eds.), Sustentabilidad y Pesca Responsable en México. Evaluación and Manejo 1999-2000. Mexico: INP-SEMARNAP. p. 297-326. [ Links ]
Díaz-Murillo, B.P. 2006. Catálogo de otolitos de peces marinos de las costas adyacentes a Baja California Sur, México [BSc thesis]. [La Paz (BCS)]: Universidad Autónoma de Baja California Sur (UABCS). 166 p. [ Links ]
Díaz-Uribe, J.G. 1994. Análisis trofodinámico del huachinango, Lutjanus peru, en las bahías de la Paz and la Ventana. BCS México. Ensenada (México): Centro de Investigación Científica and de Educación Superior. 57 p. [ Links ]
Díaz-Uribe, J.G., Chávez, E.A., Elorduy-Garay, J.F. 2004. Assessment of the Pacific red snapper (Lutjanus peru) fishery in the southwestern Gulf of California = Evaluación de la pesquería del huachinango (Lutjanus peru) en el suroeste del Golfo de California. Cienc Mar. 30(4):561-574. https://doi.org/10.7773/cm.v30i4.342 [ Links ]
Espino-Barr, E., Hernández-Montaño, D., Cabrera-Mancilla, E., Gutiérrez-Zavala, R.M., Gil-López, H.A., Cabral-Solís, E.G., García-Boa, A., Meléndez, C., Puente-Gómez, M., Romero-Acosta, C. 2006. Huachinango del Pacífico Sur. In: Arreguín-Sánchez, F., Beléndez-Moreno, L., Meléndez-Gómez, I., Solana-Sansores, R., Rancel-Dávalos, C., (eds.), Sustentabilidad y pesca responsable en México. Evaluación y manejo. Mexico: INPSAGARPA. p. 101-129. [ Links ]
Fischer, W., Krupp, F., Schneider, W., Sommer, C., Carpenter, K.E., Niem, V.H. 1995. Guía FAO para la Identificación de Especies para los Fines de Pesca, Pacífico Centro-Oriental. Vol. 2, Vertebrados: Parte 1. Rome (Italy): Food and Agriculture Organization of the United Nations. p. 647-1200. [ Links ]
Froese, R., Pauly, D., editors. 2019. FishBase: World Wide Web electronic publication. [place unkown]: Fishbase; accessed 2020 March 10. http://www.fishbase.org . [ Links ]
Gallardo-Cabello, M., Sarabia-Méndez, M., Espino-Barr, E., Anislado-Tolentino, V. 2010. Biological aspect of Lutjanus peru in Bufadero Bay, Michoacan, Mexico: growth, reproduction and condition factors = Aspectos biológicos de Lutjanus peru en Bahía Bufadero, Michoacán, México: crecimiento, reproducción y factores de condición. Rev Biol Mar Oceanogr. 45(2):205-215. https://doi.org/10.4067/s0718-19572010000200002 [ Links ]
García, C.B., Contreras, C.C. 2011. Trophic levels of fish species of commercial importance in the Colombian Caribbean. Int J Trop Biol. 59(3):1195-1203. http://doi.org/10.15517/rbt.v0i0.3391 [ Links ]
Gerking, S.D. 1994. Feeding ecology of fish. USA: Academic Press. 416 p. [ Links ]
Gómez-Gutiérrez, J., Tremblay, N., Martínez-Gómez, S., Robinson, C.J., Del-Ángel-Rodríguez, J., Rodríguez-Jaramillo, C., Zavala-Hernández, C. 2010. Biology of the subtropical sac-spawning euphausiid Nyctiphanes simplex in the northwestern seas of Mexico: Vertical and horizontal distribution patterns and seasonal variability of brood size. Deep-Sea Res Pt II. 57(7-8):606-615. http://doi.org/10.1016/j.dsr2.2009.10.010 [ Links ]
Hobson, E.S. 1968. Predatory behavior of some shore fishes in the Gulf of California. US Fish Wildl Serv Res Rep. 73:1-92. [ Links ]
Hurlbert, S.H. 1978. The measurement of niche overlap and some relatives. Ecology. 59(1):67-77. https://doi.org/10.2307/1936632 [ Links ]
Hyslop, E.J. 1980. Stomach contents analysis a review of methods and their application. J Fish Biol. 17(4):411-429. http://doi.org/10.1111/j.1095-8649.1980.tb02775.x [ Links ]
Inda‐Díaz, E.A., Sánchez‐Velasco, L., Lavín, M.F. 2014. The effects of a tidal‐mixing front on the distribution of larval fish habitats in a semi‐enclosed sea during Winter. J Mar Biol Assoc UK. 94(7):1517-1530. https://doi.org/10.1017/s002531541400023x [ Links ]
Jiménez-Valverde, A., Hortal, J. 2003. Las curvas de acumulación de especies and la necesidad de evaluar la calidad de los inventarios biológicos. Rev Iber Aracnol. 8:151-161. [ Links ]
Krebs, C. 1999. Ecological methodology. Menlo Park (CA): Addison Wesley Longman. 620 p. [ Links ]
Ladrón-de-Guevara, P., Heckel, G., Lavaniegos, B.E. 2015. Spatial and temporal occurrence of fin whales (Balaenoptera physalus) and euphausiids (Nyctiphanes simplex) in the Ballenas Channel, Gulf of California, Mexico = Variación espaciotemporal de la distribución de rorcuales comunes (Balaenoptera physalus) y eufáusidos (Nyctiphanes simplex) en el canal de Ballenas, golfo de California, México. Cienc Mar. 41(2):125-142. https://doi.org/10.7773/cm.v41i2.2497 [ Links ]
Lanz, E., Nevárez-Martínez, M.O., López-Martínez, J., Dworak, J.A. 2008. Spatial distribution and species composition of small pelagic fishes in the Gulf of California. Rev Biol Trop. 56(2):575-590. https://doi.org/10.15517/rbt.v56i2.5609 [ Links ]
Lavín, M.F, Marinone, S.G. 2003. An overview of the physical oceanography of the Gulf of California. In: Velasco-Fuentes, O.U., Sheinbaum, J., Ochoa, J. (eds.), Nonlinear processes in geophysical fluid dynamics. Dordrecht (Netherlands): Springer-Science Business Media, BV. 376 p. https://doi.org/10.1007/978-94-010-0074-1_11 [ Links ]
López-Serrano, A. 2018. Variación geográfica e interanual de la biomasa de Sardinops Sagax y Engraulis mordax en el Golfo de California: Un Enfoque Acústico [dissertation]. [La Paz (BC, Mexico)]: Centro Interdisciplinario de Ciencias Marinas-Instituto Politécnico Nacional (CICIMAR-IPN) . 155 p. [ Links ]
Lagler, K.F., Bardach, J.E., Miller, R.R., May-Passino, D.R.M. 1984. Ictiología. Mexico City: AGT Editor. 1-489 p. [ Links ]
Lowry, M.S. 2011. Photographic catalog of California marine fish otoliths: Prey of California sea lions (Zalophus californianus). NOAA Tech Memo NMFS-SWFSC 483: NOAA. 250 p. [ Links ]
Martínez-Gómez, S. 2009. Producción de biomasa de Nyctiphanes simplex (Crustacea: euphausiacea) en el Golfo de California, México [MSc thesis]. [La Paz (BC, Mexico)]: Centro Interdisciplinario de Ciencias Marinas-Instituto Politécnico Nacional. 107 p. [ Links ]
Martínez-Zavala, M.A., Nevárez-Martínez, M.O., Anguiano-Carrazco, M.L., Santos-Molina, J.P., Godínez-Cota, A.R. 2010. Captura de peces pelágicos menores en el Golfo de California, temporada de pesca 2007-2008. Cienc Pesq. 18(2):5-18. [ Links ]
Mendoza-Portillo, F.J. 2013. Estructura de la comunidad del holoplancton y meroplancton durante invierno y verano en el Golfo de California [MSc thesis]. [La Paz (BC, Mexico)]: Centro interdisciplinario de Ciencias Marina-Instituto Politécnico Nacional. 86 p. [ Links ]
Miller, G.L., Jorgensen, S.C. 1973. Meristic characters of some marine fishes of the western Atlantic Ocean. Calif Dep Fish Game Fish Bull. 71:301-312. [ Links ]
Morales, J., García-Alzate, C. 2016. Estructura trófica de los peces en arroyos del Corral de San Luis, cuenca del Bajo Magdalena, Caribe, Colombia. Rev Biol Trop. 64(2):715-732. [ Links ]
Morales-Zárate, M.V., Arreguín-Sánchez, F., López-Martínez, J., Lluch-Cota, S.E. 2004. Ecosystem trophic structure and energy flux in the northern Gulf of California, Mexico. Ecol Model. 174(4):331-345.https://dx.doi.org/10.1016/j.ecolmodel.2003.09.028 [ Links ]
Moreno, C.A., Duarte, W.E., Zamorano, J.H. 1979. Variación latitudinal del número de especies de peces en el sublitoral rocoso: una explicación ecológica. Arch Biol Med Exper. 12:169-178. [ Links ]
Moreno-Sánchez, X.G., Abitia-Cardenas, L.A., Trujillo-Retana, G., Navia-López, A.F., Ramírez-Pérez, J.S., Shirasago-German, B. 2016. Variation of feeding habits of Lutjanus peru (Actinopterygii: Perciformes: Lutjanidae) caught in two regions of the Gulf of California, Mexico. Acta Ichthyol Piscat. 46(2):97-108. http://doi.org/10.3750/AIP2016.46.2.05 [ Links ]
Moreno-Sánchez, X.G., Pérez-Rojo, M.P., Irigoyen-Arredondo, M.S., Marín-Enríquez, E., Abitia-Cárdenas, L.A. 2019a. Feeding habits of the leopard grouper, Mycteroperca rosacea (Actinopterygii: Perciformes: Epinephelidae), in the central Gulf of California, BCS, Mexico. Acta Ichthyol Piscat. 49(1):9-22. http://doi.org/10.3750/AIEP/02321 [ Links ]
Moreno-Sánche,z X.G., Palacios-Salgado, D.S., Granados-Amores, J., Abitia-Cárdenas, A.B., Escobar-Sánchez, O. 2019b. Feeding habits of the Mexican barracuda, Sphyraena ensis Jordan and Gilbert, 1882, in the southeastern end of the Gulf of California = Hábitos alimentarios de la barracuda Mexicana, Sphyraena ensis Jordan y Gilbert, 1882, en el extremo sureste del golfo de California. Cienc Mar. 45(3):137-150. https://doi.org/10.7773/cm.v45i3.2969 [ Links ]
Morris, R.H., Abbott, D..P, Haderlie, E.C. 1980. Intertidal Invertebrates of California. Stanford (CA): Stanford University Press. 690 p. [ Links ]
Musseau, C., Vincenzi, S., Jesenšek, D., Cantera, I., Boulêtreau, S., Santoul, F., Crivelli, A.J. 2015. Direct and indirect effects of environmental factors on dietary niches in size-structured populations of a wild salmonid. Ecosphere. 6(12):256. http://doi.org/10.1890/ES15-00109.1 [ Links ]
Nikolsky, G.V. 1963. The ecology of fishes. New York (NY, USA): Academic Press. 352 p. [ Links ]
Oksanen, J., Blanchet, F.G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D., Minchin, P.R., O’Hara, R.B., Simpson, G.L., Solymos, P., et al. 2016. Vegan: Community Ecology Package. v.2.4-1: R documentation. Vienna (Austria): [publisher unknown]; accessed 2019 Feb 14. http://CRAN.R-project.org/package=vegan [ Links ]
Parrish, J.D. 1987. The trophic biology of snapper and grouper. In: Polovina, J.J., Ralston, S. (eds.), Tropical Snappers and Groupers: Biology and Fisheries Management. Boulder (CO, USA): Westview Press. p. 405-463. [ Links ]
Pérez-España, H. 2003. Ecological importance of snappers in the stability of modeled coastal ecosystems. Ecol Model. 168(1-2):13-24. http://doi.org/10.1016/S0304-3800(03)00201-1 [ Links ]
Pinkas, L., Oliphant, M.S., Iverson, I.L.K. 1971. Food habits of albacore, bluefin tuna, and bonito in California waters. Calif Dep Fish Game Fish Bull. 152:1-105. [ Links ]
R Core Team. 2020. R: A language and environment for statistical computing. Vienna (Austria): R Foundation for Statistical Computing. https://www.R-project.org/ [ Links ]
Roden, G.I. 1964. Oceanographic aspects of the Gulf of California In: Gonzáles-Farias, F., Rosa-Vélez, J., (eds.), Temas de Oceanografía Biológica en México, Vol 2; Ensenada (BC, Mexico): Universidad Autónoma de Baja California Sur. 288 p. [ Links ]
Rojas-Herrera, A.A., Chiappa-Carrara, X. 2002. Hábitos alimenticios del flamenco Lutjanus guttatus (Pisces: Lutjanidae) en la costa de Guerrero, México = Feeding habits of the spotted rose snapper Lutjanus guttatus (Pisces: Lutjanidae) in the coast of Guerrero, Mexico. Cienc Mar. 28(2):133-147. http://doi.org/10.7773/cm.v28i2.219 [ Links ]
Rojas-Herrera, A.A., Mascaró, M., Chiappa-Carrara, X. 2004. Hábitos alimentarios de los peces Lutjanus peru y Lutjanus guttatus (Pisces: Lutjanidae) en Guerrero, México. Rev Biol Trop. 52(4):959-971. [ Links ]
Salgado-Barragán, J., Hendrickx, M.E. 2010. Clave ilustrada para la identificación de los estomatópodos (Crustacea: Hoplocarida) del Pacífico oriental = An illustrated key to the identification of eastern Pacific stomatopods (Crustacea: Hoplocarida). Rev Mex Biodiv. 81:1-49. http://dx.doi.org/10.22201/ib.20078706e.2010.0.224 [ Links ]
Santamaría, A., Chávez, E.A. 1999. Evaluación de la pesquería de Lutjanus peru (Pisces: Lutjanidae) de Guerrero, México. Rev Biol Trop. 47(3):571-580. https://doi.org/10.15517/rbt.v47i3.19208 [ Links ]
Santamaría-Miranda, A., Elorduly-Garay, J.F., Rojas-Herrera, A.A. 2003. Hábitos alimentarios de Lutjanus peru (Pisces: Lutjanidae) en las costas de Guerrero, México. Rev Biol Trop. 51(2):101-123. [ Links ]
Santana-Iturríos, M.D., Palacios-Salgado, D.S., Salinas-Zavala, C.A. 2013. Abundance and distribution of lantern fishes (Myctophiformes: Myctophidae) around San Pedro Martir Island, Gulf of California, during 2008. Latin Am J Aquat Res. 41(3):387-394. https://doi.org/10.3856/vol41-issue3-fulltext-2 [ Links ]
Saucedo-Lozano, M., González-Sansón, G., Chiappa-Carrara, X. 1999. Alimentación natural de juveniles de Lutjanus peru (Nichols and Murphy, 1922) (Lutjanidae: Perciformes) en las costas de Jalisco and Colima, México = Natural feeding of juveniles of Lutjanus peru (Nichols and Murphy, 1922) (Lutjanidae: Perciformes) off the coast of Jalisco and Colima, Mexico. Cienc Mar. 25(3):381-400. https://doi.org/10.7773/cm.v25i3.716 [ Links ]
Schwartzkopf, B.D., Cowan, J.H. Jr. 2017. Seasonal and sex differences in energy reserves of red snapper Lutjanus campechanus on natural and artificial reefs in the northwestern Gulf of Mexico. Fisheries Sci. 83(1):13-22. https://doi.org/10.1007/s12562-016-1037-1 [ Links ]
Spitz, J., Mourocq, E., Leauté, J.P., Quéro, J.C., Ridoux, V. 2010. Prey selection by the common dolphin: Fulfilling high energy requirements with high quality food. J Exp Mar Biol Ecol. 390(2):73-77. https://doi.org/10.1016/j.jembe.2010.05.010 [ Links ]
Stephens, D.W., Krebs, J.R. 1986. Foraging theory. Princeton (NJ): Princeton University Press. 247 p. https://doi.org/10.1046/j.1420-9101.1988.1010086.x [ Links ]
Suzuki, R., Terada, Y., Shimodaira, H. 2019. pvclust: Hierarchical Clustering with P-Values via Multiscale Bootstrap Resampling. R package version 2.2-0. Vienna (Austria): [publisher unknown]; accessed 2021 Jan 12. https://CRAN.R-project.org/package=pvclust [ Links ]
Vázquez-Sánchez, R.I. 2005. Hábitos alimentarios del pargo amarillo Lutjanus argentiventris (Peters, 1869) en la bahía de la Paz, B.C.S [MSc thesis]. [Mexico]: Centro interdisciplinario de Ciencias Marinas-Instituto Politécnico Nacional (CICIMAR-IPN). 114 p. [ Links ]
Wilkinson, T.A.C., Wiken, E., Bezaury-Creel, J., Hourigan, T., Agardy, T., Herrmann, H., Janishevski, L., Madden, C., Morgan, L., Padilla, M. 2009. Ecorregiones marinas de América del Norte. Montreal (Canada): Commission for Environmental Cooperation. 200 p. [ Links ]
Yáñez-Arancibia, A., Nugent, R.S. 1977. El papel ecológico de los peces en estuarios y lagunas costeras. Anales del Centro Ciencias del Mar y Limnología de la Universidad Nacional Autónoma de México. 4(1):107-114. [ Links ]
Zárate-Becerra, M.E., Espino-Barr, E., Puente-Gómez, M., García-Boa, A., Cabral-Solís, E.G., Hernández-Montaño, D., Meléndez-Galicia, C., Arellano-Torres, A., Gutiérrez-Zavala, R.M., Cabrera-Mancilla, E., et al. 2014. Huachinango del Pacífico Centro-Sur, costa de Nayarit a Chiapas. In: Beléndez-Moreno, F.J., Espino-Barr, E., Galindo-Cortes, G., Gaspar-Dillanes, M.T., Huidobro-Campos, L., Morales-Bojorquez, E., (eds.), Sustentabilidad and Pesca Responsable en México. Evaluación and Manejo. Mexico City: Instituto Nacional de Pesca. p. 141-175. https://dx.doi.org/10.13140/rg.2.1.1184.8807 [ Links ]
Recibido: 27 de Agosto de 2020; Aprobado: 20 de Mayo de 2021











 text in
text in 



