Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.48 Ensenada Jan./Dec. 2022 Epub Nov 17, 2023
https://doi.org/10.7773/cm.y2022.3312
Artículos
Sobre las variaciones morfológicas en una población de Cladonema radiatum (Hydrozoa: Cladonematidae): Nueva evidencia en el sur del golfo de México
1Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional, Unidad Mérida, Departamento de recursos del mar, 97310 Mérida, Yucatán, Mexico.
2Universidad Autónoma de Yucatán, Facultad de Medicina Veterinaria y Zootecnia, Departamento de recursos marinos tropicales, 97100 Mérida, Yucatán, Mexico.
La falta de conocimiento sobre la variabilidad morfológica en poblaciones de hidrozoos ha generado numerosas identificaciones erróneas a lo largo de la historia. Cladonema radiatum Dujardin, 1843 se caracteriza por presentar diferentes morfologías en diferentes localidades del mundo, lo cual ha ocasionado diversas confusiones taxonómicas dentro del grupo. En el presente estudio se analiza la variabilidad morfológica en una población de C. radiatum. El material provino de una laguna costera en el sur del golfo de México. Los muestreos se llevaron a cabo durante 3 meses del año 2017. En cada sitio de muestreo se registraron los valores de salinidad, oxígeno disuelto y temperatura. Cladonema radiatum fue más abundante y presentó tamaños más grandes cuando la laguna tuvo los valores más bajos de salinidad. Se reconocieron 6 morfologías diferentes. La presencia de papilas gelatinosas en la superficie abaxial de los bulbos marginales y un arreglo abaxial de los nematocistos en las ramificaciones más cortas de los tentáculos marginales son características documentadas por primera vez en la especie. Estas consideraciones enriquecen la descripción taxonómica de C. radiatum y contribuyen al conocimiento sobre la taxonomía de hidrozoos en México. No obstante, la taxonomía de Cladonema continúa siendo confusa. El presente trabajo establece una base para futuros estudios integradores que clarifiquen los límites morfológicos del género. Sin embargo, solo trabajos integradores basados en la morfología y el análisis molecular de las especies del género permitirán decodificar su naturaleza críptica.
Palabras clave: taxonomía; plasticidad fenotípica; laguna costera; Anthoathecata; evolución
The lack of knowledge on the morphological variability in hydrozoan populations has resulted in numerous misidentifications over history. Cladonema radiatum Dujardin, 1843 is characterized by presenting different morphologies in different localities of the world, which has caused many taxonomic confusions within the group. In this study, the morphological variability in a population of C. radiatum is analyzed. The material came from a coastal lagoon in the southern Gulf of Mexico. The samplings were carried out for 3 months in 2017. Salinity, dissolved oxygen, and temperature were recorded at each sampling site. Cladonema radiatum was more abundant and bigger when the lagoon showed the lowest levels of salinity. Six different morphologies were recognized. The presence of gelatinous papillae on the abaxial surface of marginal bulbs and an abaxial arrangement of nematocysts in the shortest branches of the tentacles are features recorded for the first time in the species. These considerations enrich the taxonomic description of C. radiatum and contribute to the knowledge on the taxonomy of Hydrozoa in Mexico. The taxonomy of Cladonema continues to be confusing, and the present work sets a basis for further integrative studies clarifying the morphological boundaries of the genus. However, only integrative works based on the morphology and molecular analyses of the species would be able to decode its cryptic nature.
Key words: taxonomy; phenotypic plasticity; coastal lagoon; Anthoathecata; evolution
INTRODUCCIÓN
La variabilidad morfológica en poblaciones de hidrozoos es un fenómeno común que no debe pasar desapercibido (Ralph 1956; Wyttenbach et al. 1973; Kosevich 2008; Cunha et al. 2015, 2016, 2020). La falta de conocimiento sobre este tema ha resultado en numerosas identificaciones erróneas de las especies a través de la historia. Un ejemplo de esto son las especies del género CladonemaDujardin, 1843, el cual se distribuye ampliamente en el mundo y posee un estilo de vida semi-epibéntico (Schuchert 2006, Gershwin y Zeidler 2008, Schuchert 2012, Cedeño-Posso 2014). La taxonomía de Cladonema ha sido objeto de discusión a través de los años, debido a la carencia de investigación sobre su variabilidad morfológica (Schuchert 2006). Actualmente, el género Cladonema comprende 8 especies válidas: Cladonema californicumHyman, 1947; Cladonema myersiRees, 1949; Cladonema novaezelandiaeRalph, 1953; Cladonema pacificum Naumov, 1955; Cladonema radiatum; Cladonema timmsiiGershwin y Zeidler, 2008; Cladonema multiramosumZhou, Gu, Wang & Chen, 2022; y Cladonema digitatumFang et al., 2022 (Schuchert 2022). Sin embargo, pocos trabajos se han centrado en delimitar las características morfológicas diagnósticas, por lo que los límites taxonómicos del género permanecen inciertos. Algunos ejemplos de estos trabajos son los realizados por Billard (1905), Mayer (1910), Russell (1953), Brinckmann-Voss (1970), Bouillon et al. (2004) y Schuchert (1996, 2006, 2012). No obstante, la mayoría de estos trabajos enfatizan en el desarrollo y la morfología de la fase medusa, y dejan poco estudiadas características diagnosticas importantes del hidroide y sus posibles variaciones morfológicas.
Cladonema radiatumDujardin, 1843 es la especie más estudiada del género y probablemente de la familia Cladonematidae. La mayoría de los estudios sobre esta especie se han realizado en el mar Mediterráneo (Brinckmann-Voss 1970, Bouillon et al. 2004, Schuchert 2006, Gravili et al. 2015). En México se ha reportado a C. radiatum en numerosas ocasiones en el mar Caribe (Segura-Puertas y Damas-Romero 1997, Segura-Puertas et al. 2003); sin embargo, para esta región solo existe un trabajo sobre su taxonomía en el sur del golfo de México (Ahuatzin-Hernández et al. 2020). Esta especie se distribuye principalmente en el océano Atlántico, en el mar Mediterráneo, a lo largo de las costas de Europa, en el mar Caribe y en el golfo de México, aunque también se encuentra en algunas localidades del Indo-Pacífico (Gershwin y Zeidler 2008, Gravili et al. 2015, Ahuatzin-Hernández et al. 2020). Cladonema radiatum se caracteriza por presentar numerosas morfologías, las cuales han generado sinonimias y confusión dentro del grupo a lo largo de la historia (ver Schuchert 2006 para una lista completa de sinonimias). Actualmente, la ubicación de las gónadas, las características en los patrones de ramificación y el número de los canales radiales, así como el número de tentáculos marginales, son reconocidos como características taxonómicas confiables para identificar a la especie (Bouillon et al. 2004, Schuchert 2006). Sin embargo, los estudios enfocados en la variabilidad morfológica de C. radiatum son escasos y antiguos o representan poblaciones de Europa, por lo que su taxonomía continua poco estudiada en algunas localidades del océano Atlántico (Billard 1905, Mayer 1910, Russell 1953).
A través de los años, las principales investigaciones sobre la variabilidad morfológica en poblaciones de hidrozoos se han centrado en colonias de hidroides (e.g., Ralph 1956; Cunha et al. 2015, 2020), pero aquellas relacionadas con la variabilidad morfológica en hidromedusas son escasas (e.g., Russell 1953, Álvarez-Silva et al. 2003, Ocaña-Luna et al. 2021). Este sesgo ha generado un conocimiento fragmentario sobre la taxonomía e historia natural de diversos grupos de hidrozoos, lo cual ha llevado a identificaciones erróneas, sinonimias y especies dudosas (Hirai 1958, Schuchert 2006). Técnicas recientes basadas en la biología molecular han sido útiles para resolver algunos de estos problemas, y se han reportado diversas especiaciones crípticas en hidrozoos (Nawrocki et al. 2010, Miglietta y Cunningham 2012, Miglietta et al. 2019); sin embargo, las descripciones taxonómicas basadas en la morfología continúan siendo fundamentales para el entendimiento de la sistemática y la evolución de los grupos taxonómicos (Cunha et al. 2016).
En México son escasos los estudios que brindan información sobre la morfología y la taxonomía de hidromedusas (e.g., Álvarez-Silva et al. 2003, Cortés-Lacomba et al. 2013, Ahuatzin-Hernández et al. 2020, Mendoza-Becerril et al. 2020, Ocaña-Luna et al. 2021). En este trabajo se analizan las variaciones morfológicas en una población de C. radiatum. Se describen nuevas características sobre los bulbos y el arreglo de los nematocistos en los tentáculos marginales de la especie, lo cual brinda una descripción taxonómica enriquecida y mejora el conocimiento sobre la taxonomía de las poblaciones de hidrozoos en México.
MATERIALES Y MÉTODOS
Área de estudio
La laguna costera de Chelem se localiza en la península de Yucatán, al sur del golfo de México, entre el puerto de Progreso y el poblado de Chelem (Herrera-Silveira y Morales-Ojeda 2010). La laguna se encuentra rodeada principalmente por Rhizophora mangle y tiene un comportamiento usualmente euhalino. Su profundidad varía entre 0.5 y 2.5 m. La laguna de Chelem ha sido impactada por la construcción de carreteras y puentes, dragados, rellenos y la creación de conexiones artificiales al mar, lo cual ha alterado las condiciones hidrológicas del ecosistema, su profundidad y su composición biológica (Herrera-Silveira 2006). El fondo de Chelem está cubierto principalmente por Halodule wrightii y Thalassia testudinum; sin embargo, también se encuentran presentes algunas especies de macroalgas verdes y rojas (Herrera-Silveira 2006, Herrera-Silveira y Morales-Ojeda 2010).
Muestreo de campo
El material zooplanctónico se recolectó en la laguna costera de Chelem (21°17ʹ N, 89°40ʹ W), a través de arrastres circulares con una red de zooplancton de 60 cm de diámetro y 333 μm. Los muestreos se llevaron a cabo durante 3 meses (julio, septiembre y noviembre) del año 2017. Debido a la poca profundidad de la laguna, fue posible recolectar pólipos pertenecientes a C. radiatum (21°16ʹ33ʺ N, 89°40ʹ06ʺ W; 0.5-1.5 m de profundidad), lo cual permitió corroborar su identificación. Los pólipos fueron recolectados incidentalmente a través de arrastres zooplanctónicos y a través de estructuras de bioincrustación. En cada estación de muestreo se midieron parámetros de temperatura, oxígeno disuelto y salinidad utilizando un multiparamétrico YSI, modelo 550 (Tabla 1). Las muestras de zooplancton fueron fijadas en una solución de formaldehido al 4% con agua de mar, y los ejemplares de hidromedusas mejor preservados fueron depositados en la Colección Regional de Cnidarios de la Península de Yucatán, con sede en la Universidad Nacional Autónoma de México: Facultad de Ciencias, Unidad Multidisciplinaria de Docencia e Investigación-Sisal, Yucatán (números de catálogo: YUC-CC-254-11-001544, YUC-CC-254-11-001545).
Tabla 1 Valores de la abundancia de las hidromedusas, la salinidad , el oxígeno disuelto (DO, mg·L-1) y la temperatura (°C) registrados en cada estación durante los 3 meses de muestreo.
| Stations | |||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | ||||
| July | Medusae | 28 | 11 | 7 | 3 | 1 | 5 | 0 | 0 | 1 | 0 | 1 | 13 | ||
| Temp | 30.0 | 29.6 | 29.3 | 29.5 | 29.6 | 29.7 | 29.5 | 29.5 | 29.9 | 29.8 | 30.2 | 29.7 | |||
| DO | 6.0 | 4.4 | 3.7 | 4.0 | 2.9 | 1.3 | 1.5 | 1.7 | 1.8 | 1.9 | 2.3 | 2.4 | |||
| Salinity | 37.3 | 39.6 | 40.2 | 40.3 | 40.7 | 41.1 | 39.6 | 38.3 | 37.5 | 37.5 | 37.4 | 38.4 | |||
| September | Medusae | 3 | 0 | 5 | 0 | 0 | 0 | 6 | 13 | 7 | 5 | 0 | 0 | ||
| Temp | 31.6 | 31.0 | 30.4 | 30.8 | 30.3 | 30.7 | 30.6 | 30.4 | 29.8 | 29.9 | 30.4 | 30.4 | |||
| DO | 1.4 | 2.6 | 2.9 | 3.9 | 3.3 | 3.4 | 5.3 | 5.4 | 2.9 | 3.4 | 3.4 | 3.6 | |||
| Salinity | 40.9 | 45.6 | 46.4 | 40.3 | 41.1 | 39.9 | 41.1 | 39.8 | 36.9 | 36.3 | 36.8 | 33.3 | |||
| November | Medusae | 16 | 1 | 1 | 0 | 0 | 2 | 0 | 0 | 3 | 2 | 0 | 0 | ||
| Temp | 27.7 | 27.6 | 27.8 | 27.4 | 27.3 | 26.7 | 27.6 | 27 | 26.2 | 26.3 | 26.4 | 26.5 | |||
| DO | 7.4 | 6.8 | 6.1 | 6.5 | 6.6 | 6.4 | 6.8 | 6.2 | 5.9 | 5.9 | 5.8 | 4.7 | |||
| Salinity | 42.3 | 45.1 | 45.5 | 42.0 | 41.8 | 41.7 | 39.9 | 38.9 | 38.1 | 38.0 | 38.1 | 38.2 | |||
| Long | 89°46'8.36'' | 89°47'19.1'' | 89°47'7.1'' | 89°44'48.2'' | 89°44'39.5'' | 89°44'27.5'' | 89°44' 4.7'' | 89°43'41.4'' | 89°42'47.3'' | 89°42'15.4'' | 89°42'17.3'' | 89°41'42.7'' | |||
| Lat | 21°14'48.8'' | 21°14'36.9'' | 21°14'58.0'' | 21°15'21'' | 21°14'51.7'' | 21°15'43.7'' | 21°15'12.1'' | 21°15'39.6'' | 21°15'49'' | 21°15'34.1'' | 21°15'55'' | 21°16'03'' | |||
El material zooplanctónico fue examinado con un microscopio estereoscópico, y 134 ejemplares de C. radiatum fueron separados para este estudio. Los dibujos y las fotografías de las características taxonómicas fueron realizadas usando una cámara digital montada en un microscopio óptico. Las características morfológicas (i.e., canales radiales, tentáculos orales, tentáculos marginales, ramificación de los tentáculos marginales y arreglo de los nematocistos; características del manubrio; la forma de la umbrela, su ancho y su alto; y la presencia de proyección apical) de ejemplares preservados fueron observadas y registradas. Las morfologías de C. radiatum se establecieron considerando el número y los patrones de ramificación de los canales radiales, así como el número de los tentáculos orales y los bulbos marginales, ya que la mayor variabilidad morfológica en la especie ocurre en estas estructuras (Gravili et al. 2015). Además, estas características prevalecen durante el desarrollo ontogénico (Brinckmann-Voss 1970) y no se ven afectadas por los métodos del muestreo, como podría suceder con las ramificaciones de los tentáculos marginales o la forma de la umbrela.
RESULTADOS
De manera general, los ejemplares presentaron una umbrela ligeramente más ancha (0.82 mm [0.3 ± 2.2]) que alta (0.67 mm [0.2 ± 1.8]). Cladonema radiatum fue más abundante durante el mes de julio, y los ejemplares recolectados durante este mes tuvieron, en promedio, los tamaños más grandes de umbrela. Además, en el mes de julio se registraron los niveles más bajos de salinidad y oxígeno disuelto (39.0 y 2.8 mg·L-1, respectivamente). Durante este mes, la temperatura mostró valores intermedios entre septiembre y noviembre (29.7 °C) (Tabla 2).
Tabla 2 Medidas promedio de los ejemplares y los parámetros fisicoquímicos para cada mes.
| Width (mm) | Height (mm) | Temperature (°C) | Dissolved oxygen (mg·L-1) | Salinity | ||
| Jul | Average | 0.86 | 0.73 | 29.7 | 2.8 | 39.0 |
| Jul | Min | 0.40 | 0.20 | 29.3 | 1.3 | 37.2 |
| Jul | Max | 1.40 | 1.40 | 30.2 | 6.0 | 41.0 |
| Jul | n | 70.00 | 70.0 | 8.0 | 8.0 | 8.0 |
| Sep | Average | 0.85 | 0.64 | 30.4 | 3.5 | 39.9 |
| Sep | Min | 0.30 | 0.20 | 29.8 | 1.3 | 36.2 |
| Sep | Max | 2.20 | 1.80 | 31.6 | 5.3 | 46.4 |
| Sep | n | 39.00 | 39.00 | 6.0 | 6.0 | 6.0 |
| Nov | Average | 0.68 | 0.56 | 27.0 | 6.4 | 40.8 |
| Nov | Min | 0.30 | 0.20 | 26.2 | 4.7 | 38.0 |
| Nov | Max | 1.80 | 1.50 | 27.7 | 7.4 | 45.4 |
| Nov | n | 25.00 | 25.00 | 6.0 | 6.0 | 6.0 |
Se identificaron 6 configuraciones morfológicas diferentes (A-F) (Fig. 1). Los canales radiales y los tentáculos orales fueron las características más variables. El número total de canales radiales y bulbos marginales mostraron patrones relacionados. Asimismo, los patrones de ramificación de los canales radiales se encuentran relacionados con los tentáculos orales y las aristas que conforman la base del manubrio, ya que estos coinciden en número y los canales radiales surgen de estas aristas, así que la distribución de los patrones de ramificación depende de esta característica. La morfología D fue la más numerosa en este estudio (n = 121), mientras que las morfologías B, C y F estuvieron representadas por solo un ejemplar (Tabla 3). Una posible séptima morfología, representada por un solo ejemplar con 9 tentáculos marginales, 5 tentáculos orales y 3 canales radiales no ramificados y 3 ramificados fue reconocida. Sin embargo, esta morfología no fue considerada en el trabajo, ya que el ejemplar se encontraba muy deteriorado y las características mencionadas previamente podrían resultar inciertas. La presencia de papilas sobre la superficie abaxial de los bulbos y un arreglo abaxial de nematocistos son características observadas por primera vez en esta especie.
Tabla 3 Configuraciones morfológicas (A-F) registradas en una población de Cladonema radiatumDujardin, 1843 en el sur del golfo de México.
| A | B | C | D | E | F | |
| Total radial canals (n) | 9 | 8 | 7 | 9 | 8 | 10 |
| Straight canals (n) | 5 | 4 | 3 | 3 | 2 | 2 |
| Branched canals (n) | 2 | 2 | 2 | 3 | 3 | 4 |
| Marginal bulbs (n) | 9 | 8 | 7 | 9 | 8 | 10 |
| Oral tentacles (n) | 7 | 6 | 5 | 6 | 5 | 6 |
| Width average (mm) | 0.95 (0.9-1.0) | 0.80 | 0.40 | 0.81 (0.3-2.2) | 0.92 (0.3-1.2) | 0.60 |
| Height average (mm) | 0.85 (0.6-1.10) | 0.90 | 0.40 | 0.67 (0.2-1.8) | 0.71 (0.4-1.0) | 0.20 |
| Pouches | Present | Absent | Absent | Present | Present | Absent |
| Black marks | Present | Present | Absent | Present | Absent | Absent |
| Total specimens (n) | 2 | 1 | 1 | 121 | 7 | 1 |

Figura 1 Patrones registrados en los canales radiales de las diferentes morfologías encontradas en Cladonema radiatumDujardin, 1843.
Taxonomía
La clasificación de C. radiatum es la siguiente.
Clase: Hidrozoa Owen, 1843
Subclase: Hidroidolina Collins, 2000
Superorden: Anthoathecata Cornelius, 1992
Orden: Capitata Kühn, 1913
Familia: Cladonematidae Gegenbaur, 1857
Especie: Cladonema radiatumDujardin, 1843
(Fig. 2 a-g, ver Schuchert 2006 para una lista completa de sinonimias).
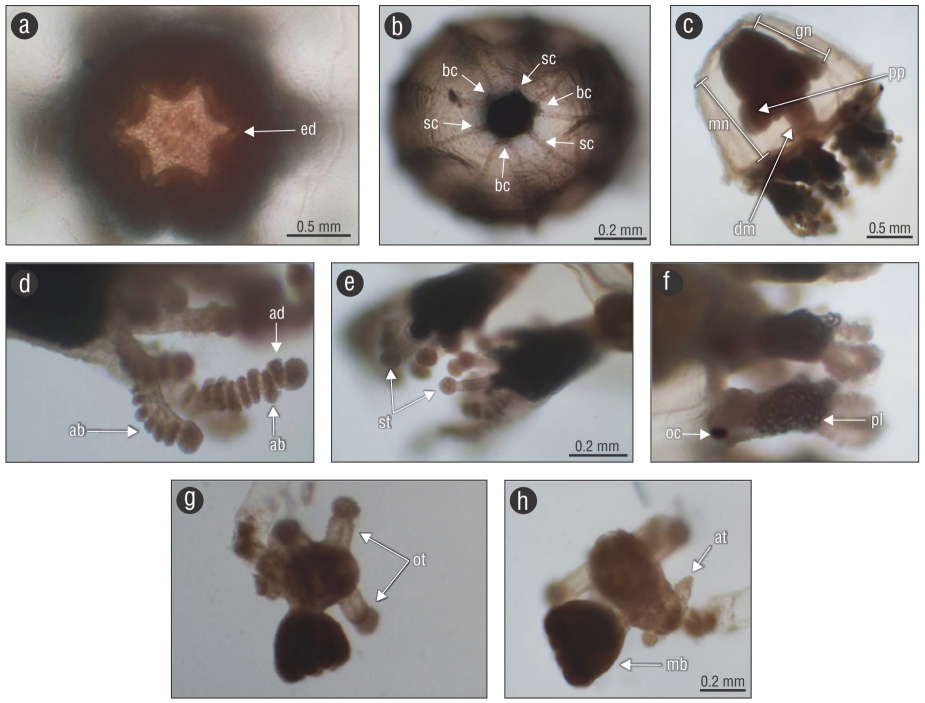
Figura 2 Características diagnosticas de Cladonema radiatumDujardin, 1843. (a-b) Vista aboral de la medusa: ed = aristas que conforman la base del manubrio, bc = canales ramificados, sc = canales no ramificados. (c) Ejemplar maduro de C. radiatum: mn = manubrio, gn = gónadas, pp = protuberancias perradiales en forma de saco y dm = porción distal del manubrio. (d) Tentáculos punzantes: ab = hilera de nematocistos abaxiales y ad = hilera de nematocistos adaxiales. (e) Tentáculos secundarios: st = tentáculos adhesivos. (f) Bulbo marginal: oc = ocelo y pl = papilas. (g-h) Hidroide: ot = tentáculos orales, at = tentáculos aborales y mb = brotes medusoides.
Diagnosis
Los especímenes mostraron las siguientes características: umbrela con forma de campana; 7-10 canales radiales, algunos de ellos ramificados; manubrio cilíndrico, con 5-7 tentáculos orales con un cúmulo de nematocistos en su parte terminal. Las gónadas cubren 2/3 superiores del manubrio. El número de tentáculos marginales se corresponde con el número total de canales radiales. Los bulbos marginales poseen un ocelo redondo de color negro en posición abaxial en su base y numerosas papilas gelatinosas sobre su superficie abaxial. Los tentáculos marginales son ramificados, con una base alargada y engrosada y numerosos cúmulos de nematocistos, con una ramificación principal alargada, de la cual surgen por detrás numerosos tentáculos adhesivos cortos. Los nematocistos se encuentran dispuestos en posiciones alternas, de forma abaxial-adaxial a lo largo de todo el tentáculo principal y exclusivamente abaxial en las ramificaciones laterales cortas. Es evidente un cúmulo de nematocisto en la parte terminal de cada ramificación. De 1 a 6 tentáculos surgen por detrás de los bulbos marginales; estos solo poseen un cúmulo terminal.
Descripción de la hidromedusa
La medusa posee una umbrela en forma de campana, con o sin proyección apical y cuando esta está presente es redondeada y poco perceptible. Su manubrio cilíndrico, carece de pedúnculo y tiene una base hexagonal, heptagonal o pentagonal, dependiendo del número de aristas que conforman su base, las cuales coinciden en número con los tentáculos orales. Tiene de 5 a 7 (usualmente 6) tentáculos orales, los cuales presentan un cúmulo de nematocistos en su parte terminal. Están presentes marcas redondas cerca de la base del manubrio, constituidas de pigmentos oscuros, y otras elongadas, en forma de líneas, cerca de su parte distal; las marcas son más evidentes en ejemplares maduros, y ambos tipos de marcas (redondeadas y lineales) coinciden en número con los tentáculos orales y las aristas que conforman la base del manubrio. El manubrio puede presentar o no protuberancias perradiales en forma de saco. En este estudio 18 ejemplares mostraron protuberancias y 116 carecieron de ellas. Cuando están presentes, las protuberancias en forma de saco coinciden en número con las marcas en el manubrio y los tentáculos orales. Las gónadas cubren 2/3 de la parte superior del manubrio. De 7 a 10 (usualmente 9) canales radiales están presentes, de los cuales algunos (usualmente 3) se encuentran ramificados; la ramificación se puede observar a diferentes distancias de la base del canal radial. El número de canales radiales coincide con el número de tentáculos marginales, los cuales surgen de bulbos tentaculares elongados. Cada bulbo marginal presenta en su base un ocelo oscuro y redondeado en posición abaxial y numerosas papilas gelatinosas, igualmente dispuestas sobre su superficie abaxial. Los tentáculos marginales se ramifican hasta 8 veces en los ejemplares más maduros. Los tentáculos presentan una rama principal larga, de la cual se ramifican y surgen otros tentáculos más cortos con numerosos cúmulos de nematocistos, y por detrás de estos surgen 1-6 tentáculos adhesivos, los cuales solo poseen un cúmulo terminal de nematocistos para su sujeción en algún sustrato. Los cúmulos de nematocistos en las ramificaciones muestran 2 arreglos. Los nematocistos de la ramificación principal están dispuestos de forma abaxial-adaxial alternada o dispersos aleatoriamente, mientras que aquellos de las ramificaciones cortas se encuentran dispuestos exclusivamente de manera abaxial. Cada ramificación presenta un cúmulo de nematocistos evidente en su parte terminal.
Descripción del hidroide
El hidroide tiene crecimiento estolonal, es esbelto y tiene un pedicelo más largo que el hidrante, con un perisarco liso y blando, el cual termina justo debajo del hidrante. El hidrante tiene un hipostomio redondeado y 2 verticilos de tentáculos; el primer verticilo está constituido por 4 tentáculos orales capitatos, mientras que el segundo está constituido por 4 tentáculos aborales filiformes, los cuales surgen por debajo de los tentáculos orales. El hidrante presenta brotes medusoides muy evidentes, los cuales surgen por debajo de los tentáculos aborales.
Observaciones
La presencia de protuberancias perradiales en forma de saco en el manubrio no fue considerada como una característica para reconocer las morfologías en este estudio. Las protuberancias estuvieron presentes a través de las diferentes morfologías y no fueron útiles para reconocer algún patrón adicional (Fig. 3).

Figura 3 Ejemplares maduros de Cladonema radiatumDujardin, 1843. (a) Medusa con protuberancias perradiales en forma de saco en el manubrio. (b) Medusa sin protuberancias.
Cladonema radiatum fue descrita por primera vez en el mar Mediterráneo, St. Malo y Lorient (Francia) (Dujardin 1843). Desde entonces ha sido reportada en diversas localidades del mundo, principalmente a través de los océanos Atlántico y Pacífico. Algunos registros de esta especie son los siguientes: Noruega, Islas Británicas, Irlanda, Suecia, Dinamarca, Helgoland, Holanda, Bélgica y Francia (Mayer 1910, Russell 1953, Schuchert 1996, Schuchert 2006); Italia (Brinckmann-Voss 1970); y el mar Negro y la costa atlántica de la península Ibérica (Medel y López-González 1996). También ha sido registrada en las costas de Brasil (Migotto 1996, Bittencourt-Farias et al. 2020), el mar Arábigo (Daly-Yahia et al. 2003, Ghory et al. 2020), los mares caribeños de Colombia y México (Segura-Puertas y Damas-Romero 1997, Cedeño-Posso 2014), el sur del golfo de México (Ahuatzin-Hernández et al. 2020), Florida (Kramp 1959, Vervoort 1968), Bermuda (Calder 1988), Belice (Calder 1991) y Bahamas (Mayer 1910, Kramp 1970).
DISCUSIÓN
Cladonema radiatum fue más abundante durante el mes de julio, cuando se registraron los niveles más bajos de salinidad y la temperatura osciló entre los 29.3 y 30.2 °C. La temperatura registrada en Chelem durante este mes coincide con la reportada por Bittencourt-Farias et al. (2020) en el sur del océano Atlántico. Sin embargo, la temperatura de Chelem es menor que la registrada por Ghory et al. (2020) en el mar Arábigo. Asimismo, la salinidad en Chelem es mayor que la registrada en otros ecosistemas donde se ha reportado esta especie (Bittencourt-Farias et al. 2020, Ghory et al. 2020). En general, los estudios ecológicos sobre C. radiatum son escasos; sin embargo, existe bastante información disponible sobre su cultivo artificial, ya que es una especie fácil de mantener en el laboratorio. En este sentido, Brinckmann-Voss (1970) señaló que el hidroide y la medusa de C. radiatum son fáciles de mantener en cajas Petri a 18 °C, una temperatura significativamente menor que la reportada en este estudio. Schuchert (2006) reportó que brotes medusoides en poblaciones del Mediterráneo murieron a temperaturas menores que los 14 °C, pero crecieron con éxito en intervalos de 22 a 30 °C, una temperatura similar a la registrada en Chelem. Asimismo, Ranjith et al. (2021) mantuvieron una población de C. radiatum de la costa sureste de la India a temperaturas y salinidades de 30 °C y 35, respectivamente, valores que encajan en los intervalos registrados durante los 3 meses de este estudio. Esta variabilidad en las condiciones fisicoquímicas donde se desarrolla C. radiatum sugiere una amplia tolerancia a la heterogeneidad ambiental, una de las claves para el éxito de este taxón.
El hidroide de C. radiatum puede ser difícil de distinguir entre algunos miembros de la familia Corynidae (Schuchert 2006, 2012); sin embargo, los brotes medusoides, el crecimiento estolonal, las características del perisarco y los tentáculos, así como los patrones en los canales radiales, los tentáculos marginales y las gónadas de la medusa (Gershwin y Zeidler 2008, Schuchert 2012, Cedeño-Posso 2014, Ghory et al. 2020) permitieron determinar a la especie bajo estudio cómo C. radiatum.
El hidroide de C. pacificum puede distinguirse del de C. radiatum por la carencia de tentáculos filiformes (Rees 1979, Cedeño-Posso 2014, Ghory et al. 2020). Asimismo, las gónadas son la única característica que permite diferenciar a estas especies durante su fase medusa (Schuchert 2006). Los estudios basados en la taxonomía de C. pacificum son escasos, lo cual ha generado diversas sinonimias con la especie (Rees 1982). Cladonema pacificum se encuentra restringida al océano Pacífico, cerca de los mares de Japón, Rusia y Estados Unidos de América (Gershwin y Zeidler 2008), mientras que C. radiatum es una especie común en el océano Atlántico, principalmente en las costas de Europa (Schuchert 2006).
Algunos autores han considerado que no existe suficiente material para diferenciar a C. myersi de C. radiatum (Rees 1979, Stepanjants et al. 1993). Sin embargo, la primera puede distinguirse por las características del hidroide, el cual carece de tentáculos filiformes aborales (Rees 1949). Asimismo, algunas diferencias en la medusa pueden ser resaltadas, tales como los canales radiales no ramificados (máximo 7, rara vez 5 o 6), la ubicación de las gónadas (Schuchert 2006, Cedeño-Posso 2014) y el número de ramificaciones en los tentáculos primarios (Rees 1949). Cladonema myersi es muy similar a C. pacificum durante la fase pólipo. Sin embargo, las principales diferencias entre estas especies pueden señalarse en los canales radiales de la medusa (Gershwin y Zeidler 2008, Cedeño-Posso 2014).
Las características diagnosticas de C. timmsii son los canales radiales no ramificados, las gónadas dimórficas, la presencia de papilas en los bulbos y un arreglo característico de los nematocistos en los tentáculos marginales (Gershwin y Zeidler 2008). Considerando lo anterior, C. radiatum podría distinguirse de C. timmsii por los canales radiales ramificados y el arreglo de los nematocistos, ya que las papilas fueron registradas en los ejemplares de este estudio. Algunos ejemplares de C. radiatum con 8-10 canales radiales no ramificados han sido reportados previamente en la literatura (Mayer 1910, Russell 1953); sin embargo, estos son poco comunes, por lo que hasta que no se realicen mayores investigaciones sobre este tema, esta característica puede seguir considerándose como diagnostica para C. timmsii. Desafortunadamente, el hidroide de C. timmsii es desconocido, así que no es posible realizar comparaciones morfológicas completas e integrativas.
La descripción original de C. novaezelandiae es limitada (Ralph 1953, Schuchert 1996). Esta especie fue considerada una sinonimia de C. radiatum por Schuchert (1996) debido al pobre estado de preservación del material original. No obstante, C. novaezelandiae es considerada como una especie válida actualmente (Schuchert 2022). Los registros después de la primera descripción de C. novaezelandiae son nulos, y las características morfológicas mencionadas en trabajos recientes están basadas en su descripción original (Gershwin y Zeidler 2008, Cedeño-Posso 2014, Bittencourt-Farias et al. 2020, Ranjith et al. 2021). Además, las características del manubrio y los ocelos aún no han sido descritas y aquellas en la ramificación de los canales radiales y los tentáculos marginales son poco claras (Gershwin y Zeidler 2008, Ranjith et al. 2021). Después de analizar las características de C. novaezelandiae, es notable que estas coinciden con aquellas registradas en las morfologías B, C y D de este trabajo, excepto por el número de ramificaciones en los tentáculos primarios. Sin embargo, la ramificación de los tentáculos está relacionada con el desarrollo de los organismos, así que esta no es una característica diagnóstica confiable para definir a una especie (Fujiki et al. 2019). Desafortunadamente, el hidroide de C. novaezelandiae es desconocido. Por lo tanto, no es posible una diferenciación completa de la especie y una sinonimia con C. radiatum no está suficientemente establecida, ya que sus características podrían ser diferentes a las del hidroide de C. radiatum (Schuchert 2006). La identidad taxonómica de C. novaezelandiae es incierta, por lo que sería deseable centrar más investigaciones en las poblaciones de Cladonema provenientes de Nueva Zelanda para clarificar su identidad a través de trabajos integrativos, describir su fase pólipo y sus variaciones morfológicas, así como decodificar su identidad molecular.
Cladonema californicum es probablemente la medusa más fácil de distinguir dentro del género. Esta posee canales radiales no ramificados y hasta 9 bulbos marginales, de los cuales surge un tentáculo primario bifurcado. Cladonema californicum presenta solo un tentáculo secundario con un cúmulo de nematocistos en su parte terminal para una función adhesiva (Hyman 1947). El resto de las características morfológicas en la medusa y el hidroide son similares a las de C. radiatum y otras especies de Cladonema (Rees 1979, Gershwin y Zeidler 2008, Bittencourt-Farias et al. 2020). Además, C. californicum es la única especie en la que se han documentado las marcas negras en forma de rayas reportadas en el manubrio de los ejemplares de este trabajo (Hyman 1947). Resulta difícil poder atribuir una función a esta característica; sin embargo, podría ser considerada como un patrón útil para distinguir otras morfologías en la especie.
Cladonema digitatum puede distinguirse de sus congéneres por la presencia de protuberancias digitiformes en el manubrio, canales radiales ramificados en forma de Y, tentáculos con 3-11 ramificaciones adhesivas y 3-7 ramificaciones punzantes que surgen del tentáculo principal como ramificaciones laterales (Fang et al. 2022). La forma de las protuberancias y el patrón de ramificación de los tentáculos marginales de C. digitatum son similares a las características observadas en los ejemplares de este estudio. Sin embargo, C. digitatum puede distinguirse de C. radiatum por la ramificación en forma de Y de los canales radiales, la cual es diferente a la observada en los ejemplares de este trabajo. Las características descritas para el hidroide de C. digitatum son similares a las reportadas en C. radiatum (Fang et al. 2022).
Cladonema multiramosum puede distinguirse de sus congéneres por tener un mayor número de tentáculos adhesivos (8-24, rara vez 5-7) y por poseer pequeñas ramificaciones laterales irregulares en los canales radiales (Zhou et al. 2022). El hidroide de C. multiramosum es similar al de C. radiatum; sin embargo, se pueden distinguir por el número de gemaciones medusoides, el cual es mayor en C. multiramosum. Además, el arreglo de las gemaciones medusoides reportado para C. multiramosum puede considerarse como un carácter diagnóstico, ya que no se ha reportado en otras especies (Zhou et al. 2022).
Algunas morfologías reportadas en este trabajo han sido documentadas en otras localidades del mundo. Los ejemplares de Salento, Italia (Gravili et al. 2015), coinciden con aquellos de la morfología E del presente estudio. El número de bulbos en los ejemplares del mar Arábigo (Ghory et al. 2020) es el mismo que el registrado en las morfologías A y D. Los ejemplares de la costa de Brasil (Atlántico sur) y el sur del golfo de México (en una laguna costera diferente a la de este estudio) (Ahuatzin-Hernández et al. 2020, Bittencourt-Farias et al. 2020) coinciden con la morfología D, la más numerosa en este trabajo. Asimismo, las morfologías registradas por Billard (1905), Mayer (1910) y Russell (1953) son consistentes con las morfologías B y E del presente estudio. La configuración morfológica registrada en las costas de India (Ranjith et al. 2021) coincide con la séptima morfología descartada en este trabajo (4-5 tentáculos orales y 9 bulbos tentaculares). Sin embargo, en este estudio solo se encontró 1 ejemplar con estas características y su estado de preservación estaba deteriorado. Esto alienta a realizar más investigaciones sistemáticas sobre hidrozoos en lagunas costeras del sur del golfo de México, ya que podrían existir otras morfologías aún no descritas. Estos hechos sugieren que la prevalencia de las diferentes morfologías de C. radiatum podría depender de la distribución geográfica y la heterogeneidad ambiental (Mayer 1910; Russell 1953; Schuchert 1996, 2006; Ahuatzin-Hernández et al. 2020; Bittencourt-Farias et al. 2020; Ghory et al. 2020).
La variación morfológica intraespecífica en hidrozoos puede estar relacionada con diversos factores ambientales, tales como la temperatura, la disponibilidad de alimento, la presión por depredación y la hidrodinámica (Cunha et al. 2016). No obstante, la variación en los patrones de ramificación de los canales radiales de las especies de Cladonema no está asociada de manera específica con algún factor ambiental y no está del todo claro si su ramificación sucede antes o después de la liberación de la medusa (Brinckmann-Voss 1970). En algunas especies, como C. pacificum, el patrón de ramificación está presente desde un estado de desarrollo temprano (Fujiki et al. 2019), por lo que es probable que esta característica sea parte del desarrollo ontogénico. Por otro lado, Schierwater y Hadrys (1998) estudiaron la relación entre la metagénesis y los factores ambientales en otras especies de la familia Cladonematidae y mostraron que el tamaño de la umbrela en Eleutheria dichotoma se ve afectado por la temperatura. Estos autores también concluyeron que el desarrollo de la especie está fuertemente predeterminado genéticamente; sin embargo, algunos factores ambientales pueden tener un efecto importante en la iniciación de la reproducción sexual. La falta de conocimiento sobre las características ontogénicas del género Cladonema alienta más esfuerzos en este campo, ya que este es un tema importante para entender la biología y la evolución del grupo.
Las características morfológicas como las protuberancias perradiales en forma de saco y las marcas negras redondeadas y en forma de líneas en el manubrio han sido reportadas previamente en las especies de Cladonema (Mayer 1910, Hyman 1947, Russell 1953, Kramp 1959, Schuchert 2006, Gershwin y Zeidler 2008). Sin embargo, sus funciones permanecen inciertas. Gershwin y Zeidler (2008) atribuyeron la presencia de protuberancias a un dimorfismo sexual; Mayer (1910) mencionó que estas están confinadas a las gónadas y son parte de la reproducción, mientras que Russell (1953) y Schuchert (2006) mencionaron que son parte del desarrollo del organismo y están presentes solo en los ejemplares sexualmente maduros. En este estudio se observaron ejemplares juveniles (umbrela pequeña, pocas ramificaciones en los tentáculos marginales, poco desarrollo en las gónadas) con la presencia de protuberancias, por lo que la idea de que estas forman parte del desarrollo ontogénico es descartada, al menos en C. radiatum. Esta idea contrasta con lo señalado por Ranjith et al. (2021), ya que las protuberancias estuvieron ausentes en los ejemplares más pequeños de su estudio. El dimorfismo sexual propuesto por Gershwin y Zeidler (2008) debe ser confirmado para el resto de las especies de Cladonema a través de estudios histológicos específicos. Se necesita más información detallada a la par de análisis moleculares e histológicos para definir la función de estas características. Cladonema radiatum posee una morfología variable, lo cual complica poder definir su dimorfismo sexual con base en solo la literatura (Ranjith et al. 2021).
Este trabajo analizó las diferencias morfológicas entre los congéneres de C. radiatum, lo cual permitió reconocer los limites morfológicos del género (Tabla 4). Esta es la primera vez que se registran papilas gelatinosas en los bulbos de C. radiatum, ya que estas eran consideradas características diagnosticas de C. timmsii (Gershwin y Zeidler 2008). Asimismo, el arreglo de los nematocistos en los tentáculos marginales de C. radiatum coincide con lo registrado previamente para las ramificaciones principales (Schuchert 2006, 2012). Sin embargo, el patrón de las ramificaciones cortas en las poblaciones de Cladonema provenientes del sur del golfo de México añade una nueva consideración, ya que este no había sido registrado previamente. Esto evidencia la necesidad de más investigaciones sobre este grupo, ya que otras características importantes podrían permanecer aún sin describirse.
Tabla 4 Comparación de la morfología entre las especies válidas dentro de CladonemaDujardin, 1843.
| Cladonema radiatum Dujardin, 1843 | Cladonema californicum Hyman, 1947 | Cladonema timmsii Gershwin & Zeidler, 2008 | Cladonema pacificum Naumov, 1955 | Cladonema myersi Rees, 1949 | Cladonema novaezelandiae Ralph, 1953 | Cladonema multiramosum Zhou, Gu, Wang & Chen, 2022 | Cladonema digitatum Fang et al., 2022 | |
| Medusa stage | ||||||||
| Bell size | Up to 4.00 mm high and 3.00 mm wide | Up to 3.00 mm wide and shorter than wide | About 2.00 mm high and wide | 2.00-3.50 mm high and 2.2 mm wide | Up to 0.80 mm wide | About 3.00 mm wide | 1.36-1.95 mm high and 1.57-2.26 mm wide | 1.62-3.17 mm high and 2.22-3.75 mm wide |
| Radial canals | 7-11 | 9 (rarely 11) | 9 | 9 (rarely 6) | 7 (rarely 5 or 6) | 7-8 | 8-11 | 7-9 (usually 9) |
| Straight canals | 3-5 | 9 (rarely 11) | 9 | 3 | 7 (rarely 5 or 6) | 7-8 | 8-11 | 5 |
| Branched canals | 2-4 | Absent | Absent | 6 | Absent | 1 | Some radial canals bifurcate close to the manubrium, and some with several tiny branches on the top | 1-4 Y-shaped |
| Manubrium | Not extending beyond bell margin | Beyond bell margin | Not extending beyond bell margin | Not available | Half the height of bell cavity | Not available | Manubrium spindle-shaped, able to extend beyond the umbrella margin | Extending beyond bell margin |
| Gonads | Surrounding the upper 2/3 of manubrium | Surrounding almost the whole manubrium | Surrounding stomach in upper half, female without pouches; male with 6 radially arranged pouches | Surrounding almost the whole manubrium | Not available | Surrounding the manubrium | Around upper 1/2-1 (mean 4/5) of the manubrium | Around upper 1/2-8/9 of the manubrium |
| Pouches | Present: 4-7 perradial pouch-like protuberances | Present: 6, rarely 7 elongated rounded protrusions | Present | Absent | Not available | Present: 6 pouches | Present: 5-8 pouches (usually 6) | Present: 4-7 finger-like pouches |
| Oral tentacles | 4-7 | 6 | 6 | 6 | 6 | 6 | 5-8 | 3-6 (usually 5 or 6) |
| Tentacle branches | 4-10 | 1-2 | 6-8 | 6-12 | 7 | Up to 10 | 3-6 | 3-7 growing from the main branch as side branches |
| Nematocyst arrangement | Abaxial-adaxial in the main branch and only abaxial in the shorter branches | Scattered | The main median branch with 2 rows of alternate clusters, side branches with 1 row of abaxial warts | Abaxial-adaxial in the main branch, according to figures provided in Fujiki et al. (2019) | Scattered | Not available | Not available | Not available |
| Suctorial tentacles | 1-6 | 1 | 5-7 | Up to 12 | 3 | Up to 7 | 8-24 | 3-11 (usually >4) |
| Ocelli | Rounded and black, with ectodermal cuticular lens | Elongated and red | Dark red; cup-like, with lens | Rounded and dark, according to figures provided in Fujiki et al. (2019) | Reddish | Not available | Black | Black |
| Cnidoma (µm) | Desmonemes (9.00-12.00 × 3.50-5.00) and stenoteles (13.00-16.00 × 9.00-10.00, 9.50-11.00 × 5.00-8.50) | Desmonemes (8.50-10.00 × 4.00-5.00, 9.00-11.00 × 4.50-5.00) and stenoteles (10.00 × 16.00, 8.00-8.50 × 12.00, 21.00-23.00 × 14.00-16.00,14.00-18.00 × 9.50-11.00) | Not available | Not available | Not available | Not available | Stenoteles (7.50-18.50) × (4.60-11.90), desmonemes (6.20-9.00) × (3.30-5.10), and mastigophores (11.10-14.30) × (3.30-4.70) | Mastigophores (12.16-18.45) × (3.12-7.57), stenoteles (6.03-22.38) × (3.16-13.83) and desmonemes (5.58-8.88) × (3.09-4.93) |
| Polyp stage | ||||||||
| Filiform tentacles | Present | Present | Unknown | Absent | Absent | Unknown | Present | Present |
| Cnidoma (µm) | Stenoteles (11.00-17.00 × 8.00-10.00) and mastigophores (present only in stolons 10.00-12.00 × 3.50-4.00) | Stenoteles (14.00-18.50 × 10.00-12.00, 18.00 × 28.00) | Not available | Not available | Not available | Not available | Stenoteles (10.20-18.60) × (6.50-10.90) | Stenoteles (10.55-25.00) × (6.23-14.83) |
| Distribution | Atlantic, Indian, and Pacific Oceans | Pacific Ocean, Northern California, USA | Indian Ocean, South Australia | Pacific Ocean, East Asia, North of Japan, Russia, San Francisco Bay? | Pacific Ocean, Southern California | Pacific Ocean, New Zealand | Fuzhou, China | Fuzhou, China |
| References | Schuchert (1996, 2006), Gershwin and Zeidler (2008), Cedeño-Posso (2014), Ranjith et al. (2021), present study | Hyman (1947), Rees (1979), Schuchert (2006), Gershwin and Zeidler (2008), Cedeño-Posso (2014), Ranjith et al. (2021) | Gershwin and Zeidler (2008), Ranjith et al. (2021) | Rees (1982), Gershwin and Zeidler (2008), Fujiki et al. (2019), Ranjith et al. (2021) | Schuchert (2006), Gershwin and Zeidler (2008), Cedeño-Posso (2014), Ranjith et al. (2021) | Gershwin and Zeidler (2008), Cedeño-Posso (2014), Ranjith et al. (2021) | Zhou et al. (2022) | Fang et al. (2022) |
La taxonomía de Cladonema continúa siendo confusa debido a su variabilidad morfológica y a la falta de investigación sobre su taxonomía. Solo trabajos integrativos que consideren la morfología, análisis moleculares de las especies, el ciclo de vida completo y sus diferentes localidades tipo podrían ser capaces de decodificar la naturaleza críptica del género (Ranjith et al. 2021). El estudio del desarrollo del ciclo de vida desde hidroide hasta medusa, considerando sus variaciones morfológicas, es una de las claves principales para entender la identidad real y los limites taxonómicos de Cladonema, a la par con análisis moleculares de las especies alrededor del mundo, por lo que más estudios sobre estos temas son necesarios (Brinckmann-Voss 1970, Schuchert 2006, Nawrocki et al. 2010, Miglietta y Cunningham 2012, Miglietta et al. 2019). Aunque este trabajo consideró solo la variabilidad morfológica de C. radiatum, establece una base para futuros estudios integradores. Desafortunadamente, los estudios taxonómicos sobre Hidrozoa basados en su morfología son escasos, principalmente en México, donde la carencia de investigación en este tema es notable (e.g., Cortés-Lacomba et al. 2013, Ahuatzin-Hernández et al. 2020, Mendoza-Becerril et al. 2020). Este trabajo contribuye al conocimiento de este tema y alienta a más investigadores a interesarse en él, ya que es relevante no solo para entender la taxonomía y la evolución de un grupo, sino también su diversidad y ecología.
AGRADECIMIENTOS
Los autores agradecen a Pablo Alberto Hernández-Solís su apoyo en la preparación de los dibujos taxonómicos y a Candita Eúan-Canul su apoyo en el procesamiento de muestras. Los autores declaran que no hay un conflicto de interés.
REFERENCIAS
Ahuatzin-Hernández, J.M., Canul-Cabrera, J.A., Eúan-Canul, C.M., León-Deniz, L.V. 2020. Hydromedusae (Cnidaria: Hydrozoa) from the coastal lagoon of Bocas de Dzilam, Yucatán. = Hidromedusas (Cnidaria: Hidrozoa) de la laguna costera de Bocas de Dzilam, Yucatán. Hidrobiológica. 30(3):221-231. https://doi.org/10.24275/uam/izt/dcbs/hidro/2020v30n3/Ahuatzin [ Links ]
Álvarez-Silva, C., Gómez-Aguirre, S., Miranda-Arce, M.G. 2003. Variaciones morfológicas en Blackfordia virginica (Hydroidomedusae: Blackfordiidae) en lagunas costeras de Chiapas, México = Morphological variations in Blackfordia virginica (Hydroidomedusae: Blackfordiidae) from coastal lagoons of Chiapas, Mexico. Revista Biol Trop. 51(2):409-412. [ Links ]
Billard, A. 1905. Note complémentaire sur les hydroïdes de la Baie de la Hougue = Additional note on hydroids in the Baie de la Hougue. Bull Mus d’Hist Nat Paris. 11(6):500-502. [ Links ]
Bittencourt-Farias, G., Leitão, S.N., Mendes-de-Castro-Melo, P.A., Nogueira-Júnior, M., Tosetto, E.G. 2020. First in situ record of the medusa stage of Cladonema radiatum (Cnidaria: Anthoathecata) in the South Atlantic Ocean. Ocean Coast Res. 68:e20349. https://doi.org/10.1590/s2675-28242020068349 [ Links ]
Bouillon, J., Medel, M.D., Pagès, F., Gili, J.M., Boero, F., Gravili, C. 2004. Fauna of the Mediterranean: Hydrozoa. Sci Mar. 68(2):5-438. http://doi.org/10.3989/scimar.2004.68s25 [ Links ]
Brinckmann-Voss, A. 1970. Anthomedusae/Athecata (Hydrozoa, Cnidaria) of the Mediterranean. Part I. Capitata. Fauna e Flora Golfo di Napoli. 39:1-96. [ Links ]
Calder, D.R. 1988. Shallow water hydroids of Bermuda: The Athecatae. R Ont Mus Life Sci Contributions. 148:1-107. https://doi.org/10.5962/bhl.title.52225 [ Links ]
Calder, D.R. 1991. Associations between hydroid species assemblages and substrate types in the mangal at Twin Cays, Belize. Can J Zool. 69(8):2067-2074. https://doi.org/10.1139/z91-288 [ Links ]
Cedeño-Posso, C. 2014. First record of the genus Cladonema (medusae and polyps) in Colombia. Zootaxa. 3793(5):597-599. https://doi.org/10.11646/zootaxa.3793.5.8 [ Links ]
Cortés-Lacomba, R., Álvarez-Silva, C., Gutiérrez-Mendieta, F. 2013. Listado actualizado de las medusas de la Laguna de Términos, Campeche, México = An updated list of the jellyfish from Laguna de Términos, Campeche, Mexico. Hidrobiológica. 23(2):209-217. [ Links ]
Cunha, A.F., Collins, A.G., Marques, A.C. 2020. When morphometry meets taxonomy: morphological variation and species boundaries in Proboscoida (Cnidaria: Hydrozoa). Zool J Linn Soc. 190(2):417-447. https://doi.org/10.1093/zoolinnean/zlz166 [ Links ]
Cunha, A.F., Genzano, G.N., Marques, A.C. 2015. Reassessment of morphological diagnostic characters and species boundaries requires taxonomical changes for the genus Orthopyxis L. Agassiz, 1862 (Campanulariidae, Hydrozoa) and some related Campanulariids. PLoS ONE. 10(2):e0117553. https://doi.org/10.1371/journal.pone.0117553 [ Links ]
Cunha, A.F., Maronna, M.M., Marques, A.C. 2016. Variability on microevolutionary and macroevolutionary scales: a review on patterns of morphological variation in Cnidaria Medusozoa. Org Divers Evol. 16(3):431-442. https://doi.org/10.1007/s13127-016-0276-4 [ Links ]
Daly-Yahia, M.N., Goy, J, Daly-Yahia-Kéfi, O. 2003. Distribution et écologie des Méduses (Cnidaria) du golfe de Tunis (Mediterranée sud occidentale) = Distribution and ecology of Medusae and Scyphomedusae (Cnidaria) in Tunis Gulf (SW Mediterranean). Oceanol Act. 26(5-6):645-655. https://doi.org/10.1016/j.oceact.2003.05.002 [ Links ]
Dujardin, F. 1843. Observations sur un nouveau genre de medusaires provenant de la metamorphose des Syncorynes = Observations on a new kind of jellyfish resulting from the metamorphosis of Syncorynes. Comptes rendus des seances de l’Academie des sciences, Paris. 16:1132-1136. [ Links ]
Fang, X., Lin, S., Zhang, Y., Zhou, K., Wang, Z., Zhou, K., Chen, J. 2022. Identification of a novel species, Cladonema digitatum sp. nov. (Cnidaria: Hydrozoa: Cladonematidae), using DNA barcoding and life cycle analyses. Front Mar Sci. 9:891998. https://doi.org/10.3389/fmars.2022.891998 [ Links ]
Fujiki, A., Hou, S., Nakamoto, A., Kumano, G. 2019. Branching pattern and morphogenesis of medusa tentacles in the jellyfish Cladonema pacificum (Hydrozoa, Cnidaria). Zool Lett. 5:12. https://doi.org/10.1186/s40851-019-0124-4 [ Links ]
Gershwin, L.A., Zeidler, W. 2008. Cladonema timmsii, a new species of hydromedusae (Cnidaria: Hydrozoa) from a salt lake in South Australia. Zootaxa. 1826(1):59-68. https://doi.org/10.11646/zootaxa.1826.1.4 [ Links ]
Ghory, F.S., Ali, Q.M., Ahmed, Q. 2020. First record of Cladonema radiatum Dujardin, 1843 (Hydrozoa: Cladonematidae) from northern Arabian Sea, Pakistan. Int J Fish Aquat Res. 5(3):14-16. [ Links ]
Gravili, C., de-Vito, D., di-Camillo, C.G., Martell, L., Piraino, S., Boero, F. 2015. The non-Siphonophoran Hydrozoa (Cnidaria) of Salento, Italy with notes on their life-cycles: an illustrated guide. Zootaxa. 3908(1):1-187. https://doi.org/10.11646/zootaxa.3908.1.1 [ Links ]
Herrera-Silveira, J. 2006. Lagunas Costeras de Yucatán (SE, México) Investigación, Diagnóstico y Manejo. ECOTROPICOS. 19(2):94-108. [ Links ]
Herrera-Silveira, J., Morales-Ojeda, S.M. 2010. Subtropical karstic coastal lagoon assessment, SE Mexico. The Yucatan Peninsula case. In: Kennish, M.J., Paerl, H.W. (eds.), Coastal Lagoons: Critical Habitats of Environmental Change. Boca Raton (FL): CRC Press. p. 310-315. [ Links ]
Hirai, E. 1958. On the species of Cladonema radiatum var. mayeri Perkins. Bull Mar Biol Stn Asamushi. 9(1):23-25. [ Links ]
Hyman, L.H. 1947. Two new hydromedusae from the California coast. Trans Am Microsc Soc. 66(3):262-268. https://doi.org/10.2307/3223391 [ Links ]
Kosevich, I.A. 2008. Decoding the morphogenetic evolution of thecate hydroids. J Mar Biol Assoc UK. 88(8):1687-1694. https://doi.org/10.1017/S0025315408001720 [ Links ]
Kramp, P.L. 1959. The hydromedusae of the Atlantic Ocean and adjacent waters. Dana Rep. 46:1-283. [ Links ]
Kramp, P.L. 1970. 16. Some medusae from the Bahamas. Sarsia. 44(1):59-68. https://doi.org/10.1080/00364827.1970.10411179 [ Links ]
Mayer, A.G. 1910. Medusae of the World. Vol. 1 and 2, the hydromedusae. Washington (DC): Carnegie Institution. 498 p. https://doi.org/10.5962/bhl.title.5996 [ Links ]
Medel, D., López-González, P.J. 1996. Updated catalogue of hydrozoans of the Iberian Peninsula and Balearic Islands, with remarks on zoogeography and affinities. Sci Mar. 60(1):183-209. [ Links ]
Mendoza-Becerril, M.A., Estrada-González, M.C., Mazariegos-Villarreal, A., Restrepo-Avendaño, L., Villar-Beltrán, R.D., Agüero, J., Cunha, A.F. 2020. Taxonomy and diversity of Hydrozoa (Cnidaria, Medusozoa) of La Paz Bay, Gulf of California. Zootaxa. 4808(1):1-37. https://doi.org/10.11646/zootaxa.4808.1.1 [ Links ]
Miglietta, M.P., Cunningham, C.W. 2012. Evolution of life cycle, colony morphology, and host specificity in the family Hydractiniidae (Hydrozoa, Cnidaria). Evolution. 66(12):3876-3901. http://doi.org/10.1111/j.1558-5646.2012.01717.x [ Links ]
Miglietta, M.P., Maggioni, D., Matsumoto, Y. 2019. Phylogenetics and species delimitation of two hydrozoa (phylum Cnidaria): Turritopsis (McCrady, 1857) and Pennaria (Goldfuss, 1820). Mar Biodivers. 49(3):1085-1100. https://doi.org/10.1007/s12526-018-0891-8 [ Links ]
Migotto, A.E. 1996. Benthic shallow-water hydroids (Cnidaria, Hydrozoa) of the coast of São Sebastião, Brazil, including a checklist of Brazilian hydroids. Zool Verhandelingen, Leiden. 306:1-125. [ Links ]
Nawrocki, A.M., Schuchert, P., Cartwright, P. 2010. Phylogenetics and evolution of Capitata (Cnidaria: Hydrozoa), and the systematics of Corynidae. Zool Scripta. 39(3):290-304. https://doi.org/10.1111/j.1463-6409.2009.00419.x [ Links ]
Ocaña-Luna, A., Sánchez-Ramírez, M., Islas-García, A. 2021. Temporal abundance and population parameters of the invasive medusa Blackfordia virginica Mayer, 1910 (Hydroidomedusae: Blackfordiidae) in Pueblo Viejo lagoon, Mexico. BioInvasions Rec. 10(4):826-837. https://doi.org/10.3391/bir.2021.10.4.07 [ Links ]
Ralph, P.M. 1953. A guide to the athecate (Gymnoblastic) hydroids and medusae of New Zealand. Tuatara. 5(2):59-75. [ Links ]
Ralph, P.M. 1956. Variation in Obelia geniculata (Linnaeus, 1758) and Silicularia bilabiata (Coughtrey, 1875) (Hydroida, F. Campanulariidae). Transactions of the R Soc New Zealand. 84(2):279-296. [ Links ]
Ranjith, L., Kalidas, C., Saravanan, R., Jagadis, I., Linga-Prabu, D., Kavitha, M., Mathan-Babu, A., Joshi, K.K., Manojkumar, P.P. 2021. Observation on the morphological and gonadal aspects of Cladonema radiatum (Class: Hydrozoa) from Tuticorin Bay, Southeast coast of India. Zootaxa. 4990(3):591-595. https://doi.org/10.11646/zootaxa.4990.3.12 [ Links ]
Rees, J.T. 1979. The polyp and immature medusa stages of Cladonema californicum, Hyman, 1947 (Anthomedusae: Cladonemidae) with biological notes and a discussion of the taxonomy of the genus Cladonema. J Nat Hist. 13(3):295-302. https://doi.org/10.1080/00222937900770231 [ Links ]
Rees, J.T. 1982. The Hydrozoan Cladonema in California: a possible introduction from East Asia. Pac Sci. 36(4):439-444. [ Links ]
Rees, W.J. 1949. On Cladonema myersi, a new species of hydroid from the Californian Coast. Proc Zool Soc Lond. 119(4):861-865. https://doi.org/10.1111/j.1096-3642.1950.tb00912.x [ Links ]
Russell, F.S. 1953. The Medusae of the British Isles. Anthomedusae, Leptomedusae, Limnomedusae, Trachymedusae and Narcomedusae. London: Cambridge University Press. 530 p. [ Links ]
Schierwater, B., Hadrys, H. 1998. Environmental factors and metagenesis in the hydroid Eleutheria dichotoma. Inverteb Reprod Dev. 34(2-3):139-148. https://doi.org/10.1080/07924259.1998.9652646 [ Links ]
Schuchert, P. 1996. The marine fauna of New Zealand: athecate hydroids and their medusae (Cnidaria: Hydrozoa). New Zealand Oceanogr Inst Mem. 106:1-159. [ Links ]
Schuchert, P. 2006. The European athecate hydroids and their medusae (Hydrozoa, Cnidaria): Capitata Part 1. Revue Suisse de Zool. 113(2):325-410. https://doi.org/10.5962/bhl.part.80356 [ Links ]
Schuchert, P. 2012. North-West European athecate hydroids and their Medusae. Synopses Br Fauna New Ser. 59:1-364. [ Links ]
Schuchert, P. 2022. World Hydrozoa Database. Cladonema Dujardin, 1843. World Register of Marine Species. [place unknown]: [publisher unknown]; accessed 2022 Dec 22. http://www.marinespecies.org/aphia.php?p=taxdetails&id=117049 . [ Links ]
Segura-Puertas, L., Damas-Romero, M. 1997. Variación estacional de la comunidad de medusas (Cnidaria) en la Laguna Bojórquez, Cancún, México. Hidrobiológica. 7(1):59-64. [ Links ]
Segura-Puertas, L., Suárez-Morales, E., Celis, L. 2003. A checklist of the Medusae (Hydrozoa, Scyphozoa and Cubozoa) of Mexico. Zootaxa. 194(1):1-15. https://doi.org/10.11646/zootaxa.194.1.1 [ Links ]
Stepanjants, S.D., Ovanesyan, I.G., Sirenko, B.I. 1993. Cladonematidae representative (Hydrozoa, Athecata, Capitata) in Saint-Petersburg aquariums. Cladonema revision [Russian with English summary]. Issledovaniya Fauny Morei. 45:90-105. [ Links ]
Vervoort, W. 1968. Report on a collection of Hydroida from the Caribbean region, including an annotated checklist of Caribbean hydroids. Zool Verhandelingen Leiden. 92:1-124. [ Links ]
Wyttenbach, C.R., Crowell, S., Suddith, R.L. 1973. Variations in the mode of stolon growth among different genera of colonial hydroids, and their evolutionary implications. J Morphol. 139(3):363-375. https://doi.org/10.1002/jmor.1051390306 [ Links ]
Zhou, K., Gu, Y., Wang, L., Chen, J. 2022. Discovery of Cladonema multiramosum sp. nov. (Cnidaria: Hydrozoa: Cladonematidae) using DNA barcoding and life cycle analyses. Acta Oceanologica Sinica. 41(3): 44-52. https://doi.org/10.1007/s13131-021-1900-5 [ Links ]
Recibido: 21 de Septiembre de 2021; Aprobado: 06 de Diciembre de 2021











 text in
text in 



