Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.48 Ensenada Jan./Dec. 2022 Epub Nov 17, 2023
https://doi.org/10.7773/cm.y2022.3259
Artículos
Aspectos reproductivos de la viejita Paranthias colonus (Perciformes: Serranidae) en la costa central mexicana del Pacífico
1Universidad de Guadalajara, Departamento de Estudios para el Desarrollo Sustentable de Zonas Costeras. 48980 San Patricio-Melaque, Jalisco, Mexico.
2Canadian Rivers Institute, Saint John, NB E2L 4A6, Canada.
Muchas especies de la familia Serranidae son hermafroditas y tienen importancia comercial. Paranthias colonus pertenece a esta familia, y no se conocen las características de su reproducción. La presente investigación se llevó a cabo con ejemplares provenientes de la pesca comercial en la costa sur de Jalisco, México. En total, fueron procesados 1,541 ejemplares, los cuales presentaron una longitud media de 30.30 ± 0.10 cm y un intervalo de longitud de 19.80 a 38.00 cm. Las gónadas de los ejemplares fueron analizadas macro y microscópicamente. La proporción de sexos fue de 1.00:0.97 (H:M). De acuerdo con los valores mensuales máximos del índice gonadosomático, los estadios de madurez gonadal y el diámetro de los ovocitos, P. colonus presenta 2 periodos reproductivos amplios, de marzo a junio y de noviembre a diciembre. Se encontró correlación significativa entre los valores medios mensuales del índice gonadosomático y el factor de condición relativo. Las gónadas en estadio maduro presentaron ovocitos en 6 fases de desarrollo diferentes y con diámetros de 14.30 a 417.40 µm, lo que supone que el desarrollo de los ovocitos es asincrónico. En el testículo, el desarrollo de la línea germinal es del tipo lobular no restringido. Este órgano no presentó un arreglo típico de un pez teleósteo, ya que los lóbulos parecen estar delimitados por lamelas. La información generada en este estudio indica que P. colonus es una especie gonocórica. La longitud media de madurez fue de 26.80 cm en hembras y 26.90 cm en machos. Las longitudes medias de captura indicaron que el 79.70% de las hembras y el 83.30% de los machos ya se habían reproducido por lo menos una vez antes de ser capturados.
Palabras clave: Serranidae; reproducción; gonocórica; longitud de madurez; costa central mexicana del Pacífico
Many species in the family Serranidae are hermaphrodites and of commercial importance. Paranthias colonus belongs to this family, and its reproductive traits are unknown. The present research was carried out with specimens taken from the commercial fishery on the southern coast of Jalisco, Mexico. A total of 1,541 specimens were processed, with an average length of 30.30 ± 0.10 cm and a length interval of 19.80 to 38.00 cm. Specimen gonads were analyzed macro- and microscopically. The sex ratio was 1.00:0.97 (F:M). According to the maximum monthly values of the gonadosomatic index, gonad maturity stages, and oocyte diameters, P. colonus has 2 broad reproductive periods, from March to June and from November to December. A significant correlation was found between the monthly mean values of the gonadosomatic index and the relative condition factor. Gonads in the mature stage had oocytes in 6 different development phases, with diameters that ranged from 14.30 to 417.40 µm, which means that oocyte development is asynchronous. In the testicle, the development of the germ line is of the unrestricted lobular type. This organ did not present the typical arrangement found in teleost fish, since lobes seem to be delimited by lamellae. The information developed in this study indicates that P. colonus is a gonochoric species. Average length at sexual maturity was 26.80 cm for females and 26.90 cm for males. Average catch lengths indicated that 79.70% of females and 83.30% of males had already reproduced at least once before being caught.
Key words: Serranidae; reproduction; gonochoristic; length at sexual maturity; Pacific coast of central Mexico
INTRODUCCIÓN
Para conocer la biología de una especie, es necesario identificar algunos parámetros poblacionales (Granados-Lorencio 1996). Un aspecto importante en la biología de los organismos es la reproducción, y los estudios sobre la reproducción en poblaciones de peces explotadas por la pesca son cruciales en el desarrollo de modelos de evaluación y el manejo de los recursos, ya que analizan variables esenciales como la longitud media de madurez y el potencial reproductivo, entre otras (Sley et al. 2012).
Muchas especies de la familia Serranidae se consideran de gran valor económico, especialmente en las pesquerías costeras de áreas tropicales y subtropicales. Paranthias colonus es un serránido que se distribuye desde el golfo de California hasta Perú, incluidas las islas (Heemstra y Randall 1993). De esta especie, se ha registrado malformación en la columna (Rodríguez-Romero et al. 2001), la fauna parásita (Mendoza-Cruz et al. 2013), agregaciones importantes y el comportamiento reproductivo en el golfo de California (Sala et al. 2003).
Paranthias colonus es capturada por la pesca comercial en las costas de Jalisco y Colima (Rojo-Vázquez et al. 2001; Espino-Barr et al. 2003, 2004). Muchas especies presentan características biológicas que las hacen sensibles a la explotación pesquera intensa (Ralston 1987), como la agregación en lugares y tiempos específicos al momento de realizar el desove (Burton et al. 2005, Nemeth et al. 2007, Starr et al. 2007) y la forma de reproducción. El objetivo de esta investigación es generar información sobre aspectos reproductivos de P. colonus, una especie que se captura comercialmente en la costa mexicana del Pacífico.
MATERIALES Y MÉTODOS
Los ejemplares se obtuvieron de las capturas de la pesca comercial que se realiza en la bahía de Navidad (19°10ʹ30ʺN, 19°14ʹ50ʺ N; 104°49ʹ45ʺ W, 104°41ʹ30ʺ W), costa sur de Jalisco. La bahía presenta fondos rocosos, fondos blandos y fondos mixtos de arena y roca, y en ella destacan estructuras arrecifales en zonas semiprotegidas (Rojo-Vázquez et al. 2001).
De enero de 1999 a diciembre de 2008 (excepto 2001), durante 5 días de cada mes, se muestrearon los organismos capturados por pescadores de la región, quienes utilizaron redes agalleras de 7.62, 8.89, 10.16 y 11.43 cm de luz de malla. Se registró la longitud total (LT, 0.10 cm), el peso total (PT, 0.10 g) y el sexo de cada individuo, y se extrajeron y pesaron las gónadas (peso de la gónada, PG; 0.01 g). Las gónadas se clasificaron de acuerdo con Everson et al. (1989) y se conservaron en formol neutro.
Se tomaron muestras de 0.50 cm de grosor de ovarios y testículos para el análisis histológico. Las muestras se deshidrataron (alcohol etílico), incluyeron (Paraplast), cortaron (5.00 μm de grosor), tiñeron (hematoxilina-eosina) y preservaron (bálsamo de Canadá). Para cada mes de muestreo, se eligieron 10 cortes por estadio de madurez. De estos, se midió el diámetro de 10 ovocitos (con núcleo visible; diámetro de ovocito, DO) de cada fase encontrada y se midió el grosor de la túnica ovárica en 4 puntos aleatorios. Las medidas se realizaron con una cámara digital (AxioCam ERc5s, Zeiss) acoplada a un microscopio (Axiostar, Zeiss). Los ovocitos se clasificaron según Yamamoto y Yamazaki (1961), Lucano-Ramírez et al. (2001) y Brown-Peterson et al. (2011), y para el testículo, se consideraron los criterios de Uribe et al. (2014).
Se combinó la información de los meses de todos los años para generar un año tipo. Lo anterior se realizó con base en la tendencia observada y, también, porque en algunos meses el tamaño de muestra fue bajo. Se obtuvo la proporción sexual para el total de organismos, por mes y por clase de longitud, y se utilizó la prueba de Chi cuadrada (χ2) para comprobar diferencias significativas de la proporción 1:1. Se calculó el índice gonadosomático (IGS = [PG/PT] × 100), el factor de condición relativo (FCR = [PT/LT3.06] × 100) y la longitud media de madurez (L50). Esta última fue estimada haciendo un ajuste no lineal al modelo logístico mediante PLT = 1/[1 + e (bLT + a) ] × 100, donde PLT es el porcentaje de individuos maduros en la LT, y a y b son parámetros de la curva ajustada.
Se realizaron análisis de varianza de una vía para examinar las diferencias entre los valores mensuales (IGS, FCR y DO), y en caso de obtener valores significativos, se aplicó la prueba post hoc de Student-Newman-Keuls para identificar grupos homogéneos. Se realizaron análisis de correlación de Spearman (r s ) entre IGS, FCR y DO. Para los análisis estadísticos, se utilizó el programa STATISTICA v.7.1 (StatSoft 2006), y en todos los casos se utilizó un nivel de significación de 0.05.
RESULTADOS
Distribución de longitudes y proporción sexual
En los 9 años de muestreo se recolectaron en total 1,541 organismos de P. colonus, los cuales presentaron longitudes de entre 19.50 y 38.00 cm, con valor medio (± error estándar de la media) de 30.30 ± 0.07 cm. La longitud media de las hembras fue de 30.20 ± 0.10 cm y la de los machos, 30.40 ± 0.10 cm (Tabla 1). La mayor frecuencia de organismos para ambos sexos se presentó en las longitudes de 30.00 y 32.00 cm LT (Fig. 1). De todos los organismos muestreados, 782 (51%) fueron hembras y 759 (49%) machos; la proporción sexual fue de 1.00:0.97 (H:M) y no difirió de la proporción teórica esperada (χ2 = 0.34, P = 0.559). Se observaron diferencias significativas en la proporción sexual en febrero (1.00H:2.40M; χ2 = 6.08, P = 0.014) y agosto (1.00H:0.60M; χ2 = 8.85, P = 0.003). En ninguna clase de longitud (20.00 a 38.00 cm) se presentó diferencia en la proporción sexual.
Tabla 1 Número de hembras (F) y machos (M), longitud total (media ± error estándar de la media) y proporción de sexos por año para Paranthias colonus capturada en la bahía de Navidad, Jalisco, México.
| Year | F | M | Female TL (cm) | Male TL (cm) | Range | F:M ratio | χ2 | P |
| 1999 | 63 | 43 | 30.50 ± 0.25 | 30.60 ± 0.25 | 26.10 - 35.40 | 1.00:0.68 | 3.77 | 0.052 |
| 2000 | 46 | 59 | 30.80 ± 0.25 | 30.40 ± 0.26 | 25.80 - 35.40 | 1.00:1.28 | 1.61 | 0.204 |
| 2002 | 23 | 23 | 31.90 ± 0.30 | 32.10 ± 0.42 | 27.70 - 37.00 | 1.00:1.00 | 0.00 | 1.000 |
| 2003 | 143 | 162 | 28.30 ± 0.29 | 28.40 ± 0.25 | 19.50 - 36.00 | 1.00:1.13 | 1.18 | 0.277 |
| 2004 | 50 | 58 | 29.20 ± 0.47 | 30.60 ± 0.31 | 20.70 - 35.00 | 1.00:1.16 | 0.59 | 0.442 |
| 2005 | 72 | 68 | 31.10 ± 0.35 | 30.70 ± 0.45 | 20.60 - 35.00 | 1.00:0.94 | 0.11 | 0.740 |
| 2006 | 206 | 194 | 30.40 ± 0.16 | 30.50 ± 0.14 | 21.70 - 38.00 | 1.00:0.94 | 0.36 | 0.548 |
| 2007 | 53 | 45 | 30.80 ± 0.32 | 31.60 ± 0.27 | 24.10 - 36.50 | 1.00:0.85 | 0.65 | 0.420 |
| 2008 | 126 | 107 | 31.40 ± 0.23 | 32.20 ± 0.21 | 20.40 - 36.60 | 1.00:0.85 | 1.55 | 0.213 |
| Total | 782 | 759 | 30.20 ± 0.10 | 30.40 ± 0.10 | 19.50 - 38.00 | 1.00:0.97 | 0.34 | 0.559 |
Estadios de madurez gonadal
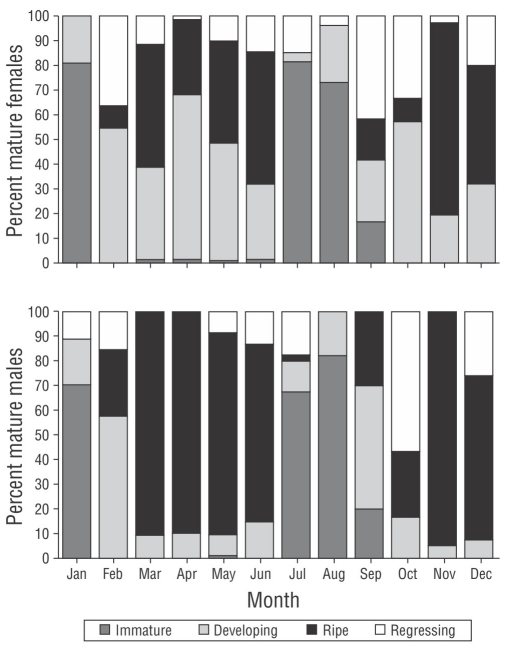
Se identificaron 4 estadios de madurez en ambos sexos. El estadio maduro se presentó en porcentajes altos de marzo a junio y de noviembre a diciembre tanto en hembras (30% a 78%) como en machos (67% a 95%). El estadio inmaduro presentó porcentajes altos en enero, julio y agosto en ambos sexos (Fig. 2).
Variación mensual del índice gonadosomático
El valor medio total del IGS para los machos fue más alto que el valor para las hembras (F 1, 1,254 = 374.88, P < 0.001). Los valores medios más altos ocurrieron de marzo a junio y de noviembre a diciembre, y difirieron de manera significativa con respecto al resto de los meses tanto para las hembras (F 11, 631 = 82.27, P < 0.001) como para los machos (F 11, 604 = 93.24, P < 0.001). En las comparaciones por pares, se identificaron 5 grupos en ambos sexos y se distinguieron 2 tendencias, medias con valores bajos (hembras 1, 2, 3; y machos A, B, C) y valores altos (hembras 4, 5; y machos D, E) (Fig. 3). La variación del IGS para hembras y machos siguió una tendencia semejante, la cual indicó correlación alta (r s = 0.97, P < 0.001, n = 12).
Variación mensual del factor de condición relativo
El FCR medio para hembras (0.98 ± 0.003) y machos (0.97 ± 0.003) no mostró diferencias significativas (F 1, 1,539 = 0.20, P = 0.684). Las medias mensuales del FCR variaron en ambos sexos. Los valores máximos se registraron en abril y diciembre (1.00 ± 0.01 y 1.01 ± 0.01, respectivamente) tanto para las hembras como para los machos, y los valores mínimos se registraron en julio (0.93 ± 0.01) en el caso de las hembras y en junio y septiembre (0.93 ± 0.01 y 0.93 ± 0.02, respectivamente) en el caso de los machos. A pesar de la poca variación mensual, se registró diferencia significativa tanto para las hembras (F 11, 770 = 5.06, P < 0.001) como para los machos (F 11, 747 = 6.51, P < 0.001) (Fig. 4). La prueba de contrastes múltiples detectó 2 grupos para las hembras y 3 para los machos, con varios traslapos entre los meses; sin embargo, los valores máximos y mínimos se separaron del resto de los valores mensuales. Se presentó correlación significativa entre las medias mensuales del FCR para hembras y machos (r s = 0.92, P < 0.001, n = 12). La variación conjunta del IGS y el FCR para hembras resultó significativa (r s = 0.63, P = 0.026, n = 12), mientras que para los machos no lo fue (r s = 0.53, P = 0.071, n = 12), aunque estuvo muy próxima al valor de probabilidad marginal.
Variación mensual del diámetro de ovocitos
La variación mensual del DO presentó diferencia significativa (F 11, 4,290 = 40.23, P < 0.001). La prueba por pares distinguió 3 grupos: los ovocitos de menor diámetro en julio, agosto y septiembre; los diámetros intermedios en junio, octubre y noviembre; y los de mayor diámetro en mayo y diciembre, con un traslapo entre los diámetros medianos y grandes de enero a abril (Fig. 5). Se encontró correlación entre el DO y el IGS (r s = 0.64, P = 0.026, n = 12). Con los resultados obtenidos de los valores altos del estadio maduro, el IGS y el DO, podemos decir que el periodo reproductivo de P. colonus es de marzo a junio y de noviembre a diciembre.
Descripción de las gónadas
Las gónadas, estructuras pareadas unidas por la parte más angosta al orificio urogenital, se localizaron por debajo de la vejiga natatoria. Los ovarios, por lo general, presentaron forma cilíndrica y tonalidades de color naranja. Los ovarios inmaduros pesaron 2.10 ± 0.20 g (media ± error estándar de la media) y presentaron ovocitos que midieron 53.07 ± 1.31 µm (intervalo de 28.60 a 163.90 µm); los ovarios en estadio en maduración pesaron 11.80 ± 0.40 g, con ovocitos que midieron 159.79 ± 2.94 µm (intervalo de 28.80 a 522.70 µm); los ovarios maduros pesaron 18.50 ± 0.40 g, con ovocitos que midieron 180.12 ± 2.83 µm (intervalo de 28.80 a 498.41 µm); y los ovarios en estadio desovado pesaron 9.10 ± 0.60 g, con ovocitos que midieron 165.30 ± 4.03 µm (intervalo de 29.20-417.40 µm). Por otro lado, los testículos fueron de color blanco. Los testículos inmaduros pesaron 2.90 ± 0.40 g; aquellos en desarrollo, 12.70 ± 0.90 g; los maduros, 31.20 ± 0.40 g; y los desovados, 9.790 ± 0.80 g. El peso de los testículos maduros, en promedio, superó el peso de los ovarios maduros de forma significativa (F 1, 1,254 = 312.89, P < 0.001). El testículo más grande pesó 57.81 g y perteneció a un organismo de 33.00 cm con IGS de 13.56, y el ovario más pesado fue de 44.99 g y perteneció a una hembra de 35.10 cm con IGS de 10.18.
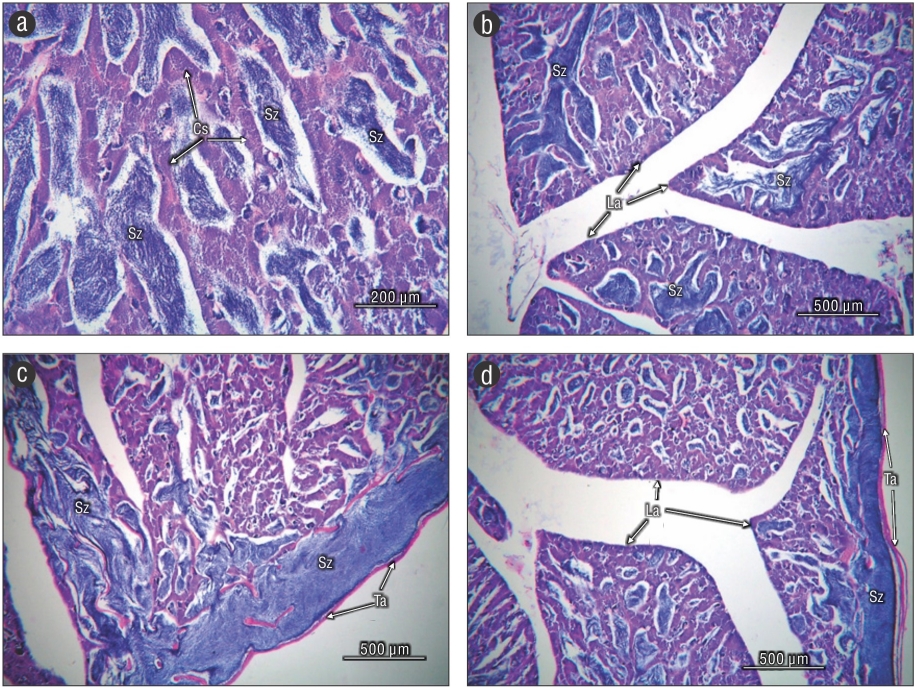
En el ovario inmaduro solo se identificaron ovocitos en crecimiento primario con diámetro de 54.30 ± 0.35 µm, los cuales se encontraron bien organizados dentro de las lamelas (Fig. 6a, b). En los siguientes estadios de maduración gonadal se distinguieron ovocitos con alveolos corticales (113.20 ± 0.75 µm), vitelogénesis primaria (203.79 ± 1.83 µm), vitelogénesis secundaria (305.37 ± 2.00 µm), migración tardía de la vesícula germinal (323.86 ± 2.83 µm) y vesícula germinal degradada (336.13 ± 5.07 µm). En el ovario maduro se identificaron 6 fases (Fig. 6c, d), y los ovocitos de mayor tamaño fueron los maduros (336.13 ± 5.07 µm); la presencia de estas distintas fases sugiere que los ovocitos se desarrollan de manera asincrónica. El arreglo que presentó el testículo fue del tipo lobular no restringido. Los lóbulos estuvieron formados por cistos, los cuales presentaron diferente grado de desarrollo de la espermatogénesis (Fig. 7a). También se pudieron distinguir pliegues o septos (tipo lamelas) que delimitaron a los cistos y, dentro de esta delimitación, un concentrado de espermatozoides (Fig. 7b). No se observó un conducto principal en el centro del testículo, pero se distinguieron concentraciones de espermatozoides en la periferia del testículo, muy cerca de la capa testicular; también se apreció un lumen claro (Fig. 7c, d). Paranthias colonus es una especie gonocórica, ya que microscópicamente no se observó ninguna característica que pudiera dar algún indicio de hermafroditismo.
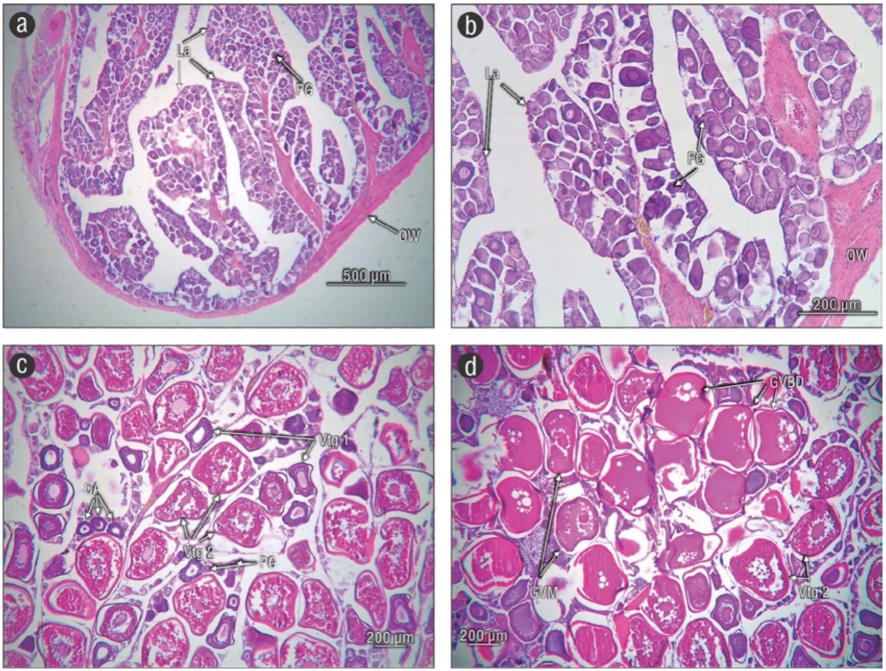
Figura 6 Ovario de Paranthias colonus con ovocitos con desarrollo asincrónico. (a, b) Estadio inmaduro con túnica ovárica (OW), ovocitos en crecimiento primario (PG) y lamelas (La). (c) Ovocitos en PG, alveolos corticales (CA), vitelogénesis primaria (Vtg 1) y vitelogénesis secundaria (Vtg 2). (d) Ovocitos en migración tardía de la vesícula germinal (GVM), Vtg 2 y vesícula germinal degradada (GVBD).
Longitud media de madurez
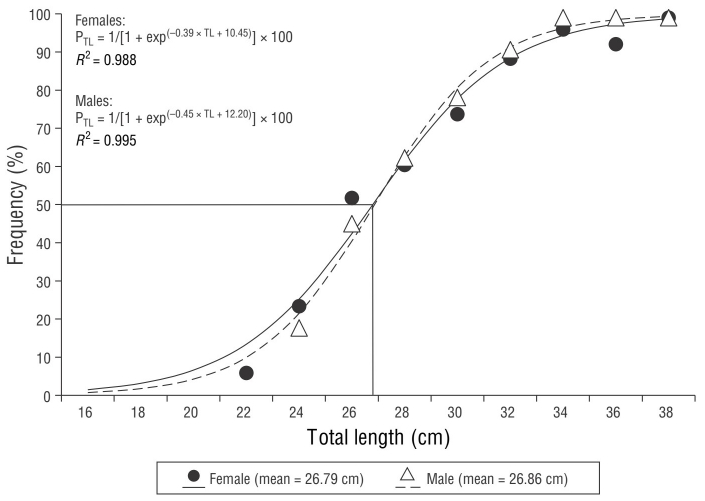
La hembra más pequeña con gónadas maduras midió 22.70 cm y el macho más pequeño, 23.50 cm. La longitud media de madurez sexual, estimada mediante el ajuste no lineal, fue de 26.79 cm para las hembras y 26.86 cm para los machos (Fig. 8). Las longitudes medias de captura comercial para las hembras (30.30 cm) y los machos (30.40 cm) indicaron que, respectivamente, el 79.70% y el 83.30% de los organismos ya se habían reproducido por lo menos una vez.
DISCUSIÓN
Conocer el intervalo y/o el promedio de la longitud de los organismos capturados por las pesquerías es importante, ya que esto ayuda a conocer la estructura de la población en una zona de interés (Gallardo-Cabello et al. 2007). La longitud máxima y la longitud media encontradas para P. colonus en este trabajo son cercanas a las reportadas por Espino-Barr et al. (2004) (máxima: 38.31; media: 28.67 cm) en la costa de Jalisco y por Mendoza-Cruz et al. (2013) en El Sargento, Baja California Sur (máxima: 39.00 cm). Espino-Barr et al. (2003) registraron longitudes menores (máxima: 35.30 cm; media: 27.90 cm) para la costa de Colima. Las ligeras diferencias entre estos valores podrían estar relacionadas con el tamaño de muestra, el periodo de captura, el sitio de recolecta y el arte de pesca utilizado (Cruz-Romero et al. 1987, Sadovy y Shapiro 1987, Craig et al. 1999).
La proporción sexual es un elemento importante en la estructura poblacional de las especies. La diferencia en el número de individuos de cada sexo puede variar entre poblaciones y durante el ciclo de vida debido a cambios en los factores ambientales, la disponibilidad de alimento, la mortalidad, entre otros (Nikolsky 1963). La proporción sexual registrada en este estudio para P. colonus no presentó diferencia en el número de hembras y machos. En contraste, para Paranthias furcifer, Posada-López (1996) encontró que el número de hembras fue mayor que el número de machos (1.3:1.0), y esta diferencia en la proporción sexual se atribuye a la influencia de la profundidad en el sitio de muestreo. De igual manera, se ha encontrado que los géneros Epinephelus (Caballero-Arango et al. 2008, Erisman 2008, De Martini et al. 2011, Ruiz-Ramírez et al. 2018) y Mycteroperca (Caballero-Arango et al. 2011), también de la familia Serranidae, han estado representados por un número mayor de hembras, aunque es importante mencionar que estos géneros son hermafroditas protóginas.
Conocer la temporada reproductiva es un objetivo esencial en estudios similares al actual. Para lograrlo, frecuentemente, se han analizado los porcentajes de los estadios de madurez gonádica, tal como se ha realizado para distintas especies de serránidos, como P. furcifer (Posada-López 1996), Mycteroperca tigris (Caballero-Arango et al. 2011), Epinephelus acanthistius (Díaz-Madrid et al. 2012) y Epinephelus labriformis (Ruiz-Ramírez et al. 2018). Al igual que en trabajos anteriores, en el presente estudio se empleó una escala de maduración morfocromática para definir la temporada reproductiva de P. colonus. El análisis mensual del IGS también es un método útil para delimitar la temporada reproductiva de las especies; el aumento del IGS indica madurez en la gónada, mientras que el descenso revela desove o inactividad (Htun-Han 1978). Por otra parte, el análisis de la variación del DO medio a lo largo del año se puede emplear para reforzar el establecimiento de una temporada reproductiva de peces (Lucano-Ramírez et al. 2016; Ruiz-Ramírez et al. 2018; Lucano-Ramírez et al. 2019a, b). Entonces, de acuerdo con los valores máximos del IGS de hembras y machos, los valores máximos del DO medio y los mayores porcentajes de gónadas maduras, P. colonus presenta 2 periodos reproductivos, uno de marzo a junio y otro de noviembre a diciembre, con la misma intensidad, aunque el primero fue un poco más amplio y marcado. El mismo patrón (2 periodos reproductivos) fue observado en otras especies de serránidos, como M. tigris (en Campeche, Caballero-Arango et al. 2011) y E. labriformis (en Jalisco; Erisman 2008, Ruiz-Ramírez 2017). En el caso de P. furcifer en el suroeste de Puerto Rico, el desove ocurre en 2 periodos asociados con la luna llena en noviembre y diciembre (Posada-López 1996), y estos meses coinciden con uno de los periodos de reproducción observados en el presente estudio para P. colonus. En la región de estudio ocurren intensas surgencias de febrero a mayo que provocan alta concentración de clorofila a y aumento en la productividad (Ambriz-Arreola et al. 2012). Este periodo de enriquecimiento beneficia a especies que desovan en este tiempo, como es el caso de P. colonus. En noviembre y diciembre termina el periodo de ciclones y lluvias, la temperatura empieza a bajar y las condiciones oceanográficas son intermedias. No queda claro cuál es la influencia aquí, pero estos meses de transición climática podrían tener un beneficio en algunas especies que aún está por demostrarse.
El FCR evalúa el bienestar general de los organismos asociado con el cambio de corpulencia, el crecimiento y la madurez sexual (Rodríguez-Gutiérrez 1992). Este factor depende de la edad, el sexo, la estación, el estado de maduración, la alimentación, las reservas de tejido graso y el desarrollo muscular (Barnham y Baxter 1998). En P. colonus, el FCR presentó correlación positiva con el IGS, lo cual indica que la reproducción y la condición del organismo tienen cierta relación, pero que el proceso reproductivo no afecta de manera importante la condición del organismo. Una tendencia semejante fue reportada por Ruiz-Ramírez et al. (2017), quienes señalaron que el factor de condición para E. labriformis fue relativamente constante conforme avanzó el periodo de reproducción. Por otra parte, Estrada-Godínez et al. (2011) mencionaron que Mycteroperca rosacea, así como otras especies de serránidos y peces tropicales, no deja de alimentarse durante el periodo de maduración y desove.
Muchas especies de la familia Serranidae son hermafroditas, entre estas, las de los géneros Cephalopholis, Epinephelus, Mycteroperca y Plectropomus (Sadovy de Mitcheson y Liu 2008). Según Sadovy y Shapiro (1987), para sustentar que una especie es hermafrodita, se deben observar individuos en proceso de cambio de sexo (individuos en transición), por ejemplo, que en un ovario en regresión aparezcan en el epitelio germinal cistos con células en alguna fase de la espermatogénesis (Smith 1965). En el caso de P. colonus, si bien pertenece a la familia Serranidae, no se encontró ningún organismo en transición de hembra a macho o viceversa, no se registraron diferencias en el intervalo de longitud de hembras y machos, y se encontraron tanto hembras como machos pequeños y grandes, por lo que se puede suponer que esta especie no es hermafrodita. Sadovy de Mitcheson y Liu (2008) mencionaron que se conocen especies gonocóricas y citan, entre ellas, las especies del género Paralabrax, Epinephelus striatus, M. rosacea y P. furcifer.
No se han encontrado trabajos que describan el desarrollo de los ovocitos de P. colonus. Con base en los resultados obtenidos en el presente trabajo, el desarrollo es del tipo asincrónico. Nagahama (1983) y Maack y George (1999) mencionaron que las especies que tienen ovocitos con desarrollo asincrónico pueden presentar una temporada reproductiva amplia, durante la cual desovan en varias ocasiones. Considerando lo anterior, coincidimos con estos autores, ya que P. colonus presentó un periodo reproductivo prolongado con 2 etapas máximas de 4 y 2 meses cada una.
Son pocos los trabajos que analizan el desarrollo del testículo en peces, debido a que los cambios en las células son difíciles de distinguir (West 1990). El testículo de P. colonus estuvo organizado por lóbulos, y estos, por cistos en su interior, rasgos de un desarrollo del tipo lobular. Este tipo de organización testicular se ha registrado en diferentes especies de peces (Grier et al. 1980; Grier 1993; Albieri et al. 2010; Ruiz-Ramírez et al. 2012, 2017; Lucano-Ramírez et al. 2014, 2016, 2017). Además, en el testículo de P. colonus se observaron pliegues (semejantes a las lamelas de los ovarios) en donde se encontraron organizadas las células espermáticas, algo observado también en E. labriformis (Ruiz-Ramírez 2018), mas nunca se observaron ovocitos.
Para la gestión racional de la pesca sobre poblaciones sujetas a explotación, es elemental conocer la L50, ya que permite proponer medidas de regulación (longitud mínima de captura, determinadas artes de pesca) (Jennings et al. 2001, Ruiz-Ramírez et al. 2018). El presente y otros trabajos han estimado la L50 de diferentes especies para saber si estas se reproducen por lo menos una vez antes de ser capturadas (Ruiz et al. 1999, Guirao et al. 2005, Lucano-Ramírez et al. 2016, Ruiz-Ramírez et al. 2018), una estimación muy recomendada (Beverton y Holt 1957). En el presente trabajo se observó que las L50 de hembras y machos fueron cercanas (26.80 y 26.90 cm, respectivamente). Esta observación es frecuente y se ha reportado para Diodon holocanthus (Lucano-Ramírez et al. 2011) y Lutjanus argentiventris (Lucano-Ramírez et al. 2014); aunque Posada-López (1996) no menciona la L50 para P. furcifer, la hembra y el macho más pequeños con gónadas maduras midieron longitudes similares (14.40 y 13.80 cm longitud furcal, respectivamente). En la región de estudio, la captura comercial de P. colonus incluye un gran porcentaje de individuos (80%-83%) que ya tuvieron al menos un evento reproductivo, lo que indica que gran parte de la población logra reproducirse y dar continuidad a la especie. Es muy importante continuar con estudios que permitan obtener más información básica de esta especie que genere un beneficio a mediano y largo plazo.
AGRADECIMIENTOS
Esta investigación fue financiada por la Universidad de Guadalajara. Los autores agradecen a Manuel Díaz y a sus acompañantes su ayuda en la realización de las actividades de pesca, a las cooperativas “Rivera Melaque” y “Punta Farallón” por permitir el uso de sus instalaciones y a los estudiantes su colaboración en los muestreos.
REFERENCIAS
Albieri, R.J., Araújo, F.G., Ribeiro, T.P. 2010. Gonadal development and spawning season of white mullet Mugil curema (Mugilidae) in a tropical bay. J Appl Ichthyol. 26(1):105-109. https://doi.org/10.1111/j.1439-0426.2009.01369.x [ Links ]
Ambriz-Arreola, I., Gómez-Gutiérrez, J., Franco-Gordo, M.C., Lavaniegos, B.E., Godínez-Domínguez, E. 2012. Influence of coastal upwelling-downwelling variability on tropical euphausiid abundance and community structure in the inshore Mexican central Pacific. Mar Ecol Prog Ser. 451:119-136. https://doi.org/10.3354/meps09607 [ Links ]
Barnham, C., Baxter, A. 1998. Condition factor, K, for salmonid fish. Fisheries Notes:1-3. FN0005 [ Links ]
Beverton, R.J.H., Holt, S.J. 1957. On the Dynamics of Exploited Fish Populations. London (United Kingdom): Ministry of Agriculture, Fisheries and Food. (ser. 2; vol. 19). [ Links ]
Brown-Peterson, N.J., Wyanski, D.M., Saborido-Rey, F., Macewicz, B.J., Lowerre-Barbieri, S.K. 2011. A standardized terminology for describing reproductive development in fishes. Mar Coast Fish. 3(1):52-70. https://doi.org/10.1080/19425120.2011.555724 [ Links ]
Burton, M.L., Brennan, K.J., Muñoz, R.C., Parker, R.O. Jr. 2005. Preliminary evidence of increased spawning aggregations of mutton snapper (Lutjanus analis) at Riley’s Hump two years after establishment of the Tortugas South Ecological Reserve. Fish Bull. [accessed 2020 Sep 13]; 103(2):404-410. https://spo.nmfs.noaa.gov/content/preliminary-evidence-increased-spawning-aggregations-mutton-snapper-lutjanus-analis-rileys [ Links ]
Caballero-Arango, D., Brulé, T., Colás-Marrufo, T., Tuz-Sulub, A., Puerto-Novelo, E. 2011. Sexualidad y ciclo sexual de la cuna gata Mycteroperca tigris de los arrecifes coralinos del Banco de Campeche (Sureste del Golfo de México) = Sexuality and Sexual Cycle of the Tiger Grouper Mycteroperca tigris from Coral Reefs of the Campeche Bank (Southeastern of Gulf of Mexico). Proceedings of the 63rd Gulf and Caribbean Fisheries Institute; 1-5 Nov 2010; San Juan Puerto Rico. p. 193-197. [ Links ]
Caballero-Arango, D., Brulé, T., Montero-Muñoz, J.L., Colás-Marrufo, T. 2008. Análisis preliminar sobre la variación de algunos parámetros reproductivos del mero rojo del Banco de Campeche en el periodo 1989-2004 = Preliminary Analysis on the Variation of Some Reproductive Parameters of Bank of Campeche’s “Red Grouper” in the Period 1989-2004. Proceedings of the 60th Gulf and Caribbean Fisheries Institute; 5-9 Nov 2007; Punta Cana, Dominican Republic. p. 247-253. [ Links ]
Craig, M.T., Pondella, D.J., Hafner, J.C. 1999. Analysis of age and growth in two eastern Pacific groupers (Serranidae: Epinephelinae). Bull Mar Sci. 65(3):807-814. [ Links ]
Cruz-Romero, M., Espino-Barr, E., García-Boa, A. 1987. Edad y crecimiento en la cabrilla Epinephelus labriformis (Jenyns, 1843) en el estado de Colima. Acta Cient Potos. 9:165-176. [ Links ]
De Martini, E.E., Everson, A.R., Nichols, R.S. 2011. Estimates of body sizes at maturation and at sex change, and the spawning seasonality and sex ratio of the endemic Hawaiian grouper (Hyporthodus quernus, F. Epinephelidae). [accessed 2020 Oct 19]; Fish Bull. 109(1):123-134. https://spo.nmfs.noaa.gov/content/estimates-body-sizes-maturation-and-sex-change-and-spawning-seasonality-and-sex-ratio [ Links ]
Díaz-Madrid, L.C., Vega, A.J., Robles, P.Y.A. 2012. Descripción macro y microscópica de las gónadas de la cherna roja: Epinephelus acanthistius (Serranidae) capturadas en el parque nacional Coiba, Pacífico Panameño. Tecnociencia. 14(2):5-21. [ Links ]
Erisman, B. 2008. Reprodutive biology and evolution of Epinephelid and Serranid (Perciformes, Epinephelidae, Serranidae) [dissertation]. [San Diego (CA)]: Scripps Institution of Oceanography, University of California. p. 46-97 [ Links ]
Espino-Barr, E., Cabral-Solis, E.G., Garcia-Boa, A., Puentes-Gómez, M. 2004. Especies marinas con valor comercial de la costa de Jalisco, México. Manzanillo (Mexico): Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Instituto Nacional de Pesca, Centro Regional de Investigación Pesquera. 145 p. [ Links ]
Espino-Barr, E., Cruz-Romero, M., Garcia-Boa, A. 2003. Peces marinos con valor comercial de la costa de Colima, México. Manzanillo (Mexico): Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Instituto Nacional de Pesca, Centro Regional de Investigación Pesquera. 106 p. [ Links ]
Estrada-Godínez, J.A., Maldonado-García, M., Gracia-López, V., Carrillo, M. 2011. Reproductive cycle of the leopard grouper Mycteroperca rosacea in La Paz Bay, Mexico = Ciclo reproductivo de la cabrilla sardinera Mycteroperca rosacea en la bahía de La Paz, México. Cienc Mar. 37(4):425-441. https://doi.org/10.7773/cm.v37i4A.1954 [ Links ]
Everson, A.R., Williams, H.A., Ito, B.M. 1989. Maturation and reproduction in two Hawaiian eteline snappers, uku, Aprion virescens, and onaga, Etelis coruscans. Fish Bull. 87:877-888. [ Links ]
Gallardo-Cabello, M., Espino-Barr, E., Garcia-Boa, A., Cabral-Solis, E.G., Puente-Gomez, M. 2007. Study of the growth of the green Jack Caranx caballus (Günther, 1868) in the coast of Colima, México. J Fish Aquat Sci. 2(2):131-139. https://doi.org/10.3923/jfas.2007.131.139 [ Links ]
Granados-Lorencio, C. 1996. Ecología de Peces. Bogotá (Colombia): Mac Graw Hill. p. 161-200. [ Links ]
Grier, H.J. 1993. Comparative organization of the Sertoli cells including the Sertoli cell barrier. In: Russell, L.D., Griswold, M.D. (eds.), The Sertoli Cell. Clearwater (FL): Cache River Press. p. 703-739. [ Links ]
Grier, H.J., Linton, J.R., Leatherland, J.F., de-Vlaming, V.L. 1980. Structural evidence for two different testicular types in teleost fishes. Am J Anat. 159(3):331-345. http://doi.org/10.1002/aja.1001590307 [ Links ]
Guirao, R., Socorro, J., Reyes, T., Roo, J., Fernández-Palacios, H., Izquierdo, M.S. 2005. Estudio del desarrollo gonadal del jurel dentón Pseudocaranx dentex (Bloch y Schneider, 1801) en aguas costeras de las islas Canarias = Gonadal development in striped jack Pseudocaranx dentex (Bloch & Schneider, 1801) in Canary Islands coastal waters. Bol Inst Esp Oceanogr. 21(1-4):253-264. [ Links ]
Heemstra, P.C., Randall, J.E. 1993. FAO species catalogue. Vol. 16, Groupers of the world (Family Serranidae, subfamily Epinephelinae): An annotated and illustrated catalogue of the grouper, rockcod, hind, coral grouper, and lyretail species known to date. Rome (Italy): FAO Fisheries Synopsis. [ Links ]
Htun-Han, M. 1978. The reproductive biology of the dab Limanda limanda (L.) in the North Sea: gonosomatic index, hepatosomatic index and condition factor. J Fish Biol. 13(3):369-378. http://doi.org/10.1111/j.1095-8649.1978.tb03445.x [ Links ]
Jennings, S., Kaiser, M.J., Reynolds, J.D. 2001. Marine Fisheries Ecology. Oxford (United Kingdom): Blackwell. p. 239-257. [ Links ]
Lucano-Ramírez, G., Gómez-García, M.J., Ruiz-Ramírez, S., González-Sansón, G., Aguilar-Betancourt, C., Flores-Ortega, J.R. 2019a. Reproductive characteristics of the sole Achirus mazatlanus (Pleuronectiformes: Achiridae) in the Barra de Navidad coastal lagoon, Jalisco, Mexico = Aspectos reproductivos del lenguado Achirus mazatlanus (Pleuronectiformes: Achiridae) en la laguna costera de Barra de Navidad, Jalisco, México. Cienc Mar. 45(2):47-58. https://doi.org/10.7773/cm.v45i2.2952 [ Links ]
Lucano-Ramírez, G., Pérez-Peña, E., Ruiz-Ramírez, S., Rojo-Vázquez, J., González-Sansón, G. 2011. Reproducción del pez erizo, Diodon holocanthus (Pisces: Diodontidae) en la plataforma continental del Pacífico central mexicano = Reproduction of the Spiny Puffer, Diodon holocanthus (Pisces: Diodontidae) in the continental shelf of Mexican Central Pacific. Rev Biol Trop. 59(1):217-232. http://hdl.handle.net/10669/26165 [ Links ]
Lucano-Ramírez, G., Rivera-Ríos, E.G., Ruiz-Ramírez, S., González-Sansón, G., Pérez-Toledo, A. 2016. Reproducción de Carangoides vinctus (Perciformes: Carangidae) en el Pacífico central mexicano = Reproduction of Carangoides vinctus (Perciformes: Carangidae) in the Mexican Central Pacific. Lat Am J Aquat Res. 44(3):610-622. http://doi.org/10.3856/vol44-issue3-fulltext-20 [ Links ]
Lucano-Ramírez, G., Robles-Ravelero, M., Ruiz-Ramírez, S., González-Sansón, G., Aguilar-Betancourt, C., Perez-Toledo, A. 2019b. Biología reproductiva de Mulloidichthys dentatus (Perciformes: Mullidae) en el Pacífico tropical mexicano. Rev Biol Mar Oceanogr. 54(1):118-128. https://doi.org/10.22370/rbmo.2019.54.1.1656 [ Links ]
Lucano-Ramírez, G., Ruiz-Ramírez, S., González-Sansón, G., Ceballos-Vázquez, B.P. 2014. Reproductive biology of the yellow snapper, Lutjanus argentiventris (Pisces, Lutjanidae), from the Mexican central Pacific = Biología Reproductiva del pargo alazán, Lujanus argentiventris (Pisces, Lutjanidae), en el Pacífico central mexicano. Cienc Mar. 40(1):33-44. https://doi.org/10.7773/cm.v40i1.2325 [ Links ]
Lucano-Ramírez, G., Villagrán-Santa, Cruz. M., Ruiz-Ramírez, S., López-Murillo, T. 2001. Histology of the oocytes of Lutjanus peru (Nichols and Murphy, 1922) (Pisces: Lutjanidae) = Histología de los ovocitos de Lutjanus peru (Nichols y Murphy, 1992) (Pisces: Lutjanidae). Cienc Mar. 27(3):335-349. https://doi.org/10.7773/cm.v27i3.493 [ Links ]
Maack, G., George, M.R. 1999. Contributions to the reproductive biology of Encrasicholina punctifer Fowler, 1938 (Engraulidae) from West Sumatra, Indonesia. Fish Res. 44(2):113-120. https://doi.org/10.1016/S0165-7836(99)00084-3 [ Links ]
Mendoza-Cruz, M., Valles-Vega, I., Lozano-Cobo, H., Gómez del Prado Rosas, M.C., Castro-Moreno, P.N. 2013. Parasitofauna de Paranthias colonus (Valenciennes, 1846) en el Sargento, Baja California Sur, México. Neotrop Helminthol. [accessed 2021 Jan 03]; 7(1):13-18. https://sisbib.unmsm.edu.pe/bvrevistas/neohel/v7n1/pdf/a03v7n1.pdf [ Links ]
Nagahama, Y. 1983. The functional morphology of teleost gonads. In: Hoar, W.S., Randall, D.J., Donaldson, E.M. (eds.), Fish Physiology. Orlando (FL): Academic Press. (Reproduction; vol. 9). p. 223-275. https://doi.org/10.1016/S1546-5098(08)60290-3 [ Links ]
Nemeth, R.S., Blondeau, J., Herzlieb, S., Kadison, E. 2007. Spatial and temporal patterns of movement and migration at spawning aggregations of red hind, Epinephelus guttatus, in the U.S. Virgins Islands. Environ Biol Fish. 78:365-381. http://doi.org/10.1007/s10641-006-9161-x [ Links ]
Nikolsky, G.V. 1963. The Ecology of Fish. New York: Academic Press. 352 p. [ Links ]
Posada-López, J.M. 1996. Life-history, reproductive biology and sexual pattern of the Creole fish, Paranthias furcifer (Valenciennes, 1828) (Pisces: Serranidae) [dissertation]. [Mayagüez (Puerto Rico)]: University of Puerto Rico. [ Links ]
Ralston, S. 1987. Mortality rates of snappers and groupers. In: Polovina, J.J., Ralston, S. (eds.), Tropical snappers and groupers. Biology and Fisheries Management. Boulder: Westview Press. p. 375-404. [ Links ]
Rodríguez-Gutiérrez, M. 1992. Técnicas de Evaluación Cuantitativa de la Madurez Gonádica en Peces. Mexico: AGT Editor. 79 p. [ Links ]
Rodríguez-Romero, J., Cárdenas, L., Pérez-Urbiola, J.C., Hinohuye-Rivera, R., Silva-Hernández, M.A. 2001. A spinal column malformation in creolefish Paranthias colonus (Osteichthys: Serranidae). Rev Biol Trop. 49(3-4):1267-1268. [ Links ]
Rojo-Vázquez, J., Aguilar-Palomino, B., Galvan-Piña, V.H., Godínez-Domínguez, E., Hernández-Vazquez, S., Ruiz-Ramírez, S., Lucano-Ramírez, G. 2001. Ictiofauna de la pesquería ribereña en Bahía de Navidad, Jalisco, México, asociada al evento El Niño 1997-1998. Rev Biol Trop. 49(3-4):915-929. [ Links ]
Ruiz, L.J., Figueroa, R.M., Prieto, A.A. 1999. Ciclo reproductivo de Lactophrys quadricornis (Pisces: Ostraciidae) de la costa nororiental de Venezuela. Rev Biol Trop. 47(3):561-570. http://doi.org/10.15517/RBT.V47I3.19207 [ Links ]
Ruiz-Ramírez, S., Lucano-Ramírez, G., González-Sansón, G., Rojo-Vázquez, J.A., Arellano-Martínez, M. 2012. Biología reproductiva de Anisotremus interruptus (Perciformes: Haemulidae) en el Pacífico central mexicano. Rev Biol Trop. 60(2):709-720. http://doi.org/10.15517/rbt.v60i2.3986 [ Links ]
Ruiz-Ramírez, S., Molina-Arenas, E.G., Lucano-Ramírez, G., Aguilar-Betancourt, C., Flores-Ortega, J.R., Kosonoy-Aceves, D., González-Sansón, G. 2017. Aspectos reproductivos de la lisa Mugil curema (Mugiliformes: Mugilidae) en la laguna costera de Barra de Navidad, Jalisco, México. Lat Am J Aquat Res. 45(2):443-456. https://doi.org/10.3856/vol45-issue2-fulltext-19 [ Links ]
Ruiz-Ramírez, S., Pérez-Segoviano, A.M., Lucano-Ramírez, G., González-Sansón, G., Aguilar-Betancourt, C., Flores-Ortega, J.R. 2018. Reproducción de la cabrilla pinta Epinephelus labriformis en la Bahía de Navidad, Jalisco, México. Rev Biol Mar Oceanogr. 53(3):335-347. http://doi.org/10.22370/rbmo.2018.53.3.1358 [ Links ]
Sadovy, Y., Shapiro, D.Y. 1987. Criteria for the diagnosis of hermaphroditism in fishes. Copeia. 1987(1):136-156. https://doi.org/10.2307/1446046 [ Links ]
Sadovy de Mitcheson, Y., Liu, M. 2008. Functional hermaphroditism in teleosts. Fish Fisher. 9(1):1-43. http://doi.org/10.1111/j.1467-2979.2007.00266.x [ Links ]
Sala, E., Aburto-Oropeza, O., Paredes, G., Thompson, G. 2003. Spawning aggregations and reproductive behavior of reef fishes in the Gulf of California. Bull Mar Sci. 72(1):103-121. [ Links ]
Sley, A., Jarboui, O., Ghorbel, M., Bouain, A. 2012. Annual reproductive cycle, spawning periodicity and sexual maturity of blue runner Caranx crysos (Pisces, Carangidae) from the Gulf of Gabes (Tunisia, Eastern Mediterranean). J Appl Ichthyol. 28(5):785-790. http://doi.org/10.1111/j.1439-0426.2012.02039.x [ Links ]
Smith, C.L. 1965. The patterns of sexuality and classification of serranid fishes. Am Mus Novit. 2207:1-20. [ Links ]
Starr, R.M, Sala, E., Ballesteros, E., Zabala, M. 2007. Spatial dynamics of the Nassau grouper Epinephelus striatus in a Caribbean atoll. Mar Ecol Prog Ser. 343:239-249. http://doi.org/10.3354/meps06897 [ Links ]
StatSoft. 2006. Statistica (data analysis software system) v.7.1. [accessed 2019 Nov 22]. https://www.statsoft.com . [ Links ]
Uribe, M.C., Grier, H.J., Mejía-Roa, V. 2014. Comparative testicular structure and spermatogenesis in bony fishes. Spermatogenesis. 4(3):e983400. https://doi.org/10.4161/21565562.2014.983400 [ Links ]
West, G. 1990. Methods of assessing ovarian development in fishes: A review. Aust J Mar Freshwater Res. 41(2):199-222. https://doi.org/10.1071/MF9900199 [ Links ]
Yamamoto, K., Yamazaki, M. 1961. Rhythm of development in the oocyte of the gold-fish, Carassius auratus. Bull Fac Fish. 12(2):93-114. [ Links ]
Recibido: 01 de Marzo de 2021; Aprobado: 01 de Junio de 2021











 text in
text in