Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.35 n.4 Ensenada Dec. 2009
Artículos de investigación
Shark breeding grounds and seasons in the Gulf of California: Fishery management and conservation strategy*
Zonas y temporadas de reproducción y crianza de tiburones en el Golfo de California: Estrategia para su conservación y manejo pesquero
CA Salomón–Aguilar*, CJ Villavicencio–Garayzar, H Reyes–Bonilla
Departamento de Biología Marina, Universidad Autónoma de Baja California Sur, Apartado postal 19–B, La Paz, CP 23080, Baja California Sur, México. * E–mail: csalomon@uabcs.mx
Recibido en mayo de 2008.
Aceptado en octubre de 2009.
Abstract
Sharks show high biological fragility and, given the intense fishing regimes to which they are exposed in the Gulf of California, it is necessary to establish a conservation and management strategy providing for the protection of their nursery areas. We reviewed the literature concerning shark reproductive biology to determine priority management areas in the Gulf of California by complementarity analysis and different selection criteria. Four levels of management and conservation priority were determined for six quadrants: level 1 corresponded to the area off Mazatlán (Sinaloa) and the area of El Sargento, La Ventana, and Punta Arenas (Baja California Sur); level 2 to the areas of Teacapán (Sinaloa) and Seri (Sonora); level 3 to the areas of San Francisquito–El Barril (Baja California) and Kino Bay (Sonora); and level 4 to the area of La Manga (Sonora). Analysis of space–time variables in a geographic information system indicated that 71% of the commercially important shark species concentrate in coastal zones, mainly in bays, coastal lagoons, estuaries, and wetlands (central and southern Gulf of California) during spring and summer (May–August), except for Prionace glauca, Isurus oxyrinchus, Alopias pelagicus, and Squatina californica that reproduce in winter and spring. The protection of recruitment areas (critical habitats) during peak breeding periods should be an essential part of any resource management plan.
Key words: neonates, mating, recruitment, nursery area, gravid females.
Resumen
Los tiburones presentan gran fragilidad biológica y debido a los intensos regímenes de pesca a los que están expuestos en el Golfo de California es necesario establecer una estrategia de manejo y conservación que contemple la protección de sus zonas de crianza. Se realizó una revisión de literatura existente en relación a la biología reproductiva de los tiburones para localizar áreas prioritarias de manejo en el Golfo de California mediante análisis de complementariedad y diversos criterios de selección. Se encontraron seis cuadrantes en cuatro niveles de prioridad de manejo: el nivel 1 incluyó la zona adyacente a Mazatlán (Sinaloa) y el área de El Sargento, La Ventana y Punta Arenas (Baja California Sur); el nivel 2 las zonas de Teacapán, (Sinaloa) y seri (Sonora); el nivel 3 las zonas de San Francisquito–El Barril (Baja California) y Bahía Kino (Sonora); y el nivel 4 la zona de La Manga (Sonora). El análisis de las variables espacio–tiempo en un sistema de información geográfica indicó que 71% de las especies de tiburones de importancia comercial se concentra en la zona costera, principalmente en bahías, lagunas costeras, estuarios y marismas (regiones central y sur del Golfo de California) durante la temporada primavera–verano (mayo a agosto), excepto Prionace glauca, Isurus oxyrinchus, Alopias pelagicus y Squatina californica, que se reproducen en invierno y primavera. La protección de estas áreas críticas de reclutamiento (hábitats críticos) en las temporadas de máxima reproducción y crianza debe ser parte fundamental del plan de manejo del recurso.
Palabras clave: neonatos, apareamiento, reclutamiento, área de crianza, hembras grávidas.
Introducción
Los tiburones son un recurso pesquero vulnerable y susceptible a la sobrepesca dado que se caracterizan por un bajo potencial reproductivo, un reducido número de crías, tienen periodos de gestación largos y crecimiento lento, y requieren de un periodo largo para alcanzar la madurez sexual (Walker 1992, Castro 1993). Además, factores como el incremento en el esfuerzo pesquero y la degradación de importantes sitios de crianza en hábitats costeros, estuarinos y de agua dulce, propician que las poblaciones disminuyan (Camhi et al. 1998, Stone et al. 1998). Por lo anterior, se reconoce que sus áreas de reproducción y crianza son hábitats críticos de vital importancia para mantener la continuidad del reclutamiento (SEMARNAP 2000a, Anislado y Robinson 2001, Heupel y Simpfendorfer 2002, Heupel et al. 2007).
Las áreas de crianza son zonas geográficamente discretas en el rango de distribución espacial de una especie donde las hembras grávidas expulsan a sus crías o depositan sus huevos, y donde los jóvenes pasan sus primeras semanas, meses o años de vida (Castro 1993). En las zonas de reproducción los adultos se congregan para aparearse y éstas no necesariamente coinciden con las áreas de crianza (Hanchet 1988, Castro 1993). La migración de tiburones a aguas someras es un comportamiento prevalente, ya que existen registros de áreas de crianza en comunidades marinas fosilizadas de hace más de 320 millones de años (Lund 1990).
Se han realizado diversos trabajos relacionados con las áreas de crianza de tiburones. Castro (1993) determinó, mediante la presencia de hembras grávidas con embriones próximos a la expulsión, neonatos y jóvenes, que Bahía Bulls, en la parte sur de Carolina, EUA, es área de crianza para nueve especies en primavera y verano; mientras que la región del sur de Florida y las Bahamas es utilizada con los mismos fines por Negaprion brevirostris, y las lagunas de la costa oriental de Florida son las principales áreas de crianza para Carcharhinus leucas. Simpfendorfer y Milward (1993) examinaron la composición de capturas y dietas de integrantes de la familia Carcharhinidae y Sphyrnidae en la Bahía de Cleveland, Australia, y encontraron que la permanencia de individuos jóvenes en las áreas de crianza depende de la abundancia de las presas. Heupel y Simpfendorfer (2002) estimaron las tasas de mortalidad natural y por pesca usando datos de telemetría de los jóvenes de Carcharhinus limbatus y concluyeron que éstos son más vulnerables durante su permanencia en áreas de crianza.
Las zonas prioritarias de manejo (reservas marinas) son áreas marinas protegidas (AMPs) o de no pesca diseñadas bajo el principio de conectividad, que aportan beneficios como la recuperación de stocks, conservación de los sitios de congregaciones reproductivas y de reclutamiento, incremento de las capturas en áreas contiguas, disminución de la sobrepesca de especies vulnerables y mejoramiento económico a través del turismo (FCRR 1997, Bonfil 1999, Dahlgren y Sobel 2000, Roberts et al. 2001). Algunas de las desventajas del uso de AMPs como herramienta de manejo pesquero son: la concentración del esfuerzo pesquero en porciones más pequeñas del stock, beneficios económicos pesqueros evidentes a largo plazo, conflictos entre diversas pesquerías, resistencia de la comunidad a su implementación y para los tiburones en particular existen dos aspectos que complican la aplicación de las AMPs, su limitada utilidad con especies altamente migratorias y la dificultad de incluir hábitats donde estén representados todos los estadios de vida (FCRR 1997, Bonfil 1999).
A nivel mundial las AMPs establecidas para tiburones son de tres tipos. El primero son las AMPs informales, diseñadas mediante la legislación de los gobiernos para la protección de algunas especies vulnerables a sobreexplotación en aguas de su jurisdicción; por ejemplo, las establecidas para Carcharodon carcharias, Rhincodon typus, Cetorhinus maximus, Carcharias taurus, Odontaspis noronhai y Pristiophorus schroederi en EUA, Australia y otros países. Después están las AMPs oficiales o formales, que tienen como propósito proteger especies con fines ecológicos, y de las cuales existen solamente dos ejemplos: 15 sitios de las Maldivas para Carcharhinus amblyrhynchos, y Dry Tortugas, Florida en donde se protege a Ginglymostoma cirratum durante su temporada de apareamiento (mayo a agosto). El tercer tipo son las áreas de no pesca (reservas marinas) que se utilizan como herramientas de manejo pesquero, de las cuales hasta antes de 1999 sólo existía una en Australia para proteger stocks reproductivos de Carcharhinus obscurus, C. plumbeus, Galeorhinus galeus y Mustelus antarcticus; no obstante, en lo últimos años éstas se han implementado en EUA para los tiburones oscuro, arenero y nocturno, y en la India para nueve especies de tiburón (Bonfil 1999, ICSF 2001). Con respecto a México, en la Norma Oficial Mexicana NOM–029–PESC–2006 se establecen diez áreas de refugio para proteger la reproducción y/o el nacimiento de tiburones y rayas durante el mes de junio de cada año, de las cuales tres se encuentran en el Golfo de California; sin embargo, no se especifican zonas y épocas de veda debido a que no existe un conocimiento suficiente de las áreas y temporadas reproductivas (Alejo–Plata et al. 2007, SAGARPA 2007a).
La producción total de tiburón en el Golfo de California fue de 12,089 t en 2006, lo que representó 67% de la producción mexicana en el Pacífico, con un valor de $122,933 miles de pesos (SAGARPA 2006). Desafortunadamente, 50% de la producción de especies de importancia comercial en esta zona está integrada por organismos inmaduros y hembras grávidas (Madrid et al. 1997, SAGARPA 2007a). Por ello es indispensable identificar las áreas de reproducción y crianza de tiburones, para que exista la posibilidad de protegerlas frente a los evidentes indicios de sobre pesca (Camhi et al. 1998, Anislado y Robinson 2001). El objetivo de este trabajo fue detectar zonas de reproducción y crianza de tiburones en el Golfo de California e identificar las temporadas de máxima utilización por estas especies. Finalmente, esta información fue empleada junto con una serie de atributos básicos de las diferentes especies de tiburón para sugerir áreas potencialmente prioritarias para el manejo.
Es importante aclarar que el uso de AMPs como estrategia de conservación y manejo pesquero es complicada debido a la imprecisión histórica que se ha presentado en la comprensión del concepto de área de crianza para tiburones, y dada la falta de criterios estandarizados para identificarlas (Heithaus 2007, Heupel et al. 2007). La mayoría de los autores sugieren que estas zonas son benéficos para los jóvenes dada su disponibilidad de alimento y protección contra depredadores; por lo tanto, éstos son considerados como los principales criterios para identificarlas (Springer 1967, Bass 1978, Branstetter 1990). Actualmente, el concepto se ha ampliado y mejorado, y se ha planteado la posibilidad de definir estas zonas usando tres criterios cuantitativos para organismos menores a un año: (1) los tiburones son más comunes de encontrar en esta área que en otras, (2) los individuos presentan una tendencia a permanecer o regresar por largos periodos (semanas o meses), y (3) el hábitat es usado repetidamente a través de los años. Con esta perspectiva y considerando las características de las historias de vida de las especies (talla de nacimiento, tasa de crecimiento, edad de primera madurez, estructura de tallas de las hembras grávidas y los neonatos) se facilita el proceso de selección de estos sitios mediante un esquema más riguroso (Heupel et al. 2007, Kinney y Simpfendorfer 2009). Los registros numéricos de hembras grávidas y neonatos en el Golfo de California son limitados; incluso la información presente en la literatura muchas veces es anecdótica debido que no existía un marco teórico claro sobre todos los datos que se deben de registrar y documentar para el estudio de la biología reproductiva de los elasmobranquios. Por ello, las áreas de crianza identificadas en el presente trabajo se pueden considerar potenciales y su propuesta es un ejercicio heurístico sobre las posibles zonas prioritarias de manejo realizado con la mejor información disponible de la región.
Materiales y métodos
Se realizó la recopilación y análisis de la literatura publicada, tesis e informes técnicos que contienen información sobre conducta y biología reproductiva de las especies de tiburones de importancia comercial en el Golfo de California, con la finalidad de identificar áreas y temporadas de reproducción y crianza, las cuales fueron seleccionadas utilizando los criterios establecidos por Castro (1993):
• Para identificar y proponer sitios como área de reproducción la literatura tenía que manejar información referente a hembras con cicatrices de cópula, hembras grávidas con embriones en etapas tempranas de desarrollo, hembras y machos en fase reproductiva, y una proporción de sexos cercana a 1:1.
• Para denominar una zona como área de crianza, la literatura debía contemplar información pertinente a hembras grávidas con embriones en etapas tardías de desarrollo (próximos a la expulsión), y la presencia de neonatos e individuos jóvenes en las capturas.
Áreas y temporadas de reproducción y crianza
Se dividió el Golfo de California en tres regiones en función de las áreas de captura que se manejan en la pesquería de tiburón (Castillo–Géniz et al. 2000, CONAPESCA–INP 2004). La información recopilada sobre áreas y temporadas de reproducción y crianza de las especies se incorporó en un sistema de información geográfica con la finalidad de detectar similitudes y diferencias mediante el análisis espacio–tiempo (ESRI 1999).
Zonas prioritarias de manejo
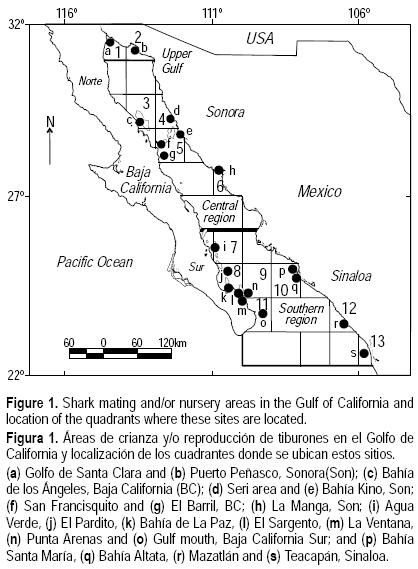
Para el análisis se utilizaron cuadrantes geográficos de 1° de latitud x 1° de longitud, en los que se ubicaron las áreas de reproducción y crianza de tiburones (fig. 1). Para clasificar los cuadrantes en orden prioritario de conservación se realizó un análisis de complementariedad (Humphries et al. 1991, Scout et al. 2001). Este método permite maximizar el número de especies que se protegerían en una región dada de la zona de estudio (en este caso, la zona costera del Golfo de California) pero designando al mismo tiempo para su protección un número mínimo de áreas, los cuales son dos criterios fundamentales para la optimización de las labores de conservación (Vane–Wright et al. 1991, van Jaarsveld et al. 1998). La técnica de complementariedad se ha vuelto clave para definir áreas relevantes pues, a criterio del investigador, se pueden involucrar aspectos tanto ecológicos como filogenéticos del grupo de interés (Rodrigues y Gaston 2002, Faith et al. 2003). Es una técnica ampliamente utilizada en ambientes terrestres (Sarkar et al. 2006), y en México ha sido empleada en especial para analizar la situación de mamíferos y plantas (Contreras–Medina et al. 2001, Ceballos 2007). Para especies marinas este algoritmo ha sido usado en la definición de áreas prioritarias para protección de peces óseos en Sudáfrica, Australia, Chile y EUA (Turpie et al. 2000, Fox y Beckley 2005, Tognelli et al. 2005, Geselbracht et al. 2009), pero ésta es su primera aplicación al caso de peces cartilaginosos.
Con base en la revisión bibliográfica, en el presente estudio se consideraron para la selección de áreas los siguientes criterios (tablas 1, 2 y 3): (a) número total de especies que se reproducen y/o utilizan áreas de crianza en cada cuadrante, (b) presencia de especies con fecundidad baja (menos de 10 crías potenciales), (c) presencia de especies que maduran a tallas mayores a los 200 cm de longitud total, (d) presencia de especies con sitios limitados de reproducción, (e) presencia de especies cuyas capturas son más importantes (Castillo–Géniz et al. 2000, Smith et al. 2009), y (d) presencia de especies consideradas de primera categoría por el valor comercial de sus aletas (Smith et al. 2009).
Finalmente, se elaboraron mapas donde se especifican los cuadrantes prioritarios para la conservación con respecto a cada criterio y uno final resultante de la integración de todos los criterios, que representa los niveles relativos de importancia para el manejo de cada área de crianza y reproducción de tiburones. Además se realizó el análisis de discrepancias o espacios para detectar cuántas de las áreas prioritarias de manejo identificadas corresponden a un AMP. El mapa se construyó empleando el programa ArcView 3.2 (ESRI 1999).
Resultados
Especies de importancia comercial
Con base en la literatura se estableció que existen registros de áreas de crianza y reproducción de 14 especies de tiburones de importancia comercial en el Golfo de California, distribuidas en seis familias: Carcharhinidae, Sphyrnidae, Triakidae, Squatinidae, Lamnidae y Alopiidae (tabla 1).
Las seis especies que presentaron más registros en cuanto a sitios de reproducción fueron: Carcharhinus limbatus, Sphyrna lewini, Rhizoprionodon longurio, Carcharhinus falciformis, Squatina californica y Carcharhinus obscurus (tabla 1).
Áreas y temporadas de reproducción y crianza de tiburones
En el Alto Golfo de California se congregan R. longurio, Mustelus henlei y S. californica con fines reproductivos en primavera. La región central del Golfo de California es utilizada como área de reproducción, nacimiento y crianza por varias especies durante la temporada de máxima utilización de primavera y verano: en San Francisquito y El Barril, Baja California (BC), se han observado congregaciones de R. longurio, C. falciformis, C. obscurus, C. limbatus y S. lewini; en Bahía Kino y La Manga, Sonora, se han observado de C. falciformis, C. obscurus y C. limbatus. En la región sur del Golfo de California, C. falciformis, C. limbatus, R. longurio, S. lewini y Sphyrna zygaena se reproducen principalmente en Bahía Santa María–Altata, Sinaloa; mientras que C. falciformis, R. longurio, Nasolamia velox, S. lewini, S. zygaena y M. lunulatus lo hacen en Mazatlán, Sinaloa (tablas 2, 3).
Similitudes y diferencias en la temporalidad del ciclo reproductivo y de crianza
El 71% de las especies de tiburones de importancia comercial que se reproducen y utilizan áreas de crianza en el Golfo de California completan su ciclo durante las temporadas de primavera y verano, a excepción de cuatro (Prionace glauca, Isurus oxyrinchus, Squatina californica y Alopias pelagicus) que difieren en cuanto a este comportamiento. El angelito (S. californica) presenta áreas de crianza y reproducción desde Bahía de Los Ángeles, BC, hasta Bahía de La Paz, Baja California Sur (BCS), pero también en Sonora durante invierno–primavera. El zorro azul (A. pelagicus) se congrega con fines reproductivos en la región central del Golfo de California y en la zona adyacente a Mazatlán en otoño, invierno y primavera. Las especies I. oxyrinchus y P. glauca se reproducen en la región sur del golfo en invierno y primavera (tablas 2, 3, 4).
Zonas prioritarias de manejo
Como resultado de la revisión bibliográfica se identificaron 19 zonas de reproducción y crianza de tiburones en el Golfo de California presentes en 13 cuadrantes, de los cuales seis corresponden a Sonora y Sinaloa y siete a BC y BCS (fig. 1). De los 13 cuadrantes sólo tres (5, 10 y 12) presentaron actividad reproductiva de cinco especies o más, destacando entre ellos el cuadrante 12 (zona adyacente a Mazatlán; tabla 4).
De acuerdo con los análisis de complementariedad, las áreas prioritarias para el manejo con base en el total de especies que se reproducen y utilizan áreas de crianza por cuadrante se encuentran en los cuadrantes 12 (zona adyacente a Mazatlán), 9 (área de El Sargento, La Ventana y Punta Arenas, BCS), 5 (San Francisquito y El Barril, BC, y Bahía Kino), 4 (zona seri de Sonora) y 13 (Bahía de Teacapán, Sinaloa) (fig. 2a). Considerando a las especies con fecundidad menor a 10 crías potenciales por temporada reproductiva, las principales áreas de reproducción y crianza que deben considerarse como prioritarias para el manejo de tiburones están en los cuadrantes 12, 6 (La Manga, Sonora), 4 y 13 (fig. 2b). Con base al criterio de las especies que maduran a tallas mayores a los 200 cm de longitud total, las áreas prioritarias de manejo están localizadas en los cuadrantes 5, 9 y 13 (fig. 2c); pero partiendo de las especies con número limitado de sitios de reproducción y crianza, los cuadrantes prioritarios serían el 12, 9, 5, 4 y 13 (fig. 2d). En la figura 2e se presentan los cuadrantes 12, 9, 6 y 4 como los más importantes considerando, por cuadrante, el número de especies más pescadas en el Golfo de California. Finalmente, los cuadrantes 12 y 9 (fig. 2f) son los prioritarios para el manejo de las especies de tiburón si se toma como base aquellas cuyas aletas son consideradas de primera clase para su comercialización.
Niveles de prioridad para el manejo de las áreas de crianza y reproducción de tiburones
Integrando los cuadrantes prioritarios de conservación con base a cada uno de los criterios (a–f), se identificaron cuatro niveles de importancia relativa para el manejo de las áreas de reproducción y crianza. El primer nivel corresponde a los cuadrantes 12 y 9, el segundo al 13 y el 4, el tercero al 5, y el cuarto al 6 (fig. 3). Con el manejo los seis cuadrantes mencionados se protegería a todas las especies que usan el Golfo de California para crianza y reproducción (tabla 4).
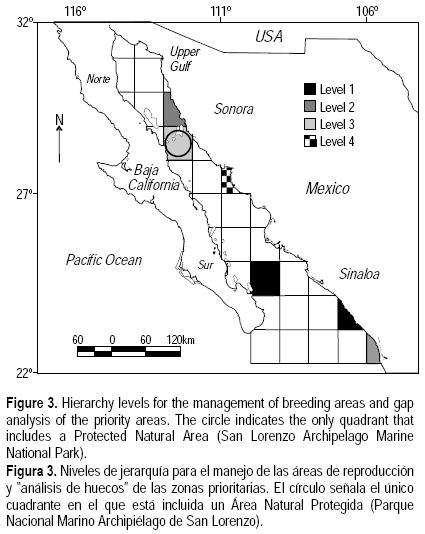
Finalmente, se observó que de los seis cuadrantes o regiones clave identificados, solamente en una (16.7%) existe un AMP (fig. 3).
Discusión
Especies de importancia comercial
De las 24 especies de tiburones que se capturan en el Golfo de California (Villavicencio–Garayzar 1996c, Castillo–Géniz et al. 2000, Villavicencio 2000) se encontraron reportes de áreas de crianza y reproducción de 14, sobresaliendo C. limbatus, S. lewini, R. longurio, C. falciformis, S. californica y C. obscurus por tener el mayor número de registros. Esto se debe posiblemente a tres situaciones: (a) son las que más se pescan en el área de estudio; (b) por ello se tiene más información, ya que se aprovechan los datos que se generan en las pesquerías ribereñas; y (c) el recurso es accesible para su observación durante sus temporadas de congregaciones reproductivas en la zona costera (Villavicencio–Garayzar 1996c, Castillo–Géniz et al. 2000, Alejo–Plata et al. 2007).
Áreas y temporadas de reproducción y crianza
El comienzo de la temporada de apareamiento, gestación, nacimientos y crianza depende principalmente de la temperatura (Pratt y Casey 1990). En el Golfo de California, la temperatura alcanza sus valores mínimos de 18–19°C en abril (primavera) y comienza a incrementarse hasta llegar a su máximo, entre agosto y septiembre (verano), de 30–31°C (Álvarez–Borrego et al. 1978, García–Pámanes y Lara–Lara 2001). Durante este periodo los tiburones tropicales (C. falciformis, C. leucas, C. limbatus, C. obscurus, R. longurio, M. lunulatus, M. henlei, N. velox, S. lewini, S. zygaena) encuentran en el Golfo de California las condiciones bióticas y abióticas que permitirán a los neonatos crecer rápidamente para incorporarse a la población de juveniles y adultos (Castro 1993, Castillo–Géniz et al. 2000, Mendizábal et al. 2000, Alejo–Plata et al. 2007).
En el Golfo de California, principalmente en las regiones central y sur, las surgencias más importantes se presentan en invierno–primavera (Álvarez–Borrego y Schwartzlose 1979, García–Pámanes y Lara–Lara 2001) propiciando el incremento de la productividad primaria que a su vez enriquecerá las fuentes primordiales de alimento para los tiburones neonatos y jóvenes en las áreas de crianza (lagunas costeras, bahías, estuarios y marismas) durante los meses de máximas congregaciones reproductivas, mayo a agosto (Villavicencio 2000). Además, la Corriente de California entra al Golfo de California en invierno y principios de primavera, lo que favorece la migración de los tiburones azul, mako y zorro azul en esas temporadas a la región sur del golfo, para llevar a cabo sus ciclos de reproducción y crianza (Mendizábal 1995, Arias 1998, Mendizábal et al. 2000).
Similitudes y diferencias en la temporalidad del ciclo reproductivo y de crianza
Castro (1993), Simpfendorfer y Milward (1993) y Alejo–Plata et al. (2007) mencionan que el uso común de un área de crianza por varias especies de tiburón ocurre porque la disponibilidad de alimento es alta. Este comportamiento se observó en C. falciformis, C. leucas, C. limbatus, C. obscurus, R. longurio, M. lunulatus, M. henlei, N. velox, S. lewini y S. zygaena en la temporada de máxima reproducción en primavera–verano (mayo a agosto); mientras que los tiburones de aguas frías a templadas, como el mako, el azul, el angelito y el zorro azul, presentan temporadas de crianza y reproducción que corresponden a invierno y primavera (ver tablas 1 y 4), principalmente en la boca del Golfo de California (Mendizábal et al. 2000, Villavicencio 2000).
Zonas prioritarias de manejo
Varios autores (Castro 1993, Klimley et al. 1993, Simpfendorfer y Milward 1993, Bonfil 1997, Anislado y Robinson 2001) han documentado que los movimientos horizontales que realizan los tiburones hacia aguas someras son una estrategia evolutiva que se ha mantenido en su historia de vida y por lo tanto deben éstas ser consideradas como áreas críticas para conservar las relaciones stock/reclutamiento (Lund 1990, Castro 1993, SAGARPA 2007a).
Los cuadrantes prioritarios para el manejo (fig. 2a–f) están en la regiones central y sur del Golfo de California, donde se presentan las zonas de surgencias más importantes. Posiblemente su elevada productividad primaria permite el establecimiento de importantes concentraciones de calamares, sardinas, macarela y anchoveta, las que a su vez soportan poblaciones de grandes depredadores, como los tiburones, cuando se acercan a la zona costera con fines reproductivos y de crianza (Álvarez–Borrego et al. 1978, Castillo–Géniz et al. 2000, Villavicencio 2000).
Los principales problemas para diseñar AMPs para los tiburones radican en poder incluir en ellas la mayoría de los hábitats donde pasan sus diferentes estadios de vida, e implementarlas para especies altamente migratorias y oceánicas (A. pelagicus, P. glauca, I. oxyrinchus y C. limbatus) por su amplia distribución, lo que implicaría proteger áreas muy grandes, una tarea imposible de conseguir (Nakano 1994, Bonfil 1999, Mendizábal et al. 2000); por eso en este trabajo se consideraron los centros de congregaciones reproductivas donde coinciden las especies en la zona costera y las características de las historias de vida (tablas 1, 3) como criterios de selección, a fin de escoger pocas áreas interconectadas, lo cual cumple con un requisito fundamental para que la conservación de recursos pesqueros sea factible (Bonfil 1999, Contreras–Medina et al. 2001).
Niveles de prioridad para el manejo de las áreas de crianza y reproducción de tiburones
Los 13 cuadrantes detectados en este estudio (fig. 1) son todos importantes porque representan posibles zonas de congregaciones reproductivas (Cudney y Turk 1998, Mendizábal et al. 2000, Villavicencio 2000, Márquez et al. 2005), pero presentan diferentes niveles de prioridad si se quiere lograr un manejo óptimo de las áreas de reproducción y crianza identificadas con los análisis de complementariedad. En los cuadrantes correspondientes al nivel 1 de prioridad, los cuadrantes 12 y 9, se protegería a seis especies principales (R. longurio, N. velox, S. lewini, S. zygaena, A. pelagicus, M. lunulatus) en el primero y a I. oxyrinchus y P. glauca en el segundo. En los de nivel 2, en los cuadrantes 13 y 4 se protegería a C. leucas y M. henlei, respectivamente; mientras que en el nivel 3, las tres especies que estarían siendo objetos de manejo en el cuadrante 5 serían C. falciformis y C. limbatus (San Francisquito–El Barril) y S. californica (Bahía Kino). Finalmente, dentro del nivel 4 se protegería a C. obscurus en el cuadrante 6. Con la protección de las zonas antes mencionadas se aseguraría un manejo más adecuado del recurso en el Golfo de California porque se trata de sitios complementarios con respecto a las especies.
En el Golfo de California las principales fuentes de mortalidad por pesca (producción pesquera y cantidad de embarcaciones) para tiburones se encuentran por orden de importancia en sitios de Sinaloa, BC, BCS y Sonora (tabla 5), lo cual resulta consistente con los niveles de prioridad detectados en el presente trabajo. Esto se debe a la correspondencia que existe entre las zonas de pesca y las áreas de reproducción y crianza en sus principales temporadas (Villavicencio–Garayzar 1996c, Bizarro et al. 2007).
El Golfo de California es la zona con mayor producción anual de tiburones en todo el Pacífico mexicano. La posible implementación de las seis áreas prioritarias de manejo propuestas en este trabajo para pesquerías multiespecíficas de tiburones podría tener fuertes impactos socioeconómicos en las comunidades ribereñas si éstas dependen exclusivamente de esta actividad para subsistir. Para hacer frente a esta situación las autoridades administrativas de las AMPs y los pescadores deberán trabajar en conjunto para evitar conflictos; además, se tendrían que buscar actividades complementarias o alternativas enfocadas al aprovechamiento de otros recursos, como el turismo, para las comunidades (FCRR 1997; Bonfil 1997, 1999; SAGARPA 2006).
El establecimiento de zonas de protección puede causar impacto sobre pesquerías distintas a la que se busca proteger y originar el fracaso de su implementación; por ejemplo, el Servicio Nacional de Pesquerías Marinas de EUA intentó cerrar las áreas de crianza de tiburones a la pesca, pero esta medida fue rechazada debido a la falta de investigación sobre el tema y al efecto adverso que tendría sobre la pesquería de camarón. Este mismo problema se presentó en Australia al momento de tratar de implementar AMPs para Squalus acanthias, debido a que éste es capturado frecuentemente de manera incidental en redes de arrastre (Castro 1993, Bonfil 1999). La misma situación se podría presentar en el Golfo de California en el caso de que se quisieran implementar zonas de protección para Squatina californica, M. lunulatus, M. henlei e individuos jóvenes de otras especies como Sphyrna lewini y S. zygaena, ya que estas especies quedan constantemente atrapados en las redes de enmalle usadas para la captura de escama (Anislado y Robinson 2001, Pérez–Jiménez y Sosa–Nishizaki 2008).
En cuanto al conocimiento de las áreas de crianza en el Golfo de California, no se cuenta con un análisis de la estructura de tallas de hembras grávidas y de neonatos, ni de sus movimientos locales o estacionales (Heupel et al. 2007). En cuanto al tiempo de residencia de los neonatos, se desconoce si las zonas son primarias o secundarias; o con respecto al grado de exposición a depredadores, si las áreas son zonas protegidas o abiertas (Bass 1978, Branstetter 1990, Heupel et al. 2007). Por ello, cabe aclarar que hace falta información para poder proponer sitios de conservación con base en criterios biológicos robustos basados en la abundancia, residencia y uso interanual de estos sitios por organismos jóvenes; por ende, la propuesta de manejo que aquí se presenta es heurística y puede estar lejos de garantizar a una verdadera protección. Sin embargo, los reportes de las diversas fuentes bibliográficas revisadas (ver tabla 3) indican la presencia de neonatos y hembras grávidas, por lo que no se pueden descartar definitivamente como hábitats críticos dado que no se sabe la cantidad de individuos examinados en los estudios de biología reproductiva, y es posible que algunos de ellos hayan sido capturados en su ruta migratoria estacional (corredor) o que las artes de pesca no fueran selectivas para los neonatos, lo cual podría ser el caso para la bibliografía que señala pocos individuos encontrados. Por ello es importante que cuando se realicen investigaciones de este tipo se incluyan datos cuantitativos y se analice la estructura de tallas de hembras grávidas y neonatos para saber si realmente se trata de un área de crianza (Beck et al. 2001, Heupel et al. 2007).
En la Norma Oficial Mexicana NOM–029–PESC–2006 se establecen el complejo Bahía Santa María–Altata y la Bahía de Teacapán, en Sinaloa, y los bajos Gorda y Espíritu Santo, en BCS como zonas de refugio para proteger la reproducción y el nacimiento de tiburones en el Golfo de California (SAGARPA 2007a) lo cual difiere de nuestros resultados, ya que solamente coincide en cuanto a la zona adyacente a Teacapán; sin embargo, la ley no incluye la mayoría de las zonas prioritarias de manejo descritas en la presente propuesta heurística (fig. 3), quedando fuera sitios que se consideraron muy importantes en este estudio como Mazatlán, en Sinaloa; El Sargento, La Ventana y Punta Arenas, en BCS; el área marina San Francisquito–El Barril, en BC; y la zona seri, Bahía Kino y La Manga, en Sonora. Esto se debe a que la información disponible del número de hembras grávidas y neonatos en las fuentes compiladas y revisadas no es lo suficientemente robusta para identificar áreas de crianza con el enfoque cuantitativo actual (Heupel et al. 2007), ya que los datos necesarios para determinar estos hábitats esenciales en el Golfo de California han sido interpretados de manera amplia y liberal, y están basados en definiciones cualitativas con criterios insuficientes que solamente hacen referencia a la presencia de estos organismos (Heithaus 2007, Heupel et al. 2007, Kinney y Simpfendorfer 2009) (tabla 3). Por ejemplo, en la tabla 3 se presentan las características de las historias de vida de 14 especies, de las cuales sólo de seis se cuenta con información cualitativa y cuantitativa de estos estadios. Aún así los registros son limitados para poder identificar a una zona como área de crianza de tiburones de forma precisa. Por eso en la NOM–029–PESC–2006 aparece un número limitado de zonas de refugio, debido a que la información con que se contaba al momento de su formulación era sumamente escasa.
Además de lo anterior, a partir de la comparación de los cuadrantes prioritarios para manejo encontrados en el presente estudio con la ubicación de las áreas naturales protegidas (ANPs) del Golfo de California, se observó que sólo 16.7% de las zonas aquí definidas como prioritarias para tiburones son parte de una ANP (fig. 3); tal es el caso de la zona de San Francisquito y El Barril, que son sitios que están contemplados dentro del Parque Nacional Archipiélago de San Lorenzo (SEMARNAT 2006). Sin embargo, el análisis de discrepancias identificó una serie de nuevas áreas importantes que coinciden con otras propuestas derivadas de investigaciones realizadas por el gobierno federal mexicano, como la de CONABIO–CONANP–TNC–PRONATURA (2007) que está enfocada en la preservación de la biodiversidad marina, ecosistemas y procesos ecológicos relevantes, y la del Programa de Ordenamiento Ecológico Marino del Golfo de California (SEMARNAT 2006).
En la Ley General del Equilibrio Ecológico y La Protección al Ambiente, y en su reglamento, se establecen las bases para la implementación de ANPs (SEMARNAP 1988, SEMARNAP 2000b). Evaluar la factibilidad jurídica de implementar zonas prioritarias para la conservación de tiburones es una atribución del gobierno federal que debe basarse en estudios científicos elaborados por la SEMARNAT y con la colaboración de organizaciones públicas o privadas. Estos sitios podrían ser designados como Áreas de Protección de la Flora y la Fauna (tipo de AMP ecológica) para conservar ecosistemas y procesos frágiles en compatibilidad con las disposiciones del título sexto de la Ley General de Pesca y Acuacultura Sustentables (LEGEPAS), artículo 36, con un plan de manejo respectivo; mientras que desde el punto de vista pesquero técnicamente serían zonas de refugio pesquero o reservas marinas (artículo 32 de la LEGEPAS). La aplicación de este tipo de estrategia de conservación puede ser compatible con cualquier plan de manejo del recurso debido a que los lineamientos de la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) prevén la protección de hábitats críticos y especies vulnerables, lo cual quedaría cubierto con los criterios de conservación utilizados en los análisis de complementariedad (SEMARNAP 1988, 2000a, b; FAO 2001; SAGARPA 2007a, b).
Finalmente, con el presente trabajo se puso de manifiesto que no existe suficiente información de tipo cuantitativo fundamental para identificar áreas de crianza de tiburones en el Golfo de California más precisas con el enfoque que actualmente manejan Heupel et al. (2007); además, el análisis reflejó que el conocimiento regional del tema está basado en conceptos sustentados con observaciones que en un principio no estaban diseñadas para examinar las funciones de estos hábitats esenciales (Kinney y Simpfendorfer 2009), lo que indica que las posibles áreas deben ser sujetas a investigación oceanográfica, biológica y pesquera que incluya preferentemente programas pilotos de marcado y recaptura de tiburones neonatos, análisis de isótopos estables en individuos jóvenes, monitoreo acústico, y la aplicación de técnicas genéticas para comprobar la fidelidad y el uso interanual de los sitios. Además, es necesario conocer a detalle la influencia de las características físicas del ambiente (temperatura del agua y estructura del hábitat) sobre los organismos jóvenes y desarrollar estudios que describan la degradación histórica causada por actividades antrópicas en la zona (Heithaus 2007, Heupel et al. 2007). Sin embargo, para alcanzar tales objetivos de investigación y monitoreo, los cuales podrían generar las bases de datos más robustos para el manejo mediante AMPs, es necesario aplicar medidas de conservación a la mayor brevedad posible debido al estado que guardan las poblaciones. El modelo propuesto para determinar zonas prioritarias de conservación para tiburones a partir de análisis de complementariedad es aplicable, con posibles implicaciones y modificaciones, en otras regiones y para otros organismos considerados estrategas K; esto es, que producen pocas crías con mayor probabilidad de llegar a adultos, tienes tasas de crecimiento lentas, madurez sexual tardía, etc. Aunque la estrategia de protección de áreas prioritarias de crianza y reproducción para tiburones aquí planteada no es la única opción para su conservación, si resulta una herramienta útil para la recuperación de los elasmobranquios, pero para la elaboración de mejores planes de manejo es necesario complementarla con acciones que favorezcan la protección de las diferentes clases de edad.
Agradecimientos
La presente investigación fue financiada por el Consejo Nacional de Ciencia y Tecnología (becario número 8736). Agradecemos a la Universidad Autónoma de Baja California Sur las facilidades brindadas durante la elaboración de este trabajo y a L Castillo–Geniz sus valiosas aportaciones y sugerencias al manuscrito.
Referencias
Alejo–Plata C, Gómez–Márquez J, Ramos S, Herrera E. 2007. Presencia de neonatos y juveniles del tiburón martillo Sphyrna lewini (Griffith & Smith 1834) y del tiburón sedoso Carcharhinus falciformis (Müller & Henle 1839) en la costa de Oaxaca, México. Rev. Biol. Mar. Oceanogr. 42(3): 403–413. [ Links ]
Álvarez–Borrego S, Rivera J, Gaxiola–Castro G, Acosta–Ruiz M, Schwartzlose R. 1978. Nutrientes en el Golfo de California. Cienc. Mar. 5(2): 53–71. [ Links ]
Álvarez–Borrego S, Schwartzlose R. 1979. Masas de agua del Golfo de California. Cienc. Mar. 6: 43–63. [ Links ]
Anislado V. 2008. Demografía y pesquería del tiburón martillo, Sphyrna lewini (Griffith y Smith 1834) (Pisces: Elasmobranchii), en dos provincias oceanográficas del Pacífico mexicano. Ph.D. thesis, Universidad Nacional Autónoma de México, 252 pp. [ Links ]
Anislado V, Robinson C. 2001. Edad y crecimiento del tiburón martillo Sphyrna lewini (Griffith y Smith 1834) en el Pacífico central de México. Cienc. Mar. 27(4): 501–520. [ Links ]
Arias A. 1998. Regionalización del Golfo de California: Una propuesta a partir de concentración de pigmentos fotosintéticos. B.Sc. dissertation, Universidad Autónoma de Baja California Sur, México, 57 pp. [ Links ]
Bass AJ. 1978. Problems in studies of sharks in the southwest Indian Ocean. In: Hodgson ES, Mathewson RF (eds.), Sensory Biology of Sharks, Skates and Rays. Office of Naval Research, Department of the Navy, Arlington, pp. 545–594. [ Links ]
Beck MW et al. 2001. The identification, conservation, and management of estuarine and marine nurseries for fish and invertebrates. BioScience 51: 633–641. [ Links ]
Bernal T. 1999. Observaciones sobre la biología de Carcharhinus obscurus (LeSueur 1818) y Carcharhinus limbatus (Valenciennes 1839) (Pises: Carcharhinidae) en el Golfo de California. B.Sc. dissertation, Universidad Autónoma de Baja California Sur, México, 55 p. [ Links ]
Bizarro J, Smith W, Hueter R, Tyminski J, Márquez–Farías JF, Castillo–Géniz JL, Cailliet GM, Villavicencio–Garayzar CJ. 2007. The status of shark and ray fishery resources in the Gulf of California: Applied research to improve management and conservation. Report to the David and Lucille Packard Foundation, 237 pp. [ Links ]
Blanco–Parra MP, Galván–Magaña F, Márquez–Farías F. 2008. Age and growth of the blue shark, Prionace glauca Linnaeus 1758, on the northwest coast off Mexico. Rev. Biol. Mar. Oceanogr. 43(3): 513–520. [ Links ]
Bonfil R. 1997. Status of shark resources in the southern Gulf of Mexico and Caribbean: Implications for management. Fish. Res. 29(2): 101–117. [ Links ]
Bonfil R. 1999. Marine protected areas as a shark fisheries management tool. In: Seret B, Sire J–Y (eds.), Proc. 5th Indo–Pacific Fish Conference, Noumea, 1997. Paris: Soc. Fr. Ichtyol., pp. 217–230. [ Links ]
Branstetter S. 1990. Early life–history implications of selected carcharhinoid and lamnoid sharks of the northwest Atlantic. In: Pratt HL Jr, Gruber SH, Taniuchi T (eds.), Elasmobranchs as Living Resources: Advances in Biology, Ecology, Systematics and the Status of the Fisheries. NOAA Tech. Rep. 90, National Marine Fisheries Service, Silver Spring, MD, pp. 17–28. [ Links ]
Cadena L. 2001. Biología reproductiva de Carcharhinus falciformis (Chondrichthyes: Carcharhiniformes: Carcharhinidae) en el Golfo de California. B.Sc. dissertation, Universidad Autónoma de Baja California Sur, 68 p. [ Links ]
Camhi M, Fowler S, Musick J, Brautigam A, Fordham S. 1998. Shark and their Relatives: Ecology and Conservation. IUCN Species Survival Commission, Occ. Pap. 20, 39 pp. [ Links ]
Castillo J. 1990. Contribución al conocimiento de la biología y pesquería del cazón bironche, Rhizoprionodon longurio (Jordán y Gilbert 1882) (Elasmobranchii, Carcharhinidae), del sur de Sinaloa, México. B.Sc. dissertation, Universidad Nacional Autónoma de México, 128 pp. [ Links ]
Castillo–Géniz JL, Márquez–Farías JF, Cid del Prado–Vera A, Soriano–Velásquez SR, Corro–Espinosa D, Ramírez–Santiago C. 2000. Tiburones del Pacífico mexicano. Pesquería artesanal. In: Sustentabilidad y Pesca Responsable en México: Evaluación y Manejo. Instituto Nacional de la Pesca, SEMARNAP, pp. 127–151. [ Links ]
Castro J. 1993. The shark nursery of Bulls Bay, South Carolina, with a review of the shark nurseries of the sourtheastern coast of the United States. Env. Biol. Fish. 38: 37–48. [ Links ]
Ceballos G. 2007. Conservation priorities for mammals in mega–diverse Mexico: The efficiency of reserve networks. Ecol. Appl. 17: 569–578. [ Links ]
CONABIO–CONANP–TNC–PRONATURA. 2007. Análisis de vacíos y omisiones en conservación de la biodiversidad marina de México: Océanos, costas e islas. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Comisión Nacional de Áreas Naturales Protegidas, The Nature Conservancy–Programa México, Pronatura, México DF, 129 pp. [ Links ]
CONAPESCA–INP. 2004. Plan de Acción Nacional para el Manejo y Conservación de Tiburones, Rayas y Especies Afines en México (PANMCT). SAGARPA, Mazatlán, México, 85 pp. [ Links ]
Conde M. 2005. Aspectos de la biología reproductiva del tiburón mako Isurus oxyrinchus (Rafinesque 1810) en la costa occidental de Baja California Sur, México. B.Sc. dissertation, Universidad Autónoma de Baja California Sur, México, 72 pp. [ Links ]
Contreras–Medina R, Morrone J, Luna I. 2001. Biogeographic methods identify gymnosperm biodiversity hotspots. Naturwissenschaften 88: 427–430. [ Links ]
Cudney R, Turk P. 1998. Pescando entre Mareas del Alto Golfo de California. CEDO AC, Puerto Peñasco, Sonora, México, 166 pp. [ Links ]
Dahlgren C, Sobel J. 2000. Designing a Dry Tortugas ecological reserve: How big is big enough? Bull. Mar. Sci. 66: 707–719. [ Links ]
ESRI. 1999. ArcView v3.2 GIS. Enviromental Systems Research Institute, New York. [ Links ]
Faith DP, Carter G, Cassis G, Ferner S, Wilkie L. 2003. Complementarity, biodiversity viability analysis and policy based algorithms for conservation. Eviron. Sci. Pol. 6: 311–328. [ Links ]
FAO. 2001. La Ordenación Pesquera: Conservación y Ordenación del Tiburón. FAO orientaciones técnicas para la pesca responsable. Roma, 66 pp. [ Links ]
FCRR. 1997. The Design and Monitoring of Marine Reserves. Fisheries Centre Research Rep. 5(1). Pitcher T (ed. [ Links ]).
Fox NJ, Beckley LE. 2005. Priority areas for conservation of western Australian coastal fishes: A comparison of hotspot, biogeographical and complementarity approaches. Biol. Conserv. 126: 420–428. [ Links ]
García–Pámanes J, Lara–Lara J. 2001. Pastoreo por el micro–zooplancton en el Golfo de California. Cienc. Mar. 27: 73–90. [ Links ]
Geselbracht L, Torres R, Cumming GS, Dorfman D, Beck M, Shaw D. 2009. Identification of a spatially efficient portfolio of priority conservation sites in marine and estuarine areas of Florida. Aquat. Conserv.: Mar . Freshwat. Ecos. 19: 408–420. [ Links ]
Guerrero L. 2002. Captura comercial de elasmobranquios en la costa suroccidental del Golfo de California, México. B.Sc. dissertation, Universidad Autónoma de Baja California Sur, México, 54 pp. [ Links ]
Hanchet S. 1988. Reproductive biology of Squalus acanthias from the east coast, South Island, New Zealand. N.Z. J. Mar. Freshwat. Res. 22(4): 537–549. [ Links ]
Heithaus MR. 2007. Nursery areas as essencial shark habitats: A theoretical perspective. In: McCandless CT, Kohler NE, Pratt HL Jr (eds.), Shark Nursery Grounds of the Gulf of Mexico and the East Coast Waters of the United States. American Fisheries Society, Symp. 50, Bethesda, Maryland, pp. 3–13. [ Links ]
Heupel M, Simpfendorfer C. 2002. Estimation of mortality of juvenile blacktip sharks, Carcharhinus limbatus, with a nursery area using telemetry data. Can. J. Fish. Aquat. Sci. 59: 624–632. [ Links ]
Heupel M, Carlson J, Simpfendorfer C. 2007. Shark nursery areas: Concepts, definition, characterization and assumptions. Mar. Ecol. Prog. Ser. 337: 287–297. [ Links ]
Humphries C, Vane–Wright R, Williams P. 1991. Biodiversity reserves: Setting new priorities for the conservation of wildlife. Park 2: 34–38. [ Links ]
ICSF (International Collective in Support of Fishworkers). 2001. India: La pesca de tiburones una veda mal pensada. SAMUDRA 30: 1–10. [ Links ]
Kinney M, Simpfendorfer C. 2009. Reassessing the value of nursery areas to shark conservation and management. Conserv. Lett. 2: 530–60. [ Links ]
Klimley AP, Cabrera–Mancilla I, Castillo LG. 1993. Descripción de los movimientos horizontales y verticales del tiburón martillo Sphyrna lewini del sur del Golfo de California, México. Cienc. Mar. 19: 95–115. [ Links ]
Lund R. 1990. Chondrichthyan life hystory styles as revealed by the 320 million years old Mississipian of Montana. Env. Biol. Fish. 27: 1–19. [ Links ]
Madrid J, Sánchez P, Ruiz A. 1997. Diversity and abundance of a tropical fishery on the Pacific shelf of Michoacán, Mexico. Estuar. Coast. Shelf Sci. 45: 485–495. [ Links ]
Manjarrez C, Juárez F, Rodríguez J, González A, Díaz R, Lizárraga X, Vega A. 1983. Estudio sobre algunos aspectos biológicos–pesqueros del tiburón en la zona sur de Sinaloa. Memoria de Servicio Social, Universidad Autónoma de Sinaloa, 79 pp. [ Links ]
Márquez F, Corro D, Castillo J. 2005. Observations on the biology of the Pacific sharpnose shark (Rhizoprionodon longurio, Jordan and Gilbert 1882), captured in southern Sinaloa, Mexico. J. Northw. Atl. Fish. Sci. 35: 107–114. [ Links ]
Mendizábal D. 1995. Biología reproductiva, crecimiento, mortalidad y diagnostico de Alopias pelagicus (tiburón zorro) y Carcharhinus limbatus (tiburón volador) de la boca del Golfo de California al Golfo de Tehuantepec (periodo 1986–1987). M.Sc. thesis, Universidad Nacional Autónoma de México, 125 pp. [ Links ]
Mendizábal, Oriza D, Vélez–Marín R, Soriano–Velásquez SR, Castillo–Géniz JL. 2000. Tiburones oceánicos del Pacífico. In: Sustentabilidad y Pesca Responsable en México: Evaluación y Manejo. Instituto Nacional de la Pesca, SEMARNAP, pp. 155–195. [ Links ]
Nakano H. 1994. Age, reproduction and migration of blue shark in the North Pacific Ocean. Bull. Nat. Res. Inst. Far Seas Fish. 31: 141–256. [ Links ]
Pérez–Jiménez JC, Sosa–Nishizaki O. 2008. Reproductive biology of the brown smoothhound shark Mustelus henlei in the northern Gulf of California, Mexico. J. Fish Biol. 73: 782–792. [ Links ]
Pratt H, Casey J. 1990. Shark reproductive strategies as limiting factor in direct fisheries, with a review of Holden's method of estimating growth–parameter. NOAA Tech. Rep. NMFS 90: 97–108. [ Links ]
Rodrigues ASL, Gaston KJ. 2002. Maximising phylogenetic diversity in the selection of networks of conservation areas. Biol. Conserv. 105: 103–111. [ Links ]
Roberts CM, Bohnsack JA, Gell F, Hawkins JP, Goodridge R. 2001. Effects of marine reserves on adjacent fisheries. Science 294: 1920–1923. [ Links ]
SAGARPA. 2006. Anuario Estadístico de Acuacultura y Pesca. Cap. I: Producción pesquera. CONAPESCA 219: 13–100. [ Links ]
SAGARPA. 2007a. Norma Oficial Mexicana NOM–029–PESC–2006. Pesca responsable de tiburones y rayas: Especificaciones para su aprovechamiento. Diario Oficial de la Federación, 14 de febrero de 2007, primera sección, 32 pp. [ Links ]
SAGARPA. 2007b. Ley General de Pesca y Acuacultura Sustentables. Diario Oficial de la Federación, 24 de julio de 2007, primera sección, pp. 25–60. [ Links ]
Sánchez J. 1977. Análisis de la pesquería del tiburón en la zona Seri, Sonora, México. B.Sc. dissertation, Universidad Nacional Autónoma de México, 34 pp. [ Links ]
Sarkar S et al. 2006. Biodiversity conservation planning tools: Present status and challenges for the future. Ann. Rev. Environ. Res. 31: 125–159. [ Links ]
Saucedo C, Colado G, Martínez J, Burgos S, Chacón J, Espinoza J. 1982. Contribución al estudio de la pesquería del tiburón en la zona sur del estado de Sinaloa. Memoria del Servicio Social Universitario, Universidad Autónoma de Sinaloa, 68 pp. [ Links ]
Scout J, Davis F, McGhie R, Wright R, Groves C, Estes J. 2001. Nature reserves: Do they capture the full range of America's biological diversity? Ecol. Aplicat. 11: 999–1007. [ Links ]
SEMARNAP. 1988. Ley General del Equilibrio Ecológico y la Protección al Ambiente. Diario Oficial de la Federación, 28 de enero de 1988, 96 pp. [ Links ]
SEMARNAP. 2000a. Ley General de Vida Silvestre. Diario Oficial de la Federación, 3 de julio de 2000, segunda sección, 43 pp. [ Links ]
SEMARNAP. 2000b. Reglamento de la Ley del Equilibrio Ecológico y la Protección al Ambiente en Materia de Áreas Naturales Protegidas. Diario Oficial de la Federación, 30 de noviembre de 2000, primera sección, 44 pp. [ Links ]
SEMARNAT. 2006. Programa de Ordenamiento Ecológico Marino del Golfo de California. Ed. Discover, 138 pp. [ Links ]
Simpfendorfer C, Milward N. 1993. Utilisation of a tropical bay as a nursery area by sharks of the families Carcharhinidae and Sphyrnidae. Environ. Biol. Fish. 37: 337–345. [ Links ]
Smith WD, Bizarro JJ, Cailliet GM. 2009. La pesca artesanal de elasmobranquios en la costa oriental de Baja California, México: Características y consideraciones de manejo. Cienc. Mar. 35: 209–236. [ Links ]
Springer S. 1967. Social organization of shark populations. In: Gilbert PW, Metheson RF, Rall DP (eds.), Sharks, Skates and Rays. Johns Hopkins Press, Baltimore, pp. 149–174. [ Links ]
Stone BR, Bailey CM, McLaughlin AS, Mace MP, Schulze MB. 1998. Federal management of Atlantic shark fisheries. Fish. Res. 39: 215–221. [ Links ]
Tognelli MF, Silva–García C, Labra FA, Marquet PA. 2005. Priority areas for the conservation of coastal marine vertebrates in Chile. Biol. Conserv. 126: 420–428. [ Links ]
Torres A. 1999. Observaciones sobre la biología reproductiva de la cornuda barrosa Sphyrna lewini (Griffith y Smith 1834) (Pises: Sphyrnidae) en aguas del noroeste de México. B.Sc. dissertation, Universidad Nacional Autónoma de México–ENEPI, 68 pp. [ Links ]
Turpie JK, Beckley LE, Katua SM. 2000. Biogeography and the selection of priority areas for conservation in South African coastal fishes. Biol. Conserv. 92: 59–72. [ Links ]
Van Jaarsveld AS et al. 1998. Biodiversity assessment and conservation strategies. Science 279: 2106–2108. [ Links ]
Vane–Wright R, Humphries C, Williams P. 1991. What to protect? Systematics and the agony of choice. Biol. Conserv. 55: 235–254. [ Links ]
Vázquez R. 2003. Aspectos biológicos de tiburones y rayas en la costa del centro y sur de Sinaloa, en invierno y primavera. B.Sc. dissertation, Universidad Autónoma Metropolitana, México, 103 pp. [ Links ]
Villavicencio C. 2000. Áreas de crianza de tiburones en el Golfo de California. Universidad Autónoma de Baja California Sur. Informe Final SNIB–CONABIO proyecto L054, México. [ Links ]
Villavicencio–Garayzar CJ. 1996a. Aspectos poblacionales del angelito, Squatina californica (Ayres), en Baja California, México. Rev. Invest. Cien. Ser. Cienc. Mar. UABCS 7(1–2): 15–21. [ Links ]
Villavicencio–Garayzar CJ. 1996b. Reproducción de Carcharhinus obscurus (Pises: Carcharhinidae) en el Pacífico nororiental. Rev. Biol. Trop. 4: 141–153. [ Links ]
Villavicencio–Garayzar CJ. 1996c. Pesquería de tiburón y cazón. In Casas–Valdez M, Ponce–Díaz G (eds.), Estudio del Potencial Pesquero y Acuícola en Baja California Sur. SEMARNAP, Gob. del estado de Baja California Sur, FAO, UABCS, CIBNOR, CICIMAR, INP CETMAR, México, pp. 305–316. [ Links ]
Walker T. 1992. Fishery simulation model for sharks applied to the gummy shark, Mustelus antarticus (Günther), from southern Australian waters. Aust. J. Mar. Freshwat. Res. 43: 195–212. [ Links ]
Zayas J. 1998. Biología reproductiva del tiburón ángel Squatina californica (Ayres 1859) (Pises: Squatinidae) en el Golfo de California. B.Sc. dissertation, Universidad Autónoma de Baja California Sur, México, 49 pp. [ Links ]
* DESCARGAR VERSIÓN BILINGÜE (INGLÉS–ESPAÑOL) EN FORMATO PDF
Traducido al inglés por Christine Harris














