Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.34 n.2 Ensenada Jun. 2008
Notas de investigación
Actividad antioxidante ex vivo de los polisacáridos del alga roja Porphyra yezoensis
Ex vivo antioxidation activity of polysaccharides from the red alga Porphyra yezoensis
F Liu, J Liu, J Gu, L Zhang, W Shen, T Guo, C Liu, P He*
Key Laboratory of Aquatic Genetic Resources and Aquacultural Ecosystems Certificated by the Ministry of Agriculture, Shanghai Ocean University, Shanghai 200090, PR, China. * E-mail: pmhe@shou.edu.cn
Recibido en agosto de 2007.
Aceptado en abril de 2008.
Resumen
Se estudió la actividad antioxidante de polisacáridos extraidos del alga roja Porphyra yezoensis. Se midió y analizó sistemáticamente su eficiencia para eliminar los radicales libres O-2·, -OH y DPPH, y sus efectos inhibitorios en la hemólisis inducida por H2O2 en eritrocitos de ratón, así como en la peroxidación lipídica en homogeneizado de hígado de ratón. Los resultados sugieren que el polisacárido de Porphyra, en el intervalo de concentración experimental, presentó actividad antioxidante. La eficiencia de eliminación para O-2· resultó notablemente alta, con una tasa máxima de 82.77%. La eficiencia para eliminar el radical ·OH fue aún mayor, con una tasa máxima de 85.63%, mientras que para eliminar DPPH fue de 13.97%. Los efectos inhibitorios en la hemólisis de eritrocitos de ratón y en la formación de malondialdehído en el hígado de ratón fueron significativos, con tasas máximas de inhibición de 82.90% y 58.48%, respectivamente. Estos resultados en su conjunto indican que los polisacáridos extraídos de Porphyra tienen una fuerte actividad antioxidante.
Palabras clave: Porphyra yezoensis, polisacáridos, antioxidante, radical libre.
Abstract
The ex vivo antioxidation activity of polysaccharide extracted from the red seaweed Porphyra yezoensis was studied by systematically measuring and analyzing the scavenging efficiencies on the free radicals O-2·, -OH and DPPH, and the inhibitory effects on the hemolysis in mouse erythrocytes induced by H2O2 and on lipid peroxidation in mouse liver homogenates. The results show that Porphyra polysaccharide, in the experimental concentration range, possessed antioxidation activity. The scavenging efficiency for O-2· was found to be remarkably high and the maximum scavenging rate was 82.77%. The scavenging efficiency for ·OH was even higher than for O-2·, with a maximum removing rate of 85.63%, whereas for DPPH it was 13.97%. The inhibitory effects on mouse erythrocyte hemolysis and malondialdehyde formation in mouse liver were significant, with maximum inhibition rates of 82.90% and 58.48%, respectively. The combined data indicate that the polysaccharide extracted from Porphyra has strong antioxidation activity.
Key words: Porphyra yezoensis, polysaccharide, antioxidation, free radical.
Introducción
Los radicales libres derivados del oxígeno son productos secundarios comunes en el proceso metabólico; sin embargo, estos compuestos son muy activos y pueden causar daños aparentes, conocidos como daños oxidativos, en las membranas de las células y otras estructuras celulares (Cuzzocrea et al. 2001). El daño causado por los radicales libres ha sido vinculado directamente con enfermedades como la arterioesclerosis, la formación de cataratas, el envejecimiento y la carcinogénesis (Cuzzocrea et al. 2001). Para contrarrestar la destructividad de los radicales libres, el cuerpo humano posee un complejo sistema de defensa antioxidante que utiliza una variedad de vitaminas, minerales y otras sustancias naturales (Cuzzocrea et al. 2001). Por tanto, es posible prevenir el daño radical complementando la dieta con ciertos alimentos, nutrientes y hierbas que presentan actividad antioxidante.
En años recientes se ha demostrado que los polisacáridos sulfatados del alga parda Fucus vesiculosus presentan actividad antioxidante (Ruperez et al. 2002). Xue et al. (2001) confirmaron esta actividad mediante una prueba de la reducción férrica de los antioxidantes. Los polisacáridos sulfatados de Laminaria japonica y Ecklonia kurome Okam también han sido señalados como secuestradores de radicales libres (Hu et al. 2001, Ruperez et al. 2002, Han et al. 2006). Más recientemente, los datos generados en varios laboratorios de investigación científica indican que el polisacárido de alga roja (Porphyra haitanensis o P. yezoensis) tiene múltiples funciones biológicas, como anticoagulante (Zhou y Chen 1990), antisenescente (Zhang et al. 2002), antifatigante (Guo et al. 2005), anticancerígeno (Zhang et al. 2001) y antivirus (Zhou y Chen 1990), así como efectos sobre la proliferation de linfocitos y células de Sertoli (Xiao et al. 2003, Guo et al. 2006), modulación inmune y actividad secuestradora de radicales libres (Zhou y Chen 1989, Yashizawa et al. 1993, 1995).
El alga roja Porphyra es una importante fuente alimenticia en la dieta asiática y es muy utilizada en la medicina tradicional china. Se ha encontrado que tres fracciones de polisacáridos con diferentes contenidos de sulfato de P. haitanensis muestran actividad antioxidante (Wang et al. 2004) y que dos fracciones de polisacáridos de P. yezoensis tienen propiedades antifatigantes y anticáncer, y que aumentan la inmunidad (Guo et al. 2005, 2006; Zhang et al. 2007). El objetivo de este estudio fue analizar la actividad antioxidante de los polisacáridos extraidos de P. yezoensis.
Material y métodos
Material
Los polisacáridos de P. yezoensis fueron proporcionados por el Laboratorio de Biotecnología de Algas Marinas de la Universidad de la Pesca de Shanghai, China. Se secaron y cortaron hojas de P. yezoensis en pedazos pequeños. Se les extrajeron los lípidos mediante recirculación de alcohol y los polisacáridos con agua caliente durante 3 h. Se concentró el extracto y se extrajeron las proteínas usando el método de Sevag. Los polisacáridos fueron precipitados con alcohol (95%) antes de purificarse utilizando una columna DEAE-52 (lavado con agua destilada y NaCl 3 M) y una columna SephadexG-200 (lavado con NaCl 0.02 M), siguiendo el protocolo descrito previamente por Liu et al. (2005) y Gu et al. (2007). Este procedimiento produjo polisacáridos acídicos con 9% de sulfato (Liu et al. 2005, Gu et al. 2007).
Medición de la actividad secuestradora del radical anión superóxido (0-2·)
El método para medir la actividad secuestradora del radical anión superóxido es similar al protocolo descrito por Ponti et al. (1978). De forma resumida, los radicales aniones superóxidos se generaron con el sistema PMS-NADH-NBT. La solución reactiva (3 mL) consistió en Tris-HCl 0.5 M (pH 8.0), desoxicoenzima I (NADH) 80 μM, nitroazul de tetrazolio (NBT) 50 μM y metasulfato de fenazina (PMS) 16 μM. Se añadieron los polisacáridos disueltos en agua destilada a la solución amortiguadora hasta alcanzar concentraciones finales de 2.5, 5, 10, 20, 40, 80 y 160 μg mL-1, y se registró la absorbancia a 517 nm después de 30 min. Para el control, se sustituyó la NADH con el amortiguador Tris-HCl.
Medición de la actividad secuestradora del radical hidroxilo (·OH)
La actividad secuestradora del radical hidroxilo se midió siguiendo el protocolo descrito por Smirnoff y Cumbes (1989). La solución reactiva consistió en fosfato de sodio 150 mM (pH 7.4), FeSO4-EDTA 0.15 mM, salicilato de sodio 2 mM y H2O2 6 mM. Se agregaron diferentes polisacáridos a concentraciones finales de 0.5 a 400 μg mL-1. Para el control se sustituyó el H2O2 con el amortiguador de fosfato de sodio (150 mM, pH 7.4). Las mezclas fueron incubadas a 37°C durante 1 h y se registró la absorbancia a 510 nm.
Medición de la actividad secuestradora del radical DPPH
Para medir la actividad secuestradora del radical DPPH se siguió el protocolo descrito por Zhang et al. (2003). Se generaron los radicales libres usando 1,1-difenil-picril-hidracilo (DPPH). Brevemente, el DPPH se disolvió en tolueno mínimo y se mezcló con etanol al 50% hasta una concentración final de 127 μM. La solución reactiva (2 mL) consistió de 1.9 mL de DPPH y diferentes concentraciones (15-250 μg mL-1) de polisacáridos. La absorbancia de las mezclas se midió usando un espectrofotómetro a 525 nm después de 20 min.
Medición de la hemólisis inducida por H2O2 en eritrocitos
Las actividades secuestradoras de los polisacáridos en la hemólisis inducida por H2O2 en eritrocitos de ratón se midieron siguiendo el protocolo descrito por Li et al. (2000). De forma resumida, se agregó heparina de sodio a la sangre de ratón como anticoagulante, y se centrifugó a 100 g durante 10 min. Se eliminaron el plasma y los glóbulos blancos de la sangre, y los eritrocitos fueron lavados tres veces con solución salina fisiológica. Después del último lavado, se centrifugó la muestra a 100 g durante otros 10 min, y se resuspendieron las células en solución salina fisiológica. La solución reactiva (3 mL) consistió de 1 mL de suspensión de eritrocitos, diferentes concentraciones (2.5-200 μg mL-1) de polisacáridos y 1 mL de H2O2 400 μM. Se incubó la mezla a 37°C por 1 h, y posteriormente se agregaron seis volúmenes de solución salina fisiológica y se centrifugó a 300 g durante 6 min. La absorbancia del sobrenadante se determinó usando un espectrofotómetro a 415 nm. En el caso del control no se agregaron polisacáridos.
Medición de la actividad inhibidora de la peroxidación lipídica en el homogeneizado de hígado de ratón
Se preparó el homogeneizado de hígado de ratón siguiendo el protocolo descrito por Li et al. (2000). Inmediatamente después de sacrificar los ratones por dislocación cervical se separaron los tejidos del hígado y se suspendieron en solución fisiológica salina fría (0.5%). Se centrifugó la solución en suspensión a 50 g y 4°C durante 10 min para obtener el sobrenadante. Para medir los efectos inhibitorios de los polisacáridos en la peroxidación lipídica en el homogeneizado de hígado de ratón, se incubó el sobrenadante (1 mL) con 1 mL de polisacárido (2-280 μg mL-1), 100 μL de FeSO4 6 mM y 40 μL de H2O2 20 mM, a 37°C por 1 h. La reacción se detuvo con la adición de ácido tricloroacético al 15% (1 mL), seguido de ácido 2-tiobarbitúrico al 0.7% (1 mL). Después de la remoción del precipitado de proteína mediante centrifugación a 100 g durante 10 min, se registró la absorbancia a 532 nm. La coloración adquirida se debe al producto de la oxidación del peróxido lipídico: el complejo malondialdehído-ácido tiobarbitúrico. En el caso de las muestras control se omitieron el FeSO4 y el H2O2.
Cálculo de la tasa de eliminación
El porcentaje de actividad secuestradora se evaluó usando la siguiente ecuación:
Tasa de eliminación (%) = (A - Ax)/(A - Ao) × 100%
donde A es la absorbancia del sistema de generación de radicales libres, Ax es la absorbancia de las muestras, y Ao es la absorbancia del control.
Análisis estadístico
Los datos se procesaron con el paquete SPSS (SPSS Inc., IL, EUA) y se analizaron usando la prueba t de Student. Se consideró estadísticamente significativo un nivel de P < 0.01 en relación con las muestras de control.
Resultados
Efectos de la concentración de polisacáridos sobre la tasa de eliminación para el radical anión superóxido (O-2·)
Las tasas de eliminación del radical anión superóxido con diferentes concentraciones del polisacárido de Porphyra se presentan en la figura 1. El IC50 del polisacárido de Porphyra resultó entre 2.5 y 5.0 μg mL-1, lo que indica que la actividad secuestradora de los polisacáridos fue significativa. La tasa de eliminación de vitamina C (control positivo) con 20 μg mL-1 fue de 36.06%, mientras que la del polisacárido fue de alrededor de 68.38% con 20 μg mL-1. La tasa de eliminación alcanzó 82.77% cuando la concentración de polisacáridos fue de 160 μg mL-1.

Efectos de la concentración de polisacáridos sobre la tasa de eliminación para el radical libre hidroxilo (·OH)
Los efectos de la concentración de polisacáridos sobre la tasa de eliminación del radical hidroxilo se muestran en la figura 2. Como puede observarse, el polisacárido de Porphyra también presentó actividad secuestradora del radical hidroxilo. La tasa de eliminación de vitamina C (control positivo) con 20 μg mL-1 fue de 56.23%, mientras que la del polisacárido con 10 μg mL-1 fue de alrededor de 25.18%. La eficiencia de eliminación alcanzó 85.63% cuando la concentración de polisacáridos era de 400 μg mL-1.

Efectos de la concentración de polisacáridos sobre la tasa de eliminación para el radical DPPH
La capacidad del polisacárido de Porphyra para eliminar el radical DPPH se muestra en la figura 3. En comparación con los radicales anión superóxido e hidroxilo, la actividad secuestradora del radical DPPH fue mucho menor, con una eficiencia de eliminación mayor a 10% sólo cuando la concentración de polisacáridos fue mayor a 125 μg mL-1 (ver fig. 3). La tasa de eliminación de vitamina C (control positivo) con 20 μg mL-1 fue de 64.31%.

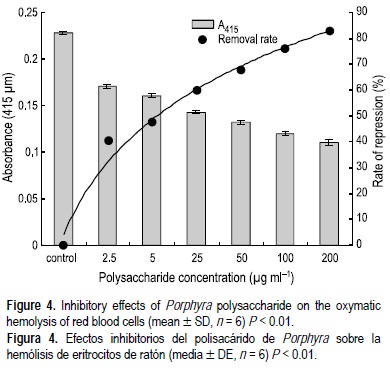
Efectos del polisacárido sobre la hemólisis de eritrocitos
Los efectos del polisacárido de Porphyra sobre la hemólisis inducida por H2O2 en eritrocitos de ratón se muestran en la figura 4. A concentraciones mayores el polisacárido de Porphyra presentó fuertes efectos de protección contra la hemólisis. El IC50 del polisacárido sobre la hemólisis inducida por H2O2 fue de alrededor de 26 μg mL-1. La eficiencia de eliminación del polisacárido de Porphyra en la hemólisis de eritoricitos alcanzó 82.90% a la concentración de polisacáridos de 200 μg mL-1.
Efectos del polisacárido sobre los niveles de malondialdehido
El malondialdehído (MDA), que se forma de la desintegración de ácidos grasos poliinsaturados, es un buen indicador para determinar el grado de peroxidación lipídica. Según nuestros datos las fracciones de polisacáridos de P. yezoensis inhibieron significativamente la peroxidación lípidica microsomal (fig. 5). El IC50 del polisacárido de Porphyra en la peroxidación lipídica fue de alrededor de 299.07 μg mL-1.

Discusión
Los radicales libres son peligrosos para los organismos vivientes y están directamente asociados con varias enfermedades, incluyendo tumores e inflamaciones. Por tanto, es de suma importancia que los seres vivos logren eliminar o equilibrar los radicales libres dañinos como el anión superóxido o el hidroxilo (Xin y Liu 2000). El DPPH es un radical libre estable y el método DPPH es comúnmente empleado para evaluar la actividad antioxidante. Las investigaciones realizadas en años recientes indican que los polisacáridos de algas presentan considerable actividad antioxidante. Por ejemplo, el polisacárido de Sargassum thunbergii elimina eficazmente especies de oxígeno reactivo con un IC50 de 0.5 mg (Zhang y Yu 1997), mientras que el fucoidán de Laminaria japonica (IC50 = 20.3 μg mL-1) puede eliminar el radical anión superóxido y, en menor grado, los radicales hidroxilo y DPPH (Zhang et al. 2003). La capacidad para eliminar el anión superóxido es generalmente mayor en las plantas superiores. Los mayores valores registrados corresponden al extracto de cáscara de la granada roja y al extracto de la bellota de Quercus aliena, con valores de IC50 de 4.01 y 4.92 μg mL-1, respectivamente (Jin et al. 2005, Guo S et al. 2007). Los polisacáridos de Porphyra utilizados en este trabajo presentaron un efecto de eliminación aún mayor sobre el radical anión superóxido, con un valor de IC50 de 2.5 a 5.0 μg mL-1 y una tasa de eliminación de hasta 82.77%. La eficiencia de eliminación de los radicales hidroxilo y DPPH fue aún mejor, con tasas de eliminación máximas de 85.63% y 13.97%, respectivamente.
Los eritrocitos se encuentran en un ambiente saturado de oxígeno in vivo, con abundancia de ácidos grasos poliinsaturados. La hemoglobina quelante de metales alrededor de los eritrocitos podría catalizar fácilmente la peroxidación lípidica, lo cual haría a los eritrocitos susceptibles a daños por oxidación. Estudios sobre la estructura y la función de los eritrocitos han proporcionado información importante para prevenir la oxidación celular (Zhang y Yu 1997, Yang et al. 1999). Se ha observado que algunos polisacáridos de algas, como el de Laminaria, desempeñan un papel protector en la hemólisis inducida por H2O2 en los eritrocitos (Zhang et al. 2003, Luo et al. 2004). Nuestros datos sugieren que el polisacárido de Porphyra inhibió de forma eficaz la hemólisis inducida por H2O2 en los eritrocitos de ratón. El valor de IC50 fue de 25 μg mL-1, y la tasa de inhibición alcanzó 82.90% a la concentración de polisacáridos de 200 μg mL-1.
El nivel de MDA aumenta cuando el sistema inmune de un organismo está decaído. Los peróxidos de lípidos redundantes dañan la membrana celular y aceleran el envejecimiento y la muerte de la célula. Por tanto, el nivel de MDA es un indicador importante de la oxidación lipídica (Zhang et al. 2003, Luo et al. 2004, Han et al. 2006). Según nuestros datos, a concentraciones altas el polisacárido de Porphyra inhibió el incremento de los niveles de MDA inducidos por Fe2+ y H2O2 en el homogeneizado de hígado de ratón, lo que indica que puede impedir el proceso de peroxidación lipídica in vitro. Algunos investigadores opinan que la metodología TBARS puede tener interferencia por la bilirrubina y el DNA; debido a esta limitación, es necesario realizar experimentos adicionales, tales como pruebas inmunohistoquímicas, para confirmar nuestra teoría.
En años recientes se ha encontrado que una gran cantidad de productos botánicos dietéticos son beneficiosos en la quimioprevención de diferentes enfermedades. Varios de ellos, como la apigenina, la curcumina, las proantocianidinas de semilla de uva, el resveratrol, la silimarina y los polifenoles del té verde, presentan efectos de protección contra la fotocarcinogénesis en sistemas in vitro así como in vivo debido a sus propiedades antioxidantes y antiinflamatorias (Baliga y Katiyar 2006). El fucoidán (Koyanagi et al. 2003), Agaricus blaze (Ito et al. 1997) y Laminaria (Hoffman y Raper 1996) aparentemente muestran actividades antitumorales. También se ha observado que el polisacárido de Porphyra presenta efectos de protección contra la hepatotoxicidad inducida por CCl4 (Guo TT et al. 2007).
Conforme se incrementa la contaminación del medio ambiente la salud humana resulta cada vez más afectada. Debido a la avirulencia de los productos botánicos, éstos se están usando en todo el mundo contra varias enfermedades. Nuestros resultados indican que el polisacárido de Porphyra podría convertirse en un nuevo medicamento preventivo para combatir enfermedades relacionadas con la oxidación. Estudios adicionales sobre otras funciones biológicas del polisacárido de Porphyra seguramente arrojarán otras aplicaciones favorables para la salud.
Agradecimientos
Este trabajo recibió apoyo financiero del Proyecto Nacional 863 y el Comité Científico de Shanghai, China (Proyecto Clave de Bio-Medicina #054319936, Plan Pujiang #05PJ14086), así como del Fondo de Disciplina Académica de Shanghai (#Y1101).
Referencias
Baliga MS, Katiyar SK. 2006. Chemoprevention of photo-carcinogenesis by selected dietary botanicals. Photochem. Photobiol. Sci. 5: 243-253. [ Links ]
Cuzzocrea S, Riley D, Caputi AP, Salvemini D. 2001. Antioxidant therapy: A new pharmacological approach in shock, inflammation, and ischemia reperfusion injury. Pharmacol. Rev. 53: 135-159. [ Links ]
Gu JW, Zhang LX, Xu HL, Guo TT, He PM. 2007. Studies on the isolation and purification of polysaccharide from Porphyra yezoensis and its anti-cancer activity. J. Bioeng. China 27: 50-54. [ Links ]
Guo S, Deng Q, Xiao J, Xie B, Sun Z. 2007. Evaluation of antioxidant activity and preventing DNA damage effect of Pomegranate extracts by chemiluminescence method. Agric. Food Chem. 55: 3134-3140. [ Links ]
Guo TT, Gu JW, Zhang LX, Liu F, He PM. 2005. Mice anti-fatigue experiment with crude polysaccharide from Porphyra yezoensis. Proc. 10th International Symposium on the Efficient Application and Preservation of Marine Biological Resources. Yeosu University, Korea, pp. 81-87. [ Links ]
Guo TT, Zhang LX, Gu JW, Liu F, He PM. 2006. Effect of crude polysaccharide from Porphyra yezoensis on the lymphocytes and the sertoli cells. Lett. Biotechnol. 17: 359-361. [ Links ]
Guo TT, Xu HL, Zhang LX, Zhang JP, Guo YF, Gu JW, He PM. 2007. In vivo protective effect of Porphyra yezoensis polysaccharide against carbon tetrachloride induced hepatotoxicity in mice. Regul. Toxicol. Pharmacol. 49: 101-106. [ Links ]
Han H, Zhou HY, Liu CC, Wang CB. 2006. Studies on the extraction of polysaccharides sulfate from three algae and their scavenging activity on free radicals. Chin. J. Mar. Drugs 25: 33-36. [ Links ]
Hoffman R, Paper DH, Donaldson J, Vogl H. 1996. Inhibition of angiogenesis and murine tumour growth by Laminaria sulphate. Br. J. Cancer 73: 1183-1187. [ Links ]
Hu JF, Geng MY, Zhang JT, Jiang HD. 2001. An in vitro study of the structure-activity relations of sulfated polysaccharide from brown algae to its antioxidant effect. J. Asian Nat. Prod. Res. 3: 353-358. [ Links ]
Ito H, Shimura K, Itoh H, Kawade M. 1997. Antitumor effects of a new polysaccharide-protein complex (ATOM) prepared from Agaricus blazei (Iwade Strain 101) 'Himematsutake' and its mechanisms in tumor-bearing mice. Anticancer Res. 17: 277-284. [ Links ]
Jin YS, Heo SI, Lee MJ, Rhee HI, Wang MH. 2005. Free radical scavenging and hepatoprotective actions of Quercus aliena acorn extract against CCl4-induced liver. Free Radic. Res. 39: 1351-8. [ Links ]
Koyanagi S, Tanigawa N, Nakagawa H, Soeda S, Shimeno H. 2003. Oversulfation of fucoidan enhances its anti-angiogenic and antitumor activities. Biochem. Pharmacol. 65: 173-179. [ Links ]
Li ZX, Huang CG, Cai YJ. 2000. The chemical structure and antioxidative activity of polysaccharide from Asparagus cochinchinensis. Acta Pharm. Sinica 35: 358-362. [ Links ]
Liu F, Gu ZK, He PM. 2005. Effect of factors on extraction of polysaccharide from Porphyra. J. Shanghai Fish. Univ. 14: 26-29. [ Links ]
Luo JH, Yang YB, Lin YC. 2004. Antioxidative activities of two metabolites of cultured marine fungus, Halorosellinia oceanicum 323 in vitro. J. Chin. Med. Mater. 27: 188-192. [ Links ]
Ponti V, Dianzani MV, Cheeseman KJ. 1978. Studies on the reduction of nitroblue tetrazolium chloride mediated through the action of NADH and phenazine methosulate. Chem. Biol. Interact. 23: 281-285. [ Links ]
Ruperez P, Ahrazem O, Leal JA. 2002. Potential antioxidant capacity of sulfated polysaccharides from the edible marine brown seaweed Fucus vesiculosus. J. Agric. Food Chem. 50: 840-845. [ Links ]
Smirnoff N, Cumbes QJ. 1989. Hydroxyl radical scavenging activity of compatible solutes. Phytochemistry 28: 1057-1060. [ Links ]
Wang YJ, Yao RY, Zhang HP, Guo XJ. 2004. Studies on the response to oxidation of rat body induced by 60Co radiation with s sulfate polysaccharides from Porphyra haitanensis. Chin. J. Mar. Drugs 23: 32-35. [ Links ]
Xiao MT, Yang JL, Lin HY. 2003. Extraction of Porphyra haitanensis polysaccharides and anti-influenza virus activity. J. Fuzhou Univ. (Nat. Sci.) 31: 631-635. [ Links ]
Xin XL, Liu CH. 2000. Progress in the study of antioxidant effects of Chinese herbal polysaccharides. J. Beijing Univ. TCM 23: 54-55. [ Links ]
Xue C, Fang Y, Lin H. 2001. Chemical characters and antioxidative properties of sulfated polysaccharides from Laminaria japonica. J. Appl. Phycol. 13: 67-70. [ Links ]
Yang GM, Ye SY, Li JL. 1999. Effect of anisodamine on auto-oxidation of erythrocytes. Chin. Pharmacol. Bull. 15: 460-462. [ Links ]
Yashizawa Y, Enomoto A, Todoh H, Ametani A, Kaminogawa S. 1993. Activation of marine macrophages by polysaccharide fractions from marine alga (Porphyra yezoensis). Biosci. Biotech. Biochem. 57: 1862-1866. [ Links ]
Yashizawa Y, Ametani A, Tsunehiro J, Numura K, Itoh M, Fukui F. 1995. Macrophage stimulation activity of the polysaccharide fraction from a marine alga (Porphyra yezoensis): Structure-function relationships and improved solubility. Biosci. Biotech. Biochem. 59: 1933-1937. [ Links ]
Zhang EX, Yu LJ. 1997. Studies on polysaccharide from Sargassum thunbergh for its ability to scavenge active oxygen species. Chin. J. Mar. Drugs 16: 1-4. [ Links ]
Zhang LX, Xu HL, Gu JW, Guo TT, He PM. 2007. Effects of polysaccharide from Porphyra yezoensis on the growth of four cancer lines. Lett. Biotechnol. 18: 608-611. [ Links ]
Zhang QB,Yu PZ, Zhou GF. 2003. Studies on antioxidant activities of fucoidan from Laninaria japonica. Chin. Trad. Herb. Drugs 4: 824-826. [ Links ]
Zhang WY, Liu YF, Chen H. 2001. The effect of polysaccharide from Porphyra yezoensis Ueda on proliferation of lymphocytes. J. China Pharm. Univ. 32: 57-59. [ Links ]
Zhang WY, Zhou JF. Chen H. 2002. Effects of a polysaccharide from Porphyra yezoensis on murine immunocyte and human leukemia K562 cells. Life Sci. Res. 6: 167-170. [ Links ]
Zhou HP, Chen QH. 1989. Studies on anti-senescence of polysaccharide from Porphyra yezoensis. J. China Pharm. Univ. 20: 231-234. [ Links ]
Zhou HP, Chen QH. 1990. Anticoagulant and antihyperlipedemic effects of polysaccharide from Porphyra yezoensis. J. China Pharm. Univ. 21: 358-360. [ Links ]
Notas
Traducido al español por Christine Harris.














