Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.33 n.3 Ensenada Sep. 2007
Notas de investigación
Dinámica del epifitismo en Padina concrescens (Dictyotales: Phaeophyta) en el suroeste de la Península de Baja California, México
Dynamics of epiphytism on Padina concrescens (Dictyotales: Phaeophyta) from the southwestern coast of the Baja California Peninsula, Mexico
C Ortuño-Aguirre*, R Riosmena-Rodríguez
Programa de Investigación en Botánica Marina, Departamento de Biología Marina, Universidad Autónoma de Baja California Sur, Apartado postal 19-B, La Paz 23080, Baja California Sur, México. * E-mail: cortuno@uabcs.mx.
Recibido en julio de 2006;
Aceptado en mayo de 2007
Resumen
Se estudió la dinámica de la comunidad de epífitos algales en función del área disponible sobre Padina concrescens en Los Cerritos, Baja California Sur (México). Se realizaron muestreos mensuales a lo largo de diez meses. Adicionalmente se colocaron estructuras experimentales con el objetivo de evaluar la sincronía y afinidad epifito-hospedero. Los resultados rechazan la hipótesis de una aparición sincrónica, sino que los epifitos están presentes todo el tiempo, colonizando el espacio disponible. Éstos cubren 60% del área total del hospedero al final de la temporada. Los ambientes muestreados muestran diferencias en cuanto a la estructura de epifitos, pero la tendencia de su desarrollo sobre el hospedero es similar. La colonización exclusiva por algas coralinas sobre el sustrato artificial se atribuye al comportamiento mismo de este tipo de epifitos.
Palabras clave: epifitos, interacciones, Padina, dinámica, experimentos.
Abstract
The community dynamics of algal epiphytes was studied in relation to the area available on Padina concrescens at Los Cerritos, Baja California Sur (Mexico). Monthly surveys were conducted over ten months. Experimental structures were also deployed in order to assess epiphyte-host synchrony and affinity. The results rejected the hypothesis of a synchronous appearance, showing that epiphytes were present all the time and occupied the space available. By the end of the season they covered 60% of all the host's area. The environments from where samples were taken revealed differences in the structure of epiphytes, though their development trend over the host was similar. The exclusive colonization of the artificial substrate by coralline algae is attributed to the behavior of this type of epiphyte.
Key words: epiphytes, interactions, Padina, dynamics, experiments.
Introducción
Entre los principales factores ambientales que limitan la distribución de las especies destacan temperatura, luz y disponibilidad de sustrato (Faucci y Boero 2000). Una de las estrategias comunes adoptada por los organismos para evitar competencia por espacio es el epifitismo. Los epifitos pueden ocupar el espacio de manera permanente o sólo por una etapa de su desarrollo. En general, se caracterizan por crecimiento rápido, reproducción temprana, tallas pequeñas y ciclo de vida corto (Coma et al. 1992, Williams y Seed 1992). La interacción consecuente que se genera entre epífito y hospedero presenta efectos tanto negativos como positivos, entre los que sobresalen la reducción de energía lumínica, traducida en la reducción de la actividad fotosintética del hospedero (Dixon et al. 1981, Hurd et al. 2000). Entre los aspectos positivos destaca la limpieza y protección del tejido por parte de los epifitos hacia el hospedero (Franschetti et al. 2002). De acuerdo con González y Goff (1989), la relación entre epifito y hospedero se fundamenta en bases químicas, físicas y ecológicas, donde el epifito busca un conjunto de condiciones que el hospedero le proporciona para su conveniente desarrollo.
En las comunidades marinas, los sustratos vegetales más requeridos son fanerógamas y macroalgas, gracias a ventajas que ofrecen para el epifito tales como espacio, refugio y alimento (Borowitzka y Lethbridge 1989, Aguilar-Rosas y Machado-Galindo 1990). La mayoría de los estudios sobre epifitismo se han concentrado en la relación entre epifitos animales sobre fanerógamas marinas o macroalgas, particularmente Laminariales (Dixon et al. 1981, Freile-Pelegrin et al. 1999, Norderhaug et al. 2002). Pocos han abordado el tema desde la perspectiva de macroalgas epifitas o han explorado la utilización de experimentos para evaluar sus observaciones (Buschmann et al. 1997, Sánchez-Lizaso y Riosmena-Rodríguez 1997). En general, se conoce bien el elenco de especies de algas epifitas sobre fanerógamas marinas, siendo los principales grupos algas rojas, principalmente coralinas costrosas, y algas cafés, especialmente formas filamentosas (Harlin 1980). En contraste, en muchos estudios descriptivos sobre macroalgas, las especies epifitas son comúnmente ignoradas, subestimando la riqueza específica de cada zona. De manera particular, se conoce cómo es la distribución de epifitos sobre por área (Lavery y Vanderklift 2002), algunos de los mecanismos de fijación, preferencia de epifitos sobre un determinado tejido, especie o sustrato. En años recientes muchos de los estudios sobre epifitos se han enfocado a buscar defensas en contra de ellos para combatirlos en cultivos de especies comerciales como Gracilaria, Gelidium y Kapaphycus (Kuschel y Buschmann 1991, Freile-Pelegrin et al. 1999, Dawes et al. 2000, Friedlander et al. 2001). A pesar del conocimiento con que se cuenta, el debate continua acerca de si existe sincronía entre la aparición del huésped y el hospedero, y se discute ampliamente si huésped y hospedero aparecen de manera casual sirviendo este último solamente como sustrato físico para los epifitos o, si existen interacciones entre ambos (Sánchez-Lisazo y Riosmena-Rodríguez 1997) al grado de que la presencia de uno es consecuencia de la presencia del otro. Esto resulta importante desde para entender la estructura comunitaria hasta para el diseño de estrategias en el manejo de epifitos en cultivos comerciales. La realización de experimentos en el campo paralelos al análisis de muestras recolectadas podría ayudar a contestar esta interrogante.
Los objetivos del presente estudio, por lo tanto, son determinar el elenco de la comunidad de epifitos y su variación espacial y temporal, así como establecer si existe una relación entre la cobertura de epífitos en función del desarrollo de la alga parda Padina concrescens (Thivy).
Materiales y métodos
El estudio se realizó en Los Cerritos, Baja California Sur (México) (23°19'79" N, 110°10'69" W) (fig. 1). En 2003, se realizaron muestreos mensuales de una población de P. concrescens presente en un ambiente de poza de marea y en uno de canal de marea, recolectando el azar en cinco cuadrantes de cada ambiente, para obtener la cobertura de epifitos en relación al área de P. concrescens. Las muestras fueron trasladadas al laboratorio donde se limpiaron del exceso de sedimento, se fijaron en una solución de formaldehído con agua de mar al 4% y se colocaron en frascos de plástico debidamente etiquetados. Para evaluar si existe sincronía entre la presencia de epifitos y el hospedero de interés, en este caso macroalgas, se llevó a cabo un experimento con estructuras de plástico. El experimento consistió en hacer clareos entre la población, e instalar estructuras de plástico de morfología y tamaño similares a los de frondas naturales de P. concrescens, que fueron colocadas sobre una tapadera de botella de plástico con pegamento epóxico Z-par, y que recibieron el nombre de frondas experimentales. Se colocaron en total 360 (180 por cada sitio) frondas experimentales que permanecieron durante un periodo de cuatro meses.
El tamaño de muestra se determinó mediante el método de la curva de rarefacción (Brower et al. 1998), y éste fue de 60 frondas mes-1, las cuales fueron elegidas al azar (datos y descripción en Ortuño-Aguirre 2004). Posteriormente, se midió la relación largo-ancho con un vernier manual (±0.25 mm de margen de error) para obtener el área total de la fronda. La evaluación de la cobertura de epifitos sobre las frondas se realizó colocando dos transectos (vertical y horizontal) en ambos lados de la fronda (dorsal y ventral). Sobre los transectos se ubicaron 20 puntos equidistantes, separando los epifitos convenientemente por grupos tales como algas verdes, algas pardas, algas rojas filamentosas, algas coralinas y "otros". Las frondas experimentales fueron procesadas en su totalidad y la cobertura fue evaluada como cobertura total, no separada por grupos, debido a que estas frondas fueron epifitadas sólo por algas coralinas, las cuales no se pueden separar como individuos.
Finalmente, se realizó la determinación de los epifitos al nivel de género (ya que los ejemplares no presentaron las características de especie) con la ayuda de las claves propuestas por Abbott y Hollenberg (1976). Para la determinación de los epifitos de las frondas experimentales, se aplicó la técnica histológica para algas coralinas estandarizada por Riosmena-Rodríguez et al. (1999); en este caso las determinaciones se realizaron a nivel específico con base en las claves propuestas por Riosmena-Rodríguez (2002, datos no publicados).
Resultados
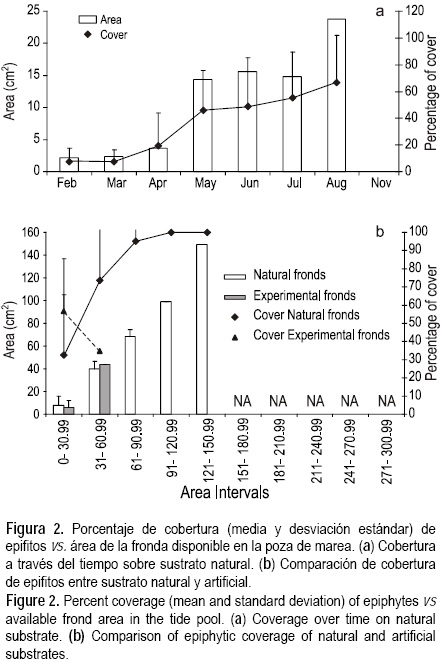
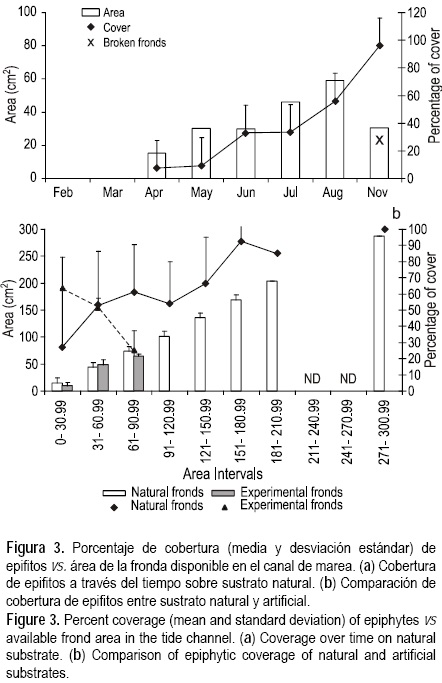
Los resultados muestran que los epifitos están presentes durante toda la temporada ocupando el espacio disponible, y no existe una sincronía en la aparición epifito-hospedero; sin embargo, en ambos ambientes los epifitos incrementan en función de la superficie que ofrece el hospedero (figs. 2, 3). Aunque existen esporas de epifitos, se encontró que las frondas experimentales sólo fueron colonizadas por algas rojas coralinas hasta en más de 60% de su área, en contraste a una cobertura menor a 5% en las frondas naturales. En mayo se observa un marcado incremento en el área de las frondas en ambos ambientes (figs. 2a, 3a); sin embargo, aunque en la poza de marea la cobertura de epifitos se dispara (fig. 2a), no ocurre lo mismo en el canal, donde el aumento es moderado y se dispara hasta junio (fig. 3a), y a partir de entonces se observa un incremento gradual. Al final de la temporada, los epifitos cubrieron las frondas en un 60%. Al evaluar la cobertura de epifitos por intervalos de área entre frondas experimentales y frondas de P. concrescens se observa una tendencia inversa a la descrita anteriormente, cuando el área de fronda aumentó, la cobertura de epifitos disminuyó (figs. 2b, 3b). Cabe mencionar que no se tomaron muestras durante septiembre y octubre ya que el sitio de muestreo fue inaccesible debido a un huracán. Continuando el muestreo en noviembre, ya para entonces la población de P. concrecens había desaparecido de la poza de marea y sólo se encontró en el canal, donde se observó una considerable pérdida de área de las frondas; sin embargo, los epifitos cubrían más de 95% del área total de la fronda.
Se identificaron cinco grupos de epifitos: entre las algas verdes se encontró el género Ulva Linnaeus; entre las algas pardas los géneros Ectocarpus Lyngbye y Ralfsia Berkeley; entre las algas rojas filamentosas los géneros Acrochaetium Nageli y Erythotrichia Areschoug; entre las algas rojas coralinas estuvieron Pneophyllum coronatum (Rosanoff) Penrose, Lithophyllum pustulatum (Lamouroux) Foslie, Amphiroa misakiensis Yendo y A. beauvoissi Lamouroux, todos estos en las frondas experimentales; y dentro del grupo "otros" se observó la presencia de briozoarios y huevos de un molusco gasterópodo.
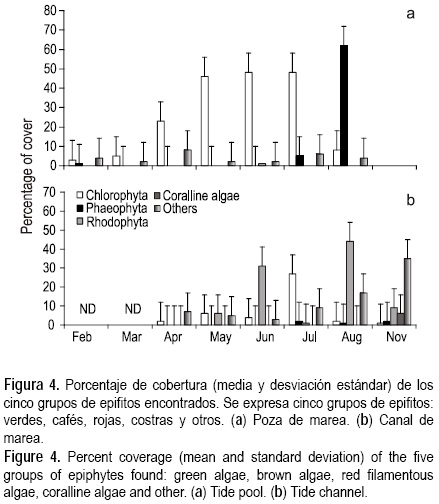
Se observaron diferencias espaciotemporales en la presencia y abundancia de epifitos (fig. 4), notándose un comportamiento competitivo entre éstos. En el ambiente de pozas de marea (fig. 4a) se observaron tres de los cinco grupos, dominanando en cobertura algas verdes y pardas, que fueron el grupo dominante la mayor parte del tiempo, excepto en agosto que disminuyen de un 47% a 8% en cobertura sobre la fronda de P. concrescens; por el contrario, las algas pardas aumentan de un 3% a 56.5% ocupando el espacio. El grupo denominado "otros" es el que ocurrió con menor proporción a lo largo del tiempo. En contraste, en el ambiente de canal se encontraron representados los cinco grupos de epifitos (fig. 4b), dominando el grupo de algas rojas filamentosas, seguido por el de algas verdes. La cobertura de algas rojas se dispara de un 5% en mayo a 29% en junio; sin embargo, en julio la cobertura de este grupo es menor a 5%, ocupando el espacio disponible las algas verdes, en una tendencia inversa a la disminución del grupo anterior. Finalmente, estos dos grupos de epifitos son desplazados en cobertura por el grupo "otros", el cual presenta un incremento progresivo a partir del mes de julio y es dominante hacia noviembre.
Discusión
Los resultaron muestran que no existe una relación sincrónica entre la aparición de los epifitos y el hospedero P. concrescens, ya que aquellos están presentes todo el tiempo y colonizan el espacio disponible, incrementándose en función del área del hospedero. Esto concuerda con lo observado en Cystoseira C. Agardh, Gelidium Lamouroux y algunas fanerógamas marinas: el nivel de epifitismo es mayor cuando existe la mayor superficie y biomasa del hospedero (Heijs 1987, Arrontes 1990, Reyes y Afonso-Carrillo 1995, Kanamori et al. 2004). En estudios como los realizados por McLachlan y Craigie (1966) y Van Alstyne et al. (2001), se mencionan resultados similares, lo que se ha atribuido entre otros factores a la disminución de sustancias de defensa en contra de los epifitos a medida que el hospedero se vuelve senescente (Wikstroem y Pavia 2004). Lo anterior es apoyado por lo observado en las frondas experimentales, las cuales fueron colonizadas desde los primeros días demostrando la existencia de esporas en el medio. Esto lleva a que es posible que las diferencias en los tipos de epifitos encontrados en ambos ambientes esté relacionada con la habilidad competitiva de algunos epifitos y por supuesto con las necesidades y preferencia de los mismos (Gacia et al. 1999, Kanamori et al. 2004).
Aun cuando es diferente la estructura de epifitos entre los ambientes marea, resalta la continua presencia del género Ulva en ambos ambientes. Algunos estudios registran especies de este género como epifitos, principalmente en condiciones de estrés. Gacia et al. (1999) mencionan que en ambientes de temperaturas cálidas y escasos en nutrientes encontraron a Ulva fasciata Delile como epífito de Thalassia testudinum, y Friedlander et al. (2001) mencionan a Ulva sobre Gracilaria lemaneiformis (Bory de Saint-Vincent) Greville. La presencia de géneros como Erythrotrichia, Acrochaetium en el ambiente de canal no resulta extraña, ya que de acuerdo con Gacia et al. (1999) y Williams y Seed (1992) este tipo de epifitos filamentosos son comunes en la zona intermareal, y se considera que ofrecen protección al hospedero contra la desecación. En este ambiente el comportamiento competitivo es marcado principalmente entre algas verdes y algas rojas filamentosas. Las algas epifitas encontradas corresponden a las que comúnmente son mencionadas como epifitas de macroalgas y fanerógamas marinas (Brauner 1975). Por otro lado, la ausencia de algas coralinas como epifitas en P. concrescens difiere respecto a otros estudios, ya que éstas son comúnmente encontradas sobre varias especies de fanerógamas y algas pardas como Sargassum, Ecklonia, Macrocystis; sin embargo, en este estudio su presencia es marcadamente restringida a las unidades experimentales, lo que puede deberse al rápido crecimiento de los otros epifitos que ocupan rápidamente el espacio disponible, lo que les da una ventaja sobre las especies coralinas (Sebens 1982, Morcom et al. 1997, Morcom y Woelkerling 2000).
Agradecimientos
Agradecemos al departamento de Biología Marina de la Universidad Autónoma de Baja California Sur por el apoyo para algunas salidas de campo importantes para el presente trabajo. Agradecemos las atinadas sugerencias de dos revisores de este trabajo. Este trabajo representa una parte de la tesis de licenciatura del primer autor. El segundo autor agradece el financiamiento de CONACYT (V0115-R) y CONABIO (U044) para el procesamiento del material.
Rerefencias
Abbott IA, Hollenberg GJ. 1976. Marine Algae of California. Stanford Univ. Press, California, 827 pp. [ Links ]
Aguilar-Rosas R, Machado-Galindo A. 1990. Ecological aspects of Sargassum muticum (Fucales, Phaeophyta) in Baja California, Mexico: Reproductive phenology and epiphytes. Hydrobiologia 204/205: 185-190. [ Links ]
Arrontes J. 1990. Composition, distribution on host and seasonality of epiphytes on three intertidal algae. Bot. Mar. 33: 205-211. [ Links ]
Borowitzka MA, Lethbridge RC. 1989. Seagrasses epiphytes. Chapter 14. In: Larkum AWD, McComb AJ, Shepherd SA (eds.), Biology of Seagrasses. Aquatic Plant Studies 2. Elservier, Amsterdam, 841 pp. [ Links ]
Brauner JF. 1975. Seasonality of epiphytic algae on Zostera marina at Beaufort, North Carolina. Nova Hedwigia 26: 125-133. [ Links ]
Brower JE, Zar JH, Von Ende CN. 1998. Field and Laboratory Methods for General Ecology. McGraw-Hill, 273pp. [ Links ]
Buschmann AH, Retamales CA, Figueroa C. 1997. Ceramialean epiphytism in an intertidal Gracilaria chilensis (Rhodophyta) bed in southern Chile. J. Appl. Phycol. 9(2): 129-135. [ Links ]
Coma R, Llobet I, Zabala M, Pili JM, Hughes RG. 1992. The population dynamics of Halecium petrosum and Halecium pusillum (Hydrozoa; Cnidaria) epiphytes of Halimeda tuna in the northwestern Mediterranean. Sci. Mar. 56: 161-169. [ Links ]
Dawes CJ, Teasdale BW, Friedlander M. 2000. Cell wall structure of the agarophytes Gracilaria tikvahiae and G. cornea (Rhodophyta) and penetration by the epiphyte Ulva lactuca (Chlorophyta). J.Appl. Phycol. 12: 567-575. [ Links ]
Dixon J, Schroeter SC, Kastendick J. 1981. Effects of the encrusting bryozoan Membranipora membranacea on the loss of blades and fronds by the giant kelp Macrocystis pyrifera (Laminariales). J. Phycol. 17: 341-345. [ Links ]
Faucci A, Boero F. 2000. Structure of an epiphytic hydroid community on Cystoceira at two sites of different wave exposure. Sci. Mar. 64: 255-264. [ Links ]
Franschetti S, Giangrande A, Terlizzi A, Miglietta MP, DellaTommassa L, Boero F. 2002. Spatio-temporal variation of hydroids and polychaetes associated with Cystoseira amentacea (Fucales: Phaeophyceae). Mar. Biol. 140: 949-957. [ Links ]
Freile-Pelegrin Y, Robledo D, Serviere-Zaragoza E. 1999. Gelidium robustum agar: Quality characteristics from exploited beds and seasonality from an unexploited bed at southern Baja California, Mexico. Hydrobiologia 398/399: 501-507. [ Links ]
Friedlander M, Kashman Y, Weinberger F, Dawes CJ. 2001. Gracilaria and its epiphytes. 4. The response of two Gracilaria species to Ulva lactuca in a bacteria-limited environment. J. Appl. Phycol. 13: 501-507. [ Links ]
Gacia E, Littler MM, Littler DS. 1999. An experimental test of the capacity of food web interactions (fish-epiphytes-seagrasses) to offset the negative consequences of eutrophication on seagrass communities. Estuar. Coast. Shelf Sci. 48: 757-766. [ Links ]
González MA, Goff LJ. 1989. The red algal epiphytes Microcladia coulteri and M. californica (Rhodophyceae: Ceramiaceae). II. Basiphyte specificity. J. Phycol. 9: 230-232. [ Links ]
Harlin MM. 1980. Seagrass epiphytes. In: Phillips RC, McRoy CP (eds.), Handbook of Seagrass Biology: An Ecosystem Perspective. Garland STPM Press, New York, pp. 117-151. [ Links ]
Heijs FML. 1987. Qualitative and quantitative aspects of the epiphytic component in a mixed seagrass meadow from Papua New Guinea. Aquat. Bot. 27: 363-383. [ Links ]
Hurd CL, Durante KM, Harrison PJ. 2000. Influence of bryozoan colonization on the physiology of the kelp Macrocystis integrifolia (Laminariales, Phaeophyta) from nitrogen-rich and poor sites in Barkley Sound, British Columbia, Canada. Phycologia 39: 435-440. [ Links ]
Kanamori M, Goshima S, Mukai H. 2004. Seasonal variation in host utilization of epiphytic Lacuna species in mixed algal and surfgrass stands in Japan. Mar. Ecol. 25: 51-69. [ Links ]
Kuschel FA, Buschmann AH. 1991. Abundance, effects and management of epiphytism in intertidal cultures of Gracilaria (Rhodophyta) in southern Chile. Aquaculture 92: 7-19. [ Links ]
Lavery PS, Vanderklift MA. 2002. A comparison of spatial and temporal patterns in epiphytic macroalgal assemblages of the seagrasses Amphibolis griffithii and Posidonia coriacea. Mar. Ecol. Prog. Ser. 236: 99-112. [ Links ]
McLachan J, Craigie JS. 1966. Antialgal activity of some simple phenols. J. Phycol. 2: 133-135. [ Links ]
Morcom NF, Woelkerling WJ. 2000. A critical interpretation of coralline-coralline (Corallinales, Rhodophyta) and coralline-other plant interactions. Cryptogamie: Algol. 21: 1-31. [ Links ]
Morcom NF, Ward SA, Woelkerling WJ. 1997. Competition of epiphytic nongeniculate corallines (Corallinales, Rhodophyta): Overgrowth is not victory. Phycologia 36: 468-471. [ Links ]
Norderhaug KM, Christie H, Rinde E. 2002. Colonisation of kelp imitations by epiphyte and holdfast fauna; a study of mobility patterns. Mar. Biol. 965-973. [ Links ]
Ortuño-Aguirre C. 2004. Dinámica del epifitismo en relacion con la estructura poblacional de Padina concrescens (Dictyotales; Phaeophyta) en la playa Los Cerritos, BCS, México. Tesis de licenciatura, Universidad Autónoma de Baja California Sur, La Paz, México, 67 pp. [ Links ]
Reyes J, Afonso-Carrillo J. 1995. Morphology and distribution of nongeniculate coralline algae (Corallinaceae: Rhodophyta) on the leaves of the seagrass Cymodocea nodosa (Cymodoceae). Phycologia 34: 179-190. [ Links ]
Riosmena-Rodríguez R. 2002. Taxonomy of the order Corallinales (Rhodophyta) from the Gulf of California, Mexico. Ph.D. thesis, La Trobe University, 200 pp. + 89 lam. [ Links ]
Riosmena-Rodríguez R, Woelkerling WJ, Foster MS. 1999. Taxonomic reassessment of rhodolith-forming species of Lithophyllum (Corallinales: Rhodophyta) in the Gulf of California, Mexico. Phycologia 38: 401-417. [ Links ]
Sánchez-Lizaso JL, Riosmena-Rodríguez R. 1997. Macroalgas epifitas de Zostera marina L. en Bahía Concepción, BCS, México. Oceánides 12: 55-59. [ Links ]
Sebens KP. 1982. Competition for space: Growth rate, reproductive output, and scape in size. Am. Nat. 120: 189-197. [ Links ]
Van Alstyne KL, Whitman SL, Ehling JM. 2001. Differences in herbivore preferences, phlorotannin production, and nutritional quality between juvenile and adult tissues from marine algae. Mar. Biol. 139: 201-210. [ Links ]
Wikstroem SA, Pavia H. 2004. Chemical settlement inhibition versus post settlement mortality as an explanation for differential fouling of two congeneric seaweeds. Oecologia 138: 223-230. [ Links ]
Williams GE, Seed R. 1992. Interactions between macrofaunal epiphytes and their host algae. In: John DM, Hawkins SJ, Price JH (eds.), Plant-Animal Interactions in the Marine Benthos. Systematics Association Spec. Vol. 46, pp. 189-211. [ Links ]














