Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.32 n.1a Ensenada Mar. 2006
Artículos
Validación histológica de los estadios de madurez gonádica de las hembras de calamar gigante (Dosidicus gigas) en el Golfo de California, México
Histological validation of the gonadal maturation stages of female jumbo squid (Dosidicus gigas) in the Gulf of California, Mexico
JG Díaz-Uribe1*, A Hernández-Herrera2, E Morales-Bojórquez1, S Martínez-Aguilar1, MC Suárez-Higuera1, A Hernández-López2
1 Instituto Nacional de la Pesca, Centro Regional de Investigación Pesquera-La Paz, Carretera a Pichilingue s/n km 1, CP 23020 La Paz, Baja California Sur, México. * E-mail: diazjuan@prodigy.net.mx
2 Departamento de Pesquerías y Biología Marina, Centro Interdisciplinario de Ciencias Marinas, Instituto Politécnico Nacional, Apartado postal 592, CP 23000 La Paz, Baja California Sur, México.
Recibido en enero de 2004.
Recibido en su forma actual en junio de 2005.
Aceptado en noviembre de 2005.
Resumen
Se analizó la estructura de ovocitos en las gónadas de hembras de calamar gigante (Dosidicus gigas), para validar los estadios morfocromáticos de madurez sexual, basados en una escala de seis etapas. Las muestras fueron obtenidas quincenalmente en el área de Santa Rosalía, Baja California Sur, entre junio del 2001 y noviembre del 2002. De cada gónada se obtuvieron cortes histológicos para contar el número de ovocitos en cada nivel de desarrollo. Con la frecuencia de ovocitos en cada nivel de desarrollo, se estimó el índice de madurez (IM) para evaluar la correspondencia de cada estadio de madurez morfocromática con la estructura de ovocitos en el tejido de la gónada. El análisis histológico indica que los primeros tres estadios de madurez morfocromática (I-III) predominan ovocitos en un nivel de desarrollo 2 o inferior, en los cuales no inicia todavía el crecimiento secundario y por lo tanto corresponden a organismos juveniles sexualmente inmaduros. En los otros tres estadios (IV-VI) predominan ovocitos en niveles de desarrollo más avanzados que corresponden a adultos maduros o en proceso de maduración. De acuerdo con el análisis de varianza, esta escala de madurez permite distinguir de manera confiable y expedita a los organismos sexualmente inmaduros de los maduros. Un análisis más detallado de los intervalos de confianza del IM, indica que cada estadio de madurez morfocromática presenta una estructura de ovocitos distinta excepto entre los estadios II y III en los cuales las diferencias se observan más bien a nivel morfológico.
Palabras clave: Dosidicus gigas, calamar gigante, maduración gonádica, índice de madurez, Golfo de California.
Abstract
The oocyte structure of jumbo squid (Dosidicus gigas) female gonads was analyzed to validate morphochromatic sexual maturation stages based on a six-phase scale. Samples were obtained fortnightly from the Santa Rosalía area, Baja California Sur, from June 2001 to November 2002. Histological preparations were obtained from each gonad to count the number of oocytes at each level of development. The frequency of oocytes at each level was then used to estimate a maturity index (MI) to assess the correspondence between morphochromatic maturation stages and the oocyte structure in the gonad tissue. The histological analysis showed that morphochromatic stages I, II and III were ruled by oocytes in developmental level 2 or less (i.e., secondary growth has not yet begun), and thus correspond to sexually immature juveniles. Stages IV, V and VI were ruled by oocytes in more advanced developmental levels and correspond to mature or maturing adults. According to the analysis of variance, the morphochromatic maturity scale allowed sexually immature individuals to be readily and reliably distinguished from mature ones. A detailed analysis of MI confidence intervals showed that each morphochromatic maturity stage had a specific oocyte structure, except for stages II and III, which presented morphological differences.
Key words: Dosidicus gigas, jumbo squid, gonad maturation, maturity index, Gulf of California.
Introducción
A pesar de que la pesquería del calamar gigante (Dosidicus gigas, D'Orbingy 1835) en México data desde 1974, la abundancia de este recurso es tan variable que no fue hasta 1995 cuando la pesquería se estableció de forma permanente en la región central del Golfo de California (Klett 1996). Desde entonces esta pesquería se ha convertido en una importante fuente de empleos e ingresos económicos, por lo que la estimación de la abundancia del recurso en esta región ha cobrado especial relevancia (Nevárez-Martínez et al. 2000; Morales-Bojórquez et al. 2001a, 2001b). Debido a su corto ciclo de vida, el método más usado para evaluar la abundancia en calamares ha sido el método de reducción de stock de Delury, que supone la existencia de una sola cohorte en la población (Rosenberg et al. 1990, Morales-Bojórquez et al. 2001b). A pesar de que las estimaciones de abundancia con este método han probado ser útiles para el manejo de la pesquería en el Golfo de California (INP 2001), el número de cohortes en la población sigue siendo una incógnita y es todavía un tema de discusión (Ehrhardt et al. 1983, 1986; Markaida y Sosa-Nishisaki 2001).
El análisis del proceso de maduración sexual en varias especies de cefalópodos ha sido fundamental para entender su ciclo de vida, identificar poblaciones y cohortes, e incluso para definir estrategias de manejo (Sauer y Lipinski 1990). En el caso de D. gigas, existen varios estudios en los que se analiza el ciclo reproductivo a partir de los cambios morfocromáticos de las gónadas (Nesis 1970, Michel et al. 1986, Tafur y Rabí 1997, Markaida y Sosa-Nishisaki 2001, Tafur et al. 2001); sin embargo, todos ellos han empleado escalas de madurez diferentes, por lo cual también se han hecho distintas interpretaciones del proceso de maduración en esta especie. Aunque Michel et al. (1986) describieron por primera vez el desarrollo de los gametos de D. gigas del Golfo de California y de forma paralela describieron también los cambios morfológicos de las gónadas, no existe un análisis formal de la composición de gametos conforme se desarrolla la gónada. En este contexto, consideramos que las estimaciones de abundancia y las estrategias de manejo del calamar gigante podrían mejorarse en la medida que se comprenda mejor el proceso de su maduración sexual y que se puedan identificar el número de cohortes en la población. Por ello, el objetivo de este trabajo es validar histológicamente los estadios de madurez basados en las propiedades morfocromáticas de las gónadas del calamar gigante que se distribuye en el área de Santa Rosalía, Baja California Sur, que es una de las principales zonas de pesca de este recurso.
Materiales y métodos
Se obtuvieron muestras quincenales de 20 organismos a partir de las capturas comerciales en Santa Rosalía, de junio a noviembre de 2001 y de mayo a noviembre de 2002 (fig. 1). De cada organismo se registró la longitud del manto, el peso total y el peso del manto, y se extrajeron las gónadas. El sexo y la madurez gonádica se identificaron a partir de las propiedades morfocromáticas de las gónadas en fresco, según la descripción de Lipinski y Underhill (1995) (tabla 1). Las gónadas se fijaron en solución de Davidson (Bell y Lighter 1988).

De cada gónada se obtuvo una muestra de tejido de 1 cm3 aproximadamente, se deshidrató en alcohol etílico, se transparentó con Hemo-De y finalmente se incluyó en parafina de punto de fusión alto. Posteriormente, se realizaron cortes transversales de 7 µm de espesor con un microtomo de rotación manual y el tejido resultante se tiñó con hematoxilina-eosina (H&E). Se identificaron los distintos niveles de desarrollo de los ovocitos en función de su morfología y del epitelio folicular que los rodea. La escala microscópica se basó en la descripción de Michel et al. (1986) (tabla 2). Para medir la composición de ovocitos en la gónada, de cada laminilla se seleccionaron aleatoriamente tres campos visuales de 0.25 cm2 y se contó el número de ovocitos en cada nivel de desarrollo. Posteriormente se calculó el índice de madurez (IM) del organismo con base en la ecuación de Sauer y Lipinski (1990):
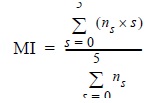
donde s es un número discreto entre 1 y 5 asignado a cada etapa de desarrollo del ovocito (tabla 2) y ns es el número de ovocitos contados en el estadio s.
Este índice se utilizó para evaluar las diferencias entre los estadios de madurez que fueron asignados a partir de las propiedades morfocromáticas de las gónadas (llamada de aquí en adelante madurez morfocromática). Las comparaciones se hicieron bajo la hipótesis de que los estadios de madurez morfocromática son un buen indicador del nivel de desarrollo de los ovocitos en las gónadas. Esta hipótesis se probó evaluando las características del tejido en cada nivel de madurez morfo-cromática y mediante la valoración del IM a través de un análisis de varianza de una vía y pruebas de Tukey para comparación múltiple de factores (Neter et al. 1996).
Resultados
Se recolectaron un total de 271 gónadas, el 75% de hembras y el 25% de machos. Dado que no se obtuvo una buena representación del desarrollo gonádico de los machos, los resultados correspondieron exclusivamente al análisis de maduración de las hembras de calamar. Las tallas de las hembras en los muestreos oscilaron entre 33 y 91 cm de longitud del manto (LM); las más frecuentes estuvieron entre 67.5 y 77.5 cm LM (fig. 2a). Aunque se encontró una hembra madura de 37 cm LM, la mayor parte de las hembras adultas fueron mayores de 50 cm LM, principalmente entre 75 y 80 cm LM. El análisis de frecuencia acumulada indicó que menos del 5% de las hembras maduras fueron menores de 60 cm LM y 50% de ellas tuvieron 74 cm LM o menos (fig. 2b).

Además de los cuatro niveles de desarrollo descritos por Michel et al. (1986), en este estudio se pudo identificar un nivel más al inicio del desarrollo del ovocito (nivel 1) que se caracterizó por la escasa o nula presencia de células foliculares alrededor de la membrana celular (fig. 3a). De esta forma, los dos primeros niveles de desarrollo describen ovocitos en crecimiento primario, en virtud de que no se encontraron indicios de formación de vitelo (fig. 3a, b). En los tres niveles restantes se describen ovocitos en crecimiento secundario con evidencias de formación de vitelo (fig. 3c-e).
De acuerdo con los conteos hechos al microscopio, se observó que la composición de ovocitos en el tejido cambia de acuerdo con la morfología externa de la gónada en el proceso de maduración sexual (tabla 3). En las gónadas en estadio de madurez I, prácticamente todos los ovocitos están en el nivel 1 de desarrollo. En las gónadas en estadio II y III siguen predominando los ovocitos en desarrollo 1 (70-80%); sin embargo, los ovocitos en desarrollo 3 empiezan a ser más abundantes (10-20%). En las gónadas en estadio IV, cerca del 90% de los ovocitos están en desarrollo 3 y 4 en una proporción 1:2. En este estadio se observa la proporción más baja de ovocitos en desarrollo 1. En las gónadas de estadio V, continúan predominando los ovocitos en desarrollo 3 y 4, aunque en una proporción menor (65%) ya que los ovocitos en desarrollo 1 vuelven a incrementar su abundancia. En este estadio se alcanza la mayor proporción de ovocitos en desarrollo 5 (~10%). Sólo en las gónadas en estadio VI se observaron todos los niveles de desarrollo aunque más del 90% de los ovocitos estaban entre el nivel 1 y 3, con predominancia del 2.
Estos cambios también se reflejaron en el IM, cuyo promedio se incrementó conforme las gónadas avanzaban en el estadio de madurez hasta el nivel IV (fig. 4). En los estadios de madurez V y VI, la reaparición de ovocitos en etapas de desarrollo inicial, principalmente en nivel 1, propició que el IM, en promedio, disminuyera. El análisis de varianza confirmó que existen diferencias entre los estadios de madurez gonádica (F = 45.02, P < 0.05). La prueba de comparaciones múltiples de Tukey indica que los estadios IV y V son significativamente distintos a los estadios I a III (tabla 4). El estadio VI no se diferenció estadísticamente de ningún estadio, a excepción del IV.

Discusión
Considerando que el crecimiento secundario observado en los ovocitos en desarrollo 3 marca el inicio de la maduración del ovocito (Arnold y Williams-Arnold 1977, Selman y Arnold 1977) y que el IM representa el nivel de desarrollo medio de los ovocitos, entonces IM > 2 puede utilizarse como criterio para definir a un organismo en actividad reproductiva, ya que ello significa que la mayoría de los ovocitos han alcanzado por lo menos el nivel 3 de desarrollo. Por lo tanto, aquellos organismos que se clasificaron en estadio de madurez entre I y III pueden considerarse reproductivamente inactivos ya que IM = 2. De manera complementaria, los organismos en estadio de madurez entre IV y VI, pueden considerarse reproductivamente activos ya que IM > 2. Dado que en el estadio de madurez VI se presentan ovocitos en todos los niveles de desarrollo, éste es el estadio con mayor variabilidad en el IM; sin embargo, su promedio es mayor a 3, lo cual refleja actividad reproductiva. En este sentido, la escala de madurez morfocromática es lo suficientemente confiable para evaluar de manera expedita los periodos de actividad reproductiva de la población en función de la frecuencia de organismos en cada estadio de madurez.
La escala de madurez morfocromática, sin embargo, tiene una relación mucho más estrecha con la estructura de ovocitos de lo que el análisis de varianza sugiere. Las gónadas clasificadas en estadio de madurez I, presentan una estructura de ovocitos tan homogénea que el IM presenta un intervalo de confianza muy pequeño, quedando fuera de los intervalos calculados para los otros estadios de madurez (fig. 4). Las gónadas maduras en estadio IV, muestran un comportamiento similar. El IM es poco variable y se separa claramente de los intervalos calculados en los otros estadios. Esto significa que los estadios morfocromáticos I y IV de las gónadas presentan estructuras histológicas particulares y suficientemente distintas al resto de los estadios. El traslape del IM entre los estadios II y III indica que el proceso de maduración se da más a nivel morfológico (p. ej. a nivel de glándulas oviductales) que histológico, lo cual también ha sido reportado para otras especies como Loligo vulgaris reynaudii (Sauer y Lipinski 1990). En el estadio VI, la presencia de ovocitos en todos los niveles de desarrollo implica una fase de transición en la que la gónada está potencialmente lista para entrar a un nuevo proceso de maduración.
Dado que las escalas de madurez descomponen en etapas discretas un proceso continuo como la reproducción, los criterios que se utilizan para definir esas etapas son generalmente arbitrarios (Juanicó 1983) y en Dosidicus gigas esto es evidente ya que se han utilizado diversas escalas de madurez que consideran de 4 a 6 estadios diferentes (Ehrhardt et al. 1986, Michel et al. 1986, Tafur y Rabí 1997, Hernández-Herrera et al. 1998, Markaida y Sosa-Nishisaki 2001). En los últimos años la escala más utilizada para el calamar gigante del Golfo de California es la propuesta por Sauer y Lipinski (1990) y redefinida por Lipinski y Underhill (1995). De acuerdo con nuestros resultados, esta escala de madurez es válida ya que describe razonablemente los cambios que se observaron en el tejido de la gónada.
La creciente variabilidad del IM conforme avanza el estadio de madurez de la gónada indica que la maduración de ovocitos en la gónada es asincrónica (fig. 3f). Estos resultados parecen estar más de acuerdo con la hipótesis de múltiples cohortes en la población. Ehrhardt et al. (1983, 1986) encontraron hembras maduras durante todo el año, con tres picos de reproducción, lo cual es comparable con los dos picos reproductivos que se reportan para esta misma especie en las costas de Perú (Tafur y Rabí 1997, Tafur et al. 2001). Morales-Bojórquez et al. (2001c) evidenciaron que en la zona de Guaymas, Sonora, existe una mezcla de tres cohortes, mientras que Markaida et al. (2004) evidenciaron, a partir de la distribución de fechas de nacimiento, una estructura poblacional compleja, con múltiples cohortes intra anuales en la región central del Golfo de California. Aunque la información de este trabajo no permite definir todavía con precisión el número de cohortes que existen en la población, la hipótesis de cohortes múltiples parece ser más evidente y, en consecuencia, debe considerarse la contribución de cada una de ellas a la abundancia y producción del stock sujeto a explotación.
La frecuencia de tallas registrada en este estudio demostró que la pesquería de calamar en el Golfo de California se sostiene por un intervalo amplio de tallas. Sin embargo, la talla de primera madurez estimada en 74 cm LM, implica que 60% de las hembras capturadas comercialmente son juveniles. Durante 1996, Markaida y Sosa-Nishisaki (2001) encontraron que la mayor parte de las hembras capturadas en Santa Rosalía maduraban a los 74 cm LM. La constancia de la talla de primera madurez en un periodo de 5 años puede suponer estabilidad en la población; sin embargo, sería recomendable evaluar de manera más precisa el impacto que la captura de juveniles puede tener en la dinámica del stock.
Agradecimientos
Agradecemos a la Comisión Nacional de Acuacultura y Pesca (CONAPESCA) de la Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA) el apoyo económico para la realización del presente estudio. AHH es becario de COFFA. Agradecemos a las plantas Pesquera México SA, Brumar SA y Hang Yin SA las facilidades otorgadas para la obtención de muestras biológicas en el área de Santa Rosalía, y a los permisionarios y pescadores que nos proporcionaron material para las muestras biológicas. Finalmente, agradecemos a Ellis Glaizer la edición del texto en inglés.
Referencias
Arnold JM, Williams-Arnold LD. (1977). Cephalopoda: Decapoda. In: Giese AG, Pearse JS (eds.), Reproduction of Marine Invertebrates. Vol 4. Academic Press, New York, pp. 243-290. [ Links ]
Bell TA, Lighter DV. (1988). A Handbook of Normal Penaeid Shrimp Histology. Allen Press, Kansas, 114 pp. [ Links ]
Ehrhardt NM, Jaquemin PS, García BF, González DG, López BJM, Ortiz CJ, Solís NA. (1983). On the fishery and biology of the giant squid Dosidicus gigas in the Gulf of California, Mexico. In: Caddy JF (ed.), Advances in Assessment of World Cephalopod Resources. FAO Fish. Tech. Pap. 231: 306-340. [ Links ]
Ehrhardt NM, Solís NA, Jaquemin PS, Ortiz CJ, Ulloa RP, González DG, García BF. (1986). Análisis de la biología y condiciones del stock del calamar gigante Dosidicus gigas en el Golfo de California, México, durante 1980. Cienc. Pesq. 5: 63-76. [ Links ]
Hernández-Herrera A, Morales-Bojórquez E, Cisneros-Mata MA, Nevárez-Martínez MO, Rivera-Parra GI. (1998). Management strategy for the giant squid (Dosidicus gigas) fishery in the Gulf of California, Mexico. CalCOFI Rep. 39: 212-218. [ Links ]
INP, Instituto Nacional de la Pesca (2001). Sustentabilidad y pesca responsable en México: Evaluación y Manejo. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación, México, 1111 pp. [ Links ]
Juanicó M. (1983). Squid maturity scales for population analysis. In: Caddy JF (ed.), Advances in Assessment of World Cephalopod Resources. FAO Fish. Tech. Pap. 231: 341-378. [ Links ]
Klett TA. (1996). Pesquería del calamar gigante Dosidicus gigas. In: Casas-Valdez M, Ponce-Díaz G (eds.), Estudio del Potencial Pesquero y Acuícola de Baja California Sur. Vol. I. CIB-CICIMAR-UABCS, pp. 127-149 [ Links ]
Lipinski MR, Underhill LG. (1995). Sexual maturation in squid: Quantum or continuum? S. Afr. J. Mar. Sci. 15: 207-223. [ Links ]
Markaida U, Sosa-Nishisaki O. (2001). Reproductive biology of jumbo squid Dosidicus gigas in the Gulf of California, 1995-1997. Fish. Res. 54: 63-82. [ Links ]
Markaida U, Quiñónez-Velázquez C, Sosa-Nishizaki O. (2004). Age, growth and maturation of jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) from the Gulf of California, Mexico. Fish. Res. 66: 31-47. [ Links ]
Michel E, Klett A, Ochoa RI. 1986. Estudio preliminar para la determinación de madurez gonádica del calamar gigante Dosidicus gigas (D'Orbigny 1835). Cienc. Pesq. 5: 77-89. [ Links ]
Morales-Bojórquez E, Cisneros-Mata MA, Nevárez-Martínez MO, Hernández-Herrera A. (2001a). Review of stock assessment and fishery biology of Dosidicus gigas in the Gulf of California, Mexico. Fish. Res. 54: 83-94. [ Links ]
Morales-Bojórquez E, Hernández-Herrera A, Nevárez-Martínez MO, Cisneros-Mata MA, Guerrero-Escobedo FJ. 2001b. Population size and exploitation of giant squid (Dosidicus gigas D'Orbigny, 1835) in the Gulf of California, Mexico. Scientia Mar. 65: 75-80. [ Links ]
Morales-Bojórquez E, Martínez-Aguilar S, Arreguín-Sánchez F, Nevárez-Martínez MO. (2001c). Estimations of catchability-at-length for the jumbo squid (Dosidicus gigas) in the Gulf of California, Mexico. CalCOFI Rep. 42: 167-171. [ Links ]
Nesis KN. 1970. Biology of the Peru-Chilean giant squid, Dosidicus gigas. Okeanology 10: 140-152. [ Links ]
Neter J, Kutner MH, Nachtsheim CJ, Wasserman W. 1996. Applied linear statistical models. McGraw Hill, Boston, 1408 pp. [ Links ]
Nevárez-Martínez MO, Hernández-Herrera A, Morales-Bojórquez E, Balmori-Ramírez A, Cisneros-Mata MA, Morales-Azpeitia R. 2000. Biomass and distribution of the jumbo squid (Dosidicus gigas; d'Orbigny, 1835) in the Gulf of California, Mexico. Fish. Res. 49: 129-140. [ Links ]
Rosenberg AA, Kirkwood GP, Crombie JA, Beddington JR. 1990. The assessment of stocks of annual squid species. Fish. Res. 8: 335-350. [ Links ]
Sauer WH, Lipinski MR. 1990. Histological validation of morphological stages of sexual maturity in chokker squid Loligo vulgaris reynaudii D'Orb (Cephalopoda: Loliginidae). S. Afr. J. Mar. Sci. 9: 189-200. [ Links ]
Selman K, Arnold JM (1977). An ultrastructural and cytochemical analysis of oogenesis in the squid, Loligo pealei. J. Morphol. 152: 381-400. [ Links ]
Tafur R, Rabí M. (1997). Reproduction of the jumbo squid Dosidicus gigas (Orbigny, 1835) (Cephalopoda: Ommastrephidae) off Peruvian coasts. Scientia Mar. 61: 33-37. [ Links ]
Tafur R, Rabí M., Villegas P, Rabí M, Yamashiro C. (2001). Dynamics of maturation, seasonality of reproduction and spawning grounds of the jumbo squid Dosidicus gigas (Cephalopoda: Ommastrephidae) in Peruvian waters. Fish. Res. 54: 33-50. [ Links ]














