Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Ciencias marinas
versão impressa ISSN 0185-3880
Cienc. mar vol.29 no.4 Ensenada Out. 2003
Artículos
Estudio comparativo de la adsorción de alquilbenceno lineal sulfonatos y sus intermedios de degradación sobre sedimentos y organismos marinos
A comparative study of the adsorption of linear alkylbenzene sulfonates and their biodegradation intermediates on marine sediments and organisms
M. Sáez1, V.M. León1, J.A. Rubio1, A. Gómez-Parra1 y E. González-Mazo1*
1 Departamento de Química Física, Facultad de Ciencias del Mar y Ambientales, Universidad de Cádiz, Av. República Saharaui s/n, Puerto Real, 11510 Cádiz, Spain. *E-mail: eduardo.gonzalez@uca.es
Recibido en diciembre de 2001;
aceptado en noviembre de 2002.
Resumen
La adsorción de alquilbenceno lineal sulfonatos (LAS) y ácidos sulfofenilcarboxílicos (SPC) sobre material en suspensión (sedimento y fitoplancton) ha sido determinada en experimentos de laboratorio. La caracterización cinética del proceso de adsorción permite establecer el tiempo para alcanzar el estado estacionario, el cual fue de 12 y 18 horas, para LAS y SPC, respectivamente. Los coeficientes de adsorción normalizados al contenido en carbono orgánico para sedimentos y el contenido lipídico para microalgas, son similares para cada compuesto, mostrando una clara relación con el carácter no polar del mismo. Así, los mayores coeficientes observados corresponden a los LAS (8 x 103). Se ha observado también una cierta dependencia con la especie de alga. Así, Nannochloropsis gaditana presenta coeficientes de adsorción mayores, tanto para LAS como para SPC, que Dunaliella salina.
Palabras clave: alquilbenceno lineal sulfonatos, ácidos sulfofenilcarboxílicos, adsorción, sedimentos marinos, microalgas marinas.
Abstract
Linear alkylbenzene sulfonate (LAS) and sulfophenylcarboxylate acid (SPC) adsorption on suspended material (sediment and phytoplankton) has been determined in laboratory experiments. The kinetic characterization of the adsorption process allows the time to the steady state to be established, which was 12 and 18 hours for LAS and SPC, respectively. Organic carbon normalized coefficients for sediment and lipid content normalized coefficients for microalgae are similar for each compound, showing a clear trend with its non-polar character. Therefore, the highest coefficients correspond to LAS (8 x 103). A clear tendency was observed for the species of alga: Nannochloropsis gaditana had higher partition coefficientes for both LAS and SPC than Dunaliella salina.
Key words: linear alkylbenzene sulfonates, sulfophenylcarboxylic acids, adsorption, marine sediments, marine microalgae.
Introducción
El comportamiento de las distintas especies químicas vertidas al medio marino depende en gran medida de sus propiedades quimicofísicas, las cuales gobiernan los procesos de dispersión y distribución entre los distintos compartimentos ambientales. En el medio marino costero los sedimentos en suspensión y el fitoplancton son respectivamente los compartimentos ambientales abiótico y biótico que constituyen la mayor parte del material en suspensión y, por tanto, en los que se produce preferentemente la dispersión de una determinada especie química en la columna de agua.
Los tensioactivos son sustancias anfifílicas, por lo que poseen una gran actividad superficial presentando elevada afinidad por las interfases. El alquilbenceno lineal sulfonato (LAS) es el tensioactivo aniónico más empleado en la formulación de los detergentes de uso doméstico. A pesar de su elevada biodegradabilidad, su presencia ha sido detectada en ecosistemas costeros y marinos (González-Mazo et al., 1997a; González-Mazo et al., 1998; León et al., 2002), así como la de sus intermedios de degradación, los ácidos sulfofenilcarboxílicos (SPC) (González-Mazo et al., 1997b; León et al., 2002).
El amplio consumo de LAS junto con sus elevadas concentraciones observadas en sedimentos (González-Mazo et al., 1998; León, 2001) han suscitado un creciente interés por los procesos de adsorción. En la bibliografía se encuentran varios estudios de adsorción del LAS a lodos de plantas de tratamiento de aguas residuales, así como sistemas continentales (Matthijs y De Henau, 1985), mientras que los referentes a sedimentos marinos son más escasos (Rubio et al., 1996; González-Mazo et al., 1997b; Fytianos et al., 1998). Algunos autores hacen breves referencias a la adsorción de LAS sobre algas (Chawla et al., 1988; Crist et al., 1994) pero, hasta donde llega nuestro conocimiento, se han realizado pocos estudios para caracterizar dicho proceso (Fernández et al., 1995; Fernández et al., 1996; Sáez et al., 2001).
En este trabajo se han realizado ensayos de adsorción del LAS y del SPC sobre sedimentos y microalgas marinos. Los experimentos se han llevado a cabo poniendo en contacto los diferentes compuestos con sedimentos marinos costeros y con diferentes especies de microalgas marinas (Nannochloropsis gaditana Lubián y Dunaliella salina Teodoresco), todas ellas procedentes de la Bahía de Cádiz, así como con el agua de mar empleada. Con el objeto de caracterizar el proceso de adsorción del LAS y los SPCs sobre la materia en suspensión presente en las aguas marinas costeras se establecieron los siguientes objetivos específicos:
1. Caracterizar cinéticamente el proceso de adsorción de LAS y SPC sobre material en suspensión abiótico (sedimento) y biótico (microalgas), y establecer el tiempo en alcanzar el estado estacionario.
2. Determinar los coeficientes de adsorción de LAS y SPC sobre sedimentos y microalgas.
3. Establecer la influencia de la estructura de los compuestos, así como de la composición del material en suspensión (sedimento y algas), sobre los coeficientes de adsorción.
Material y métodos
Los experimentos de adsorción del tensioactivo LAS y su intermedio de degradación SPC han sido realizados exponiendo el sedimento y las algas a una concentración determinada durante diversos tiempos de exposición. Aproximadamente 0.5 g de sedimento ó 0.2 g de alga fueron introducidos en tubos de centrífuga de plástico junto con 50 mL de agua de mar estéril dopada a la concentración deseada de LAS o SPC. Se les añadió formaldehído al 4% con el objeto de evitar la biodegradación y que el proceso de adsorción sobre las microalgas tuviera un comportamiento únicamente de adsorción como con los sólidos en suspensión, evitando la absorción. Los tubos fueron colocados en una cámara de cultivo a temperatura constante de 25°C y agitación continua. El proceso de adsorción sobre las paredes del tubo de centrífuga fue caracterizado empleando blancos de agua de mar con el tensioactivo, sin la presencia del sedimento/alga. La concentración de exposición para LAS y para SPC fue de 200 µg L-1, en todos los casos. Los experimentos se realizaron por duplicado y con blancos.
Una vez finalizado cada ensayo las muestras y blancos fueron centrifugados a 25°C y 1380 G durante 15 min., y se midió la concentración de tensioactivo en el sobrenadante. La cantidad de LAS o SPC en el sedimento o en el alga ha sido calculada por diferencia entre la concentración inicial y la medida en fase acuosa, teniendo en cuenta la adsorción a las paredes del tubo de centrífuga, determinada a partir de los blancos.
Los experimentos han sido realizados con el homólogo C11 del LAS y de SPC. El estándar de C11-LAS (sulfonato de undecil benceno lineal) tiene una pureza del 99.0% y ha sido suministrado por Petroquímica Española, S.A. (PETRESA), mientras que el ácido sulfofenilundecanoico (C11SPC), con una pureza superior al 99%, fue sintetizado en la Universidad de Cádiz mediante sulfonación del correspondiente ácido fenilun-decanoico, según el procedimiento descrito por Marcomini et al. (1993).
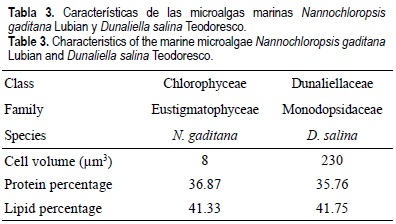
El agua de mar empleada, libre de contaminación y cuyas características se muestran en la tabla 1, procede de una zona externa al área de la Bahía de Cádiz, situada al Sur de España. El agua fue tomada a 1 metro de profundidad a más de 12 millas de la costa (Golfo de Cádiz), filtrada a través de filtros GF/F Whatman de 45 micras y esterilizada con unidades de purificación por vacío Sterivac-GP10 (20 micras). El sedimento ha sido recogido en una antigua salina de la Bahía de Cádiz que, tras su uso, se mantuvo sin recibir aporte alguno de agua, y por tanto, tampoco ha recibido residuos urbanos o de cualquier otro tipo. Tras su muestreo, el sedimento fue secado a 80°C, molturado y tamizado por 300 µm. La tabla 2 muestra sus principales características. Las microalgas empleadas fueron dos especies de algas verde: Nannochloropsis gaditana Lubián, especie autóctona de la Bahía de Cádiz, procedente de la colección de microalgas marinas del Instituto de Ciencias Marinas de Andalucía perteneciente al Consejo Superior de Investigaciones Científicas; y Dunaliella salina Teodoresco, procedente de un cultivo desarrollado en la Planta de Cultivos Marinos de la Facultad de Ciencias del Mar y Ambientales de la Universidad de Cádiz. Las características más relevantes de ambas especies se muestran en la tabla 3.


La determinación del LAS o del SPC se realizó mediante la técnica descrita por González-Mazo et al. (1998) que, en breve, consiste en una extracción en fase sólida a través de una mini-columna C18 seguida de una minicolumna de intercambio aniónico (SAX), de la muestra acidificada con HCl a pH 3. La cuantificación se realizó mediante cromatografía líquida de alta resolución con detector de fluorescencia (λexcitación = 225 nm, λemisión = 295 nm). El análisis se realizó bajo régimen isocrático con MeOH/H2O (80/20) + 10 g L-1 NaClO4 como fase móvil, y la columna empleada fue una RP-8 Lichrospher (250 mm x 4.6 mm, 10 |im de tamaño de partícula).
Resultados y discusión
La evolución temporal del cociente entre la concentración de C11-LAS en el material en suspensión y en el agua se muestra en la figura 1. Se observa como en las primeras horas de exposición hay un aumento rápido alcanzándose el equilibrio en torno a las 8-12 horas, tanto para los sedimentos como para ambas algas. Tiempos similares han sido descritos en la bibliografía para sedimentos marinos (Rubio et al., 1996), y para el alga Gracilaria debilis (Fernández et al., 1995; Fernández et al., 1996). La figura 2 muestra la evolución del C11-SPC para sedimento (fig. 2a) y ambas algas (fig. 2b, c). Se observa la misma tendencia que para el LAS aunque los coeficientes de concentraciones son menores, lo que concuerda con el mayor carácter polar de los SPC. Los tiempos para alcanzar el estado estacionario son superiores a los observados para el LAS, siendo necesarias unas 12 horas de exposición para D. salina, mientras que N. gaditana y el sedimento necesitan un tiempo mayor de exposición, de 18-20 horas. La adsorción de SPC por el material en suspensión presenta un rápido aumento inicial y una estabilización más lenta.


Una vez alcanzado el equilibrio, se establecieron los coeficientes de partición sedimento/agua (KD) y biota/agua (KB) para el C11-LAS y para el C11-SPC, los cuales indican la afinidad del compuesto por la fase sólida (sedimento, en el primer caso, y organismo en el segundo). Teniendo en cuenta el carácter hidrófobo de estos compuestos es necesaria la normalización de los coeficientes con respecto al contenido en carbono orgánico para el sedimento, obteniéndose el Koc (coeficiente de partición obtenido expresando la concentración en sedimento en términos de carbono orgánico), mientras que el coeficiente de partición biota/agua (KB) se normaliza al contenido en grasas, obteniéndose el KBLIP (coeficiente de partición obtenido expresando la concentración en biota en términos de la fracción lipídica). Los resultados obtenidos se muestran en la tabla 4. El LAS es un compuesto lipofílico, cuyo coeficiente de partición octanol agua, Kow, está en torno a 102, por lo que presenta una cierta afinidad por la materia orgánica del sedimento, como muestra el Koc, cuyo valor es 8x103, así como por los lípidos de las microalgas, que poseen KBLIP de 2x103 y 3x103 para D. salina y N. gaditana, respectivamente. Los coeficientes de adsorción, aunque del mismo orden, son ligeramente superiores en sedimento que en las algas. Dentro de las algas, los valores observados para D. salina son inferiores a los obtenidos para N. gaditana. Esta diferencia puede deberse al tamaño mucho menor de esta última, que le confiere una mayor relación superficie/volumen, así como a la presencia de una pared celular de la que Dunaliella carece y que, al tener distinta composición, tendrá también distintas características quimicofísicas.

El C11-SPC es un compuesto más polar que el C11-LAS, por lo que presenta menos afinidad sobre la fase sólida, como lo muestran los valores encontrados. En los experimentos realizados con Nannochloropsis se han observados valores ligeramente superiores a los realizados con Dunaliella y con sedimento. Este aumento puede deberse a posibles interacciones con la pared celular de esta microalga, la cual es muy resistente, aunque hasta el momento se desconoce su composición exacta.
Dada la elevado afinidad que presenta el lineal alquilbenceno sulfonato por el material particulado, los procesos de dispersión y transporte en la columna de agua tienen una gran importancia y deben ser objeto de estudio a la hora de determinar el destino final y comportamiento ambiental de sustancias de cierto carácter lipofílico.
Agradecimientos
Los autores del presente trabajo quieren expresar su gratitud a PETRESA por el suministro del LAS, y a Luís Lubián Chiachio por los cultivos de N. gaditana y toda la información suministrada sobre la misma. Este trabajo está enmarcado dentro del proyecto europeo Waste Water Cluster: PRISTINE (ENV4-CT97-494).
Referencias
Crist, R.H., Martin, J.R., Carr, D., Watson, J.R., Clarke, H.J. and Crist, D.R. (1994). Interaction of metals and protons with algae. 4. Ion exchange vs adsorption models and a reassessment of scatchard plots; Ion-exchange rates and equilibria compared with calcium alginate. Environ. Sci. Technol., 28: 1859-1866. [ Links ]
Chawla, G., Viswanathan, P.N. and Devi, S. (1988). Phycotoxicity of linear alkylbezene sulfonate. Ecotoxicol Environ. Saf. 15(2): 119-124. [ Links ]
Fernández, N.A., Chacin, E., Gutiérrez, E., Alastre, N., Llamoza, B., and Forster, C.F. (1995). Adsorption of lauryl benzyll sulphonate on algae. Bioresource Technol., 54: 111-115 [ Links ]
Fernández, N.A., Chacin, E., Gutiérrez, E., Alastre, N., Llamoza, B., and Forster, C.F. (1996). An Analysis of the Absortion of Alkyl Benzene Sulphonate by Algal Residues. Process Biochem., 31: 333-336 [ Links ]
Fytianos, K., Voudrias, E. and Mouratidou, T. (1998). The sorption-desorption behaviour of linear alkylbenzene sulfonate in marine sediments. Chemosphere, 36: 2067-2075. [ Links ]
González-Mazo, E., Forja, J.M., and Gómez-Parra, A. (1998). Fate and distribution of linear alkylbenzene sulfonates in the littoral environment. Environ. Sci. Technol. 32: 1636-1641. [ Links ]
González-Mazo, E., Quiroga, J.M., Sales, D. and Gómez-Parra, A. (1997a). Levels of linear alkylbenzenesulfonate (LAS) in waters and sediments of the coastal ecosystems of the Gulf of Cadiz. Toxicol. Environ. Chem., 59: 77-87. [ Links ]
González-Mazo, E., Honing, M., Barceló, D. and Gómez-Parra, A. (1997b). Monitoring long-chain intermediate products from the degradation of linear alkylbenzene sulfonates in the marine environment by solid-phase extraction followed by liquid chromatography/ionspray mass spectrometry. Environ. Sci. Technol. 31: 504-510. [ Links ]
León, V. M., Sáez, M., González-Mazo. E. and Gómez-Parra, A. (2002). Occurrence and distribution of linear alkylbenzene sulfonates and sulfophenylcarboxylic acids in several Iberian littoral ecosystems. Sci. Tot. Environ. 288: 215-226. [ Links ]
León, V.M. (2001). Reactividad y mecanismos de transporte de alquilbenceno lineal sulfonatos (LAS) y sus intermedios de degradación en sistemas marinos litorales. Tesis Doctoral. Universidad de Cádiz. 225 pp. [ Links ]
Marcomini, A., Di Corcia, A., Samperi, R. and Capri, S. (1993). Reverse-phase HPLC determination of linear alkylbenzene sulphonates, nonylphenol polyethoxylates and their biotransformation products. J. Chrom. A. 644: 59-71. [ Links ]
Matthijs, E. and De Henau, H. (1985). Adsorption and desorption of LAS. Tenside Surfact. Det., 22(6): 299-304. [ Links ]
Rubio, J.A., González-Mazo, E. and Gómez-Parra, A. (1996). Sorption of LAS on marine sediment. Mar. Chem., 54: 171-177. [ Links ]
Sáez, M., Gómez-Parra, A. and González-Mazo, E. (2001). Bioconcentration of linear alkylbenzene sulfonates and their degradation intermediates in marine algae. Fres. J. Anal. Chem. 371: 486-490. [ Links ]














