Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.29 n.2 Ensenada Jun. 2003
Artículos
Efecto del carragenano sulfatado en la respuesta celular de la langosta Panulirus interruptus
Effect of sulfated carrageenan on the cellular response of the lobster Panulirus interruptus
Sonia Araceli Soto1a María Teresa Viana2*
1 Facultad de Ciencias Marinas.
2 Instituto de Investigaciones Oceanológicas, Universidad Autónoma de Baja California, Apartado postal 453, Ensenada, CP 22860, Baja California, México. *E-mail: viana@uabc.mx
Recibido en julio de 2002;
aceptado en enero de 2003.
Resumen
En el presente trabajo se estimó la reacción de defensa celular en la langosta espinosa Panulirus interruptus después de inocular el polisacárido sulfatado carragenano. Se realizaron tres experimentos in vivo en los que se inyectaron 0.2 mg mL-1 de carragenano a langostas adultas y se les tomaron muestras de hemolinfa a diferentes tiempos (0, 1, 3, 6, 12, 24, 36 y 48 h). Se registró el número total de hemocitos y sus diferentes tipos como hialocitos, granulocitos y granulocitos de gránulos grandes. Después de 24 h, el conteo total de hemocitos del grupo control fue menor que el observado en los grupos experimentales. Durante los experimentos in vitro se evaluó el porcentaje de fagocitosis por los hemocitos, utilizando Escherichia coli junto con suero de langosta. Se registró de 7.6% a 31.9% de fagocitosis en presencia de diferentes concentraciones de carragenano (0.0%, 0.05%, 0.1% y 0.5%), mientras que en los tratamientos de referencia en medio para hemolinfa de langosta, la respuesta fue de 6.2% a 22.2% a las mismas concentraciones del carragenano. Se concluye que las langostas, en presencia de un glucano sulfatado, presentaron una respuesta no específica que resultó en un incremento a nivel celular y una estimulación indirecta de la fagocitosis.
Palabras clave: langosta espinosa, respuesta no específica, hemocitos, carragenano.
Abstract
In the present work, the cellular defense reaction of the spiny lobster Panulirus interruptus was studied after being inoculated with the sulfated polysaccharide carrageenan. Three in vivo experiments were undertaken, where 0.2 mg mL-1 carrageenan were administered to adult lobsters and hemolymph samples were taken at different times (0, 1, 3, 6, 12, 24, 36 and 48 h). The total hemocyte count and the types, such as hyalocytes, granulocytes and large granule granulocytes, were recorded. After 24 h, the total hemocyte count in the control group was lower than that observed in the experimental group. During the in vitro experiments, the percentage of phagocytosis by lobster hemocytes was studied using the Gram-negative bacteria Escherichia coli. A phagocytosis of 7.6% to 31.9% was observed using various carrageenan concentrations (0.0%, 0.05%, 0.1% and 0.5%) in the presence of lobster serum, whereas in the reference treatment, E. coli incubated in artificial lobster hemocyte medium showed lower phagocytic activity (6.2% to 22.2%) at the same carrageenan concentrations. It is concluded that lobsters in the presence of a sulfated glycan had a nonspecific response, with the resulting increase in cellular level and indirect phagocytosis stimulation.
Key words: spiny lobster, nonspecific response, hemocytes, carrageenan.
Introducción
Actualmente la langosta se comercializa viva y se obtiene por ella mejor precio que en cualquiera de sus presentaciones tradicionales. La metodología utilizada para ello ha implicado una serie de adaptaciones para el mantenimiento de las langostas en cautiverio y su transporte, el cual puede durar desde unas horas hasta un día empleando cajas térmicas y sistemas de empaque sofisticados (Vijayakumaran y Radhakrishnan, 1997). Sin embargo, las langostas en cautiverio son expuestas frecuentemente a factores que producen estrés que en la mayoría de los casos llevan a una supresión inmunológica con la consecuente presencia de infecciones (Paterson y Spanoghe, 1997). Durante el manejo de las langostas, el estrés asociado a éste, a su transportación, empaque, hacinamiento, cambios abruptos de temperatura durante la aclimatación, etc., favorece las condiciones necesarias para que las bacterias oportunistas invadan a los organismos, causando enfermedades infecciosas (Paterson y Spanoghe, 1997; Spanoghe y Bourne, 1997).
A diferencia de los vertebrados que pueden producir anticuerpos para resistir las infecciones, los invertebrados poseen un sistema inmunológico no específico (Söderhall y Cerenius, 1992). El sistema inmunológico de crustáceos como la langosta está relacionado directamente con la hemolinfa y las células sanguíneas o hemocitos. Los hemocitos son los principales responsables de reacciones celulares como la fagocitosis de microorganismos invasores, su inmovilización en nódulos, la encapsulación de cuerpos extraños y la reparación de heridas, acompañada de una inmediata coagulación de la hemolinfa (Hose et al., 1990; Söderhall y Cerenius, 1992). En crustáceos, antígenos de la superficie microbiana como los lipopolisacáridos y β-glucanos (componentes estructurales de la pared celular de las levaduras) son capaces de activar las funciones celulares directamente. Los β-glucanos son moléculas de poliglucosa de cadena larga unidas por enlaces P, con ramificaciones de una sola molécula de glucosa o cadenas de glucosa. Tales glucanos pueden existir en varias formas estructurales, desde oligómeros solubles en agua hasta macromoléculas insolubles o partículas (Raa, 1996). Estos productos microbianos, utilizados como inmunoestimulantes, trabajan en el sistema inmunológico no específico y resultan una alternativa al uso de antibióticos, e incluso como agentes profilácticos, en la prevención de enfermedades. Así, la administración de un inmunoestimulante antes de una infección debería estimular las defensas del animal y proveer protección contra posibles infecciones severas o letales (Raa, 1996). Actualmente existe una tendencia al uso de inmunoestimulantes en la acuacultura, donde los más utilizados en peces son los β-glucanos (Nikl et al., 1991; Yano et al., 1991; Engstad y Robertsen, 1994; Robertsen et al., 1994; Vadstein, 1997). Para crustáceos decápodos existen varios reportes sobre el uso de glucanos para activar su sistema inmunológico (Unestam y Söderhall, 1977; Kakinuma et al., 1981; Morita et al., 1981; Söderhall y Cerenius, 1992; Song et al., 1997; Chang et al., 2000; Campa-Córdova et al., 2002). Se cree que la estimulación del sistema inmunológico por glucanos se debe a la activación del sistema profenoloxidasa que representa el componente principal de un complejo enzimático de cascada durante el reconocimiento de material extraño (Söderhall y Cerenius, 1992; Song et al., 1997; Sung et al., 1998). Por otro lado, los glicanos (polisacáridos que contienen azúcares diferentes a la glucosa) han mostrado interacción con los macrófagos de ratones, e inducen una cascada de eventos celulares y bioquímicos comparables a los reportados para los β-1,3 glucanos (Williams et al., 1989). Estos glicanos, como el agar y el carragenano, son comúnmente encontrados en las macroalgas marinas. El carragenano es un polisacárido sulfatado de la pared celular de las algas rojas constituido por unidades alternantes de D-galactopiranosa unidas por enlaces α-1,3 y β-1,4 (Painter, 1983), que ha sido ampliamente utilizado como irritante en la simulación de inflamaciones en animales, o para disminuir selectivamente a los macrófagos de mamíferos (Takeda et al., 1998), e incluso, en estudios de adhesión celular en macrófagos de ratones (Chong y Parish, 1985). No obstante, existen diferencias en cuanto a los resultados obtenidos con diversos tipos de inmunoestimulantes en distintas especies acuáticas (Robertsen et al., 1994; Raa, 1996), por lo que se sospecha que la selección de un compuesto como éste, en particular, dependerá de su solubilidad, ruta de administración, tipo de organismo, dosis, etc. (Raa, 1996).
En Baja California, México, existen pocos recursos naturales explotables y éstos constituyen la base de la economía del estado, en la que la langosta, el abulón y las macroalgas son probablemente los productos marinos más importantes y, por ende, es importante realizar estudios para su mejor aprovechamiento y para el desarrollo de productos biotecnológicos. Por lo anterior, el propósito de este estudio fue probar el efecto del carragenano sulfatado sobre el incremento celular de los hemocitos en la hemolinfa y de la capacidad fagocítica de la langosta espinosa Panulirus interruptus Randall, 1840, ya que este tipo de respuestas están consideradas como parámetros o indicadores de la condición física e inmunológica de estas especies (Evans et al., 2000; Jussila et al., 2000).
Materiales y métodos
Condiciones experimentales
Se transportaron 40 langostas espinosas (P. interruptus) suministradas por la Cooperativa Bahía Tortugas (México), al laboratorio húmedo del Instituto de Investigaciones Oceanológicas de la UABC. En el laboratorio, las langostas fueron mantenidas en tres estanques rectangulares de fibra de vidrio con sistema de flujo abierto y aireación constante, en los que se colocaron trozos de tubo negro ABS (20 cm de largo por 15 cm de diámetro) como refugio para las langostas y se controlaron las condiciones experimentales como temperatura, salinidad, pH y oxígeno disuelto. Las langostas fueron alimentadas cuatro veces a la semana con trozos de pescado y calamar descongelados. Durante las tres semanas de aclimatación se revisó cada langosta y se separaron todas las que presentaban daños visibles o signos aparentes de enfermedad. Las langostas fueron marcadas, pesadas, medidas y sexadas, y antes de cada experimento se determinó su estado de intermuda de acuerdo con el esquema de Aiken (1980), utilizando en los experimentos únicamente animales en estadio de intermuda (estadio C).
Se llevó a cabo un registro mensual de la temperatura del agua de cultivo y del número de hemocitos para determinar sus valores en condiciones de cautiverio. Se tomaron muestras de hemolinfa a partir del primer segmento abdominal de las langostas, previa desinfección con etanol, utilizando una jeringa de 1 mL (aguja No. 27) con 0.3 mL de formol frío en agua de mar al 10%. Los hemocitos se contaron en una cámara Neubauer a un aumento de 600x y éstos se reportaron como conteo total de hemocitos (CTH). La clasificación de los hemocitos se realizó de acuerdo con sus características morfológicas (Cornick y Stewart, 1978) en muestras frescas, fijadas, y frotis teñidos con las tinciones de Wright, Giemsa y eosina-policromo. A partir de este análisis se obtuvo el porcentaje de cada tipo de célula o conteo diferencial de hemocitos.
Experimentos in vivo
Considerando los grupos experimentales más un grupo control, se realizaron en total tres experimentos. En el primero las langostas se mantuvieron libres, mientras que en el segundo se confinaron en jaulas. Se recurrió a un tercer experimento debido a la gran variación individual en cuanto a la concentración de hemocitos por mililitro de hemolinfa en las langostas. En él cada langosta sirvió como control, utilizando su mismo conteo de hemocitos en hemolinfa como control antes de administrar el carragenano y poder comparar contra el número de hemocitos después de suministrar el carragenano.
Experimento 1: langostas libres
Las langostas del grupo experimental (cuatro) fueron inyectadas en el primer segmento abdominal de acuerdo con su peso individual, como lo refieren Smith y Söderhall (1983), con 0.2 mg de λ-carragenano (Sigma Chemical Co.™) por mililitro de hemolinfa. El volumen de hemolinfa fue calculado de acuerdo con Bauchau (1981), quien considera que el 20% del peso de las langostas corresponde a hemolinfa. El À-carragenano usado en todos los experimentos se preparó a partir de una solución al 1% (Smith y Söderhall, 1983) en medio artificial para hemocitos de langosta (MAHL) estéril, constituido por MgCl2 6H2O (1.0 g L-1), NaCl (28.4 g L-1), MgSO4 7H2O (2.0 g L-1), CaCl2 2H2O (2.25 g L-1), KCL (0.7gL-1), dextrosa (0.5 g L-1), aminoácidos esenciales + glutamina (50x) (20.0 mL L-1), solución de vitaminas (100x) (10.0 mL L-1), Na2HPO4 7H2O (0.125 g L-1), bicarbonato de sodio (3.0 g L-1) y agua destilada (1.0 L) a un pH de 7.6 (Paterson y Stewart, 1974). El grupo control de langostas (cuatro) fue inyectado con MHAL estéril. A los tiempos 0 (tiempo cero), 1, 3, 6, 12, 24, 36 y 48 h se tomaron muestras de hemolinfa que se fijaron en formol frío (al 4% en agua de mar). Los análisis de las muestras se realizaron en las siguientes 24 h y se registró el CTH en la muestra tomada en cada tiempo.
Experimento 2: langostas confinadas con grupo control externo
En este experimento, con el objeto de disminuir el estrés, las langostas del grupo control (cuatro) y las del grupo experimental (seis) fueron confinadas individualmente en jaulas (25 x 30 x 40 cm) construidas con una malla de plástico rígido y mantenidas en estanques rectangulares. Con estas langostas se realizó el mismo procedimiento descrito en el experimento 1, registrando el CTH para cada tiempo.
Experimento 3: langostas confinadas con grupo control interno
En este experimento se usaron diez langostas individualmente confinadas en jaulas. En la primera etapa (control), se les inyectó MAHL estéril, se les tomaron muestras de hemolinfa a los mismos intervalos de tiempo que en el experimento 1 y se registraron los respectivos CTHs. Después de dos semanas se tomaron tres langostas al azar y se evaluó su CTH para asegurarse de que el nivel de hemocitos era similar al nivel inicial. En la segunda etapa (grupo experimental), a estas mismas langostas se inyectaron 0.2 mg mL-1 de carragenano y, después de transcurridos los mismos intervalos de tiempo descritos anteriormente, se procedió al conteo de hemocitos.
Debido a la gran variación existente a nivel individual en la concentración de hemocitos en la hemolinfa de las langostas, para el análisis se tomó en cuenta el incremento en el número de hemocitos. Éste se estimó como CTHn+1 - CTHn, donde n es el tiempo a la toma de muestras (0, 1, 3, 6, 12, 24, 36 y 48 h).
Análisis estadístico
El análisis estadístico consistió en una prueba de normalidad de Kolmogorov-Smirnov y una prueba t de Student entre los datos de los incrementos (CTHn+1- CTHn) del grupo control y del grupo experimental para cada tiempo muestreado (α = 5%), utilizando el programa estadístico SigmaStat™ 2.03.
Experimentos in vitro
Se incubó una cepa pura de Escherichia coli (suministrada por el laboratorio de microbiología de la Facultad de Ciencias, UABC) en caldo de lauril triptosa a 37°C durante 24 h, y se ajustó la densidad bacteriana a 2.0 x 107 cél mL-1, según lo recomendado por Smith y Söderhall (1983).
Para el conteo de hemocitos, se extrajo en MAHL estéril la hemolinfa de las langostas visiblemente saludables, usando L-cisteína (40 mg mL-1) como anticoagulante. Los hemocitos fueron recolectados a 4°C por centrifugación (700 G por 10 min) y lavados dos veces con MAHL enfriado en hielo; posteriormente, se ajustó la densidad a 1.5-2.0 x 105 cél mL-1 (Paterson y Stewart, 1974). La viabilidad celular se evaluó midiendo cada 10 min aplicando la prueba de azul tripano descrita por Phillips (1973).
Preparación de las monocapas
Se colocaron 100 µL de la suspensión de hemocitos anteriormente descrita sobre un cubreobjetos (22 x 22 mm) libre de pirógenos. Los cubreobjetos se colocaron sobre placas de plástico estériles con multiposos y se dejaron reposar durante 15 min a 20°C para permitir la extensión y adherencia de las células en la superficie del vidrio. Luego, cada cubreobjetos se lavó con dos volúmenes de 2.5 mL de MAHL estéril filtrado (0.22 µm).
Tratamiento de las monocapas con carragenano
Para observar el efecto del glicano sobre los hemocitos de langosta, las monocapas recién preparadas se cubrieron con 100 µL de 0.0%, 0.05%, 0.1% y 0.5% de λ-carragenano por triplicado y, como referencia, algunas monocapas se cubrieron con 100 µL de MAHL estéril filtrado. Todas las monocapas se incubaron en una cámara húmeda por 1 h a 15 ± 0.5°C sobre un agitador orbital (MultiMixer Mistral, Lab-Line, Instr. Inc.). Finalmente, las monocapas se fijaron en glutaraldehído al 2.5% en MAHL y se examinaron bajo un microscopio de contraste de fases (American Optical).
Actividad fagocítica
Para evaluar el efecto del suero de langosta en la actividad fagocítica se mezclaron, por triplicado, 100 µL de E. coli con 100 µL de suero de langosta previamente preparado, según Smith y Ratcliffe (1978), en tubos estériles de 1.5 mL y, como referencia, muestras con MAHL. Los tubos fueron entonces preincubados durante 1 h a 15 ± 0.5°C con agitación constante. Posteriormente, se mezclaron 100 µL de cada tratamiento (bacterias incubadas en suero y en MAHL esteril) con el mismo volumen de 0.05%, 0.1% y 0.5% de carragenano en MAHL. De estos tratamientos, 100 µL se colocaron sobre monocapas de hemocitos recién preparadas que se incubaron por 1 h a 15 ± 0.5°C sobre un agitador orbital. Después de este tiempo, las monocapas se fijaron en glutaraldehído al 2.5% en MAHL y se examinaron bajo un microscopio de contraste de fases.
Cuantificación de la fagocitosis
El porcentaje de actividad fagocítica se estimó contando el número de hemocitos que contenían una o más bacterias intracelulares, distinguiéndolos de las formas extracelulares adherentes usando el criterio descrito por Smith y Ratcliffe (1978). Las partículas fagocitadas siempre fueron observadas bajo una óptica de contraste de fases en el mismo plano focal que el citoplasma, donde las bacterias fueron menos refráctiles que las formas extracelulares.
Resultados
La temperatura del agua a lo largo del año osciló entre 24°C y 17°C, mientras que el CTH varió de 9.4 a 16.1 x 106 cél mL-1 entre marzo y julio, respectivamente. No se encontró una correlación significativa entre la variación de temperatura y el CTH (coeficiente de correlación de Pearson, r = 0.279, n = 11, P > 0.05). Salinidad, pH y oxígeno se mantuvieron en niveles normales: 32 a 34 g L-1, 7.9 a8.1, y 6.8 a 7.01 mg L-1, respectivamente.
En la langosta P. interruptus se observaron tres tipos de hemocitos (tabla 1): hialocitos, granulocitos y granulocitos de gránulos grandes (fig. 1). Los hemocitos más abundantes fueron los hialocitos (83%), mientras que los granulocitos de gránulos grandes representaron sólo un 1.8% del CTH. Las características de tinción más importantes fueron la condensación e intensidad de color del núcleo, así como el tamaño y número de gránulos del citoplasma. Sin embargo, empleando microscopía de contraste de fases, el grado de granulación y los detalles nucleares descritos anteriormente fueron más distintivos, en comparación con muestras de hemolinfa fijadas sin teñir.
Experimentos in vivo
En el experimento 1, el número de hemocitos en el grupo control varió de 11.28 a 28.23 x 106 cél mL-1, mientras que en el grupo experimental fue de 11.28 a 20.051 x 106 cél mL-1. El comportamiento de los incrementos (CTHn+1 - CTHn), tanto en el grupo control como en el grupo experimental, fue muy similar (fig. 2a), pero este último tuvo siempre mayor producción de hemocitos a lo largo del tiempo. Se observaron diferencias significativas (P < 0.05) entre el grupo control y el experimental en todos los tiempos muestreados.

En el experimento 2, el CTH en el grupo control fue de 12.78 a 26.08 x 106 cél mL-1, mientras que en el experimental, éste osciló entre 9.80 y 15.11 cél mL-1. El comportamiento de los incrementos también fue similar en ambos grupos (fig. 2b) y, de la misma manera, los organismos sujetos a tratamiento presentaron mayor producción de hemocitos hasta las 36 h, siendo otra vez similares en ambos grupos a las 48 h. En este caso se observaron diferencias significativas (P < 0.05) entre el grupo control y y el experimental a los tiempos 3, 6, 12, 24 y 36 h.
En el experimento 3, el CTH en el grupo control fue de 10.18 a 19.128 x 10 6 cél mL-1, mientras que para el experimental, éste osciló de 9.68 a 15.29 x 106 cél mL-1. Se detectaron diferencias entre ambos grupos (P < 0.05) hasta las 24 h y, posteriormente, los cambios en el CTH resultaron similares a las 36 y 48 h (fig. 2c).
Experimentos in vitro
Mediante la observación cualitativa en microscopio de contraste de fases se observó que, a medida que la concentración de carragenano aumentaba, el grado de desgranulación se vió afectado en los granulocitos y granulocitos de gránulos grandes, mientras que en los tratamientos de referencia con MAHL también se presentaron dichas diferencias aunque aparentemente en menor cantidad.
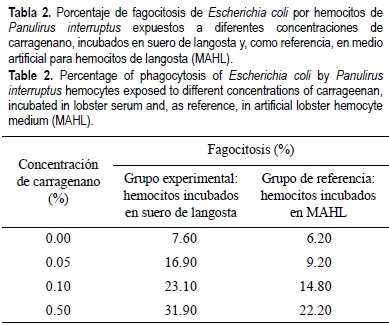
En las monocapas de hemocitos incubadas con E. coli que fueron preincubadas en suero de langosta, se observó aglutinación de bacterias y un aumento en la interconexión entre hemocitos mediante la extensión de sus filopodios. Durante los ensayos de fagocitosis con E. coli se observó que la actividad fagocítica de los hemocitos aumentó de 7.60% a 31.90% (tabla 2) para las diferentes concentraciones de carragenano (de 0% a 0.5%); en contraste, los tratamientos de referencia incubados en MAHL mostraron porcentajes menores, con 6.20% a 22.20% de fagocitosis.
Discusión
Las variaciones individuales en el CTH de P. interruptus no están asociadas con los cambios de temperatura durante el experimento, ya que en las pruebas preliminares se observó una gran variación individual en el CTH de las langostas mantenidas bajo las mismas condiciones de laboratorio. Es probable que las fluctuaciones observadas estén asociadas con otro tipo de factores, tales como condición fisiológica, ciclo de muda, madurez gonadal, monotonía de la dieta, etc. (Bauchau y Plaquet, 1973; Bauchau, 1981; Tsing et al., 1989). En cuanto al CTH de P. interruptus, los valores encontrados fueron mayores (9 a 16 x 106 cél mL-1) que los reportados para la misma especie (4.79 x 106 cél mL-1) por Gómez-Jiménez et al. (2000) y para Panulirus cygnus (4 a 8 x 106 cél mL-1) por Jussila et al. (2000). En contraste, el CTH de P. interruptus encontrado fue menor que el de la langosta Homarus americanus, de 13-28 x 106 cél mL-1 (Stewart et al., 1967; Cornick y Stewart, 1978; Stewart et al., 1983). Estas diferencias posiblemente se deben a una variabilidad intra e interespecífica en el número de hemocitos de los crustáceos decápodos (Hautton et al., 1997; Tsing et al., 1989; Gargioni y Barraco, 1998).
Se encontraron tres tipos de hemocitos: hialocitos, granulocitos y granulocitos de gránulos grandes, de acuerdo con el esquema clásico, en donde las medidas celulares corresponden a los valores reportados para hemocitos de crustáceos decápodos (Wood y Visentin, 1967; Cornick y Stewart, 1978; Hose et al., 1990; Jussila et al., 1997; Gargioni y Barraco, 1998; van de Braak et al., 2000). En este estudio, los hialocitos (80%) resultaron ser los más abundantes en P. interruptus, como lo reportan para esta misma especie Hose et al. (1990). En forma similar, los hialocitos han resultado más abundantes en H. americanus (Cornick y Stewart, 1978), en cangrejos (Bauchau y Plaquet, 1973; LaPeyre y Chu, 1990) y en camarones peneidos (Martin y Graves, 1985; Gargioni y Barraco, 1998).
La serie de tiempo de los experimentos in vivo muestra consistentemente un menor cambio en el número de hemocitos en los grupos control. Se observó que el manejo de los organismos en el experimento 1 causó estrés, denotado por cambios más drásticos en el CTH (fig. 2a). En el experimento 2, diseñado para reducir este estrés, las diferencias fueron menores (fig. 2b), y aún menores en el experimento 3 (fig. 2c). Estos experimentos muestran claramente que el carragenano produce una reacción hemocítica (no específica) significativa (P < 0.05) durante las primeras 36 h. El resultado de los tres experimentos fue similar: una reducción en el cambio del CTH seguida por una estabilización hacia niveles normales, la cual se puede interpretar como una recuperación celular. En crustáceos decápodos sujetos a vacunación e infecciones subletales se ha observado una reducción inicial en el número de hemocitos. Por ejemplo, Carcinus maenas reduce significativamente el número de hemocitos circulantes después de la inoculación con Listonella (= Vibrio) anguillarum, Moraxella spp. y Bacillus cereus (Smith y Ratcliffe, 1978; Hautton et al., 1997), de manera similar a lo observado con Scyonia ingentis (Martin et al., 1993). El CTH de Litopenaeus vannamei decrece en las primeras 24 h después de la exposición a β-glucanos y polisacáridos sulfatados, para después incrementar el número de hemocitos a niveles normales (Campa-Córdova et al., 2002). Probablemente esta reducción inicial en el cambio del CTH se deba a que las partículas de carragenano son activamente fagocitadas, disminuyendo el número de células hialinas responsables de la fagocitosis (Johansson et al., 2000). En diferentes trabajos sobre el uso de endotoxinas bacterianas como inmunoestimulantes, se ha observado que los crustáceos decápodos inyectados muestran una proliferación en el número de hemocitos circulantes durante dos a cuatro días (McKay y Jenkin, 1970; Johnson et al., 1981; Stewart et al., 1983; Goarant y Boglio, 2000).
Los experimentos in vivo trataron de emular las condiciones de estrés (manejo y exposición al aire) que sufren las langostas durante su transporte en vivo. De acuerdo con los resultados, el carragenano amortigua la reducción del cambio en el número de hemocitos, durante 36 h, tiempo en el que las langostas estuvieron expuestas a un estrés similar al producido durante el manejo y transporte en vivo. Existe evidencia de que las langostas, confinadas durante el transporte, reducen drásticamente el CTH (Jussila et al., 1997); por lo tanto, es posible que este tipo de glicano tenga potencial como agente profiláctico o estimulante de tiempo corto. Se podría inducir una reducción inicial en el CTH inoculando carragenano en las langostas, dejando sentir su efecto un mínimo de 24 h, después de lo cual los organismos deberían tener un mecanismo de defensa no específico reforzado. Esto último puede aminorar la debilidad y muerte de langostas debidas al manejo y transporte en vivo. Sin embargo, se requiere de una mayor investigación para evaluar si el carragenano administrado en el alimento puede tener en el sistema inmunológico no específico el mismo efecto observado en este estudio.
La aglutinación de E. coli incubadas en suero de langosta muestra que el suero contiene factores que estimulan o activan la agregación de células o partículas extrañas, lo cual pudiera facilitar su fagocitosis. En langostas se han caracterizado algunas opsoninas, las cuales son sustancias que facilitan el proceso de fagocitosis (McKay y Jenkin, 1970; Fuller y Doolittle, 1971; Cornick y Stewart, 1973; Hall y Rowlands, 1974; Goldenberg y Greenberg, 1983; Holmbland y Söderhall, 1999). La desgranulación observada en los hemocitos demuestra la facilidad de lisis celular (Gargioni y Barraco, 1998), aspecto importante que debe considerarse en experimentos in vitro con hemocitos. Los ensayos de fagocitosis mostraron un incremento en la actividad fagocítica al aumentar la concentración de carragenano, tanto en los incubados en suero como los incubados con MAHL, lo que demuestra que el carragenano puede activar algunos factores involucrados en la fagocitosis (Söderhall, 1992). Sin embargo, en el grupo incubado en suero de langosta se observó una mayor fagocitosis que en el grupo incubado en MAHL, lo que demuestra que hay otros factores involucrados en la fagocitosis, como son las opsoninas antes mencionadas.
En crustáceos decápodos, los β-1,3 glucanos tienen la propiedad de activar a los hemocitos (Unestam y Söderhall, 1977; Morita et al., 1981; Kakinuma et al., 1981). Paterson et al. (1976) reportaron que los hemocitos de H. americanus fagocitaron el doble de eritrocitos incubados en suero de langosta, mientras que, en cangrejos, la fagocitosis de Moraxella sp. se incrementó del 5.6% al 18.5% con la adición de laminarin (Smith y Söderhall, 1983); estos autores atribuyen este resultado a que el glicano activa el sistema profenoloxidasa que se encuentra en los hemocitos granulares. Chang et al. (2000) encontraron un incremento en la actividad fagocítica de los hemocitos de Penaeus monodon, a los cuales se les administró β-1,3 glucanos en su dieta.
El uso de un glicano como el carragenano puede activar el sistema celular de defensa de las langostas, tanto la proliferación celular como la fagocitosis. Por tanto, la administración de este glicano a las langostas puede reforzar sus defensas y elevar la supervivencia bajo condiciones de estrés.
De esta manera, se concluye que el carragenano estimula tanto la proliferación celular como la fagocitosis; sin embargo, se recomienda hacer mayores estudios en los que se pueda analizar el efecto de la administración de este compuesto por otras vías como, por ejemplo, en la alimentación, para poder dar una recomendación más práctica para su uso.
Agradecimientos
Los autores agradecen a Rafael Solana su ayuda en el análisis estadístico de los resultados y a Neil Duncan sus valiosos comentarios. Se reconoce ampliamente el apoyo financiero de CONACYT, México (proyecto 11925-B). El primer autor recibió una beca del CONACYT para completar su programa de maestría en ciencias.
Referencias
Aiken, D.E. (1980). Molting and growth. In: J.S. Cobb and B.F. Phillips (eds.), The Biology and Management of Lobsters, Vol. I. Physiology and Behavior. Academic Press, New York, pp. 57-70. [ Links ]
Bauchau, A.G. (1981). Crustaceans. In: N.A. Ratcliffe and A.F. Rowley (eds.), Invertebrate Blood Cells. Vol. 2. Academic Press, New York, pp. 385-420. [ Links ]
Bauchau, A.G. and Plaquet, J.C. (1973). Variation du nombres des hèmocytes chez les crustracès brachyoures. Crustaceana, 24: 215-223. [ Links ]
Campa-Córdova, A.I., Hernández-Saavedra, N., Phillips, R.D. and Ascencio, F. (2002). Generation of superoxide anion and SOD activity in haemocytes and muscle of American white shrimp (Litopenaeus vannamei) as a response to β-glucan and sulphated polysaccharide. Fish Shellfish Immunol., 12: 353-366. [ Links ]
Chang, C.F., Chen, H.Y., Su, M.S. and Liao, I.C. (2000). Immunomodulation by dietary β-1,3-glucan in the brooders of the black tiger shrimp Penaeus monodon. Fish Shellfish Immunol., 10: 505-514. [ Links ]
Chong, A.S. and Parish, C.R. (1985). Nonimmune lymphocite-macrophage interaction. II. Evidence that interaction involves sulfated polysaccharides recognition. Cell. Immunol., 92: 277-289. [ Links ]
Cornick, J.W. and Stewart, J.E. (1973). Partial characterization of a natural agglutinin in the hemolymph of the lobster, Homarus americanus. J. Invertebr. Pathol., 21: 225-263. [ Links ]
Cornick, J.W. and Stewart, J.E. (1978). Lobster (Homarus americanus) hemocytes: Classification, differential counts, and associated agglutinin activity. J. Invertebr. Pathol., 31: 194-203. [ Links ]
Engstad, R.E. and Robertsen, B. (1994). Specificity of a β-glucan receptor on macrophages from Atlantic salmon (Salmo salar L.). Dev. Comp. Immunol., 18: 397-408. [ Links ]
Evans, L.H., Fotedar, S., Jussila, J., McBride, S. and Tsvetnenko, E. (2000). Immunological measures of stress in spiny lobster (Panulirus cygnus George). J. Shellfish Res., 19: 678-679. [ Links ]
Fuller, M. and Doolittle, R.F. (1971). Studies ofinvertebrate fibrinogen. I. Purification and characterization of fibrinogen of the spiny lobster. Biochem., 10: 1305-1310. [ Links ]
Gargioni, R. and Barraco, M.A. (1998). Hemocytes of the palaemonids Macrobrachium rosenbergii and M. acanthurus, and of the penaeid Penaeuspaulensis. J. Morphol., 236: 209-221. [ Links ]
Goarant, C. and Boglio, E. (2000). Changes in hemocyte counts in Litopenaeus stylirostris subjected to sublethal infection and to vaccination. J. World Aquacult. Soc., 31: 123-129. [ Links ]
Goldenberg, A.Z. and Greenberg, A.H. (1983). Functional heterogeneity of carbohydrate-binding hemolymph proteins: Evidence of nonagglutinating opsonin in Homarus americanus. J. Invertebr. Pathol., 42: 33-41. [ Links ]
Gómez-Jiménez, S., Uglow, R.F. and Gollas-Galvan, T. (2000). The effects of cooling and emersion on total haemocyte count and phenoloxidase activity of the spiny lobster Panulirus interruptus. Fish Shellfish Immunol., 10: 631-635. [ Links ]
Hall, J.L. and Rowlands, D.T. (1974). Heterogeneity of lobster agglutinins. I. Purification and physicochemical characterization. Biochem., 13: 821-832. [ Links ]
Hautton, C., Williams, J.A. and Hawkins, L.E. (1997). The effects of a live in vivo pathogenic infection on aspects of the immuno-competence of the common shore crab, Carcinus maenas (L.). J. Exp. Mar. Biol. Ecol., 211: 115-128. [ Links ]
Holmbland, T. and Söderhall, K. (1999). Cell adhesion molecules and antioxidative enzymes in a crustacean, possible role in immunity. Aquaculture, 172: 111-123. [ Links ]
Hose, J.E., Martin, G.G. and Gerard, A.S. (1990). A decapod hemocyte classification scheme integrating morphology, cytochemistry, and function. Biol. Bull., 178 : 33-45. [ Links ]
Johansson, M.W., Kallaya, P.K. and Söderhall, K. (2000). Crustacean haemocytes and haematopoiesis. Aquaculture, 191: 45-52. [ Links ]
Johnson, P.T., Stewart, E.J. and Arie, B. (1981). Histopathology of Aerococcus viridians var. homari infection (gaffkemia) in the lobster, Homarus americanus, and a comparison with histological reactions to a gram-negative species, Pseudomonas petrolens. J. Invertebr. Pathol., 38: 127-148. [ Links ]
Jussila, J.J., Jago, E., Tsevetnenko, B., Dunstan, B. and Evans, L.H. (1997). Total and differential hemocyte counts in western rock lobsters (Panulirus cygnus George) under post-harvest stress. Mar. Freshwater Res., 48: 863-867. [ Links ]
Jussila, J., Tsevetnenko, E., Evans, L.H. and Jago, E. (2000). Post-harvest handling in western rock lobster: hemocytes' point of view. J. Shellfish Res. 19: 677. [ Links ]
Kakinuma, A., Asano, T., Torri, H. and Sugino, Y. (1981). Gelation of Limulus amoebocyte lysate by an antitumor (1→3)-β-D-glucan. Biochem. Biophys. Res. Comm., 101: 434-439. [ Links ]
LaPeyre, J.F. and Chu, F.L. (1990). Blue crab hemocytes: A preliminary study. In: F.O. Perkins and T.C. Cheng (eds.), Pathology in Marine Sciences. Academic Press, San Diego, California, pp. 15-20. [ Links ]
Martin, G.G. and Graves, B.L. (1985). Fine structure and classification of shrimp heamocytes. J. Morphol., 185: 339-348. [ Links ]
Martin, G.G., Poole, D., Poole, C., Hose, J.E., Arias, M., Reynolds, L., McKrell, N. and Whang, A. (1993). Clearence of bacteria injected into the haemolymph of the penaeid shrimp, Scyonia ingentis. J. Invertebr. Pathol., 62: 308-315. [ Links ]
McKay, D. and Jenkin, C.R. (1970). Immunity in the invertebrates. The role of the serum factors in phagocytosis of the erythrocytes by hemocytes of the freshwater crayfish (Parachaeraps bicarinatus). Austr. J. Exp. Biol. Med. Sci., 48: 609-617. [ Links ]
Morita, T., Tanaka, S., Nakamura, T. and Iwanaga, S. (1981). A new (1 → 3)-β-D-glucan-mediated coagulation pathway found in Limulus amebocytes. FEBS Lett., 129: 318-321. [ Links ]
Nikl, L., Albright, L.J. and Evelyn, T.P. (1991). Influence en seven immunostimulants on the immune response of coho salmon to Aeromonas salmonicida. Dis. Aquat. Org., 12: 7-12. [ Links ]
Painter, T.J. (1983). Algal polysaccharides. In: G.O. Aspinall (ed.), The Polysaccharides. Vol. 2. Academic Press, New York, pp. 25-43. [ Links ]
Paterson, B.D. and Spanoghe, P.T. (1997). Stress indicators in marine decapod crustaceans, with particular reference to the grading of western rock lobsters (Panulirus cygnus) during commercial handling. Mar. Freshwater Res., 48: 829-834. [ Links ]
Paterson, W.D. and Stewart, J.E. (1974). In vitro phagocytosis by hemocytes of the American lobster (Homarus americanus). J. Fish. Res. Board Canada, 31: 1051-1056. [ Links ]
Paterson, W.D., Stewart, J.E. and Zwicker, B.M. (1976). Phagocytosis as a cellular immune response mechanism in the American lobster Homarus americanus. J. Invertebr. Pathol., 27: 95-104. [ Links ]
Phillips, H.J. (1973). Dye exclusion tests for cell viability. In: P.F. Kruse and M.K. Patterson (eds.), Tissue Culture Methods and Applications. Academic Press, New York, pp. 406-408. [ Links ]
Raa, J. (1996). The use of immunostimulatory substances in fish and shellfish farming. Rev. Fish. Sci., 4: 229-288. [ Links ]
Robertsen, B., Engstad, R.E. and Jorgensen, J.B. (1994). β-Glucans as immunostimulants in fish. In: J.S. Stolen. and T.C. Fletcher (eds.), Modulators of Fish Immune Responses. Vol. 1. SOS Publications. Fair Haven, New Jersey, pp. 83-99. [ Links ]
Smith, V.J. and Ratcliffe, N.A. (1978). Host defense reactions of the shore crab Carcinus means (L.), in vitro. J. Mar. Biol. Assoc. UK, 58: 367-379. [ Links ]
Smith, V.J. and Söderhall, K. (1983). β-1,3 glucan activation of crustacean hemocytes in vitro and in vivo. Biol. Bull., 164: 299-314. [ Links ]
Söderhall, K. (1992). Biochemical and molecular aspects of cellular communication in arthropods. Biol. Bull., 59: 141-151. [ Links ]
Söderhall, K. and Cerenius, L. (1992). Crustacean immunity. Ann. Rev. Fish Dis., 3-23.
Song, Y.L., Liu, J.J., Chan, L.L. and Sung, H.H. (1997). Glucan-induced disease resistance in tiger shrimp (Penaeus monodon). Dev. Biolog. Standar., 90: 413-421. [ Links ]
Spanoghe, P.T. and Bourne, P.K. (1997). Relative influence of environmental factors and processing techniques on Panulirus cygnus morbidity and mortality during simulated live shipments. Mar. Freshwater Res., 48: 839-844. [ Links ]
Stewart, J., Cornick, J.W. and Dingle, J.R. (1967). An electronic method for counting lobster (Homarus americanus Milne Edwards) hemocytes and the influence of diet on hemocyte numbers and hemolymph proteins. Can. J. Zool., 45: 291-304. [ Links ]
Stewart, J.E., Arie, B. and Marks, L. (1983). Hemocyte patterns during gaffkemia infections and induction of resistance in Homarus americanus. Intl. Comm. Sci. Exp. Med. Sea, 182: 126-129. [ Links ]
Sung, H.H., Chan, H.J., Her, C.H., Chan, J.C. and Song, Y.L. (1998). Phenoloxidase activity of hemocytes derived from Penaeus monodon and Macrobrachium rosenbergii. J. Invertebr. Pathol., 71: 26-33. [ Links ]
Takeda, K., Matsumoto, T. and Yamaguchi, K. (1998). Acute induction of interleukin-6 and biphasic changes of serum complement C3 by carrageenan in mice. Med. Inflamm., 7: 221-223. [ Links ]
Tsing, A., Arcier, J.M. and Bhehèlin, M. (1989). Hemocytes of penaeid and palaemonid shrimps: Morphology, cytochemistry, and hemograms. J. Invertebr. Pathol., 53: 64-77. [ Links ]
Unestam, T. and Söderhall, K. (1977). Soluble fragments from fungal cell walls elicit defense reactions in crayfish. Nature, 265: 45-46. [ Links ]
Vadstein, O. (1997). The use of immunostimulation in marine larvi-culture: Possibilities and challenges. Aquaculture, 155: 401-407. [ Links ]
Van de Braak, C.B., Taverne, N., Botterblom, H.A., van der Knaap, W.P. and Rombout, J.H. (2000). Characterization of different morphological features of black tiger shrimp (Penaeus monodon) haemocytes using monoclonal antibodies. Fish Shellfish Immunol., 10: 515-530. [ Links ]
Vijayakumaran, M. and Radhakrishnan, E.V. (1997). Live transport and marketing of spiny lobsters in India. Mar. Freshwater Res., 48: 823-828. [ Links ]
Williams, D.L., Yaeger, R.G., Pretus, H.A., Browder, I.W., McNamee, R.B. and Jones, E.L. (1989). Immunization against Trypanosoma cruzi: adjuvant effect of glucan. Intl. J. Immunopharm., 11: 403-410. [ Links ]
Wood, P. J. and Visentin, L.P. (1967). Histological and histochemical observations of the haemolymph cells in the crayfish, Oronconectes virilis. J. Morphol., 123: 559-568. [ Links ]
Yano, T., Matsuyama, H. and Mangindaan, R.E. (1991). Polysaccharide-induced protection of carp, Cyprinus carpio L., against bacterial infection. J. Fish Dis., 14: 577-582. [ Links ]
a Dirección actual: Departamento de Biotecnología Marina, CICESE, Ensenada, CP 22860, Baja California, México.














