Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Salud mental
Print version ISSN 0185-3325
Salud Ment vol.37 n.2 México Mar./Apr. 2014
Artículo original
La liberación de calcio de los depósitos intracelulares promueve la secreción de serotonina en terminales sinápticas
Calcium release from intracellular stores promotes serotonin secretion at synaptic terminals
Citlali Trueta1
1 Departamento de Neurofisiología. Subdirección de Investigaciones en Neurociencias, Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz.
Correspondencia:
Dra. Citlali Trueta.
Departamento de Neurofisiología.
Subdirección de Investigaciones en Neurociencias,
INPRFM. Calz. México-Xochimilco 101,
San Lorenzo Huipulco, Tlalpan,
14370, México, DF.
Teléfono: +52 55 4160 - 5100.
Fax: +52 55 5655 - 9980.
E-mail: ctrueta@imp.edu.mx
Recibido: 8 de octubre de 2013.
Aceptado: 15 de noviembre de 2013.
RESUMEN
En este trabajo se estudió la participación que tiene la liberación de calcio del retículo endoplásmico en la liberación de serotonina en terminales sinápticas. Los experimentos se llevaron a cabo en sinapsis formadas en cultivo entre neuronas serotonérgicas de Retzius y neuronas mecanosensoriales sensibles a presión, aisladas del Sistema Nervioso Central de la sanguijuela. En esta preparación la estimulación con pares de impulsos produjo facilitación sináptica. La estabilización de los receptores de rianodina en un estado de sub-conductancia por la incubación con rianodina 100 μM produjo un alargamiento del potencial sináptico en respuesta a impulsos presinápticos, sugiriendo que el calcio liberado por estos canales puede alcanzar las vesículas y promover la secreción. En contraste, el vaciamiento de los depósitos intracelulares de calcio con tapsigargina 500 nM produjo una disminución gradual de la facilitación sináptica ante impulsos presinápticos pareados y abolió la liberación extrasináptica en el axón neuronal en respuesta a trenes de impulsos. Todo esto ocurrió sin cambios en las propiedades de la membrana postsináptica, lo cual sugiere que la liberación de calcio intracelular participa en un mecanismo de retroalimentación positiva que promueve la liberación presináptica y perisináptica en las neuronas serotonérgicas.
Palabras clave: Serotonina, sinapsis, liberación de calcio inducida por calcio, facilitación, retículo endoplásmico.
ABSTRACT
This work analyses the role of intracellular calcium pools in serotonin release from nerve terminals. Experiments were carried out in synapses formed in culture between serotonergic Retzius neurones and pressure mechanosensory neurons, isolated from the Central Nervous System of the leech. In this configuration, serotonin is released from clear vesicles at synapses or from extrasynaptic dense core vesicles. Locking ryanodine receptors in a subconductance state by incubation with 100 μM ryanodine caused an elongation of the synaptic potential in response to a presynaptic action potential or to trains of them, suggesting that calcium released from the endoplasmic reticulum through these channels reaches the synaptic vesicles and may promote their fusion with the plasma membrane. By contrast, depletion of intracellular calcium pools by incubation with 500 nM thapsigargin gradually decreased paired-pulse synaptic facilitation and abolished extrasynaptic axonal serotonin release in response to trains of impulses. All this occurred without changes in the properties of the postsynaptic membrane, indicating that intracellular calcium release participates in a feedback mechanism that enhances presynaptic and perisynaptic release in serotonergic neurons.
Key words: Serotonin, synapse, calcium-induced calcium release, facilitation, endoplasmic reticulum.
INTRODUCCIÓN
La serotonina es un neurotransmisor y neuromodulador de gran relevancia en la regulación de diversas funciones fisiológicas y conductas en los animales a lo largo de toda la escala filogenética, incluyendo al ser humano. Por ejemplo, la conducta agresiva y el establecimiento de la dominancia social son reguladas por la serotonina desde los crustáceos1-3 hasta los primates,4-7 donde la serotonina regula también los estados de ánimo. La serotonina regula además la alimentación,8,9 el sueño, la atención,10 la ansiedad,11 los ritmos cir-cadianos,12 la conducta sexual13,14 y la generación de patrones motores rítmicos como la locomoción, la masticación y la respiración,14-17 entre muchos otros. En los humanos, las alteraciones en el sistema serotonérgico están relacionadas con trastornos conductuales y neurológicos que incluyen a los alimenticios, la depresión,18 la epilepsia,19 la esquizofrenia,20 y la ansiedad,21 por lo que estudiar cómo se regula su liberación en el Sistema Nervioso podría contribuir a desarrollar tratamientos para este tipo de patología.
Las neuronas serotonérgicas secretan esta monoamina a partir de las terminales sinápticas,22-24 donde actúa como neurotransmisor produciendo efectos rápidos y localizados sobre terminales postsinápticas en circuitos neuronales fijos, y también a partir de sitios extrasinápticos en el soma,25-30 el axón y las dendritas,31 donde actúa como modulador produciendo efectos lentos y difusos de tipo parácrino.
Debido a la complejidad anatómica de las neuronas serotonérgicas en los vertebrados, los mecanismos finos de la liberación sináptica de serotonina se han estudiado sobre todo en sinapsis formadas en cultivo entre neuronas identificadas aisladas del Sistema Nervioso Central de la sanguijuela Hirudo medicinalis.32,33 Las neuronas en cultivo, al ser isopotenciales, presentan grandes ventajas para estos estudios. Los mecanismos básicos de liberación en estas terminales sinápticas son similares a los de las sinapsis clásicamente estudiadas como la placa neuromuscular34 y la sinapsis gigante del calamar,35,36 es decir, la liberación ocurre de manera cuántica, dependiente del calcio y del potencial de membrana presináptico.37,38 En la zona activa de las terminales sinápticas la serotonina se libera a partir de vesículas sinápticas claras, de las cuales hay una poza lista para liberarse y una poza de reserva.39 Dependiendo de la probabilidad de liberación y de la cantidad de vesículas disponibles se presentan fenómenos de plasticidad a corto plazo como la facilitación y la depresión.40 Como en muchas otras terminales sinápticas, las vesículas claras en estas terminales están rodeadas de vesículas electrodensas que también contienen serotonina39,41 y la liberan en zonas perisinápticas o extrasinápticas, produciendo también efectos postsinápticos, aunque más lentos (Trueta y De-Miguel, en preparación).
Las terminales serotonérgicas contienen retículo endoplásmico, que es un depósito intracelular de calcio.42,43 El retículo endoplásmico almacena calcio en grandes concentraciones gracias a la función de una ATPasa que transporta activamente calcio del citoplasma hacia el lumen del retículo en contra de su gradiente de concentración.42 El calcio de este reservorio intracelular se puede liberar hacia el citoplasma a través de canales llamados receptores de rianodina que se abren en respuesta a incrementos moderados en la concentración citoplásmica de calcio, produciendo la llamada liberación de calcio inducida por calcio (CICR por sus siglas en inglés).43 Este mecanismo desempeña un papel fundamental en la secreción en las células endocrinas excitables44,45 y en algunos tipos neuronales se ha mostrado que contribuye a la liberación espontánea de neurotransmisor,46-48 así como a la facilitación sináptica47 y a la liberación en respuesta a trenes de impulsos.49,50 Además, en algunas neuronas que utilizan vesículas electrodensas la liberación de calcio de los depósitos intracelulares tiene una contribución importante en el incremento de la concentración de calcio intracelular en respuesta a la actividad eléctrica51 y participa en la movilización de estas vesículas hacia la membrana y su fusión con ésta para producir la secreción de péptidos.52-54 En el cuerpo celular de las neuronas serotonérgicas de Retzius la liberación de calcio inducida por calcio también tiene una contribución importante a la secreción somática al producir la movilización de las vesículas hacia la membrana55 (León-Pinzón et al. en preparación). La presencia de cisternas de retículo endoplásmico en las terminales sinápticas en estas neuronas sugiere que este mecanismo de liberación de calcio podría participar también en la regulación de la liberación sináptica de serotonina, pero esta participación no se ha estudiado. Si bien la secreción sináptica en respuesta a un impulso es muy rápida y es poco probable que tenga una contribución por parte de esta fuente de calcio, que se activa más lentamente, la liberación de calcio inducida por calcio podría participar en la movilización de vesículas claras de la poza de reserva y/o de las vesículas electrodensas que liberan en zonas perisinápticas en respuesta a la actividad eléctrica repetitiva.
En este trabajo estudiamos la participación de la liberación de calcio inducida por calcio en la liberación sináptica y perisináptica de serotonina en respuesta a pares y trenes de impulsos. Para ello utilizamos sinapsis formadas entre neuronas serotonérgicas de Retzius y neuronas mecanosensoriales sensibles a presión (células P), aisladas del Sistema Nervioso Central de la sanguijuela Hirudo medicinalis y haciendo contacto en cultivo. La neurona presináptica de Retzius se estimuló mediante la inyección de corriente con un electrodo intracelular y la liberación de serotonina se analizó a partir de los potenciales sinápticos registrados en la célula P postsináptica. La liberación de calcio del retículo endoplásmico fue promovida utilizando rianodina, que estabiliza los receptores de rianodina en un estado semi-abierto, o fue inhibida mediante el uso de la tapsigargina, que inhibe a la ATPasa de calcio del retículo endoplásmico, produciendo el vaciamiento del depósito intracelular mediante la fuga pasiva de calcio.
MATERIAL Y MÉTODOS
Aislamiento y cultivo neuronal
Se aisló la cadena de ganglios nerviosos que forma el Sistema Nervioso Central de la sanguijuela y se abrieron las cápsulas ganglionares utilizando pinzas finas. Después del tratamiento con colagenasa-dispasa (2mg/ml), se aislaron individualmente las neuronas de Retzius (Rz) y las neuronas sensibles a presión (P) mediante succión a través de una pipeta de vidrio. Las neuronas se sembraron sobre platos de cultivo (Falcon, primaria) cubiertos con concanavalina-A, colocando el muñón axonal de la neurona de Retzius en contacto con el soma de la neurona P. La figura 1A muestra una imagen de un par de neuronas Rz-P en cultivo. Las neuronas se registraron después de 2-7 días en cultivo.

Registro intracelular
La neurona presináptica se estimuló mediante la inyección de pulsos de corriente despolarizante a través de un micro-electrodo intracelular con una resistencia de 20-30 ΜΏ lleno de cloruro de potasio 3M, utilizando un amplificador intracelular (Getting, modelo 5) en modo de balance de puente. Se utilizaron pulsos con una duración de 100 ms para producir dos potenciales de acción o de 200 ms para producir trenes de 5-6 potenciales de acción. Los potenciales sinápticos se registraron en la célula P con un microelectrodo lleno de cloruro de cesio 2M. Las señales fueron adquiridas y digitalizadas con un convertidor Digidata 1322 (Axon Instruments) a 10 KHz para su análisis posterior.
Farmacología
Después de registrar los potenciales sinápticos en condiciones control, se adicionó al baño rianodina 100 μΜ o tapsigargina 500 nM. La rianodina, en la concentración que utilizamos, estabiliza el canal de los receptores de rianodina en un estado de sub-conductancia, produciendo una liberación lenta de calcio hacia el citoplasma.56-58 La tapsigargina bloquea las ATPasas que bombean el calcio hacia el interior del retículo endoplásmico, y al no compensarse la fuga pasiva de calcio, el depósito se vacía gradualmente.
Aplicación de serotonina por iontoforesis
Se llenaron microelectrodos similares a los utilizados para el registro intracelular con una solución de 5-hidroxitriptamina-HCl 150 mM. Para retener la serotonina en el electrodo se aplicó una corriente directa constante de -1 nA al electrodo. La punta del electrodo se colocó cerca del soma de la neurona P postsináptica. Para producir la salida de serotonina se aplicaron pulsos de corriente positiva de 2 nA con una duración de 200 ms.
RESULTADOS
En pares de neuronas Rz-P (figura 1A) que habían formado sinapsis, el disparo de un potencial de acción por la neurona presináptica de Retzius evocó un potencial sináptico en la neurona P postsináptica (figura 1B), producido por la liberación presináptica de serotonina. Mientras que un par de potenciales de acción producidos con un intervalo de 300 ms o más en la neurona presináptica produjo dos potenciales sinápticos de amplitud similar en la célula P (figura 1C), la reducción de este intervalo a 100 ms o menos, produjo facilitación sináptica, determinada por la presencia de un potencial sináptico compuesto de amplitud mayor que la suma de los dos potenciales sinápticos individuales (figura 1D).
Los botones sinápticos de las neuronas de Retzius contienen cisternas de retículo endoplásmico a una distancia mayor a 500 nm de las zonas activas (ver, por ejemplo, la figura 1 en la referencia 39). Por ello, para estudiar si la liberación de calcio de estos depósitos intracelulares participa en la liberación de neurotransmisor, fue necesario investigar si el calcio que se libera a través de los receptores de rianodina se difunde hasta los sitios donde están las vesículas. Para ello se registraron las respuestas postsinápticas tras el disparo presináptico de potenciales de acción sencillos, pareados y en trenes a una frecuencia de 20 Hz en condiciones control y entonces se indujo la salida continua de calcio del retículo endoplásmico hacia el citoplasma incubando pares de neuronas con rianodina 100 μΜ, que estabiliza los canales de los receptores de rianodina en un estado de sub-conductancia.56-58
En estas condiciones se produjo un alargamiento del 552 ± 174%, en la fase de caída del potencial sináptico, de 70.5 ± 28.9 ms en condiciones control (n=11; figura 2A, panel izquierdo, trazo negro) a 389.7 ± 100.3 ms después de cinco minutos (n=3; figura 2A, panel izquierdo, trazo gris). Para comprobar que este alargamiento del potencial sináptico no fue producido por un decaimiento gradual del estado de las neuronas a lo largo del tiempo, registramos las respuestas postsinápticas de pares de neuronas que no se trataron con rianodina. En estos casos, el tiempo medio de caída del potencial sináptico se incrementó sólo marginalmente a lo largo de cinco minutos de registro (figura 2B, triángulos negros) de 106.1 ± 21.6 ms a 131.2 ± 25.2 ms después de cinco minutos de registro (n=11).

El efecto de la rianodina fue más notable ante pares o trenes de impulsos en la neurona presináptica (figura 2). Con impulsos pareados, el potencial sináptico en presencia de rianodina se incrementó en un 436 ± 168%, de 140.82 ± 19.3 ms a 689.2 ± 271.3 ms (n=5), mientras que en los controles sólo cambió de 168 ± 34.6 ms a 188.5 ± 28.1 ms (n=13). Con trenes de cinco o seis impulsos a 20 Hz la rianodina incrementó el tiempo de caída del potencial sináptico en un 420 ± 105%, de 335.9 ± 116.7 ms a 1454.3 ± 325.8 ms (n=5), mientras que en condiciones control el cambio fue de 392.7 ± 108 ms a 441.9 ± 100.1 ms (n=8).
Para comprobar que los efectos de la rianodina no fueron causados por cambios en las propiedades eléctricas de la neurona postsináptica, se registraron respuestas de las células P antes y después de la aplicación del fármaco (figura 3). Los potenciales de acción producidos por pulsos despolarizantes en la neurona postsináptica en condiciones control (figura 3A, trazo negro) y en presencia de rianodina (figura 3A, trazo gris) fueron idénticos, descartando posibles efectos sobre la actividad eléctrica postsináptica inducidos por la rianodina. Además, la resistencia de entrada y la constante de tiempo de la membrana postsináptica ante un pulso de corriente hiperpolarizante también permanecieron sin cambios (figura 3B, trazo negro) en presencia de rianodina (figura 3B, trazo gris). Más aún, la respuesta de la neurona postsináptica a la aplicación de serotonina por iontoforesis tampoco fue alterada por la rianodina (figura 3C), descartando cambios en la sensibilidad postsináptica a la serotonina por el tratamiento con rianodina. Todo esto sugiere que el calcio que se libera del retículo endoplásmico a través de los receptores de rianodina alcanza los sitios de liberación en las terminales sinápticas y es capaz de promover la fusión de las vesículas con la membrana.

Para comprobar que la actividad eléctrica presináptica estimula la liberación de calcio inducida por calcio y este mecanismo participa en la liberación de serotonina, se vaciaron los depósitos intracelulares de calcio utilizando tapsigargina. Dado que dicho vaciamiento ocurre lentamente, se registraron las respuestas cada cinco minutos durante al menos 30 minutos.
Después de 15 minutos de incubación con tapsigargina se mantuvo la generación de potenciales sinápticos en respuesta a un impulso, pero el potencial sináptico compuesto en respuesta a impulsos pareados disminuyó en un 33%, mostrando una disminución en la facilitación sináptica después de 15 minutos de incubación con tapsigargina (figura 4A). Esto no fue causado por un decaimiento del estado de las neuronas, dado que en pares registrados en ausencia de tapsigargina la amplitud del potencial sináptico compuesto disminuyó sólo marginalmente incluso después de 45 minutos de registro (figura 4B).
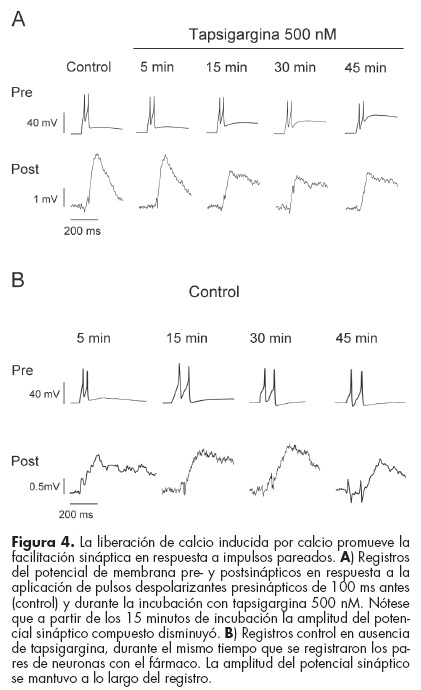
Este resultado sugiere que la liberación de calcio de los depósitos intracelulares desempeña un papel importante en la facilitación de la liberación sináptica de serotonina ante la actividad eléctrica repetitiva.
Algunos pares de neuronas Retzius-P no forman sinapsis, dado que no se producen potenciales sinápticos en respuesta a un impulso presináptico. Sin embargo, la estimulación sucesiva produce una despolarización lenta atribuible a la liberación de serotonina de las vesículas electrodensas perisinápticas (figura 5A, Control). En este tipo de conexiones la tapsigargina disminuyó gradualmente las respuestas postsinápticas hasta abolirlas por completo después de 20 minutos de incubación (figura 5A). Sin embargo, en pares de neuronas no tratadas con tapsigargina las respuestas se mantuvieron a lo largo de 30 minutos (figura 5B). Al igual que con la aplicación de rianodina las respuestas eléctricas de la neurona postsináptica no fueron afectadas por la incubación con tapsigargina (no se muestra). Estos resultados sugieren que la liberación de calcio de los depósitos intracelulares es fundamental para producir la movilización y la fusión de las vesículas electrodensas en sitios de liberación extrasináptica en el axón neuronal.

DISCUSIÓN
Los resultados mostrados en este trabajo indican que la liberación de calcio inducida por calcio modula la liberación sináptica y extrasináptica axonal de serotonina. El alargamiento de los potenciales sinápticos en pares de neuronas tratadas con rianodina sugiere que el calcio liberado del retículo endoplásmico a través de los receptores de rianodina alcanza las vesículas sinápticas y puede participar en su fusión retrasada con la membrana. Asimismo, la disminución de la liberación de serotonina después del vaciamiento de los depósitos intracelulares de calcio sugiere que la liberación de calcio inducida por calcio participa en la liberación de serotonina en las terminales en respuesta a la actividad eléctrica repetitiva.
La liberación de calcio del retículo endoplásmico desempeña un papel fundamental en el acoplamiento excitación-secreción en células endocrinas excitables44,45 y también en la liberación extrasináptica de neurotransmisores en el soma de varios tipos neuronales, incluyendo a las neuronas de Retzius,55,59-61 así como en células gliales.62 En particular la liberación de calcio inducida por calcio provee un mecanismo de retroalimentación positiva que amplifica las señales intracelulares de calcio producidas por la entrada transmembranal de este ión a través de canales dependientes de voltaje. A pesar de que en muchas neuronas se ha descrito la presencia de depósitos intracelulares de calcio e incluso su participación en la generación de señales postsinápticas en las dendritas,63-66 su papel en la liberación de neurotransmisor en las terminales presinápticas se ha estudiado poco. La presencia de retículo endoplásmico cerca de las terminales presinápticas de las neuronas serotonérgicas de Retzius sugiere que funcionalmente la liberación de calcio de estos compartimentos pudiera tener efectos sobre la movilización de las vesículas y la liberación de serotonina, como ocurre en neuronas parasimpáticas, cerebelares e hipocampales, en donde la liberación de calcio de los depósitos intracelulares favorece la liberación de transmisor.46,47,50 Sin embargo, dado que las cisternas del retículo endoplásmico no se encuentran muy cerca de las zonas de liberación y que la difusión del calcio en el citoplasma es limitada, era necesario investigar en primer lugar si el calcio liberado de este depósito alcanza los sitios de liberación para poder participar en la exocitosis. El alargamiento del potencial sináptico en presencia de rianodina sugiere que cuando se produce una liberación de calcio a través de los receptores de rianodina éste puede alcanzar las vesículas en los sitios de liberación y sostener la liberación de serotonina después de la estimulación eléctrica. La rianodina estabiliza a los canales de los receptores de rianodina en un estado de sub-conductancia en el que puede fluir calcio de manera continua, pero a una velocidad menor que a través del canal completamente abierto. En distintos tipos celulares de mamíferos, la rianodina, en la concentración utilizada en este trabajo, bloquea los receptores de rianodina, impidiendo que ocurra la liberación de calcio inducida por calcio. Sin embargo, las neuronas de la sanguijuela son poco sensibles a muchos fármacos utilizados para bloquear canales iónicos, por lo que no es sorpresivo que esta concentración alta de rianodina no bloquee los canales, sino que los estabilice en el estado semi-abierto, como hace la rianodina a concentraciones menores en células de mamífero. Sin embargo, para comprobar este efecto es necesario realizar mediciones de las señales intracelulares de calcio en respuesta a la estimulación eléctrica en presencia de rianodina en las neuronas de Retzius.
Dado que la rianodina se une a sus receptores por la parte interna de la membrana reticular, es necesario estimular a las neuronas eléctricamente para que se introduzca el compuesto y abra a los canales. Por ello es de esperarse que únicamente ocurra la liberación de calcio después de la estimulación eléctrica que produce la entrada de calcio transmembranal y con ello un incremento en la concentración citoplásmica de calcio suficiente para activar a los receptores de rianodina. Además, el efecto de la rianodina se observa decenas de milisegundos después del potencial de acción y es más evidente en respuesta a la estimulación repetitiva, presumiblemente porque el calcio que entra a través de la membrana necesita difundirse hasta el retículo endoplásmico para poder activar a los receptores de rianodina. Una vez que esto ocurre, el calcio liberado necesita también tiempo para difundirse hasta la zona activa. En el caso en que el calcio evoca la liberación de vesículas electrodensas, el esquema es más complejo y retrasado ya que estas vesículas no están en contacto con la membrana plasmática y su fusión requiere del transporte previo a la membrana, lo que añade un retraso al proceso.
En diversas preparaciones que se han utilizado para estudiar los mecanismos de liberación sináptica de neuro-transmisores la facilitación es producida por el calcio residual que permanece en la terminal después de un impulso nervioso cuando un segundo impulso ocurre antes de que la concentración de calcio haya regresado a sus niveles basales.34 Este es el caso de las neuronas de Retzius aquí estudiadas.40 La suma del calcio residual al calcio que entra por la membrana en respuesta a un segundo impulso incrementa la probabilidad de liberación del neurotransmisor,67 produciendo la fusión de un número mayor de vesículas con la membrana en respuesta al segundo impulso. La disminución gradual de la facilitación que se observó aquí después de vaciar la poza por la incubación con tapsigargina sugiere que la liberación de calcio inducida por calcio contribuye a la facilitación sináptica. Esto podría ocurrir si el calcio que se libera del retículo endoplásmico se suma al calcio residual, contribuyendo a incrementar la probabilidad de liberación. También es posible que el calcio liberado de los depósitos intracelulares promueva la movilización de vesículas de la poza de reserva hacia la poza liberable, incrementando el número de vesículas disponibles para liberar.
La inhibición que produjo la tapsigargina de las respuestas postsinápticas en los casos en que no se formaron sinapsis y únicamente ocurre liberación perisináptica, sugiere que la liberación de calcio de los depósitos intracelulares es necesaria para producir la movilización de las vesículas electrodensas hacia los sitios de liberación extrasináptica y su fusión con la membrana. La participación de la liberación de calcio inducida por calcio en la movilización de vesículas electrodensas ocurre también en el soma de las propias neuronas de Retzius durante la secreción somática,55 así como en otras preparaciones en donde la liberación ocurre a partir de este tipo de ve-sículas.53,68 Es posible que la liberación de calcio del retículo endoplásmico participe también en el proceso de fusión de las vesículas electrodensas con la membrana plasmática, ya que la entrada transmembranal de calcio en respuesta a la estimulación eléctrica posiblemente termina antes de que estas vesículas alcancen la membrana, mientras que la liberación de calcio intracelular es un proceso más lento, adecuado al curso temporal de movilización y fusión de este tipo de vesículas.
El vaciamiento de los depósitos intracelulares de calcio utilizando tapsigargina es una de las manipulaciones más comúnmente utilizadas para eliminar la contribución de estos depósitos y estudiar el papel que desempeñan en diversos fenómenos fisiológicos.42 Dado que el vaciamiento ocurre lentamente, fue necesario registrar las respuestas postsinápticas durante decenas de minutos, lo cual abre la posibilidad de que el estado de las neuronas decaiga a lo largo del tiempo. Sin embargo, las neuronas control que se registraron en ausencia del fármaco no presentaron un decaimiento significativo en la amplitud de los potenciales sinápticos en 30 minutos de registro, lo cual sugiere que los efectos observados en las neuronas tratadas con tapsigargina fueron específicamente producidos por el fármaco al vaciar los depósitos de calcio.
Dado que la disminución en la amplitud de las respuestas postsinápticas en presencia de tapsigargina ocurrió en aproximadamente 15 minutos y no se observaron cambios posteriormente, el vaciamiento de los depósitos intracelulares de calcio parece haberse completado en este tiempo.
Los efectos de la liberación de calcio del retículo endoplásmico parecen ser puramente presinápticos sobre la liberación del neurotransmisor y no sobre la sensibilidad de la membrana postsináptica a la serotonina o sobre sus propiedades eléctricas, ya que las características eléctricas de las neuronas P postsinápticas y su sensibilidad a la serotonina no fueron afectadas por la rianodina o por la tapsigargina.
En resumen, los resultados mostrados en este trabajo sugieren que la liberación de calcio inducida por calcio participa en un mecanismo de retroalimentación positiva que incrementa la liberación de neurotransmisor y ofrecen una explicación complementaria a la hipótesis del calcio residual.
REFERENCIAS
1. Livingstone MS, Harris-Warrick RM, Kravitz EA. Serotonin and octopamine produce opposite postures in lobsters. Science 1980;208:76-79. [ Links ]
2. Harris-Warrick RM, Kravitz EA. Cellular mechanisms for modulation of posture by octopamine and serotonin in the lobster. J Neuroscience 1984;4(8):1976-1993. [ Links ]
3. Kravitz EA. Serotonin and aggression: insights gained from a lobster model system and speculations on the role of amine neurons in a complex behavior. J Comparative Physiology. A sensory, Neural, Behavioral Physiology 2000;186(3):221-238. [ Links ]
4. Raleigh MJ, McGuire MT, Brammer GL, et al. Serotonergic mechanisms promote dominance acquisition in adult male vervet monkeys. Brain Res 1991;559:181-190. [ Links ]
5. Higley JD, Linnoila M. Low central nervous system serotonergic activity is traitlike and correlates with impulsive behavior. A nonhuman primate model investigating genetic and environmental influences on neurotransmission. Ann N Y Acad Sci 1997;836:39-56. [ Links ]
6. Ferris CF. Adolescent stress and neural plasticity in hamsters: a vaso-pressin-serotonin model of inappropriate aggressive behaviour. Exp Physiol 2000;85;Spec No:85S-90S. [ Links ]
7. Lesch KP, Merschdorf U. Impulsivity, aggression, and serotonin: a molecular psychobiological perspective. Behav Sci Law 2000;18:581-604. [ Links ]
8. Breisch ST, Zemlan FP, Hoebel BG. Hyperphagia and obesity following serotonin depletion by intraventricular p-chlorophenylalanine. Science 1976;192:382-385. [ Links ]
9. Saller CF, Stricker EM. Hyperphagia and increased growth in rats after intraventricular injection of 5,7-dihydroxytryptamine. Science 1976;192(4237):385-387. [ Links ]
10. Jacobs BL, Azmitia EC. Structure and function of the brain serotonin system. Physiol Rev 1992;72:165-229. [ Links ]
11. Zangrossi H Jr, Viana MB, Zanoveli J et al. Serotonergic regulation of inhibitory avoidance and one-way escape in the rat elevated T-maze. Neurosci Biobehav Rev 2001;25:637-645. [ Links ]
12. Prosser RA, Miller JD, Heller HC. A serotonin agonist phase-shifts the circadian clock in the suprachiasmatic nuclei in vitro. Brain Res 1990;534:336-339. [ Links ]
13. Hull EM, Lorrain DS, Du J et al. Hormone-neurotransmitter interactions in the control of sexual behavior. Behavioural Brain Research 1999;105(1):105-116. [ Links ]
14. Weiger WA. Serotonergic modulation of behaviour: a phylogenetic overview. Biological Reviews Cambridge Philosophical Society 1997;72(1):61-95. [ Links ]
15. McCall RB, Aghajanian GK. Serotonergic facilitation of facial motoneuron excitation. Brain Res 1979;169:11-27. [ Links ]
16. Jacobs BL, Fornal CA. 5-HT and motor control: a hypothesis. Trends Neurosci 1993;16:346-352. [ Links ]
17. White SR, Fung SJ, Jackson DA et al. Serotonin, norepinephrine and associated neuropeptides: effects on somatic motoneuron excitability. Prog Brain Res 1996;107:183-199. [ Links ]
18. Arango V, Underwood MD, Mann JJ. Serotonin brain circuits involved in major depression and suicide. Progress Brain Research 2002;136:443-453. [ Links ]
19. Jobe PC, Dailey JW, Wernicke JF. A noradrenergic and serotonergic hypothesis of the linkage between epilepsy and affective disorders. Crit Rev Neurobiol 1999;13:317-356. [ Links ]
20. Brieden T, Ujeyl M, Naber D. Psychopharmacological treatment of aggression in schizophrenic patients. Pharmacopsychiatry 2002;35(3):83-89. [ Links ]
21. Jenike MA, Rauch SL, Cummings JL et al. Recent developments in neurobiology of obsessive-compulsive disorder. J Clinical Psychiatry 1996;57(10):492-503. [ Links ]
22. Kiehn O, Rostrup E, Moller M. Monoaminergic systems in the brains-tem and spinal cord of the turtle Pseudemys scripta elegans as revealed by antibodies against serotonin and tyrosine hydroxylase. J Comp Neurol 1992;325:527-547. [ Links ]
23. Alvarez FJ, Pearson JC, Harrington D et al. Distribution of 5-hydroxy-tryptamine-immunoreactive boutons on alpha-motoneurons in the lumbar spinal cord of adult cats. J Comp Neurol 1998;393:69-83. [ Links ]
24. Moukhles H, Bosler O, Bolam JP et al. Quantitative and morphometric data indicate precise cellular interactions between serotonin terminals and postsynaptic targets in rat substantia nigra. Neuroscience 1997;76:1159-1171. [ Links ]
25. Trueta C, Méndez B, De-Miguel FF. Somatic exocytosis of serotonin mediated by L-type calcium channels in cultured leech neurones. J Physiology 2003;547 Pt2:405-416. [ Links ]
26. De-Miguel FF, Trueta C. Synaptic and extrasynaptic secretion of serotonin. Cell Mol Neurobiol 2005;25:297-312. [ Links ]
27. Colgan LA, Putzier I, Levitan ES. Activity-dependent vesicular monoamine transporter-mediated depletion of the nucleus supports somatic release by serotonin neurons. J Neurosci Off J Soc Neurosci 2009;29:15878-15887. [ Links ]
28. Kaushalya SK, Desai R, Arumugam S et al. Three-photon microscopy shows that somatic release can be a quantitatively significant component of serotonergic neurotransmission in the mammalian brain. J Neurosci Res 2008;86:3469-3480. [ Links ]
29. Sarkar B, Das AK, Arumugam S et al. The dynamics of somatic exocytosis in monoaminergic neurons. Front Physiol 2012;3. Available at: http://www.frontiersin.org/Membrane_Physiology_and_Biophysics/10.3389/fphys.2012.00414/abstract. Accessed February 13, 2013. [ Links ]
30. De Kock CPJ, Burnashev N, Lodder JC et al. NMDA receptors induce somatodendritic secretion in hypothalamic neurones of lactating female rats. J Physiol 2004;561:53-64. [ Links ]
31. Chazal G, Ralston HJ 3rd. Serotonin-containing structures in the nucleus raphe dorsalis of the cat: an ultrastructural analysis of dendrites, presynaptic dendrites, and axon terminals. J Comp Neurol 1987;259:317-329. [ Links ]
32. Nicholls JG, Kuffler DP. Quantal release of serotonin from presynaptic nerve terminals. Neurochem Int 1990;17:157-163. [ Links ]
33. Fernández-de-Miguel F, Drapeau P. Synapse formation and function: insights from identified leech neurons in culture. J Neurobiol 1995;27:367-379. [ Links ]
34. Katz B, Miledi R. The role of calcium in neuromuscular facilitation. J Physiol 1968;195:481-492. [ Links ]
35. Llinas R, Sugimori M, Silver RB. Microdomains of high calcium concentration in a presynaptic terminal. Science 1992;256:677. [ Links ]
36. Llinas R, Gruner, M, Sugimori M et al. Regulation by synapsin I and Ca(2+)-calmodulin-dependent protein kinase II of the transmitter release in squid giant synapse. J Physiol 1991;436:257-282. [ Links ]
37. Henderson LP, Kuffler DP, Nicholls J et al. Structural and functional analysis of synaptic transmission between identified leech neurones in culture. J Physiol 1983;340:347-358. [ Links ]
38. Dietzel ID, Drapeau P, Nicholls JG. Voltage dependence of 5-hydroxy-tryptamine release at a synapse between identified leech neurones in culture. J Physiol 1986;372:191-205. [ Links ]
39. Kuffler DP, Nicholls J, Drapeau P. Transmitter localization and vesicle turnover at a serotoninergic synapse between identified leech neurons in culture. J Comp Neurol 1987;256:516-526. [ Links ]
40. Stewart RR, Adams WB, Nicholls JG. Presynaptic calcium currents and facilitation of serotonin release at synapses between cultured leech neurones. J Exp Biol 1989;144:1-12. [ Links ]
41. Bruns D, Riedel D, Klingauf J et al. Quantal release of serotonin. Neuron 2000;28:205-220. [ Links ]
42. Pozzan T, Rizzuto R, Volpe P et al. Molecular and cellular physiology of intracellular calcium stores. Physiol Rev 1994;74:595-636. [ Links ]
43. Tsien RW, Tsien RY. Calcium channels, stores, and oscillations. Annu Rev Cell Biol 1990;6:715-760. [ Links ]
44. Lemmens R, Larsson O, Berggren PO et al. Ca2+-induced Ca2+ release from the endoplasmic reticulum amplifies the Ca2+ signal mediated by activation of voltage-gated L-type Ca2+ channels in pancreatic beta-cells. J Biol Chem 2001;276:9971-9977. [ Links ]
45. Kang G, Holz GG. Amplification of exocytosis by Ca2+-induced Ca2+ release in INS-1 pancreatic beta cells. J Physiol 2003;546:175-189. [ Links ]
46. Llano I, González J, Caputo C, et al. Presynaptic calcium stores underlie large-amplitude miniature IPSCs and spontaneous calcium transients. Nat Neurosci 2000;3:1256-1265. [ Links ]
47. Emptage NJ, Reid CA, Fine A. Calcium stores in hippocampal synaptic boutons mediate short-term plasticity, store-operated Ca2+ entry, and spontaneous transmitter release. Neuron 2001;29:197-208. [ Links ]
48. Simkus CRL, Stricker C. The contribution of intracellular calcium stores to mEPSCs recorded in layer II neurones of rat barrel cortex. J Physiol 2002;545:521-535. [ Links ]
49. Lauri SE, Bortolotto ZA, Nistico R, et al. A Role for Ca2+ Stores in Kainate Receptor-Dependent Synaptic Facilitation and LTP at Mossy Fiber Synapses in the Hippocampus. Neuron 2003;39:327-341. [ Links ]
50. Smith AB, Cunnane TC. Ryanodine-sensitive calcium stores involved in neurotransmitter release from sympathetic nerve terminals of the guinea-pig. J Physiol 1996;497(Pt 3):657-664. [ Links ]
51. Peng Y. Ryanodine-sensitive component of calcium transients evoked by nerve firing at presynaptic nerve terminals. J Neurosci J Soc Neurosci 1996;16:6703-6712. [ Links ]
52. Shakiryanova D, Tully A, Hewes RS et al. Activity-dependent liberation of synaptic neuropeptide vesicles. Nat Neurosci 2005;8:173-178. [ Links ]
53. Shakiryanova D, Klose MK, Zhou Y et al. Presynaptic ryanodine receptor-activated calmodulin kinase II increases vesicle mobility and potentiates neuropeptide release. J Neurosci J Soc Neurosci 2007;27:7799-7806. [ Links ]
54. Shakiryanova D, Levitan ES. Prolonged presynaptic posttetanic cyclic GMP signaling in Drosophila motoneurons. Proc Natl Acad Sci U S A 2008;105:13610-13613. [ Links ]
55. Trueta C, Sánchez-Armass S, Morales MA et al. Calcium-induced calcium release contributes to somatic secretion of serotonin in leech Retzius neurons. J Neurobiol 2004;61:309-316. [ Links ]
56. Lattanzio FA Jr, Schlatterer RG, Nicar M et al. The effects of ryanodine on passive calcium fluxes across sarcoplasmic reticulum membranes. J Biol Chem 1987;262:2711-2718. [ Links ]
57. McPherson PS, Kim YK, Valdivia H et al. The brain ryanodine receptor: a caffeine-sensitive calcium release channel. Neuron 1991;7:17-25. [ Links ]
58. Meissner G. Ryanodine activation and inhibition of the Ca2+ release channel of sarcoplasmic reticulum. J Biol Chem 1986;261:6300-6306. [ Links ]
59. Lambert RC, Dayanithi G, Moos FC et al. A rise in the intracellular Ca2+ concentration of isolated rat supraoptic cells in response to oxytocin. J Physiol 1994;478(Pt 2):275-287. [ Links ]
60. Lessmann V, Gottmann K, Malcangio M. Neurotrophin secretion: current facts and future prospects. Prog Neurobiol 2003;69:341-374. [ Links ]
61. Patel JC, Witkovsky P, Avshalumov MV et al. Mobilization of calcium from intracellular stores facilitates somatodendritic dopamine release. J Neurosci J Soc Neurosci 2009;29:6568-6579. [ Links ]
62. Hua X, Malarkey EB, Sunjara V et al. C(a2+)-dependent glutamate release involves two classes of endoplasmic reticulum Ca(2+) stores in astrocytes. J Neurosci Res 2004;76:86-97. [ Links ]
63. Llano I, Dreessen J, Kano M et al. Intradendritic release of calcium induced by glutamate in cerebellar Purkinje cells. Neuron 1991;7:577-583. [ Links ]
64. Kano M, Garaschuk O, Verkhratsky A, et al. Ryanodine receptor-mediated intracellular calcium release in rat cerebellar Purkinje neurones. J Physiol 1995;487(Pt 1):1-16. [ Links ]
65. Sun MK, Nelson TJ, Alkon DL. Functional switching of GABAergic synapses by ryanodine receptor activation. Proc Natl Acad Sci U S A 2000;97:12300-12305. [ Links ]
66. Emptage N, Bliss TV, Fine A. Single synaptic events evoke NMDA receptor-mediated release of calcium from internal stores in hippocampal dendritic spines. Neuron 1999;22:115-124. [ Links ]
67. Del Castillo, J, Katz B. Statistical nature of facilitation at a single nerve-muscle junction. Nature 1953;171:1016-1017. [ Links ]
68. Wong MY, Shakiryanova D, Levitan ES. Presynaptic ryanodine receptor-CamKII signaling is required for activity-dependent capture of transiting vesicles. J Mol Neurosci MN 2009;37:146-150. [ Links ]
Artículo sin conflicto de intereses














