Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.41 n.3 Texcoco Sep. 2023 Epub Oct 13, 2023
https://doi.org/10.18781/r.mex.fit.2304-2
Notas Fitopatológicas
Antagonismo in vitro de Trichoderma frente a Rhizoctonia solani
1 Agricultura Sustentable y Protegida, Universidad Tecnológica del Sur del Estado de Morelos (UTSEM). Carr. Puente de Ixtla-Mazatepec km 2.35, CP 62665, Puente de Ixtla, Mor., México;
2 Programa de Sanidad Forestal y Agrícola, Campo Experimental “Zacatepec”, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Carr. Zacatepec-Galeana km 0.5, CP 62780, Zacatepec, Mor., México;
3 Campo Experimental “Bajío”, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), Carr. Celaya-San Miguel Allende km 6.5, CP 38110, Celaya, Gto, México;
4 Universidad Politécnica de Francisco I. Madero. Tepatepec, CP 42660, Francisco I. Madero, Hidalgo, México;
Trichoderma spp., es un antagonista muy eficiente de patógenos de las raíces de papa. Rhizoctonia solani, causa pérdidas en varios cultivos agrícolas. El objetivo de este trabajo, fue evaluar in vitro la capacidad antagónica de T. viridie; T. koningii; T. harzanium y Trichoderma spp. frente a R. solani proveniente de un cultivo de papa. En las pruebas de confrontación, todos los aislamientos de Trichoderma se ubicaron en la clase 2 de antagonismo de la escala de Bell, donde T. harzianum y T. koningii mostraron más de 60% de inhibición del crecimiento radial de R. solani a las 120 h. En la interacción de T. harzianum y Trichoderma spp. con R. solani, como estrategia de micoparasitismo, se observó vacuolización, lisis, enrollamiento y penetración; las dos últimas presentes en todos los aislados evaluados de Trichoderma.
Palabras clave: Confrontación; micoparasitismo; biocontrol; biofungicida.
Trichoderma spp., is a highly efficient antagonist of root pathogens, such as Rhizoctonia solani, which causes loss in many crops. The aim of this research was to evaluate in vitro the antagonistic capacity of T. viride, T. koningii, T. harzianum and Trichoderma spp. isolates against R. solani from a potato crop. In confrontation tests, all Trichoderma isolates were classified as antagonists class 2 according to Bell scale, where T. harzianum and T. koningii showed more than 60% inhibition of the radial growth of R. solani at 120 h. In the interaction between T. harzianum and Trichoderma spp. with R. solani, as mycoparasitism strategy, vacuolization, lysis, coiling, and penetration were demonstrated, the last two were present in all Trichoderma isolates evaluated.
Key words: Confrontation; mycoparasitism; biocontrol; biofungicide.
La papa (Solanum tuberosum) es uno de los principales cultivos a nivel mundial, después de caña de azúcar (Saccharum officinarum), maíz (Zea mays), arroz (Oryza sativa) y trigo (Triticum spp.) (FAO, 2016). Las enfermedades que afectan a la papa, lo hacen en las raíces, tubérculos y hojas, lo que impide la formación adecuada del tubérculo; dentro de estas, se encuentra la costra negra causada por Rhizoctonia solani (Betancourth et al., 2021). Este patógeno infecta un gran número de plantas silvestres y cultivadas en México (DGSV-CNRF, 2020).
Para el control de R. solani, los productores aplican fungicidas sintéticos como Carbendazim, Fosfito de cobre y Tiabendazol (Alburqueque y Gusqui, 2018). El azoxistrobin y el propiconazol proporcionan un control eficaz de la enfermedad (Khan y Bolton, 2010). El control químico es inconveniente por su alta residualidad (Leadbeater y Gisi, 2010); por lo cual, se han investigado alternativas para el control de R. solani, entre las que se cuenta el control biológico.
El efecto antagónico de algunas especies de Trichoderma sobre R. solani fue descrito en 1932 (Weindling, 1932). Actualmente se utiliza para proteger a la planta de patógenos de la raíz y para estimular sus mecanismos de defensa (Korolev et al., 2008). Trichoderma parasita y elimina un amplio número de hongos que afectan a las plantas de interés agrícola (Romero-Arenas et al., 2017). El éxito y su empleo en la agricultura se debe a sus mecanismos de acción (Infante y Martínez, 2019).
El uso agrícola de especies de Trichoderma, es una alternativa tecnológica para la obtención de biofungicidas de alta calidad (Hernández-Mendoza et al., 2012; Companioni et al., 2019), que, a pesar de su potencial, su aplicación en México para el manejo de enfermedades en papa, ha sido escaso y los problemas con R. solani siguen vigentes. Por lo anterior, el objetivo de este trabajo fue evaluar in vitro la efectividad biológica de cuatro especies de Trichoderma como potenciales biofungicidas contra Rhizoctonia solani.
Se utilizaron aislamientos de T. viridie (Tv), T. koniingii (Tk), T. harzanium (Th) y Trichoderma spp. (Tspp.), procedentes del cepario de la Universidad Tecnológica del Sur del estado de Morelos. El aislamiento de R. solani, lo aportó el Campo Experimental Zacatepec, del INIFAP. Para el aislado de R. solani, se tomaron muestras infectadas por el hongo en el cultivo de la papa variedad Fiana proveniente de Toluca, Estado de México. Las plantas fueron lavadas con agua corriente para retirar el exceso de tierra; posteriormente, secciones con síntomas de un centimetro de diferentes partes de la planta fueron desinfestadas con hipoclorito de sodio al 3% durante 5 min y después enjuagadas con agua destilada estéril. Después se sembraron en cajas Petri con medio de cultivo agar dextrosa Sabouraud (MCD LAB) y se incubaron a 25 ± 2 °C durante 48 h. Se obtuvieron cultivos puros mediante la siembra de puntas de hifa con características y morfología de R. solani. Los aislamientos de Trichoderma y R. solani aquí descritos se encuentran acualmente en proceso de identificación molecular.
Para las evaluaciones, los hongos se mantuvieron en medio agar dextrosa Sabouraud a una temperatura de 25 ± 2 °C por 96 h (Trichoderma) y por 10 días (R. solani).
La competencia por espacio entre las especies de Trichoderma y R. solani, se evaluó utilizando el método de confrontación dual Bell et al. (1982), descrito por Martínez y Solano (1994). La evaluación se realizó en cajas Petri de 90 mm de diámetro, con medio agar dextrosa Sabouraud. Se sembraron individualmente discos de 5 mm de agar con micelio de Tv, Tk, Th y Tspp. a un centímetro del borde de cada caja Petri (réplica) y en el otro extremo un disco de 5 mm con crecimiento de R. solani. Como control se sembró R. solani sin presencia de Trichoderma. Se evaluaron cinco tratamientos con cinco repeticiones (cajas Petri) en un diseño completamente al azar. Las mediciones de crecimiento radial en confrontación se realizaron cada 24 h, hasta las 120 h a una temperatura de 25 ± 2 ºC.
La clasificación como antagonistas de los aislamientos Tv, Tk, Th y Tspp. frente a R. solani se realizó según la escala de cinco clases propuesta por Bell et al. (1982). El Porcentaje de Inhibición del Crecimiento Radial (PICR) se determinó con la fórmula PCIR=(R1-R2) / R1 x 100; donde R1 es el crecimiento radial de la colonia del fitopatógeno en el tratamiento control y R2 el crecimiento radial del aislamiento patógeno enfrentado al antagonista (Rahman et al., 2009). Los análisis estadísticos del PICR se realizaron con el software estadístico IBM SPSS® Statistics para Windows vs 25 (IBM Corp, Armonk, Nueva York, USA). Se comprobó la normalidad y homogeneidad de varianza mediante el test de Levene y Kolmogorov-Smirnov. Posteriormente, se procedió al análisis de varianza y a la prueba de comparación de medias de Tukey (p ≤ 0,01).
El micoparasitismo se observó en la zona de contacto entre ambos hongos (antagonista-patógeno) y se evaluó el tipo de interacción hifal (enrollamiento, penetración, vacuolización y lisis) (Chet et al., 1981). Para ello, se tomaron muestras con cinta adhesiva de la zona de interacción y después se colocaron en un portaobjeto con una gota de azul de lactofenol. Las muestras se observaron a 40X en un microscopio óptico (LABOMED, modelo CXL TRINOCULAR 9135007). Se realizaron tres preparaciones por réplica (caja Petri).
Los cuatro aislamientos de Trichoderma evaluados se ubicaron en la clase 2 de antagonismo de la escala de Bell et al. (1982) (Figura 1), con un crecimiento de más del 60% de la superficie sobre R. solani. Utilizando la misma escala, las evaluaciones in vitro de Pérez et al. (2020) mostraron que T. atroviride, T. konigiopsis y T. harzianum presentaron un sobre crecimiento mayor a 85% por encima de R. solani, clasificándolas en la clase 1 de antagonismo. Asimismo, frente a Botrytis sp. las cepas de T. koningii, T. atroviride, T. inhamatum y T. harzianum se clasificaron en la clase 1 (Acosta et al., 2021), al igual que T. asperellum y Trichoderma spp. contra B. cinerea (Pincay et al., 2021). El antagonismo entre hongos esta mediado por una serie de mecanismos de ataque y respuesta entre el biocontrolador y el patógeno. Trichoderma, posee una gran variedad de mecanismos de ataque; entre los más conocidos se encuentran el parasitismo, la antibiosis, la competencia por nutrientes y espacio, la liberación de enzimas que afectan el metabolismo de otros microorganismos, la activación de repuesta de defensa, la estimulación de la germinación y crecimiento (Morales-Mora et al., 2020).
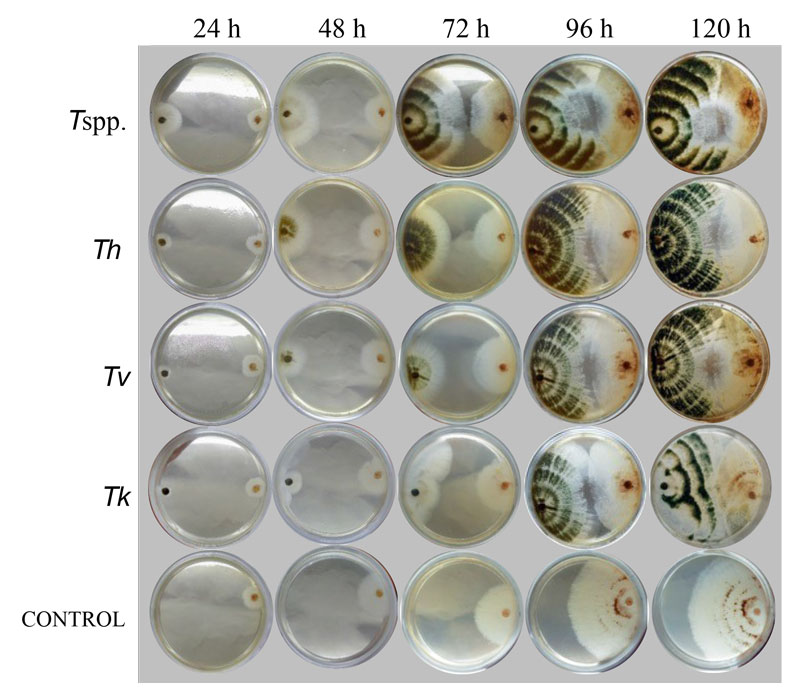
Figura 1 Confrontación de aislamientos de Trichoderma frente a R. solani en agar Sabouraud y evaluación de la inhibición del crecimiento radial de R. solani cada 24 h. Tspp.: Trichoderma spp., Th: T. harzanium, Tv: T. viridie, Tk: T. koningii, control: R. solani.
Todos los tratamientos mostraron un efecto antagónico superior al 50% a partir de las 96 h (Cuadro 1), observándose crecimiento sobre la colonia de R. solani (Figura 1). A las 120 h Tk, Th y Tspp. mostraron los mayores porcentajes de inhibición, todos con diferencias significativas en sus valores promedio (p ≤ 0,01). Los resultados muestran que estos presentan mayor velocidad de crecimiento a partir de las 72 h, por posibles metabolitos desprendidos por R. solani (Cuadro 1).
Cuadro 1 Inhibición del Crecimiento Radial (PICR) de Trichoderma sobre R. solani.
| Treatments | 24 h | 48 h | 72 h | 96 h | 120 h |
|---|---|---|---|---|---|
| Tspp. | 17.8 c | 26.2 c | 32.7 c | 55.1 c | 65.5 c |
| Th | 22.2 b | 27.9 b | 36.3 b | 57.3 b | 66.7 b |
| Tv | 11.1 d | 20.5 d | 29.8 d | 50.4 d | 57.0 d |
| Tk | 24.4 a | 31.2 a | 43.3 a | 61.2 a | 67.5 a |
| Es χ | 1.31* | 1.0* | 1.3* | 1.0* | 1.08* |
| CV (%) | 27.76 | 15.12 | 14.66 | 7.17 | 6.74 |
Tspp. = Trichoderma spp.; Th = T. harzanium; Tv = T. viridie; Tk = T. koningii; Es χ = error estándar de la media; CV = Coeficiente de variación. Letras distintas en la misma columna indican diferencias significativas según prueba de rangos múltiples de Tukey (p ≤ 0,01).
En otros ensayos in vitro, especies de Trichoderma mostraron una inhibición con Trichothecium sp., Cladosporium sp. y Fusarium sp. mayor al 50%; frente a Didymella bryoniae del 75% (Martínez et al., 2013). El uso de Trichoderma spp. cepa nativa TC05, en condiciones in vitro y en casa de malla demostró un alto potencial antagónico frente a Fusarium spp. (Rodríguez-Pinto et al., 2021). Establecer in vitro los mecanismos de acción presentes en los aislamientos de antagonistas, constituye la base de la selección de estos, no solo para las pruebas siguientes en condiciones semicontroladas y campo, sino que orientan la forma de producción que debe establecerse para lograr mayor estabilidad y eficacia en los resultados en campo.
En la Figura 2 se muestra la zona de confrontación entre Th y R. solani donde al igual que Tspp. se observaron cuatro tipos de interacción hifal con enrollamiento, penetración, vacuolización y lisis de hifas; mientras que Tv y Tk presentaron dos y tres tipos de interacción; respectivamente, siendo el enrollamiento y la penetración de hifas las estrategias de micoparasitismo utilizadas por todos los aislamientos de Trichoderma evaluados (Cuadro 2). Se ha descrito que la combinación de diferentes formas de micoparasitismo, favorece la acción de biocontrol sobre el fitopatógeno (Companioni et al., 2019).
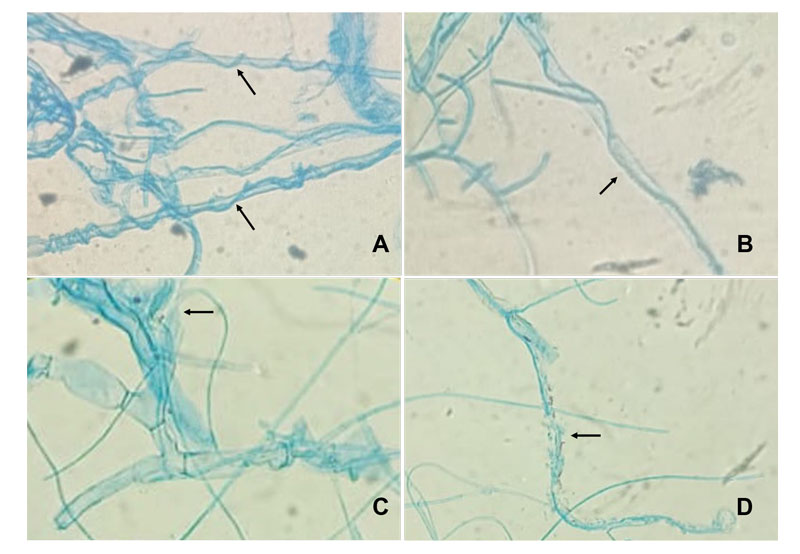
Figura 2 Mecanismos de acción antagónica de T. harzianum sobre R. solani: enrollamiento (A), penetración (B), vacuolización (C) y lisis (D).
Cuadro 2 Tipos de interacción hifal entre aislados de Trichoderma y R. solani.
| Treatments | Hyphal interaction type |
|---|---|
| Trichoderma spp. (Tspp.) | E-P-L-V |
| T. harzanium (Th) | E-P-L-V |
| T. viridie (Tv) | E-P |
| T. koningii (Tk) | E-P-L |
Leyenda: Enrollamiento (E), Penetración (P), Vacuolización (V) y Lisis (L).
Las especies de Trichoderma producen enzimas tales como ß-1,3-glucanasas, ß-1,6-glucanasas, quitinasas y proteasas, capaces de hidrolizar la pared celular de numerosos hongos (Ait-Lahsen et al., 2001). Durante este proceso, las hifas de Trichoderma crecen quimiotrópicamente hacia el huésped, una vez cerca del patógeno, comienza su adhesión y enrollamiento para finalizar con la actividad lítica.
Los resultados obtenidos en la confrontación dual de T. harzianum y T. koningii contra R. solani, mostraron altos porcentajes de inhibición del crecimiento radial. Así como, T. harzianum y Trichoderma spp. presentaron cuatro tipos de interacción hifal con el patógeno y todas las especies evaluadas se ubicaron en la clase 2 de la escala de Bell et al. (1982).
Todos aislados de Trichoderma mostraron niveles similares de antagonismo frente a R. solani; sin embargo, establecer in vitro la interacción con otras cepas de R. solani, diferentes hongos fitopatógenos y en los cultivos de origen ayudaría a la selección de especies de Trichoderma con las mejores características de parasitismo y control.
Cited literature
Acosta LT, Azania KD and Azania R. 2021. Cultivo dual in vitro de cepas nativas de Trichoderma spp. frente a Botrytis spp. patógeno de Passiflora ligularis Juss. Agropecuaria Science and Biotechnology 1: 43-55. http://revistas.untrm.edu.pe/index.php/RIAGROP/article/view/720/1022. [ Links ]
Ait-Lahsen H, Soler A, Rey M, De La Cruz J, Monte E and Llobell A. 2001. An antifungal exo-alpha-1,3-glucanase (AGN13.1) from the biocontrol fungus Trichoderma harzianum. Applied and Environmental Microbiology 67: 5833-5839. https://doi.org/10.1128/AEM.67.12.5833-5839.2001. [ Links ]
Alburqueque DA y Gusqui RM. 2018. Eficacia de fungicidas químicos para el control in vitro de diferentes fitopatógenos en condiciones controladas. Arnaldoa 25: 489-498. http://doi.org/10.22497/arnaldoa.252.25209. [ Links ]
Bell DK, Wells HD and Markham CR. 1982. In vitro antagonism of Trichoderma spp. against six fungal pathogens. Phytopathology 72: 379-382. https://www.apsnet.org/publications/phytopathology/backissues/Documents/1982Articles/Phyto72n04_379. PDF. [ Links ]
Betancourth CA, Sañudo BA, Flórez CA y Salazar CE. 2021. Manejo de la costra negra de la papa (Rhizoctonia solani) con el establecimiento de abonos verdes. Información Tecnológica 32: 165-174. http://dx.doi.org/10.4067/S0718-07642021000200165. [ Links ]
Chet I, Harman GE and Baker R. 1981. Trichoderma hamatum: its hyphal interactions with Rhizoctonia solani and Pythium spp. Microbial Ecology 7: 29-38. https://doi.org/10.1007/BF02010476. [ Links ]
Companioni GB, Domínguez AG y García VR. 2019. Trichoderma: su potencial en el desarrollo sostenible de la agricultura. Biotecnología Vegetal 19: 237-248. http://scielo.sld.cu/pdf/bvg/v19n4/2074-8647-bvg-19-04-237.pdf. [ Links ]
DGSV-CNRF. 2020. Dirección General de Sanidad Vegetal-Centro Nacional de Referencia Fitosanitaria. Pudrición de la raíz, Rhizoctonia solani. Sader-Senasica. Ficha técnica. https://www.gob.mx/cms/uploads/attachment/file/600968/Pudrición de la raíz.pdf. [ Links ]
FAO, Organización de la Naciones Unidas para la Alimentación y la Agricultura. 2016. Producción agrícola, Hortalizas. https://bit.ly/2L1KZxh (consulta, octubre 2021). [ Links ]
Hernández-Mendoza JL, Quiroz-Velázquez JD, Díaz-Franco A, García-Olivares JG, Bustamante-Dávila AJ and Gill-Langarica HR. 2012. Detection of metabolites in Flor de Mayo common beans (Phaseolus vulgaris L.) and their response to inoculation with Trichoderma harzianum. African Journal of Biotechnology 11: 11767-11771. https://www.ajol.info/index.php/ajb/article/view/129007. [ Links ]
Infante MD y Martínez CB. 2019. Actividad antagónica de Trichoderma asperellum Samuels, Lieckfeldt & Nirenberg sobre aislados de diferentes grupos anastomósicos de Rhizoctonia solani Kühn. Revista de Protección Vegetal 34: 1-7. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1010-27522019000200008. [ Links ]
Khan MFR and Bolton M. 2010. Management of Rhizoctonia root and crown rot of sugar beet. Plant Disease Management NDSU extension service. North Dakota State University. https://www.ag.ndsu.edu/publications/crops/management-of-rhizoctonia-root-and-crown-rot-of-sugar-beets. [ Links ]
Korolev N, Rav DD and Elad Y. 2008. The role of phytohormones in basal resistance and Trichoderma-induced systemic resistance to Botrytis cinerea in Arabidopsis thaliana. BioControl 53: 667-683. https://doi.org/10.1007/s10526-007-9103-3. [ Links ]
Leadbeater A and Gisi U. 2010. The challenges of chemical control of plant diseases. In: Gisi U, Chet I, Gullino ML (eds.) Recent developments in management of plant diseases. Dordrecht: Springer. 3-17. https://doi.org/10.1007/978-1-4020-8804-9_1. [ Links ]
Martínez B, Pérez J, Infante D, Duarte Y y Moreno M. 2013. Antagonismo de aislamientos de Trichoderma spp. frente a Didymella bryoniae (Fuckel) Rehm. Protección Vegetal 28: 192-198. http://scielo.sld.cu/pdf/rpv/v28n3/rpv05313.pdf. [ Links ]
Martínez B. y Solano T. 1994. Antagonismo de Trichoderma spp. frente a Alternaria solani (Ellis y Martin) Jones y Grout. Protección Vegetal.10:221-225. [ Links ]
Morales-Mora LA, Andrade-Hoyos P, Valencia-de Ita MA, Romero-Arenas O, Silva-Rojas HV y Contreras-Paredes CA. 2020. Caracterización de hongos asociados al cultivo de fresa y efecto antagonista in vitro de Trichoderma harzianum. Revista Mexicana de Fitopatología 38: 434-449. https://doi.org/10.18781/r.mex.fit.2005-7. [ Links ]
Pérez AA, Pérez MA, Martínez CB, Rollhaiser IN y Blengini MC. 2020. Selección de aislamientos de Trichoderma spp. in vitro como potenciales biofungicidas para el control de Rhizoctonia solani Kühnen la papa. Agriscientia 37: 21-33. https://doi.org/10.31047/1668.298x.v37.n2.29419. [ Links ]
Pincay A, Noboa M, Viera W, Herrera K, León A y Jackson T. 2021. Evaluación in vitro del potencial antagonista de Trichoderma spp. y hongos endófitos de mora (Rubus glaucus Benth) para el control de Botrytis cinerea. Journal of Science and Research: Revista Ciencia e Investigación 6: 109-124. https://dialnet.unirioja.es/servlet/articulo?codigo=8023668. [ Links ]
Rahman MA, Begum MF and Alam MF. (2009). Screening of Trichoderma isolates as a biological control agent against Ceratocystis paradoxa causing pineapple disease of sugarcane. Mycobiology 37(4): 277-285. https://doi.org/10.4489/MYCO.2009.37.4.277. [ Links ]
Rodríguez-Pinto ML, Campo-Arana RO, Cardona-Ayala CE, Manjarres-Cogollo EE y Rossi-Tordecilla BJ. 2021. Trichoderma spp. biocontrolador de marchitez vascular (Fusarium spp.) de la berenjena en el Caribe colombiano. Biotecnología en el Sector Agropecuario y Agroindustrial 19:158-169. https://doi.org/10.18684/bsaa.v19.n2.2021.1847. [ Links ]
Romero-Arenas O, Amaro JL, Damián MA, Valencia de Ita MA, Rivera A y Huerta M. 2017. Bio-preparados de Trichoderma spp. para el control biológico de Phytophthora capsici en el cultivo de tomate de Puebla, México. ITEA 113: 313-324. http://doi.org/10.12706/itea.2017.019. [ Links ]
Weindling R. 1932. Trichoderma lignorum as a parasite of other soil fungi. Phytopathology 22: 837-845. https://eurekamag.com/research/013/594/013594922.php. [ Links ]
Recibido: 16 de Abril de 2023; Aprobado: 18 de Agosto de 2023











 text in
text in 


