Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.41 n.2 Texcoco May. 2023 Epub Aug 11, 2023
https://doi.org/10.18781/r.mex.fit.2302-4
Artículos científicos
Identificación morfo-molecular del agente causal de la roña del aguacate en Michoacán
1 Facultad de Agrobiología Presidente “Juárez”, U.M.S.N.H. P.º Lázaro Cárdenas 2290, Emiliano Zapata, Uruapan, Michoacán, México, C. P. 60170.
2 Unidad de Biotecnología Vegetal, CONACYT-Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco A.C. Camino Arenero 1227, Zapopan, Jalisco. CP 45019, México.
3 Instituto de Investigaciones Agropecuarias y Forestales, IIAF. Carretera Morelia Zinapécuaro Kilómetro 9.5, Tarímbaro, Michoacán, México, C. P. 58880.
México es el principal productor y exportador de aguacate (Persea americana) en el mundo; sin embargo, las plagas y enfermedades son factores limitantes para la producción. Una de las enfermedades de gran importancia económica es la roña del aguacate, la cual se caracteriza por provocar lesiones de apariencia corchosa en el epicarpio de los frutos, lo que disminuye la calidad y precio hasta en un 60%. En este estudio, se realizó un muestreo dirigido a frutos de aguacate con daño en el epicarpio de aspecto corchoso, estos comúnmente conocidos en campo como “roña” y “mancha púrpura”. Para la identificación molecular y filogenética se utilizó una combinación de técnicas con claves morfológicas y marcadores moleculares (ITS1/ITS4, ITS5/ITS4, FE-1α/EF-1α, Sph1 F/Sph1R). También se realizaron pruebas de patogenicidad en frutos de plantas criollas y de las variedades Hass, Flor de María y Méndez. Mediante el análisis morfológico se identificaron a los hongos de los géneros Colletotrichum, Pestalotiopsis y Elsinoe. Con la identificación molecular y el análisis filogenético se corroboró la presencia de las especies Colletotrichum gloeosporioides y Elsinoe perseae. Colletotrichum gloeosporioides reprodujo síntomas similares al de la enfermedad roña del aguacate. Con la cepa identificada como E. perseae se corroboró el síntoma conocido en campo como “mancha púrpura”, mientras que Pestalotiopsis sp. provocó una necrosis descendente.
Palabras clave: Persea americana; Elsinoe perseae; Colletotrichum gloeosporioides; mancha púrpura
Mexico is the main producer and exporter of avocado (Persea americana) in the world; however, pests and diseases are limiting factors for production. One of the diseases of great economic importance is avocado scab, which is characterized by causing corky-looking lesions on the epicarp of the fruits, which decreases quality and price by up to 60%. In this study, a sampling was carried out aimed at avocado fruits with damage in the epicarp with a corky appearance, these commonly known in the field as “scab” and “purple spot”. For molecular and phylogenetic identification, a combination of techniques with morphological keys and molecular markers (ITS1/ITS4, ITS5/ITS4, FE-1α/EF-1α, Sph1 F/Sph1R) was used. Pathogenicity tests were also carried out on fruits in plants of Hass, Flor de María and Méndez varieties. Through morphological analysis, fungi of the genera Colletotrichum, Pestalotiopsis and Elsinoe were identified. Molecular identification and phylogenetic analysis confirmed the presence of the species Colletotrichum gloeosporioides and Elsinoe perseae. C. gloeosporioides reproduced symptoms similar to the avocado scab disease. With the strain identified as E. perseae, the symptom known in the field as purple spot was confirmed, while Pestalotiopsis sp. caused descending necrosis.
Keywords: Persea americana; Elsinoe perseae; Colletotrichum gloeosporioides; purple spot
El aguacate (Persea americana) es de gran importancia en la economía de México por la captación de divisas, siendo uno de los principales productos agrícolas de exportación (SIAP, 2022); sin embargo, las plagas y enfermedades causan pérdidas importantes en este cultivo (Urrea y Cardona, 2020). Una de las enfermedades que afecta la calidad del fruto es la denominada roña del aguacate, que provoca daños en el epicarpio de los frutos de aguacate manifestándose con lesiones de apariencia corchosa (Everett et al., 2011). Las capas de tejido de apariencia corchosa se forman como estructuras histológicas de defensa de las plantas al ser atacadas por un patógeno (Cruz et al., 2006).
Elsinoe perseae es el hongo que desde 1934 se ha relacionado con la sintomatología causada por la enfermedad roña del aguacate (Everett et al., 2011; Fan et al., 2017); sin embargo, existe una confusión de los daños que provoca este patógeno con los ocasionados por otros factores bióticos (ejemplo; alta incidencia de trips y ácaros) y abióticos (ejemplo; daños mecánicos, daños por rozadura de viento etc.) (SENASICA, 2018).
Jenkins reportó que la roña del aguacate es causada por E. persea y describió la sintomatología como lesiones de manchas oscuras redondas o irregulares que, al unirse, pueden cubrir parcial o totalmente al fruto de aguacate, dando un aspecto corchoso de color café (Everett et al., 2011; Fan et al., 2017). Por su parte Morales (2017) describió un síntoma similar al cual denominó mancha púrpura en el cual se presentan lesiones redondas iniciales de color púrpura que, al crecer, adquieren una coloración más oscura y que al coalecer dan el aspecto de roña. Sin embargo, otros autores, como Djeugap et al. (2015), Martínez-Hernández et al. (2017) y Becerra y Morales (2019), no asociaron a E. perseae al síntoma de la roña del aguacate, relacionando a otros patógenos como Colletotrichum sp., Alternaria sp., Pestalotiopsis sp., Nigrospora sp. y Curvularia sp.
Debido a esta confusión, el objetivo de este estudio fue identificar morfológica y molecularmente a los patógenos relacionados con el síntoma de la roña del aguacate, realizando muestreos dirigidos a los frutos de aspecto corchoso que comúnmente en campo son conocidos como “roña típica” y “mancha púrpura”. También se realizaron pruebas de patogenicidad para esclarecer al agente causal de esta enfermedad.
Materiales y métodos
Sitios de colecta. Se colectaron en diferentes huertos de Michoacán frutos de aguacate con síntomas de aspecto corchoso que en campo son conocidos comúnmente como “roña típica” y “mancha púrpura” (Figura 1). Después de la colecta, los frutos se colocaron en bolsas de papel estraza (26 x 12.5 x 6.5 cm) para evitar la humedad y el desarrollo de hongos saprofitos.

Figura 1 Frutos de aguacate con síntomas conocidos en campo como roña típica (A) y mancha púrpura (B).
Para la colecta de los frutos de aguacate, las áreas agroecológicas se dividieron de acuerdo con la altitud (metros sobre el nivel del mar; m.s.n.m.) que, según Anguiano et al. (2007) destacan tres tipos de climas para el desarrollo favorable de este cultivo y expresar su máximo potencial productivo: húmedo (entre 1,600 y 1,800 m.s.n.m.), semicálido subhúmedo (entre 1,200 y 1,600 m.s.n.m.) y templado subhúmedo (entre 1,900 y 2,300 m.s.n.m.) (Cuadro 1).
Aislamiento de los hongos. Los frutos de aguacate colectados en campo se lavaron con agua corriente y posteriormente se enjuagaron en agua destilada para eliminar contaminantes. Se tomaron lesiones frescas del epicarpio del fruto en fragmentos de 5 × 5 mm. Para la desinfección de los frutos, se utilizó la metodología propuesta por Zhi Li et al. (2008), con algunas modificaciones. Los fragmentos del epicarpio de los frutos de aguacate se colocaron en hipoclorito de sodio al 6% durante 90 s, seguido de un enjuague con agua destilada estéril. Posteriormente, se realizó un segundo lavado con etanol al 70% durante 60 s y un último enjuague con agua destilada estéril. El tejido se colocó en toallas de papel esterilizadas para absorber la humedad. Una vez que los fragmentos del material vegetal se desinfectaron, se realizó la siembra en cajas Petri con medio de cultivo PDA, de manera equidistante, las cajas se sellaron con parafilm, se incubaron a 28 °C, con 80% de humedad, durante 72 h. Después de este tiempo, las cajas Petri se revisaron para observar el crecimiento de los hongos.
Cuadro 1 Sitios de colecta de frutos de aguacate con síntomas de “roña típica” y “mancha púrpura”.
| Áreas agroecológicas (m.s.n.m.) | Sitios de colecta | Coordenadas | Altura m.s.n.m |
|---|---|---|---|
| Semicálido subhúmedo (1,200 y 1,600) | Cerro colorado | 19°31’69”N, 100°46’58”O | 1,243 |
| Ordeñitas | 19°23’50”N, 102°18’94”O | 1,060 | |
| Patuan | 19°39’16”N, 101°91’50”O | 1,260 | |
| Zumpimito | 19°37’29”N, 100°55’4”O | 1,600 | |
| Ziracuaretiro | 19°43’57”N, 101°92’93”O | 1,380 | |
| Taretan | 19°33’38”N, 101°918’33”O | 1,130 | |
| Mesa de Cazares | 19°37’75”N, 101°85’39”O | 1,560 | |
| San Ángel Zurumucapio | 19°44’77”N, 101°88’86”O | 1,600 | |
| Pareo | 19°33’13”N, 102°45’08”O | 1,430 | |
| Jicalan | 19°38’33”N, 102°07’61”O | 1,600 | |
| Húmedo (entre 1,600 y 1,800) | Zacandaro | 19°35’94”N, 102°18’58”O | 1,700 |
| Cutzato | 19°36’63”N, 102°13’47”O | 1,700 | |
| Toreo el alto | 19°46’00”N, 102°00’30”O | 1,800 | |
| La Basilia | 19°46’25”N, 102°06’50”O | 1,860 | |
| San Andrés Coru | 19°46’75”N, 101°94’50”O | 1,700 | |
| San Juan Nuevo | 19°41’66”N, 102°12’86”O | 1,880 | |
| Templado subhúmedo (entre 1,900 y 2,300) | Ario de Rosales | 19°20’72” N, 101°70’80”O | 1,910 |
| Canacuas | 19°64’38” N, 102°04’83”O | 2,200 | |
| Tingambato | 19°50’19” N, 101°85’25”O | 1,980 | |
| Zirahuen | 19°54167”N, 101°73’19”O | 2,090 | |
| Tancitaro | 19°33’75”N, 102°36’30”O | 2,080 | |
| El Durazno | 19°08’25”N, 101°66’00”O | 2,080 | |
| Lagunillas | 19°56’25”N, 101°41’58”O | 2,100 | |
| Cheran | 19°68’66”N,101°95’47”O | 2,380 | |
| Salvador Escalante | 19°40’64”N,101°64’00”O | 2,239 |
Identificación morfológica. Para la identificación de los aislamientos de los hongos se utilizaron las claves de Barnett y Hunter (2006). Para identificar a E. perseae se tomó como referencia la cepa ATCC 11190 de esta especie, la cual se encuentra depositada en el cepario de Miami, Florida, EUA y que fue facilitada por el Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco, A.C. (CIATEJ), Zapopan, Jalisco, México.
Identificación molecular. Los aislamientos purificados del hongo se trasladaron al CIATEJ para la extracción de ADN mediante la ruptura de la pared y membrana celular. La solución amortiguadora fue CTAB (bromuro de hexadeciltrimetilamonio) para favorecer la lisis celular. Se utilizó cloroformo-alcohol isoamílico (en proporción 24:1) como disolvente orgánico y se centrifugó a 5,000 rpm durante 10 min para favorecer la desnaturalización y separación de proteínas. Se procedió con la precipitación del ADN y se verificó su calidad mediante electroforesis en un gel de agarosa al 1.0 %.
La concentración del ADN genómico se cuantificó con un Nanodrop y se ajustó a 20 ng mL-1. La amplificación del ADN se realizó mediante PCR, usando los iniciadores ITS-5/ITS-4, ITS1/ITS4, EF-1α F/ EF-1α R y Sph1F/Sph1R. Las amplificaciones de los productos de la PCR se verificaron por electroforesis con 5μL de muestra en un gel de agarosa al 1.5 %. La purificación de los productos de PCR se realizó siguiendo las instrucciones del fabricante (Wizard® SV Gel and PCR Clean-Up System, Promega®). Los fragmentos amplificados se enviaron al laboratorio de Macrogen (Seúl, Corea del Sur) para su secuenciación.
Las secuencias bidireccionales se alinearon con los programas Geneious prime v. 2021.0.3 (Kearse et al., 2012) y MAFFT v.7.475 (Katoh y Standley, 2013), se corroboraron en BioEdit (Hall, 1999) con la finalidad de obtener una secuencia consenso y la secuencia obtenida se ensambló y comparó con las disponibles en la base de datos del Centro Nacional de Información Biotecnológica (NCBI), usando la herramienta BLAST para secuencias altamente similares.
Para la identificación con BLASTn se consideró el porcentaje de cobertura y similitud, se consideraron valores ≥80% de cobertura y un rango de 97 a 100 % de similitud de la secuencia. Es decir, hasta 3% de divergencia de la secuencia para asignar una especie (Raja y Oberlies, 2017).
Análisis filogenético. Se realizó un análisis filogenético multilocus para los aislamientos identificados como E. perseae, utilizando las secuencias obtenidas con los iniciadores ITS5/ITS4 o ITS1/ITS4, SPh1 F/SPh1 R (LSU) y EF-1α F/ EF-1α R. Para este análisis se utilizaron secuencias de especies del género Elsinoe ya depositadas en la base de datos del GenBank®. En el caso de los aislamientos obtenidos de “roña típica” se realizó un análisis basado en la secuenciación de los iniciadores ITS4/ITS5.
Una vez obtenidas las secuencias consenso, éstas se compilaron en formato FASTA. Después, las secuencias se alinearon con el programa MAFFT v.7.475 (Katoh y Standley, 2013). Las secuencias de los genes LSU, EF-1α e ITS obtenidas de las cepas identificadas como E. perseae se concatenaron en el programa MESQUITE v.3.6 (Maddison y Maddison, 2016). El análisis filogenético se basó en el algoritmo de inferencia bayesiana (BI) y previamente se determinó el modelo evolutivo en el programa JModeltest 2.1.7 (Nylander, 2004).
Para el análisis filogenético de las cepas identificadas como Colletotrichum gloeosporioides se utilizó la secuencia obtenida con los iniciadores ITS5/ITS4, así como secuencias de especies homólogas y otras pertenecientes al mismo género obtenidas del GenBank. Para la ubicación de los aislamientos se utilizó el programa MrBayes 3.2.7 (Ronquist et al., 2012) con un modelo evolutivo Jukes Cantor (JC) obtenido en el programa JModeltest 2.1.7 (Nylander, 2004). Se consideraron 10,000 generaciones y se tomaron muestras de árboles cada 1,000 repeticiones. Se ejecutó bajo el modelo Markov Monte Carlo (MCMC) y el análisis se detuvo una vez que se obtuvo un promedio y la desviación estándar (se) de partición de frecuencias entre cadenas, menor a 0.01 (se = 0.0099). Se obtuvieron 22 árboles filogenéticos de los cuales se muestrearon 18, se descartó el 25 % de los árboles. El resto de los árboles filogenéticos se combinaron para calcular la probabilidad posterior y obtener un árbol consenso (Holder y Lewis, 2003). Se utilizó como grupo externo a la especie C. boninense, cepa 126, perteneciente a otro complejo del mismo género.
Para la especie E. perseae se realizó un análisis filogenético multilocus para aportar mayor confiabilidad y soporte a la identificación de los aislados de este hongo. Se consideraron las secuencias obtenidas en esta investigación, las secuencias homólogas y de otras especies del mismo género que ocasionan daños similares en otras especies de plantas. Como grupo externo se utilizó al hongo Myriangium hispanicum que pertenece a la familia Myringiaceae. Las secuencias se obtuvieron de la base de datos del GenBank, según Fan et al. (2017). Una vez obtenidas las secuencias, se creó un archivo en formato FASTA. Las secuencias se alinearon con el programa MAFFT v.7.475 (Katoh y Standley, 2013) para cada gen. La concatenación de los genes se realizó con el programa Geneious prime v. 2021.0.3 (Kearse et al., 2012) y MESQUITE v.3.6 (Maddison y Maddison, 2016). El modelo evolutivo se obtuvo con el software JModeltest 2.1.7 (Nylander, 2004). El análisis filogenético se realizó mediante el algoritmo de IB con el programa MrBayes v. 3.2.7 (Ronquist et al., 2012). Se consideraron 575,000 generaciones y se tomaron muestras de árboles cada 1,000 repeticiones. Se ejecutó bajo el modelo MCMC y el análisis se detuvo una vez que se obtuvo un promedio y desviación estándar de partición de frecuencias entre cadenas menor a 0.01 (de = 0.0097). Se obtuvieron 1,152 árboles filogenéticos de los cuales se muestrearon 864, se descartó el 25 % de los árboles muestreados. El resto de los árboles se combinaron para calcular la probabilidad posterior y obtener un árbol consenso (Holder y Lewis, 2003).
Pruebas de patogenicidad. Para evaluar la patogenicidad, se utilizaron 25 plantas de aguacate (criollo, Hass, Flor de María, Méndez) de vivero de aproximadamente 18 meses de haber sido injertadas. Los frutos de aguacate se inocularon cuando tenían un tamaño de 6-9 cm de largo por 4-6 cm de ancho (etapa de llenado de fruto). Los aislamientos seleccionados para las pruebas de patogenicidad fueron las que tuvieron un porcentaje mayor de crecimiento de cada síntoma muestreado. Se inocularon hojas, ramas y frutos de cada planta de cada variedad.
Se realizaron dos tipos de inoculación: directa e indirecta. La primera consistió en realizar heridas en el epicarpio del fruto y en los tallos jóvenes con un alfiler entomológico del número 0. Posteriormente, se colocaron discos (≈ 1 cm de diámetro) de micelio de los hongos aislados sobre la herida, y se cubrió con algodón húmedo con agua destilada estéril y plástico “kleen pack”. En el método indirecto se realizaron pequeñas heridas a los frutos y a las ramas jóvenes, después se asperjó una suspensión con conidios, esporas y fragmentos de micelio a una concentración de 1 x 106 propágulos mL-1 que se preparó según Gilchrist Saavedra et al. (2005). Finalmente, las plantas se cubrieron con una bolsa de plástico a manera de cámara húmeda durante tres días. En las diferentes variedades se evaluó la incidencia del síntoma.
Los frutos inoculados se observaron cada semana, durante tres meses para detectar la presencia de los síntomas. Después se realizaron reaislamientos de los hongos para corroborar la identidad del patógeno.
Resultados y discusión
Identificación morfológica. De la siembra del tejido vegetal con síntoma de “roña típica” se obtuvieron 16 aislamientos diferentes, ocho se identificaron como posibles hongos fitopatógenos, los cuales corresponden a los géneros Colletotrichum, Pestalotiopsis, Fusarium, Curvularia, Alternaria, Leptosphaerulina, Cladosporium y Epicoccum. De éstos, el género Colletotrichum fue el más frecuente observándose su crecimiento en el 90% de las cajas, seguido de Pestalotiopsis en 40% de estas y el resto de los hongos no superó el 3%. Estos datos concuerdan con los trabajos de Djeugap et al. (2015), Alfaro et al. (2017) y Becerra (2019), quienes reportaron la presencia de especies del género Colletotrichum con mayor frecuencia en aislamientos del síntoma de la roña del aguacate.
Con base en los estudios realizados por Hernández y Gonzáles (2010) y Pérez et al. (2016), se descartaron las ocho especies restantes por su menor frecuencia de desarrollo de colonias (presencia en un máximo en tres cajas sembradas), así como por la identificación como hongos contaminantes para el caso de los géneros Aspergillus, Penicillium y Trichoderma.
En la identificación morfológica de la cepa con mayor frecuencia de crecimiento, se observó el desarrollo de colonias blancas con el centro gris, de textura algodonosa, con producción de masas conidiales de color naranja en el centro. Se caracterizó por ser una colonia de rápido crecimiento (en ocho días cubrió la caja Petri de 15 cm de diámetro). En sus características microscópicas, se observó micelio septado, conidios unicelulares alargados, casi cilíndricos con un ligero estrechamiento en el centro que da la apariencia de un septo y con extremos redondeados (Barnett y Hunter, 1998). Estas características coinciden con las referidas para el género Colletotrichum perteneciente al Phylum Ascomycota, Clase Hypocreomycetidae y Orden Glomerellales (Réblová et al., 2011) (Figura 2).
El segundo aislamiento con mayor porcentaje de crecimiento, Pestalotiopsis sp., desarrolló colonias blancas de micelio septado con un crecimiento rocetado. Además, se observó el desarrollo de cuerpos fructíferos de color negro que presentaron conidios multicelulares fusiformes (de 3 a 5 células) con tres flagelos apicales y uno basal (Barnett y Hunter, 2006). Estas características coincidieron con las referidas para este género que pertenece al Phylum Ascomycota, Clase Sordariomycetes y Orden Xylariales (Réblová et al., 2011) (Figura 2).
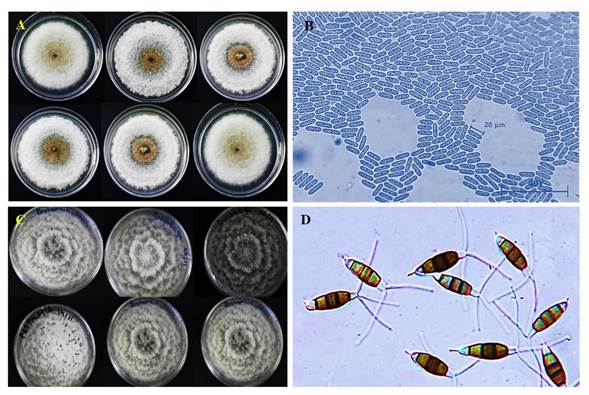
Figura 2 A) Aislamientos del género Colletotrichum sp. que muestran el crecimiento algodonoso con alto contenido de formación en el centro de propágulos cerosos de color naranja a rosado. B) Formación de conidios hialinos, ovoides u oblongos de forma acortada con terminación circular uniforme de 25- 30 μm. C) Colonias de Pestalotiopsis sp. y desarrollo de cirrus color negro brillante y de forma irregular. d) Conidios con septos y tres flagelos.
Síntoma de “mancha púrpura.” Del tejido vegetal con síntoma de “macha púrpura”, se obtuvieron 25 aislamientos, en los cuales las colonias con mayor frecuencia fueron las de crecimiento en estroma tipo viscoso y cerebriforme, lento crecimiento de 0.35 mm por día, con elevaciones en el centro, con gran variabilidad de formas y colores naranjas claro, amarillo claro, que con la edad se oscurecieron tornándose rojos cafés rojizos, algunas de apariencia afelpada, micelio aéreo y humedad en el centro, con presencia de micro y macro conidios que fueron de los 3-14 micras y micelio turuloso, estas fueron identificadas morfológicamente como Elsinoe sp., ya que estas características concuerdan con lo expuesto por Hyde et al. (2013), como características del género Elsinoe. También se identificó con crecimientos esporádicos (1-2%) a Colletotrichum sp. y Alternaria sp, (Figura 3).

Figura 3 A) Variabilidad en color y forma de crecimiento de los aislados de E. perseae. B) micelio turuloso. C) y D) conidios de 3-14 micrometros.
Identificación molecular. Mediante la amplificación de los iniciadores ITS5/ITS4 se identificó a C. gloeosporioides; sin embargo, para Pestalotiopsis sp. los resultados de la secuenciación no fueron concluyentes (Cuadro 2). Por otro lado, mediante la secuencia de los genes LSU, EF-1α e ITS se identificó a E. perseae (Cuadro 3). Las secuencias de nucleótidos identificadas se depositaron en la base de datos del GenBank (Cuadro 4).
Cuadro 2 Identificación molecular de las cepas aisladas del síntoma de “roña típica” mediante la amplificación de los iniciadores ITS5/ITS4.
| Aislamiento | Identificación morfológica | Secuencia homóloga del Gene Bank | Especie | Identidad (%) |
|---|---|---|---|---|
| C7 | Colletotrichum sp. | MK758005.1 | C. gloeosporioides | 100 |
| C9 | Pestalotiopsis sp. | N/A | N/A | N/A |
Cuadro 3 Identificación molecular del hongo aislado del síntoma de “mancha púrpura” mediante la secuencia de los genes LSU, EF-1α e ITS.
| Aislamiento | Identificación morfológica | Secuencia homóloga del GenBank® | Especie | Identidad (%) |
|---|---|---|---|---|
| C1 | E. perseae | MH855586.1 | N/A | N/A |
| C4 | E. perseae | MH855586.1 | E. perseae | 99.69 |
| H3 | E. perseae | MH855586.1 | E. perseae | 99.67 |
| H4 | E. perseae | MH855586.1 | E. perseae | 99.51 |
| H6 | E. perseae | MH855586.1 | E. perseae | 97.46 |
| EF-1α | ||||
| C1 | E. perseae | KX886902.1 | E. perseae | 100 |
| C4 | E. perseae | KX886902.1 | E. perseae | 99.71 |
| H3 | E. perseae | KX886902.1 | E. perseae | 100 |
| H4 | E. perseae | KX886902.1 | E. perseae | 100 |
| H6 | E. perseae | KX886902.1 | E. perseae | 100 |
| LSU | ||||
| C1 | E. perseae | NG_063977.1 | E. perseae | 99.72 |
| C4 | E. perseae | NG_063977.1 | E. perseae | 99.86 |
| H3 | E. perseae | NG_063977.1 | E. perseae | 99.17 |
| H4 | E. perseae | NG_063977.1 | E. perseae | 99.72 |
| H6 | E. perseae | NG_063977.1 | E. perseae | 99.86 |
Cuadro 4 Secuencias seleccionadas para el análisis filogenético de E. perseae.
| Especie | Código del aislamiento | Número de acceso al Genbank | ||
|---|---|---|---|---|
| ITS | LSU | EF-1α | ||
| C. gloeosporioides | C7 | MZ314618 | ||
| E. perseae | C1 | N/A | MZ310447 | MZ319391 |
| E. perseae | C4 | MZ310437 | MZ310448 | MZ319392 |
| E. perseae | H3 | MZ310438 | MZ310449 | MZ319393 |
| E. perseae | H4 | MZ310439 | MZ310450 | MZ319394 |
| E. perseae | H6 | MZ310440 | MZ310451 | MZ319395 |
Análisis filogenético de los aislamientos obtenidos de frutos de aguacate con síntomas de “roña típica”. El árbol filogenético agrupó seis clados, además del grupo externo, de los cuales dos agrupan en su totalidad a la especie C. gloeosporioides, donde se encuentra la cepa identificada en el presente estudio. Esto corrobora la identidad de los aislamientos obtenidos en el presente estudio como C. gloeosporioides (Figura 4).
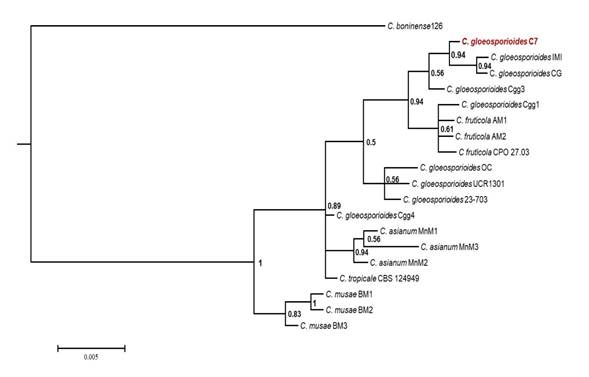
Figura 4 Árbol filogenético bayesiano para el complejo Colletotrichum gloeosporioides, reconstruido utilizando los iniciadores ITS5/ITS4. En color rojo se muestra el aislamiento obtenido en este trabajo. La barra indica la sustitución por sitio. En los nodos se ejemplifica la probabilidad posterior (PP). Se utilizó como grupo externo C. boninense, aislamiento 126, perteneciente a otro complejo del género.
Análisis filogenético de las cepas aisladas de frutos de aguacate con síntoma de “mancha púrpura”. El árbol filogenético bayesiano agrupó a más de 14 clados, además del grupo externo. Las secuencias obtenidas de las cepas identificadas morfológicamente como E. perseae se agruparon con las cepas depositadas en el GenBank con la misma especie, lo que corrobora la identidad de las cepas aisladas del síntoma de “mancha púrpura” como E. perseae y soporta el origen monofiletico de esta especie (Figura 5).
Pruebas de patogenicidad. Se inoculó con Pestalotiopsis sp. y C. gloeosporioides para evaluar el síntoma de “roña típica”; y con aislamiento identificado como E. perseae para evaluar el síntoma de “mancha púrpura”.
Pestalotiopsis sp. El síntoma que ocasionó el hongo identificado como Pestalotiopsis sp., fue necrosis seca que avanzó por el tallo hasta la base de la rama y provocó la momificación de los frutos en plantas de las variedades Hass y Flor de María. Los síntomas menos severos se encontraron en las plantas criollas y las de la variedad Flor de María, ocasionando una necrosis parcial con grietas verticales, estos síntomas concuerdan con lo reportado por Tamayo (2007), como secamiento de ramas y mancha foliar.

Figure 5 Bayesian phylogenetic tree for species of the genus Elsinoe, reconstructed using assembled sequences of primers ITS1/ITS4, ITS5/ITS4, EF-1 α F/EF-1 α R, Sph1 F/Sph1 R. Red text indicates the isolations obtained in this work. The bar indicates substitution per site. Nodes exemplify the posterior probability (PP). Myriangium hispanicum, aislamiento CBS 227.59, which belongs to another family of the same genus, was used as an external group.
Autores como Morales et al. (2009), han aislado a Pestalotiopsis versicolor de frutos de aguacate con síntomas de antracnosis y a Pestalotiopsis sp. de frutos con síntomas de roña del aguacate. Sin embargo, a pesar de que la cepa de Pestalotiopsis sp. inoculada reprodujo una corchosis, no se replicó el síntoma típico de roña observado en campo, por lo que se descarta a Pestalotiopsis sp. como el agente causal de la roña típica.
Se han reportado especies de Pestalotiopsis sp. como patógenos de algunas variedades de aguacate y otros frutales como mango, manzana, plátano y uva. Sin embargo, se desconocía con exactitud los daños que puede causar este hongo en el fruto de aguacate (Zhang et al., 2003; Djeugap et al., 2015). En las pruebas de patogenicidad, realizadas en el presente estudio se comprobó que Pestalotiopsis sp. puede ocasionar una necrosis seca total del fruto, hasta dejarlo momificado, y en ramas provoca necrosis con agrietamientos corchosos. Estos síntomas son diferentes a los reportados para la roña típica.
Colletotrichum gloeosporioides. Las enfermedades causadas por Colletotrichum sp. incluyen la antracnosis, podredumbre de frutos y flores, la mancha foliar, entre otros tipos de pudriciones; afecta a una amplia gama de cultivos, entre los que destaca el aguacate (Freeman et al., 1998; Silva y Ávila, 2011). Al ser un hongo de rápido crecimiento, puede entrar como patógeno secundario al aprovechar las lesiones que provocan otros hongos como E. perseae. Zentmyer (1984) describió que Colletotrichum sp. es incapaz de entrar directamente en el fruto y generalmente se establece en las lesiones del fruto causadas por Cercospora sp. o E. perseae. Por lo tanto, es posible que Colletotrichum sp. se encuentre como un hongo oportunista.
Las pruebas de patogenicidad para la cepa identificada como C. gloeosporioides reprodujeron síntomas similares a la roña del aguacate, lo que comprueba que otros patógenos pueden estimular la producción de capas de corcho como lo describieron Cruz et al. (2006). Las plantas inoculadas con la cepa identificada como Colletotrichum sp. presentaron en el fruto un síntoma inicial de manchas necróticas que al crecer formaron grietas de aspecto corchoso, similares a las descritas por Everett et al. (2011) y Fan et al. (2017) ocasionadas por E. perseae. En tallos se observaron síntomas de necrosis con grietas longitudinales, similares a los reproducidos por Pestalotiopsis sp.; mientras que, en ramas tiernas y pedúnculo, el síntoma fue similar a lo descrito por Everett et al. (2011) como roña del aguacate.
Elsinoe perseae. El aislamiento identificado morfológicamente como E. perseae, se obtuvo de frutos con el síntoma de “mancha púrpura”. Se reprodujeron los síntomas iniciales, los cuales son comúnmente encontrados en campo, semejante a los reportados por Morales (2017) y a su vez las lesiones iniciales coinciden con lo reportado por Jenkins en 1934 como la roña del aguacate (Everett et al., 2011; Fan et al., 2017), por lo que es sinónimo de la mancha purpura descrita por Morales (2017). Esto demuestra que estos nombres comunes son sinónimos y están asociados al mismo agente causal. Se observaron lesiones circulares pequeñas o con borde irregular de color oscuro a violáceos. Se evaluó durante dos meses y al final de la evaluación las lesiones alcanzaron un tamaño máximo de 5 mm. Se realizó un reaislamiento de los síntomas producidos en los frutos y se obtuvieron aislamientos que coincidieron morfológicamente con las cepas inoculadas (Figura 6).

Figura 6 Síntomas en frutos inoculados con: A) Elsinoe perseae, B) Pestalotiopsis sp. y D) Colletotrichum gloeosporioides.
Everett et al. (2011) y Fan et al. (2017) relacionan a Elsinoe perseae como agente causal de la roña del aguacate. Otra situación, es la identificación errónea del síntoma de esta enfermedad en campo ya que en los muestreos de este trabajo se comprobó que otros patógenos, plagas y daños mecánicos pueden provocar corchosis en el pericarpio del fruto como mecanismos de defensa (Cruz, 2006). Por lo que, la caracterización e identificación del síntoma es de suma importancia para realizar un manejo integrado adecuado de esta enfermedad.
Conclusiones
Se obtuvieron 16 aislamientos diferentes, los cuales corresponden a los géneros Colletotrichum, Pestalotiopsis, Fusarium, Curvularia, Alternaria, Leptosphaerulina, Cladosporium y Epicoccum asociada al síntoma de “roña típica”
Colletotrichum gloeosporioides no reprodujo síntomas idénticos a la “roña típica” en las pruebas de patogenicidad ya que la corchosis producida penetró al mesocarpio. Mientras que, Pestalotiopsis sp. reprodujo antracnosis descendente y momificación de los frutos.
Se obtuvieron 25 aislamientos del síntoma de mancha púrpura que correspondieron al género Elsinoe.
El hongo identificado como E. perseae inicialmente reprodujo manchas irregulares de color marrón a violáceas que al crecer y unirse formaron una corchosis limitada al epicarpio, síntomas asociados a la enfermedad conocida como “mancha púrpura”.
Se corrobora la presencia de E. perseae en Michoacán.
Literature cited
Alfaro EE, Morales GJL, Pedraza SME, Chávez BAT y Morales MKL. 2017. Hongos asociados al síndrome de la roña del aguacate en el estado de Michoacán, México. Memorias del V Congreso Latinoamericano del Aguacate. Ciudad Guzmán, Jalisco, México. 1: 114-125. http://www.avocadosource.com/Journals/Memorias_VCLA/2017/Memorias_VCLA_2017_PG_181.pdf. [ Links ]
Álvarez E, Mejía JF, and Valle TL. 2003. Molecular and pathogenicity characterization of Sphaceloma manihoticola isolates from south-central Brazil Plant Disease 87:1322-1328. https://apsjournals.apsnet.org/doi/pdf/10.1094/PDIS.2003.87.11.1322 [ Links ]
Anguiano CJ, Alcántar RJ, Toledo BR, Tapia VL, Ruíz CJ, Rodríguez CY. 2006. Caracterización edafo-climática del área productora de aguacate de Michoacán. INIFAP, Libro Técnico 4: 98-195. http://www.avocadosource.com/wac6/es/Extenso/3c-112.pdf [ Links ]
Ayala EV, Santiago SV y Nava DC. 2016. Characterization of Elsinoe pyri associated whith Apple scab in Texcoco, Mexico. Suplemento de la Revista Mexicana de Fitopatología. 34: 42-43. https://www.smf.org.mx/rmf/suplemento/docs/Volumen342016/Resumen_Poster_S342016.pdf [ Links ]
Barnett HL y Hunter BB. 2006. Illustrated genera of imperfect fungi. 4th Edition, The American Phytopatological Society, St. Paul Minnesota. 1-217. https://www.academia.edu/35499449/Illustrated_genera_of_imperfect_fungi_fourth_edition_Barnett_y_Hunter_pdf_pdf [ Links ]
Becerra MD. 2019. Síndrome de roña en aguacate Hass y criollos: hongos asociados, cambios fisiológicos, físicos y químicos. Tesis para obtener el grado de Doctora en Ciencias Agroalimentarias. Universidad Autónoma Chapingo. 1-142. http://repositorio.chapingo.edu.mx:8080/handle/20.500.12098/22 [ Links ]
Cruz BM, Hernández FY y Rivas FE. 2006. Mecanismos de Resistencia de las Plantas al Ataque de Patógenos y Plagas. Temas de Ciencia y Tecnología, 10: 45-54. https://biblat.unam.mx/es/revista/temas-de-ciencia-y-tecnologia/articulo/mecanismos-de-resistencia-de-las-plantas-al-ataque-de-patogenos-y-plagas [ Links ]
Djeugap FJ, Tsopmbeng NG, Keuete KE, Yaouba A y Serferbe S. 2015. Isolation and identification of fungi associated whit avocado fruits from local markets of the west región of Cameroon. International Journal of Agriculture and Biosciences 4: 64-68. http://dx.doi.org/10.22161/ijeab/2.1.9 [ Links ]
Everett KR, Rees GJ, Pushparajah IPS, Manning MA and Fullerton RA. 2011. Molecular Identification of Sphaceloma perseae (Avocado Scab) and its absence in New Zealand. Journal of Phytopathology 159: 106-113. https://doi.org/10.1111/j.1439-0434.2010.01739.x [ Links ]
Fan XL, Barreto RW, Groenewald JZ, Bazerra JDP, Preira OL, Cheewangkoon R, Mostert L, Tian CM and Crous PW. 2017. Phylogeny and taxonomy of the scab and spot anthracnose fungus Elsinoe (Myryngiales Dothideomycetes) Stud Mycol. 87:1-41. http://dx.doi.org/10.1016/j.simyco.2017.02.001. [ Links ]
Freeman S, Katan T, and Shabi E. 1998. Characterization of Colletotrichum Species Responsible for Anthracnose Diseases of Various Fruits. Plant Disease 82: 00. https://doi.org/10.1094/PDIS.1998.82.6.596 [ Links ]
Hall TA. 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for windows 95/98/NT. Nucleic Acids Symposium Series. 41: 95-98. https://thalljiscience.github.io/ [ Links ]
Hernández y González ME. 2010. Efectos de la contaminación microbiana y oxidaciónfenólica en el establecimiento in vitro de frutalesperennes.Cultivos Tropicales. 31:00 http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S025859362010000400015&lng=es&tlng=es. [ Links ]
Holder MT y Lewis PO. 2003. Phylogeny estimation: traditional and bayesian approaches. Nature Reviews Genetics, 4: 275-284. http://www.apeamac.com/exportaciones-de-aguacates-de-mexico-a-estados-unidos. [ Links ]
Hyde KD, Jones EG, Liu JK, Ariyawansa H, Boehm E, Boonmee S, Braun U, Chumnunti P, Crous PW, Dai DQ, Diederich P, Dissanayake A, Doilom M, Doveri F, Hongsanan S, Jayawardena R, Lawrey JD, Li YM, Liu YX, Lucking R, Monkai J, Muggia L, Nelsen MP, Pang KL, Phookamsak R, Senana IC, Shearer CA, Suetrong S, Tanaka K, Thambugala KM, Wijayawardene NN, Wikee S, Wu H, Zhang Y, Aguirre HB, Alias SA, Aptroot A, Bahkali AH, Bezerra JL, Bhat DJ, Camporesi E, Chukeatirote E, Gueidan C, Hawksworth DL, Hirayama K, Hirayama S, Kang J, Knudsen K, Li W, Li X, Liu Z y Mapook A. 2010. Families of dothideomycetes. Fungal diversity, 63: 1-313. doi:10.1007/s13225-013-0263-4 [ Links ]
Katoh K y Standley DM. 2013. MAFFT multiple sequence alignment software version 7: improvements in performance and usability. Molecular Biology and Evolution 30: 772-780. https://doi.org/10.1093/molbev/mst010 [ Links ]
Kearse M, Moir R, Wilson A, Stones HS, Cheung M, Sturrock S, Buxton S, Cooper A, Markowitz S, Duran C, Thierer T, Ashton B, Meintjes P and Drummond A. 2012. Geneious Basic: an integrated and extendable desktop software platform for the organization and analysis of sequence data. Bioinformatics 28: 1647- 1649. https://doi.org/10.1093%2Fbioinformatics%2Fbts199 [ Links ]
Maddison WP y Maddison DR. 2016. Mesquite: a modular system for evolutionary analysis version 3.6. [Internet]. Available from: http://mesquiteproject.org [ Links ]
Morales GJL. 2017. Estado actual de las enfermedades del fruto del aguacate en México: roña y antracnosis. 118-121. Nuestro mexico.com, http://www.nuestro-mexico.com/Michoacan-de-Ocampo/Ziracuaretiro/Areas-de-menos-de-500-habitantes/El-Copal/ consultada el 13 de diciembre del 2021 [ Links ]
Nylander JAA. 2004. MrModeltest v2. Program distributed by the author. Uppsala, Sweden: Evolutionary Biology Centre, Uppsala University. https://www.researchgate.net/publication/285805344_MrModeltest_V2_Program_Distributed_by_the_Author [ Links ]
Pérez AS, Leyva López NE, Magallanes-Tapia M. A., Arce-Leal P. y Méndez-Guerrero A. 2016. Contaminant fungi in vitro establishment of potato apexes. Cultrop. 37: 84-88. http://dx.doi.org/10.13140/RG.2.2.26063.69284 [ Links ]
Pérez R. M. 2008. Significant Avocado Diseases Caused by Fungi and Oomycetes. The European Journal of Plant Science and Biotechnology, 2: 01-24. http://www.globalsciencebooks.info/Online/GSBOnline/images/0806/EJPSB_2(1)/EJPSB_2(1)1-24o.pdf [ Links ]
Raja HA, Miller AN, Pearce CJ and Oberlies NH. 2017. Fungal identification using molecular tools: A primer for the natural products research community. Journal of Natural Products 80: 756-770. https://doi.org/10.1021/acs.jnatprod.6b01085 [ Links ]
Réblova M, Gams W and Seifert KA. 2011. Monilochaetes and allied genera of the Glomerellales, and a reconsideration of families in the Microascales. Studies in Mycology 68:163-191. http://dx.doi.org/10.3114/sim.2011.68.07 [ Links ]
Ronquist F, Teslenko M, Mark P, Ayres DL, Darling A, Höhna S, Larget B, Liu L, Suchard MA and Huelsenbeck JP. 2012. MrBayes 3.2: efficient Bayesian phylogenetic inference and model choice across a large model space. Systematic Biology 61: 539-542. https://doi.org/10.1093/sysbio/sys029 [ Links ]
SENASICA (Servicio Nacional de Sanidad Inocuidad y Calidad Agroalimentaria). 2018. Manual de Identificación de las Principales Plagas del Aguacate en México. https://www.gob.mx/senasica. (Consulta septiembre del 2021). [ Links ]
SIAP (Servicio de Información Agroalimentaria y Pesquera). 2022. Escenario mensual de productos agroalimentarios. https://www.gob.mx/siap (Consulta octubre de 2022). [ Links ]
Silva RHV y Ávila QGD. 2011. Phylogenetic and morphological identification of Colletotrichum boninense: a novel causal agent of anthracnose in avocado. Plant Pathology, 60: 899-908. [ Links ]
Tamayo MPJ. 2007. Enfermedades del aguacate. Revista Politécnica, 3: 51-70. https://revistas.elpoli.edu.co/index.php/pol/article/view/62 [ Links ]
Tamayo-Molano PJ. 2007. Enfermedades del aguacate. Revista Politécnica, 3:51-70. https://revistas.elpoli.edu.co/index.php/pol/article/view/62 [ Links ]
Urrea JCF, y Cardona CJE 2020. Manejo integrado de las principales plagas y enfermedades en aguacate Hass (Persea americana) en el departamento de Caldas. Programa de Agronomía Manizales. https://repository.unad.edu.co/handle/10596/38446 [ Links ]
Zentmyer GA. 1984. Avocado diseases. Tropical Pest Management, 30: 388-400. https://www.tandfonline.com/doi/abs/10.1080/09670878409370915 [ Links ]
Zhang J., Xu T. y Ge Q. 2003. Notes on Pestalotiopsis from southern China. Mycotaxon, 85: 91-92. https://www.researchgate.net/publication/296529293_Notes_on_Pestalotiopsis_from_southern_China [ Links ]
Zhi L, Huan D, Xiao Y, Jingyuan H, Zhiqi H and Xiping W. 2018. Morphological characterization and optimization of conditions for conidial production of Elsinoë ampelia, the causal organism of grapevine anthracnose. Journal of phytopathology. 166: 1-9. https://doi.org/10.1111/jph.12702 [ Links ]
Recibido: 10 de Febrero de 2023; Aprobado: 26 de Abril de 2023











 text in
text in 


