Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.41 n.1 Texcoco Jan. 2023 Epub Aug 11, 2023
https://doi.org/10.18781/r.mex.fit.2207-2
Notas Fitopatológicas
Inhibición in vitro de bacterias contra Fusarium oxysporum f. sp. cubense raza 2
1 Colegio de Postgraduados, Carretera México-Texcoco km 36.5. Montecillo, 56230 Texcoco, Estado de México, México.
2 Centro Nacional de Referencia Fitosanitaria, Dirección General de Sanidad Vegetal, Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria, Carretera Federal México-Pachuca km 37.5, 55740 Tecámac, Estado de México, México.
Existen tres razas de Fusarium oxysporum f. sp. cubense (Foc) que afectan a bananos y plátanos, los cultivares de banano grupo Cavendish son resistentes a Foc raza 1 (FocR1) y Foc raza 2 (FocR2). Sin embargo, no existen métodos de control efectivos para la Raza 4 Tropical (R4T). Lo anterior, hace necesario generar estrategias de control biológico utilizando a FocR2 como modelo fúngico que está presente en México, y que coadyuven ante la posible introducción de FocR4T al país. Se evaluó la inhibición in vitro de las cepas bacterianas Bacillus subtilis (BASU), B. velezensis (BAVE), B. sonorensis (BASO) contra tres aislamientos de FocR2 (MIC17188, MIC17191 y MIC17192) obtenidos de muestras vegetales colectadas en tres sitios de producción de plátano de Puebla, Michoacán y Oaxaca. A los 14 días, la cepa BASU tuvo en promedio, mayor inhibición (55.1%) con respecto a BAVE y BASO (45.8 y 21.7%, respectivamente) contra las tres cepas fúngicas antes mencionadas. También se evaluó la inhibición in vitro de las bacterias Paenibacillus sp. (BSP 1.1) y Serratia sp. (AC35) en tres tiempos de pre-inoculación bacteriana. La cepa BSP1.1 presentó mayor inhibición (80.1%) cuando se pre-inoculó de manera individual, siete días antes del hongo y durante siete días de confrontación.
Palabras clave: Marchitez por Fusarium; Paenibacillus sp.; Serratia sp.; Bacillus subtilis; Bacillus velezensis; Bacillus sonorensis.
There are three races of Fusarium oxysporum f. sp. cubense (Foc) that affect bananas and plantains, though the Cavendish group banana cultivars are resistant to Foc race 1 (FocR1) and Foc race 2 (FocR2). However, there are no effective control methods for the Tropical Race 4 (R4T). The foregoing makes it necessary to generate biological control strategies for FocR2 fungal model that is present in Mexico, forecasting the potential introduction of FocR4T into our country. In vitro inhibition was evaluated of bacterial strains Bacillus subtilis (BASU), B. velezensis (BAVE), and B. sonorensis (BASO) against three isolates of FocR2 (MIC17188, MIC17191 and MIC17192), obtained from plant samples collected in three banana production sites in the states of Puebla, Michoacán and Oaxaca. At 14 days, the strain BASU had in average high inhibition (55.1%) in comparison to BAVE and BASO strains (45.8 and 21.7%, respectively) against the three fungal strains mentioned before. In addition, the in vitro inhibition of Paenibacillus sp. (BSP 1.1) and Serratia sp. (AC35) was also evaluated by considering three pre-inoculation timings; the strain BSP1.1 showed high inhibition (80.1%) when pre-inoculated individually seven days before the fungus and at seven days of confrontation.
Key words: Fusarium wilt; Paenibacillus sp.; Serratia sp.; Bacillus subtilis; Bacillus velezensis; Bacillus sonorensis
Fusarium oxysporum f. sp. cubense (Foc), agente causal de la marchitez por Fusarium o Fusariosis de las musáceas, se reportó por primera vez en Australia, en 1874, y posteriormente, en 1890 se reportó en Panamá y Costa Rica (América); por lo que, se asume que este patógeno se dispersó desde estos dos países al resto de este continente (Ashby, 1913; Fish, 1970). Existen tres razas de este patógeno que afectan plátanos y bananos: i) Raza 1 (FocR1), afecta a Musa textilis (abacá), bananos de los clones Gros Michel (AAA), Maqueño (AAB), Silk (AAB), Pome (AAB), Pisang Awak (ABB) e IC2 (AAAA); ii) Raza 2 (FocR2), afecta bananos de clones Bluggoe (ABB) y otros híbridos del genoma AAAA; y iii) la Raza 4 Tropical (FocR4T), es un patógeno agresivo en los cultivares Cavendish (AAA), como Dwarf Cavendish, Grand Nain y Williams, así como en los demás cultivares susceptibles a FocR1 y FocR2 (Su et al., 1986; Ploetz, 2005). En México, esta enfermedad se reportó por primera vez en 1932 (Ploetz, 2018); así mismo, Florencio-Anastasio et al. (2022) determinaron mediante un análisis filogenético que cuatro aislamientos de Foc obtenidos de muestras de los estados de Puebla y Michoacán se agruparon dentro del Clado VI de la clasificación propuesta por Fourie et al. (2009) y Karangwa et al. (2018). FocR1 ha provocado severas epidemias que impactaron en la industria bananera en América, cuya producción fue basada en la variedad Gros Michel, lo que provocó la desaparición de la mayoría de las plantaciones comerciales de esta variedad en el período de entre 1950 a 1960, provocando pérdidas económicas de hasta $2.3 mil millones de dólares (Dita et al., 2013). En el Valle de Ulúa (Honduras) se perdieron 30,000 ha en el período de 1940 a 1960; mientras que en Surinam y Quepos (Costa Rica) se dañaron de 4,000 y 6,000 ha en un período de ocho y 12 años, respectivamente (Ploetz, 2000).
En México, durante la década de 1960 y principios de 1970, cerca de 40,000 ha cultivadas con la variedad Gros Michel fueron arrasadas; tan solo en 1994 había alrededor de 4,000 ha de plátano Manzano, las cuales se redujeron a 1,260 ha, en 2004 (Orozco-Santos, 2013) y para el ciclo 2020 se tenían establecidas 1,690 ha (SIAP, 2022). Para contrarrestar las pérdidas económicas provocadas por FocR1, la solución a nivel mundial consistió en reemplazar aquellas plantaciones establecidas con Gros Michel por cultivares del subgrupo Cavendish, que representan más del 99 % del banano de exportación (Dita et al., 2018). Por otra parte, se reportó por primera vez a FocR4T en Taiwán en 1989 (Ploetz, 2018), para 2022 su distribución comprende Australia, Birmania, China, Colombia, Filipinas, India, Indonesia, Islas Mayotte (Francia), Israel, Jordania, Laos, Líbano, Malasia, Mozambique, Omán, Pakistán, Perú, Reino Unido, Tailandia, Taiwán, Turquía y Vietnam (Ploetz et al., 2018; Promusa, 2018; DOA. 2019; ICA, 2019; Aguayo et al., 2021; García-Bastidas et al., 2020; Özarslandan y Akgül, 2020; SENASA, 2021).
La presencia de este patógeno en dos países de América (Colombia y Perú), incrementa el riesgo de su introducción a México (Florencio-Anastasio et al., 2022). Aun cuando los bananos del grupo Cavendish son resistentes a las razas 1 y 2 (Su et al., 1986), no existen cultivares de banano o plátano resistentes o productos químicos efectivos contra FocR4T (Cook, 2005). Así mismo, se han propuesto algunos esquemas de control biológico basados en el uso de bacterias y hongos antagonistas contra las razas de Foc (Bubici et al., 2019); por ejemplo, la bacteria Burkholderia cenocepacia 869T2 presentó 44.4% de inhibición in vitro, y redujo en 86.1% la incidencia de FocR4T en banano Cavendish en campo (Ho et al., 2015). También Pseudomonas fluorescens y P. fluorescens WCS417 redujeron (83.4 y 87.4%, respectivamente) la severidad de FocR4T en banano Cavendish en invernadero. El uso de biofertilizantes basados en abono de cerdo en combinación con Bacillus amyloliquefaciens NJN-6 redujo 75% la incidencia de FocR4T en banano Cavendish en invernadero (Shen et al., 2015), mientras que la misma bacteria disminuyó 68.5 % la incidencia de FocR4T en campo (Xue et al., 2015). Por otra parte, B. amyloliquefaciens W19 redujo 42.8 y 44.4% la incidencia de Foc en dos campos de banano Cavendish (Wang et al., 2016); además, B. subtilis N11redujo 82.1% la incidencia de FocR4T, mientras que la combinación de Paenibacillus polymyxa SQR21 + Trichoderma harzianun T37 redujo 64.3% la incidencia de FocR4T, en banana Cavendish (Zhang et al., 2011). Las bacterias Paenibacillus sp. BSP.1.1, Serratia sp. AC35, Pseudomonas tolaasii P61, Bacillus pumilus BFIEST 4C, B. pumilus R44, B. pumilus A1, y Serratia liquefaciens CPA C53 inhibieron el crecimiento micelial in vitro de cinco aislamientos de Foc Raza “1 o 2” en 46.6, 26.6, 12.0, 11.9, 10.1, 9.7 y 4.9%, respectivamente (Florencio-Anastasio et al., 2022). Por lo anterior, la presente investigación evaluó el efecto in vitro de cinco bacterias antagonistas sobre el desarrollo micelial de FocR2, como hongo fitopatógeno modelo, dada su presencia en el país, para valorar su aplicación potencial en futuros esquemas de manejo fitosanitario, ante una eventual introducción de FocR4T a nuestro país.
Análisis filogenético. Con la finalidad de determinar la raza a la cual pertenecen los aislamientos evaluados en el presente estudio (Cuadro 1), se siguió la misma metodología reportada por Florencio-Anastasio et al. (2022), se realizó el análisis filogenético de la región IGS (Intergenic spacers) del rDNA amplificada con los iniciadores PNFo y PN22 (Edel et al., 1995).
Cuadro 1 Origen de los aislamientos de Fusarium oxysporum f. sp. cubense raza 2, depositadas en la colección del Laboratorio de Micología, del Centro Nacional de Referencia Fitosanitaria (DGSV-Senasica) (Florencio-Anastasio et al., 2022).
| Aislamientos | Municipio / Estado | Latitud | Longitud | No. de accesión |
|---|---|---|---|---|
| CNRF-MIC17188 | Hueytamalco, Puebla | 20.00857 | -97.24197 | MN702818 |
| CNRF-MIC17189 | Hueytamalco, Puebla | 20.00882 | -97.2419 | MN702819 |
| CNRF-MIC17190 | Hueytamalco, Puebla | 20.00928 | -97.24209 | MN702820 |
| CNRF-MIC17191 | Tacámbaro, Michoacán | 19.21827 | -101.45857 | MN702821 |
| CNRF-MIC17192 | Villa de Tututepec de Melchor Ocampo, Oaxaca | 16.04554 | -97.70423 |
Aislamientos FocR2. Los aislamientos del hongo fueron donados por el Laboratorio de Micología del Centro Nacional de Referencia Fitosanitaria del Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA). Los cuales fueron aislados de plantaciones bananeras de Hueytamalco, Puebla (MIC17188; MIC17189; MIC17190), Tacámbaro, Michoacán (MIC17191) y Villa de Tututepec de Melchor Ocampo, Oaxaca (MIC17192), a partir de muestras de plantas individuales colectadas por el Programa Nacional de Vigilancia Epidemiológica Fitosanitaria (PVEF) para la vigilancia y detección oportuna de FocR4T. Las muestras colectadas consistieron en fragmentos de 5 x 1.5 cm de haces vasculares de plantas plátano con síntomas de amarillamiento.
Cepas bacterianas evaluadas. Para el bioensayo 1, se utilizaron las cepas bacterianas Bacillus subtilis (BASU), B. sonorensis (BASO), B. velezensis (BAVE), las cuales fueron proporcionadas por el Laboratorio de bacterias, Centro Nacional de Referencia Fitosanitaria del SENASICA (Cuadro 2) para evaluar su efecto en el crecimiento micelial de tres aislamientos de FocR2 (MIC17188, MIC17191 y MIC17192) (Cuadro 1). Por otra parte, en el bioensayo 2, se utilizaron las cepas bacterianas Paenibacillus sp. BSP 1.1 y Serratia sp. AC 35, las cuales fueron proporcionadas por el Laboratorio de Microbiología, Postgrado de Edafología, Colegio de Postgraduados, Campus Montecillo, para determinar su influencia en el crecimiento micelial de la cepa FocR2 CNRF-MIC17188 (número de accesión MN702818).
Cuadro 2 Origen de las bacterias antagonistas evaluadas contra Fusarium oxysporum f. sp. cubense raza 2.
| Bacteria | Clave asignada | Origen de las bacterias |
|---|---|---|
| Bacillus subtilis | BASU | SENASICA |
| Bacillus sonorensis | BASO | SENASICA |
| Bacillus velezensis | BAVE | SENASICA |
| Paenibacillus sp. | BSP 1.1 | COLPOS |
| Serratia sp. | AC 35 | COLPOS |
Bioensayo 1. Inhibición in vitro de bacterias contra tres aislamientos de FocR2. Para este bioensayo se evaluó el efecto antagonista de las cepas bacterianas: BASU, BASO, BAZE (Cuadro 1), sobre el crecimiento micelial de los aislamientos MIC17188, MIC17191 y MIC17192 (Cuadro 2) utilizando la técnica propuesta por (Pineda-Mendoza et al., 2019). Las bacterias se reactivaron en agar nutritivo (Merck®) Se establecieron cuatro tratamientos (tres bacterias más el testigo) con cuatro repeticiones cada uno. En los extremos de las cajas de Petri con medio PDA (Potato Dextrose Agar, Merck®), se colocó una asada (línea de 5 cm) de las cepas bacterianas de siete días de crecimiento. Las cajas fueron incubadas en oscuridad a 28 ± 2 °C por 24 h; posteriormente, se colocaron discos de agar de 7 mm de diámetro de cada aislamiento de FocR2, los cuales fueron removidos de los márgenes de los cultivos fúngicos de siete días de crecimiento, y se colocaron en el lado opuesto de cada caja, a 5 cm de distancia del crecimiento bacteriano. El testigo consistió en solo colocar discos del crecimiento fúngico en medio de cultivo PDA. Las cajas se incubaron nuevamente en oscuridad a 28 ± 2 °C; a los 3, 7, 10 y 14 días después de la siembra, se midió el radio de crecimiento micelial de cada aislamiento fúngico, se tomaron cuatro mediciones del crecimiento fúngico con un vernier, para calcular el porcentaje de inhibición se utilizó la formula reportada por Landa et al. (1997):
Porcentaje de inhibición
Dónde, r es el radio de crecimiento del hongo en presencia de la bacteria y R es el radio de crecimiento del hongo sin la bacteria (testigo).
Bioensayo 2. Inhibición in vitro de Paenibacillus sp. (BSP 1.1) y Serratia sp. contra el aislamiento MIC17188 de FocR2 en tres tiempos de pre-inoculación. En este bioensayo se evaluó el efecto inhibitorio in vitro de las cepas bacterianas Paenibacillus sp. (BSP 1.1) y Serratia sp. (AC 35) juntas y separadas (Cuadro 1) contra el aislamiento MIC17188 de FocR2 (Cuadro 2), en estudios previos, dicho aislamiento presentó mayor ritmo de crecimiento in vitro (Florencio-Anastasio et al., 2022), se evaluaron tres diferentes tiempos de pre-inoculación a 2, 4 y 7 días de pre-inoculación (DPI) en el medio de cultivo (pre-inoculación se refiere a la siembra de las bacterias en la caja de Petri previo a la siembra de los aislamientos del hongo, con la finalidad de que las bacterias produzcan y secreten metabolitos antifúngicos). Se utilizó el mismo procedimiento de inoculación descrito en el Bioensayo 1. Se colocó un disco de 7 mm del hongo en el centro de la caja de Petri y se colocaron asadas de 5 cm de las cepas bacterianas en extremos opuestos, de tal manera que el crecimiento bacteriano quedó separado inicialmente a 3 cm del hongo y a 6 cm entre sí. Se establecieron cuatro repeticiones por cada tratamiento, incluyendo el testigo el cual consistió de disco de 7 mm del hongo, y las cajas de Petri se incubaron nuevamente en oscuridad a 28 ± 2 °C. Se midió el radio de crecimiento micelial del aislamiento del hongo a los 2, 4, 6 y 7 días.
Diseño experimental y análisis estadístico. Para cada ensayo se estableció un diseño experimental completamente al azar y se realizaron por separado, para evitar posibles efectos cruzados por compuestos volátiles producidos por bacterias antagonistas. Los datos de inhibición se analizaron con el paquete estadístico SAS para Windows (SAS Institute Inc, 2002), realizando un análisis de varianza y la prueba de comparación de medias de Tukey (α ≤ 0.05).
Análisis filogenético. El análisis BLAST de las secuencias consenso de los aislamientos MIC17188, MIC17189, MIC17190 (Hueytamalco, Puebla) y MIC17191 (Tacámbaro, Michoacán) permitió confirmar la identidad de Fusarium oxysporum f. sp. cubense raza 2 con 100 % de cobertura y agrupadas con la raza dentro del Clado VI propuesto por Fourie et al. (2009) y Karangwa et al. (2018) (Figura 1).
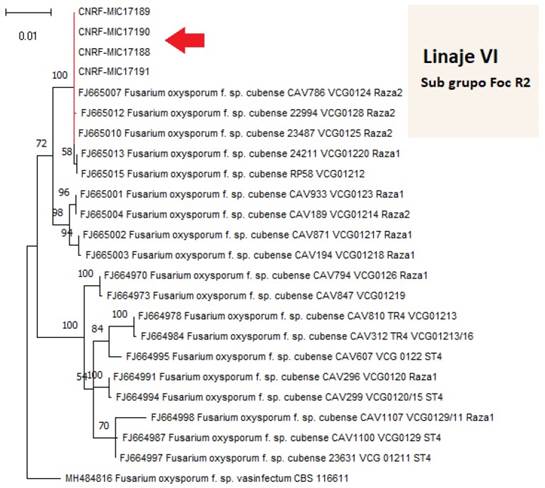
Figura 1 Análisis filogenético de cuatro aislamientos de Fusarium oxysporum f. sp. cubense (MIC17188, MIC17189, MIC17190, MIC17191) de Puebla y Michoacán, México.
Bioensayo 1. Inhibición in vitro de bacterias contra tres aislamientos de Foc R2. La cepa bacteriana BASU fue la que provocó la inhibición mayor del desarrollo micelial de los tres aislamientos de FocR2, con un 55.1% en promedio, a los 14 días de la confrontación. Por su parte, las cepas BAVE y BASO mostraron un porcentaje de inhibición promedio de 45.8 y 21.7%, respectivamente (Cuadro 3; Figuras 2 y 3).
Cuadro 3 Inhibiciones fúngicas comparativas (promedio de los tres aislamientos cepas de Fusarium oxysporum f. sp. cubense raza 2) obtenidas de confrontaciones fúngicas con tres bacterias, a los 14 días de evaluación.
| Bioensayo 1 | Inhibición fúngicaz (%) |
|---|---|
| Bacillus subtilis (BASU) | 55.1 a |
| Bacillus velezensis (BAVE) | 45.8 b |
| Bacillus sonorensis (BASO) | 21.7 c |
zValores estimados a partir de los datos de crecimiento fúngico del testigo para el bioensayo correspondiente. Las letras idénticas no son significativamente diferentes (Tukey, α ≤ 0.05), n=4.

Figura 2 Inhibición in vitro de Bacillus subtilis (BASU), B. sonorensis (BASO), y B. velezensis (BAVE) contra los aislamientos MIC17188, MIC17191 y MIC17192 de Fusarium oxysporum f. sp. cubense raza 2, a los 14 días de evaluación. A) Crecimiento micelial, y B) Porcentaje de inhibición. Medias+Error estándar. n=4.
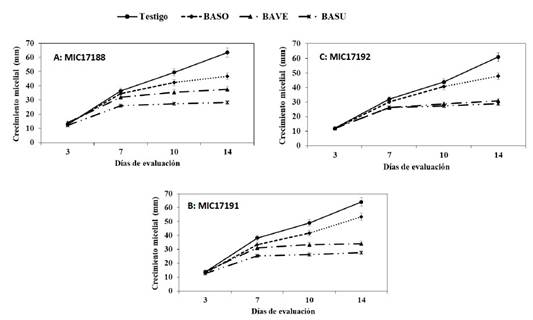
Figure 3 In vitro mycelial growth of the isolates MIC17188, MIC17191 and MIC17192, of Fusarium oxysporum f. sp. cubense race 2 in the presence of Bacillus subtilis (BASU), B. sonorensis (BASO) and B. velezensis (BAVE) bacteria, at 3, 7, 10 and 14 days of evaluation. Means + Standard error. n=4.
Bioensayo 2. Inhibición in vitro de Paenibacillus sp. (BSP 1.1) y Serratia sp. contra el aislamiento MIC17188 de FocR2 en tres tiempos de pre-inoculación. A los 7 días de evaluación, la cepa bacteriana Paenibacillus sp. BSP 1.1, por si sola tuvo el mayor efecto inhibitorio en el crecimiento micelial del aislamiento MIC17188 a los 4 y 7 DPI de 75.9 y 80.1%, respectivamente, seguido de la combinación de Paenibacillus sp. BSP 1.1 + Serratia sp. AC35 cuya inhibición fue de 52.7 y 75.5%, respectivamente; Mientras que la cepa bacteriana Serratia sp. AC35 presentó valores de inhibición del 46.8 y 52.3% en las mismas fechas de pre-inoculación (Cuadro 4; Figura 4).
Cuadro 4 Efecto inhibitorio de Paenibacillus sp. (BSP 1.1), Serratia sp. (AC 35) y su combinación, contra Fusarium oxysporum f. sp. cubense raza 2 (MIC17188), con siete días de pre-inoculación bacteriana y siete días de confrontación.
| Tratamiento | Inhibición fúngica (%)* |
|---|---|
| BSP 1.1 | 80.15 a |
| BSP 1.1 + AC 35 | 75.51 b |
| AC 35 | 52.31 c |
*Valor estimado a partir del crecimiento fúngico del testigo del bioensayo correspondiente. Letras idénticas en la columna no son significativamente diferentes (Tukey, α ≤ 0.05). n=3.
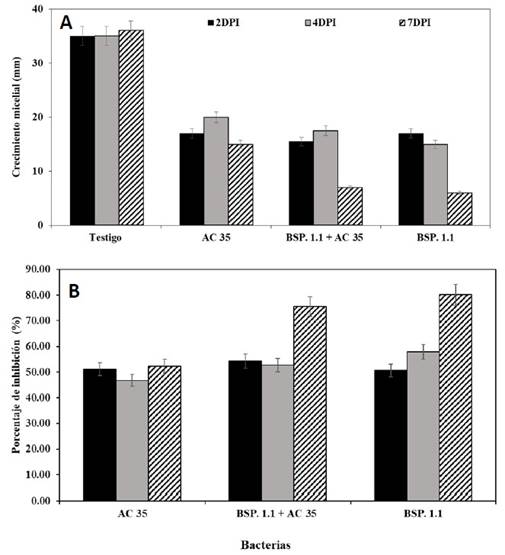
Figura 4 Inhibición in vitro de las bacterias Paenibacillus sp. (BSP 1.1) y Serratia sp. (AC35) contra el aislamiento MIC17188 de Fusarium oxysporum f. sp. cubense a tres tiempos de inoculación bacteriana (dos, cuatro y siete días). A) Crecimiento micelial, y B) Porcentaje de inhibición. A los siete días de evaluación. Medias + Error estándar. n=3.
La capacidad de inhibición in vitro de las cepas bacterianas BASU, BAVE y BASO consideradas en este trabajo, no se había determinado previamente contra ningún patógeno; estas cepas inhibieron el crecimiento miceliar de tres cepas de FocR2, en 40.87% en promedio, siendo las más efectivas BASU (55.1%) y BAVE (45.8%), en tanto que BASO mostró la menor efectividad (21.7%). Existen reportes donde indican que varias cepas bacterianas de B. subtilis ejercen inhibición in vitro hacia F. oxysporum y a la vez reducen la incidencia de FocR1 cuando se inoculan en vitroplantas de banana variedad Red banana (AAA) en condiciones de invernadero ya sea solas o en combinación con Pseudomonas fluorescens Pf1 (Rubio-Tinajero et al., 2021; Kavino y Manoranjitham, 2018). De igual forma, la efectividad de B. subtilis se ha evaluado en ensayos in vivo, con base en su capacidad de reducir la incidencia de F. oxysporum en tubérculos de Dioscorea villosa (Khan et al., 2017). En particular algunas especies de B. velezensis han mostrado cierta efectividad en la reducción de la incidencia de F. oxysporum en plántulas de banano, en condiciones de invernadero (Cao et al., 2018), y de manera especial la incidencia de FocR4T en plantas de banano Cavendish var. Brazil (Huang et al., 2019). Lo anterior concuerda con lo reportado por Segura-Mena et al. (2021) quienes mencionan que la utilización de bacterias benéficas/antagonistas son parte de prácticas de manejo del suelo para reducir la incidencia y severidad de enfermedades causadas por Fusarium.
Los resultados obtenidos sugieren que B. subtilis y B. sonorensis podrían ser potencialmente evaluadas en invernadero y posteriormente en campo, para en un futuro también ser consideradas como parte de un programa de manejo contra FocR2 y contra FocR4T, ante una eventual introducción de este último; ya sea mediante prácticas de bacterización de vitroplantas de plátano antes de su establecimiento en campo o en la elaboración de formulaciones de biofertilizantes que se podrían aplicar una vez que el cultivo está establecido en campo, como ya ha sido reportado por Kavino y Manoranjitham (2018) y Huang et al. (2019).
Respecto a la inhibición del crecimiento micelial de FocR2 MIC17188, un estudio previo, demostró que las cepas bacterianas Paenibacillus sp. BSP1.1 y Serratia sp. AC35 ejercieron una inhibición de 45 y 27% cuando se preinocularon un día antes de la confrontación fúngica (Florencio-Anastasio et al., 2022); en el presente trabajo, esta inhibición se incrementó hasta 80.1 y 52.3%, respectivamente, cuando las bacterias se preinocularon in vitro, siete días antes de la confrontación, lo que sugiere que entre más tiempo tengan las bacterias para establecerse en el medio de cultivo, mayor será el efecto inhibitorio. Lo anterior, da consistencia a lo sugerido por Caballero-Hernández (2011) al recomendar la protección de plantas de banano con bacterias antagonistas aplicadas siete días antes de la inoculación del patógeno.
Además, la cepa Paenibacillus sp. BSP1.1 también ha sido eficaz para inhibir el crecimiento micelial de Rhizoctonia sp. (Pineda-Mendoza et al., 2019), esta cepa bacteriana es atractiva para su utilización biotecnológica como parte de un programa de manejo integrado para el biocontrol de Foc, debido a alto porcentaje de inhibición contra cinco aislamientos de Foc Raza “1 o 2” (Florencio-Anastasio et al. 2022). Además, esta bacteria produce auxinas e índoles, y solubiliza fosfatos, por lo que se considera un buen promotor del crecimiento vegetal y mejora la germinación de semillas y el crecimiento de plantas de Capsicum annum (Angulo-Castro et al., 2018; Pineda-Mendoza, 2015; Pineda-Mendoza et al., 2019). Por lo tanto, Paenibacillus sp. BSP1.1 potencialmente puede utilizarse en programas de control biológico como “práctica de bacterización” una semana antes de su establecimiento en campo para inducir mayor protección a vitroplantas de plátano y banano
Conclusiones
La cepa bacteriana Paenibacillus sp. BSP 1.1, por si sola tuvo el mayor efecto inhibitorio en el crecimiento micelial del aislamiento MIC17188 de FocR2 cuando se pre-inoculó a los siete días.
El efecto inhibitorio de la inoculación combinada de las cepas bacterianas Paenibacillus sp. BSP 1.1 y Serratia sp. AC35 fue menor en comparación con la sola inoculación de la cepa Paenibacillus sp. BSP 1.1.
Agradecimientos
A la Subdirección de Diagnóstico Fitosanitario, Coordinación de Análisis de Riesgo de Plagas y Programa Nacional de Vigilancia Epidemiológica Fitosanitaria del Centro Nacional de Referencia Fitosanitaria del Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA) por facilitar el uso de sus instalaciones para esta investigación.
REFERENCIAS
Aguayo J, Cerf-Wendling I, Folscher AB, Fourrier-Jeandel C, Ioos R, Mathews MC, Mostert D, Renault C, Wilson V and Viljoen A. 2021. First report of Fusarium oxysporum f. sp. cubense Tropical Race 4 (TR4) causing Banana Wilt in the Island of Mayotte. Plant Disease 105(1):219. https://pubmed.ncbi.nlm.nih.gov/32755365/. [ Links ]
Angulo-Castro A, Ferrera-Cerrato R, Alarcón A, Almaraz-Suárez JJ, Delgadillo-Martínez J, Jiménez-Fernández M y García-Barradas O. 2018. Crecimiento y eficiencia fotoquímica del fotosistema II en plántulas de 2 variedades de Capsicum annuum L. inoculadas con rizobacterias u hongos micorrícicos arbusculares. Revista Argentina de Microbiología 50(2):178-188. https://doi.org/10.1016/j.ram.2017.03.011. [ Links ]
Ashby SF. 1913. Banana disease in Jamaica. Bulletin of the Department of Agriculture Jamaica 2(6): 95-128. https://naldc-legacy.nal.usda.gov/naldc/download.xhtml?id=12088&content =PDF. [ Links ]
Bubici G, Kaushal M, Prigigallo MI, Cabanás CGL and Mercado-Blanco J. 2019. Biological control agents against Fusarium wilt of banana. Frontiers in Microbiology 10:616. https://www.frontiersin.org/articles/10.3389/fmicb.2019.00616/full. [ Links ]
Caballero-Hernández AJ. 2011. Uso de hongos endofíticos de Trichoderma spp. para el biocontrol del Mal de Panamá (Fusarium oxysporum f. sp. cubense) raza tropical 1 en vitroplantas del cultivar Gros Michel (AAA). Tesis Magister Scientiae en Agricultura Ecológica. Centro Agronómico Tropical de Investigación y Enseñanza. Escuela de Posgrado. 90 p. https://repositorio.catie.ac.cr/handle/11554/5623. [ Links ]
Cao Y, Pi H, Chandrangsu P, Li Y, Wang Y, Zhou H, Xiong H, Helmann JD and Cai Y. 2018. Antagonism of two plant-growth promoting Bacillus velezensis isolates against Ralstonia solanacearum and Fusarium oxysporum. Scientific Reports 8:4360. https://doi.org./10.1038/s41598-018-22782-z. [ Links ]
Cook DC, Taylor AS, Meldrum RA and Drenth A. 2015. Potential economic impact of panama disease (tropical race 4) on the Australian banana industry. Journal of Plant Disease Protection 122(5/6):229-237. https://link.springer.com/article/10.1007/BF03356557. [ Links ]
Dita RMA, Echegoyén RPE y Pérez VLF. 2013. Plan de contingencia ante un brote de la raza 4 tropical de Fusarium oxysporum f. sp. cubense en un país de la región del OIRSA. Organismo Internacional Regional de Sanidad Agropecuaria (OIRSA). San Salvador, El Salvador. 155p. https://www.researchgate.net/profile/Plutarco_Echegoyen/publication /256547836_Plan_de_contingencia_ante_un_brote_de_la_raza_4_tropical_de_Fusarium_oxysporum_f_sp_cubense_en_un_pais_de_la_region_del_OIRSA/links/02e7e5236098aa1954000000.pdf [ Links ]
Dita M, Barquero M, Heck D, Mizubuti ES and Staver CP. 2018. Fusarium wilt of banana: current knowledge on epidemiology and research needs toward sustainable management. Frontiers in Plant Science 9(1468). https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6202804/. [ Links ]
DOA. 2019. Detection of Fusarium oxysporum f. sp. cubense Tropical Race 4 in Thailand. Department of Agriculture (DOA) of Thailand. Pest Reports from Thailand. International Plant Protection Convention. https://www.ippc.int/en/countries/thailand/pestreports/2019 /11/detection-of-fusarium-oxysporum-f-sp-cubense-tropical-race-4-in-thailand/. [ Links ]
Edel V, Steinberg C. Avelange l. Laguerre G, Alabouvette C. 1995. Comparison of three molecular methods for the characterization of Fusarium oxysporum strains. Phytopathology 85:579-585. https://www.apsnet.org/publications/phytopathology/backissues/Documents/1995Ar-ticles/Phyto85n05_579.PDF. [ Links ]
Florencio-Anastasio JG, García-Ávila CJ, Alarcón A, Ferrera-Cerrato R, Quezada-Salinas A, Almaraz-Suárez JJ, Moreno-Velázquez M and Hernández-Ramos L. 2022. Effectiveness of antagonistic bacteria, commercial fungicides, and fourth generation quaternary ammonium salts, against Fusarium oxysporum f. sp. cubense race “1 or 2”. European Journal of Plant Pathology 163:719-731. https://doi.org/10.1007/s10658-022-02510-0. [ Links ]
Fish S. 1970. The history of plant pathology in Australia. The Annual Review of Phytopathology 8:13-36. https://appsnet.org/History/THE%20HISTORY%20OF%20PLANT%20PATH-OLOGY%20IN%20AUSTRALIA.pdf. [ Links ]
Fourie G, Steenkamp ET, Gordon TR and Viljoen A. 2009. Evolutionary relationships among the Fusarium oxysporum f. sp. cubense vegetative compatibility groups. Applied and Environmental Microbiology 75 (14): 4770-4781. https://www.ncbi.nlm.nih.gov/ pmc/articles/PMC2708428/. [ Links ]
García-Bastidas FA, Quintero-Vargas JC, Ayala-Vásquez M, Schermer T, Seidl MF, Santos-Paiva M, Noguera AM, Aguilera-Gálvez C, Wittenberg A, Hofstede R, Sorensen A and Kema HJ. 2020. First report of Fusarium Wilt Tropical Race 4 in Cavendish bananas caused by Fusarium odoratissimum in Colombia. Plant Disease 104(3): 994. https://apsjournals. apsnet.org/doi/10.1094/PDIS-09-19-1922-PDN. [ Links ]
Ho YN, Chiang HM, Chao CP, Su CC, Hsu HF, Guo CT, Hsieh JL and Huang CC. 2015. In planta biocontrol of soilborne Fusarium wilt of banana through a plant endophytic bacterium, Burkholderia cenocepacea 869T2. Plant Soil 387: 295-306. https://link.springer.com/ content/pdf/10.1007/s11104-014-2297-0.pdf. [ Links ]
Huang J, Pang Y, Zhang F, Huang Q, Zhang M, Tang S, Fu H and Li P. 2019. Suppression of Fusarium wilt of banana by combining acid soil ameliorant with biofertilizer made from Bacillus velezensis H-6. European Journal of Plant Pathology 154: 585-596. https://link.springer.com/article/10.1007%2Fs10658-019-01683-5. [ Links ]
ICA. 2019. Resolución No. 00011912. Por medio de la cual se declara el estado de emergencia fitosanitaria en el territorio nacional por la presencia de la enfermedad conocida como marchitez de las musáceas por Foc R4T. Instituto Colombiano Agropecuario. 22 p. https://www.ica.gov.co/getattachment/499e9fe5-1c2c-482a-87a9-62ae25f02f53/2019R11912.aspx. [ Links ]
Karangwa P, Monster D, Ndayihanzamaso P, Dubois T, Niere B, Felde AZ, Shouten A, Blomme G, Beed F and Viljoen A. 2018. Genetic diversity of Fusarium oxysporum f. sp. cubense in East and Central Africa. Plant Disease 102: 552-560. https://doi.org/10.1094/PDIS-02-17-0282-RE. [ Links ]
Kavino M and Manoranjitham SK. 2018. In vitro bacterization of banana (Musa spp.) with native endophytic and rhizospheric bacterial isolates: Novel ways to combat Fusarium wilt. European Journal of Plant Pathology 151: 371-387. https://en.xmol.com/paper/article /1335489338024620155. [ Links ]
Khan N, Maymon M and Hirsch AM. 2017. Combating Fusarium infection using Bacillus-based antimicrobials. Microorganism 5:75. https://doi.org/10.3390/microorganisms5040075. [ Links ]
Landa B, Hervás A, Bettiol W and Jiménez-Díaz R. 1997. Antagonistic activity of bacteria from the chickpea rhizosphere against Fusarium oxysporum f. sp. ciceris. Phytoparasitica 25:305-318. https://www.alice.cnptia.embrapa.br/alice/bitstream/doc/12764/1/1997AP039 BettiolAntagonistic3360.PDF. [ Links ]
Orozco-Santos M. 2013. Historia y situación actual del Mal de Panamá (Fusarium oxysporum f. sp. cubense) en México. Revista Mexicana de Fitopatología 31: S35. http://rmf.smf.org.mx/suplemento/docs/suplemento.pdf. [ Links ]
Özarslandan M and Akgül DS. 2020. First report of Fusarium oxysporum f. sp. cubense Race 4 causing Fusarium wilt disease of banana in Turkey. Plant Disease 104(3):974. https://doi.org/10.1094/PDIS-09-19-1881-PDN. [ Links ]
Pineda-Mendoza DY. 2015. Potencial de tres cepas de rizobacterias como antagonistas de Rhizoctonia solani en chile serrano (Capsicum annuum L.). Tesis de maestría en Edafología. Colegio de Posgraduados, Área de Microbiología. Montecillo, Estado de México. México. 60 p. [ Links ]
Pineda-Mendoza DY, Almaraz JJ, Lara-Hernández ME, Arteaga-Garibay R y Silva-Rojas HV. 2019. Cepas de bacterias aisladas de esporomas de hongos ectomicorrízicos promueven el crecimiento vegetal. ITEA-Información Técnica Económica Agraria 115(1): 4-17. https://doi.org/10.12706/itea.2018.027. [ Links ]
Ploetz RC. 2000. Panama disease: A classic and destructive disease of banana. Plant Health Progress. https://doi.org/10.1094/PHP-2000-1204-01-HM. [ Links ]
Ploetz RC. 2005. Panama Disease: An old nemesis rears its ugly head part 2: The Cavendish era and beyond. Online. APSnet Features. https://www.apsnet.org/edcenter/apsnetfeatures/Documents/2005/PanamaDisease2.pdf [ Links ]
Ploetz R. 2018. Fusarium wilt. pp. 207-228. In: Jones, D.R. (Ed.). Diseases of Banana, Abacá, and Enset. CABI publishing. https://books.google.com.mx/books?id=HeWCDwAAQBAJ &pg=PA210&lpg=PA210&dq=Panama+disease+belice+1913&source=bl&ots=zZ9heNd4FZ&sig=ACfU3U0Ja8JJnKiPWMYIAItIszG364kP7w&hl=es&sa=X&ved=2ahUKEwjixuiVwLrkAhVEQ6wKHbRZACMQ6AEwDXoECAgQAQ#v=onepage&q&f=true. [ Links ]
Promusa. 2018. TR4 present in the UK (United Kingdom). A global programme for Musa improvement (Promusa). https://www.promusa.org/blogpost580-TR4-present-in-the-UK. [ Links ]
Rubio-Tinajero S, Osorio-Hernández E, Estrada-Drouaillet B, Silva-Espinosa JHT, Rodríguez-Mejía MDL and Nava-Juárez RA. 2021. In vitro antagonist biocontrol of Fusarium oxysporum and Dickeya chrysanthemi. Revista Mexicana de Fitopatología 39(3): 515-528. https://www.smf.org.mx/rmf/Vol3932021/RMF2104-1.pdf. [ Links ]
Segura-Mena RA, Stoorvogel JJ, García-Bastidas F, Salacinas-Niez M, Kema GHJ and Sandoval JA. 2021. Evaluating the potential of soil management to reduce the effect of Fusarium oxysporum f. sp. cubense in banana (Musa AAA). European Journal of Plant Pathology 160:441-455. https://doi.org/10.1007/s10658-021-02255-2. [ Links ]
SENASA. 2021. Primer Reporte sobre Fusarium oxysporum f. sp. cubense Raza 4 Tropical, W.C. Snyder & H.N. Hansen 1940. Servicio Nacional de Sanidad Agraria del Perú (SENASA). https://assets.ippc.int/static/media/files/pestreport/2021/04/30/Reporte_Foc_R4T_PERU_IPPC_29_abril_2021.pdf. [ Links ]
Shen Z, Ruan Y, Wang B, Zhong S, Su L, Li R and Shen Q. 2015. Effect of biofertilizer for suppressing Fusarium wilt disease of banana as well as enhancing microbial and chemical properties of soil under greenhouse trial. Applied Soil Ecology 93:111-119. https://www.sciencedirect.com/science/article/abs/pii/S0929139315001158. [ Links ]
SIAP. 2022. Anuario Estadístico de la Producción Agrícola. Servicio de Información Agroalimentaria y Pesquera (SIAP). https://nube.siap.gob.mx/cierreagricola/. [ Links ]
Su HJ, Hwang SC and Ko WH. 1986. Fusarium wilt of Cavendish bananas in Taiwan. Plant Disease 70(9): 814-818. http://www.apsnet.org/publications/PlantDisease/BackIssues/Do-cuments/1986Articles/PlantDisease70n09_814.PDF. [ Links ]
Wang BB, Shen ZZ, Zhang FG, Raza W, Yuan J, Huang R, Ruan YZ, Li R and Shen QR. 2016. Bacillus amyloliquefaciens strain W19 can promote growth and yield and suppress Fusarium wilt in banana under greenhouse and field conditions. Pedosphere 26(5): 733-744. https://www.sciencedirect.com/science/article/abs/pii/S1002016015600832. [ Links ]
Xue C, Penton R, Shen Z, Zhang R, Huang Q, Li R, Ruan Y and Shen Q. 2015. Manipulating the banana rhizosphere microbiome for biological control of Panama disease. Scientific Reports 5:11124. https://www.nature.com/articles/srep11124.pdf. [ Links ]
Zhang N, Wu K, He X, Li SQ, Zhang Z H, Shen B, Yang XM, Zhang RF, Huang QW and Shen QR. 2011. A new bioorganic fertilizer can effectively control banana wilt by strong colonization with Bacillus subtilis N11. Plant Soil 344:87-97. https://link.springer. com/article/10.1007/s11104-011-0729-7. [ Links ]
Recibido: 04 de Julio de 2022; Aprobado: 27 de Diciembre de 2022











 text in
text in 


