Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.41 n.1 Texcoco Jan. 2023 Epub Aug 11, 2023
https://doi.org/10.18781/r.mex.fit.2206-4
Notas Fitopatológicas
Evaluación in vitro de fungicidas biológicos contra Curvularia eragrostidis, hongo fitopatógeno del cultivo de piña
1 Facultad de Ciencias Biológicas y Agropecuarias, Universidad de Colima, Km 40 autopista Colima-Manzanillo, C.P. 28934, Tecomán, Colima, México.
Se evaluó la eficacia in vitro contra Curvularia eragrostidis de dos productos a base de extractos de plantas, System Max® (Mimosa tenuiflora + Quercus robur) y Sedric 4X® (Yucca schidigera), y tres productos a base de agentes de control biológico, BliteFree® (Streptomyces spp.), BioFungus Clean® (Bacillus subtilis + B. thuringiensis + Trichoderma harzianum + T. viride) y Tonka® (Bacillus subtilis + T. harzianum + Streptomyces lydicus). El fitopatógeno fue aislado de manchas foliares en plantas de piña (Ananas comosus). La cepa fue identificada por reconstrucción filogenética usando las secuencias rDNA ITS1-5.8S-ITS2 como Curvularia eragrostidis. En bioensayos dosis respuesta se evaluaron cinco concentraciones: 0 (control), 0.125, 0.25, 0.5 y 1.0% de cada producto comercial. Se midió el crecimiento diario del micelio (CDM), la inhibición del crecimiento del micelio (% ICM) y la concentración letal media (CL50). Sedric 4X® mostró el% ICM más alto (75%) a la concentración más alta, mientras que Tonka® mostró el% ICM más alto (65%) a la concentración más baja, siendo constante (65.3-66.9%) en todas las concentraciones probadas. Los valores más bajos de CL50 los alcanzaron Tonka® (0.008%), BliteFree (0.015%) y BioFungus Clean® (0.017%). En cambio, los CL50 más altos los alcanzaron Sedric 4X® (0.260%) y System Max® (3.5%). SystemMax® y Sedric 4X® mostraron una relación positiva entre concentración y% ICM, a pesar de sus valores altos de CL50. Los biofungicidas fueron más efectivos que los fungicidas a base de extractos de plantas.
Palabras clave Bacillus; CL50; fitopatógeno; Trichoderma; Streptomyces
In vitro effectiveness of two plant extract-based products, System Max® (Mimosa tenuiflora + Quercus robur) and Sedric 4X® (Yucca schidigera); and three biological control agents-based products, BliteFree® (Streptomyces spp.), BioFungus Clean® (Bacillus subtilis + B. thuringiensis + Trichoderma harzianum + T. viride), and Tonka® (Bacillus subtilis + Trichoderma harzianum + Streptomyces lydicus) were evaluated against Curvularia eragrostidis, an associated fungus to leaf spot disease in pineapple (Ananas comosus) plants. The strain was identified by phylogenetic reconstruction using the rDNA ITS1-5.8S-ITS2 sequences as Curvularia eragrostidis. Through a doses response-bioassays five concentrations: 0 (control), 0.125, 0.25, 0.5 and 1.0% of each commercial product were tested. Daily mycelial growth (DMG), mycelial growth inhibition (% MGI) and the lethal mean concentration (LC50) were calculated. Sedric 4X® showed the highest% MGI (75%) at highest concentration, while Tonka® showed the highest% MGI (65%) at lower concentration, being constant (65.3-66.9%) at all the concentrations tested. The lowers values of EC50 were achieved by Tonka® (0.008%), BliteFree® (0.015%) and BioFungus Clean® (0.017%). In contrast, the highest CE50 were reached by Sedric 4X® (0.260%) and System Max® (3.5%). SystemMax® and Sedric 4X®, showed a positive relation between concentration and% MGI, despite its highest CE50 values. The biofungicides seem to be more effective against C. eragrostidis than plant extracts fungicides.
Key words: Bacillus; CL50; phytopathogen; Trichoderma; Streptomyces
La piña (Ananas comosus) es el tercer cultivo tropical más importante en todo el mundo (Sanewski et al., 2018). Curvularia clavata es el agente causal de la mancha foliar en plantas de piña, con una incidencia de entre 35 y 58% en China (Zhong et al., 2016). Curvularia eragrostidis causa pérdidas poscosecha en frutos de piña en Brasil (Ferreira et al., 2014). Curvularia sp. causa mancha foliar en campos de cultivo de piña en Nicaragua (García-Osorio y Orozco-Gomez, 2016). México es el 7° productor de piña (INEGI, 2019) a nivel mundial. Recientemente, Maldonado-Michel et al. (2021) reportaron a C. eragrostidis como el agente causal de la mancha foliar de la piña en el estado de Colima (Pacífico Centro de México). Sin embargo, ese estudio carece de datos moleculares para una identificación precisa de las especies. También probaron la actividad antifúngica de los extractos de semillas de Swietenia humilis. No obstante, el manejo local regular de enfermedades fúngicas incluye fungicidas químicos, a pesar de que los principales efectos secundarios de estos productos están relacionados con daños a la salud humana, impacto ambiental severo y desarrollo de cepas resistentes (Heydari y Pessarakli, 2010). Por lo tanto, existe la necesidad de evaluar métodos alternativos como el uso de agentes de control biológico (ACB) y extractos de plantas (EP), que han demostrado ser más seguros y eficientes (Cerqueira-Sales et al., 2016) contra C. eragrostidis. En Colima, México, están disponibles algunos biofungicidas ACB y EP, pero no se han probado localmente y de manera adecuada. El objetivo principal de esta investigación fue identificar el agente causal de la enfermedad de la mancha foliar en piña y evaluar la efectividad in vitro de cinco productos biológicos comerciales contra C. eragrostidis.
Se tomaron muestras al azar de plantas con síntomas de mancha foliar en una plantación de piña (cv. MD2) en Tecomán, Colima, México (18° 47’ 41.3” N; 103° 51’ 26.9” O). Se recolectaron diez muestras en 2 hectáreas. El aislamiento fúngico se realizó de acuerdo con Orozco-Santos et al. (2004). Las hojas infectadas se cortaron, se lavaron con NaClO al 1% durante 3 min, se enjuagaron con agua destilada en autoclave y se secaron en papel de filtro estéril. El tejido vegetal desinfectado se molió en nitrógeno líquido y luego se liofilizó. Esto sirvió como inóculo en 400 mL de caldo Czapek agitado a 2 Hz a temperatura ambiente por 3 días. Posteriormente, se inocularon 50, 100 y 150 μL de cultivo en cajas de Petri con PDA y se incubaron a 31 °C durante 3 días. Las colonias individuales se transfirieron e incubaron durante 5 días y se usaron como inóculo para microcultivos en portaobjetos con PDA (Zhong et al., 2016).
La identificación morfológica se realizó siguiendo a Ferreira et al. (2014), Manamgoda et al. (2012) y Rocha-Santos et al. (2018). Se utilizaron muestras de cultivos monoconidiales para la identificación molecular mediante la secuenciación de la región parcial ITS utilizando los cebadores ITS1 e ITS4 (White et al., 1990). Las secuencias se inspeccionaron mediante cromatogramas utilizando el programa Sequencher™ v. 5.2.3. La secuencia curada se usó para consulta BLASTN en el GenBank de NCBI. Después se realizó un MegaBlast y se descargaron de GenBank 48 secuencias de Curvularia muy similares (Figura 1) y dos secuencias de grupos externos. Estas secuencias se alinearon usando el algoritmo CLUSTALW con parámetros predeterminados (Thompson et al., 2003) y se editaron manualmente utilizando el paquete de software MEGA X (Tamura et al., 2013). El análisis filogenético molecular consistió en un análisis filogenético de Máxima Verosimilitud (ML) con el modelo Kimura de 2 parámetros G+I (Kimura, 1980). Los huecos fueron tratados como deleciones parciales con un 95% de cobertura, utilizando un método heurístico NNI (intercambio del vecino más cercano, por sus siglas en inglés) para refinar la topología del árbol con 1000 réplicas de arranque. Los árboles se enraizaron utilizando Bipolaris maydis (=Cochliobolus heterostrophus) como clado hermano y Alternaria alternata como grupo externo (Manamgoda et al., 2012; Tan et al., 2018).

Figura 1 Análisis filogenético molecular de especies de Curvularia basado en el método de Máxima verosimilitud y utilizando el modelo Kimura de 2 parámetros (G+I). Se muestra el árbol con el logaritmo de probabilidad más alto (-1962.89). El porcentaje de árboles en los que los taxones asociados se agruparon se muestra junto a las ramas, según 1000 réplicas de arranque. El número de accesión se indica en cada taxón. Los nombres de taxones marcados con * son material ex-tipo. El país de origen de los aislamientos está entre paréntesis.
El Cuadro 1 muestra los detalles de los biofungicidas comerciales. Se evaluaron cuatro dosis con distintas concentraciones: 1.0, 0.5, 0.25 y 0.125% (v/v o p/v) en 20 mL de PDA + biofungicida. Los productos sólidos se expresaron en mg L-1 y los líquidos en mL L-1. Las cajas de Petri con PDA suplementadas se prepararon de dos formas: 1) a base de EP y 2) a base de ACB. Los productos de EP (System Max®/Sedric 4X®) se agregaron al PDA antes de la solidificación y después se sembraron en cajas de Petri. Los productos ACB se mezclaron en el PDA y se vertieron 20 mL en cajas de Petri. En cada placa de Petri se inoculó un disco de 9 mm de diámetro del hongo patógeno de 7 días de edad y se incubó a 29 °C durante 10 días.
Cuadro 1 Características de los productos biológicos evaluados en el bioensayo dosis respuesta.
| Commercial name | Active ingredient | Recommended doses | Concentration |
|---|---|---|---|
| System Max® (Plantoria) | Mimosa tenuiflora extract + Quercus robur extract | 4.5 mL L-1 | 60 and 30 % |
| Sedric 4X® (BioCampo) | Yucca schidigera extract | 3 L ha-1 | 2.16 % |
| BliteFree® (Altus Biopharm) | Streptomyces spp. | 1.5 L ha-1 | 60 % |
| BioFungus Clean® (Syme Agroinsumo) | Bacillus subtilis + B. thuringiensis + Trichoderma harzianum + T. viride | 2 L ha-1 | 1.0, 1.0, 1.0 and 1.0 % |
| Tonka® (Novigo Natura) | B. subtilis + T. harzianum + Streptomyces lydicus | 1.5 kg ha-1 | 1x108 UFC g-1 1x107 UFC g-1 and 1x106 UFC g-1 |
La tasa de crecimiento diario (TCD) se calculó midiendo el diámetro de la colonia del patógeno cada 24 horas durante 5 días usando la fórmula TCD = [(R1-R0)/(T1-T0)], donde R1 y R0 es el crecimiento del diámetro de la colonia (mm) y T1 y T0 es el tiempo (días) (Bahekar et al., 2017). La inhibición del crecimiento micelial del patógeno (% ICM) se calculó como % ICM = [(C - T)/C] x 100%, donde C = diámetro de crecimiento del control (mm) y T = diámetro de crecimiento del tratamiento (mm) (Bahekar et al., 2017). Se calcularon las concentraciones efectivas media y noventa (CE50 y CE90) mediante un análisis Probit en SAS 9.0 (Manzo-Sánchez et al., 2018). El diseño experimental consistió en un diseño completamente al azar con arreglo factorial combinatorio, siendo A la marca del producto biológico y B las diferentes dosis de cada producto. Cinco productos biológicos, cuatro dosis cada uno, y un control (sin producto). Cada tratamiento tuvo seis repeticiones, con un total de 126 unidades experimentales. El análisis de datos de TCD se llevó a cabo con ANOVA y comparación de medias utilizando la diferencia mínima significativa (DMS), con P=0.05. El porcentaje de datos de ICM se transformó utilizando la ecuación de arcsen (% ICM)½ para obtener una distribución aproximadamente normal y someter a análisis más tarde. La CE50 se calculó con un análisis Probit. Finalmente, se realizó un análisis de regresión lineal (Y=mX+b) entre la concentración del producto (X) y el porcentaje de ICM (Y).
El aislado mostró características morfológicas macro y microscópicas coincidentes con Curvularia eragrostidis, como una colonia gris algodonosa (7.7 cm, 5 días de incubación) que se tornó negra aterciopelada con bordes regulares. Conidios elipsoidales, distoseptados, de 21.6-24.9 × 11.6-13.3 µm. Conidióforos marrones, agrupados y septados. El micelio se compone de hifas septadas oscuras. El análisis filogenético molecular de especies de Curvularia, basado en el método de máxima verosimilitud, agrupó la secuencia con la anterior con alto apoyo estadístico, confirmando la identidad del aislado estudiado como C. eragrostidis. Como era de esperar, el material chino es ligeramente diferente de los aislamientos de Malasia, Indonesia y México. El subclado más cercano de C. eragrostidis incluye C. intermedia, C. pseudointermedia y C. brachyspora (Figura 1). Todas las secuencias fueron agrupadas dentro del género monofilético Curvularia con alto apoyo estadístico, separadas de Bipolaris maydis, un clado anamórfico hermano, un resultado que coincide con Manamgoda et al. (2012) y Tan et al. (2018).
El crecimiento diario de C. eragrostidis fue afectado por los productos biológicos, con diferencias altamente significativas (P≤0.0001, Cuadro 2). La TCD del grupo control fue de 1.6 cm día-1, mientras que Tonka® mostró la tasa de crecimiento más baja con las cuatro concentraciones evaluadas, con una TCD media de 0.015 cm día-1, que es 106.6 veces menor que la del grupo control. La actividad de BioFungus Clean® tuvo un efecto similar en las tres primeras concentraciones (1.0, 0.5 y 0.25%) con una media de 0.082 cm día-1. SystemMax® y Sedric 4X® solo redujeron la TCD de C. eragrostidis a partir de una concentración de 0.25% con 1.47 y 0.27 cm día-1; sin embargo, al 1.0% (0.048 cm día-1), la reducción fue estadísticamente igual entre Tonka®, Biofungus Clean® y BliteFree®, con 0.02, 0.04 y 0.021 cm día-1, respectivamente. El%ICM logró diferencias significativas (P≤0.0001) a los 5 días después de la inoculación. Sedric 4X® mostró el mayor porcentaje de inhibición al 1% de concentración (86.8%), 2.5 veces mayor que System Max® y 1.3 veces mayor que BliteFree® (63.7%) a la misma concentración. Este valor fue significativamente mayor (P≤0.0001) que las demás concentraciones del mismo producto (Cuadro 3). Por otro lado, Tonka® fue efectivo en todas las concentraciones, sin diferencias estadísticas (P≤0.2657) entre las cuatro dosis, con un promedio de 68.97% de inhibición. De manera similar, Biofungus Clean® tuvo el mismo efecto de inhibición (P≤0.0871) en todas las concentraciones, con una inhibición 1.2 veces menor que Tonka®. BliteFree® registró la tasa de inhibición más alta (P≤0.0002), con 63.7% a la concentración más alta, mientras que las concentraciones más bajas produjeron reducciones de 55.8 y 58.6%. En contraste, System Max® tuvo un pobre efecto contra C. eragrostidis, 5.1 veces menor que Tonka® (0.125%). El grupo control tuvo un crecimiento micelial radial de 7.7 cm. La Figura 2 muestra los resultados de los ensayos de inhibición con cuatro dosis de los cinco productos después de 5 días.
Cuadro 2 Tasa de crecimiento diario in vitro (cm día-1) de Curvularia eragrostidis bajo diferentes dosis de productos biológicos.
| Commercial products | Doses (%) | |||
|---|---|---|---|---|
| 0.125 | 0.25 | 0.5 | 1.0 | |
| Control | 1.635±0.018 b | 1.635±0.018 e | 1.635±0.018 c | 1.635±0.018 c |
| System Max® | 1.698±0.007 b | 1.476±0.015 d | 1.298±0.031 b | 1.186±0.057 b |
| Sedric 4X® | 1.571±0.056 b | 0.27±0.016 c | 0.173±0.008 a | 0.048±0.007 a |
| Tonka® | 0.01±0.006 a | 0.028±0.006 a | 0.013±0.008 a | 0.018±0.013 a |
| BioFungus Clean® | 0.026±0.009 a | 0.12±0.054 b | 0.086±0.030 a | 0.04±0.010 a |
| Blite Free® | 0.036±0.004 a | 0.026±0.009 a | 0.181±0.169 a | 0.021±0.010 a |
| P-value | 0.00001 | 0.00001 | 0.00001 | 0.00001 |
| F= | 1135.94 | 523.85 | 46.12 | 353.54 |
Medias (± ES) con diferente literal en la misma columna indica diferencias significativas (DMS, P≤0.05).
Cuadro 3 Inhibición del crecimiento micelial (%) de Curvularia eragrostidis bajo diferentes dosis de productos biológicos.
| Commercial products | Doses (%) | |||
|---|---|---|---|---|
| 0.125 | 0.25 | 0.5 | 1.0 | |
| System Max® | 4.51 ± 0.77 d | 5.77 ± 0.75 d | 13.16 ± 1.78 c | 24.16 ± 1.29 e |
| Sedric 4X® | 7.13 ± 1.22 c | 57.48 ± 0.55 b | 68.87 ± 0.39 a | 74.96 ± 0.14 a |
| Tonka® | 65.31 ± 0.25 a | 65.77 ± 0.62 a | 66.91 ± 0.96 a | 66.72 ± 0.61 b |
| BioFungus Clean® | 53.47 ± 1.15 b | 47.64 ± 3.62 c | 51.57 ± 2.08 b | 56.22 ± 1.27d |
| Blite Free® | 53.90±0.93 b | 56.30 ± 0.64 b | 52.95 ± 2.13 b | 61.45 ± 1.02 c |
| P-value | 0.00001 | 0.00001 | 0.00001 | 0.00001 |
| F= | 677.44 | 178.68 | 137.32 | 353.54 |
Medias (± ES) con diferente literal en la misma columna indica diferencias significativas (DMS, P≤0.05).

Figura 2 Crecimiento micelial de Curvularia eragrostidis en PDA suplementado con cinco dosis de productos biológicos.
Tonka® logra un CL50 de 0.008%, que fue el valor más bajo en comparación con el resto de los tratamientos, 32.2 veces menor que Sedric 4X® (0.260%) y 449.8 veces menor que System Max® (3.59%) (Cuadro 4). Sin embargo, BliteFree® y BioFungus Clean® también mostraron buenos valores con 0.015 y 0.017%, respectivamente. En la CE90, el mejor resultado fue nuevamente para Tonka® con 0.040%, 9.7 veces menor que BioFungus Clean® y 4.9 veces menor que BliteFree®. El análisis de regresión lineal entre los porcentajes de inhibición y las dosis del producto (Figura 3) indicó una alta correlación entre las concentraciones de System Max® (r=0.86, P≤0.0001) y Sedric 4X®, (r=0.69, P≤0.0001), y sus porcentajes de inhibición, con diferencias muy significativas. Por el contrario, BliteFree® mostró una baja correlación entre la concentración y la inhibición (r=0.40, P≤0.0008). Por otro lado, Tonka® y BioFungus Clean® no mostraron diferencias estadísticamente significativas (P≤0.1191 y P≤0.0939, Cuadro 4).
Cuadro 4 Concentración efectiva media (CE50) y noventa (CE90) de productos biológicos sobre Curvularia eragrostidis.
| Commercial products | EC50 (%) | FL (%) | Slope | Probit equation | Chi- X2 | P>Chi- X2 |
|---|---|---|---|---|---|---|
| System Max® | 3.599 | 2.32-7.01 | 0.8070 | y=0.8070(x)-0.4485 | 85.51 | ≤0.0001 |
| Sedric 4X® | 0.260 | 0.24-0.27 | 2.2153 | y=2.2153(x)+1.2974 | 536.62 | ≤0.0001 |
| Tonka® | 0.008 | NC | 0.0650 | y=0.0650(x)+0.5264 | 121.15 | ≤0.0001 |
| BioFungus Clean® | 0.017 | NC | 0.0921 | y=0.0921 (x)+0.1631 | 12.70 | ≤0.0004 |
| BliteFree® | 0.015 | NC | 0.1579 | y=0.1579 (x)+0.2876 | 38.79 | ≤0.0001 |
| Commercial products | EC90 (%) | FL (%) | Slope | Probit equation | Chi- X2 | P>Chi- X2 |
| System Max® | 139.405 | 47.22-758.51 | 0.8070 | y=0.8070(x)+(-0.4485) | 85.51 | ≤0.0001 |
| Sedric 4X® | 0.984 | 0.885-1.110 | 2.2153 | y=2.2153(x)+1.2974 | 536.62 | ≤0.0001 |
| Tonka® | 0.040 | NC | 0.0650 | y=0.0650(x)+0.5264 | 121.15 | ≤0.0001 |
| BioFungus Clean® | 0.388 | NC | 0.0921 | y=0.0921 (x)+0.1631 | 12.70 | ≤0.0004 |
| BliteFree® | 0.197 | NC | 0.1579 | y=0.1579 (x)+0.2876 | 38.79 | ≤0.0001 |
LF=limites fiduciales, NC=no estimado por el modelo, X=concentraciòn del producto biològico, Y=porcentaje de inhibiciòn. .
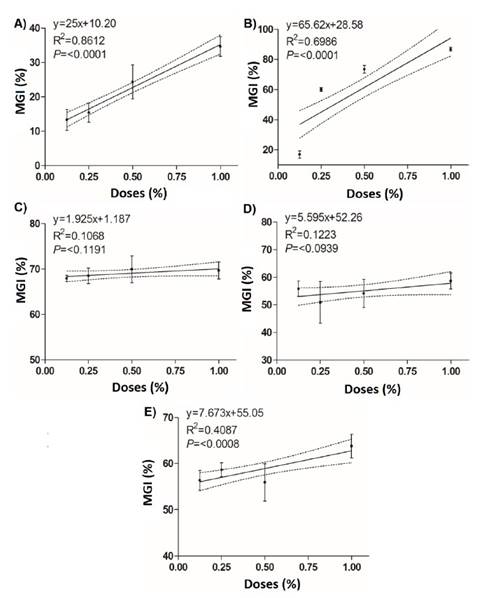
Figura 3 Regresión lineal entre la inhibición del crecimiento micelial (%) de Curvularia eragrostidis y las dosis de los productos biológicos. A) Sistema Max®; B) Sedric 4X®; C) Tonka®; D) BioFungus Clean® y E) BliteFree®.
La enfermedad de la mancha foliar causada por C. eragrostidis es una enfermedad emergente de la producción de piña en Colima, México (Maldonado-Michel et al., 2021). El presente estudio corrobora morfológica y molecularmente la identidad del agente causal. En América del Sur, C. eragrostidis ha sido reportado como patógeno vegetal en plantas de piña por Ferreira et al. (2014), con características similares a las identificadas en el presente estudio. Se han utilizado extractos de plantas para controlar patógenos vegetales en agricultura biológica y orgánica. La-Torre et al. (2014) evaluaron la eficiencia in vitro de Mimoten®, un extracto de Mimosa tenuiflora (80.0%), contra Alternaria alternata y Botrytis cinerea. La inhibición máxima obtenida fue de 19.2% y 14.1%, respectivamente, a dosis máximas (1.0%). No hay reportes del uso de M. tenuiflora contra C. eragrostidis. System Max®, usado en el presente estudio, contiene M. tenuiflora, pero complementado con extracto de Quercus sp. y ácido gálico, lo que aumentó la inhibición hasta 34.6%. La actividad antibacteriana y antifúngica de los extractos de Quercus han sido probados antes. Söhretoglu et al. (2007) probaron extractos metanólicos de cuatro especies de Quercus contra bacterias gram (+) y (-) y tres bacterias Candida spp. Los extractos fueron más efectivos contra los hongos que contra las bacterias. En hongos filamentosos, Yeo et al. (2008) probaron Q. mongolica en extractos acuosos, metanólicos y etanólicos contra Botrytis cinerea, siendo el extracto acuoso más efectivo. El ácido gálico y otros compuestos fenólicos se han probado como antifúngicos contra patógenos humanos y vegetales.
En Trichophyton rubrum, el ácido gálico (50.0 μg mL-1) redujo la actividad de la enzima esterol 14α-desmetilasa P450 (CYP51) y de la enzima escualeno epoxidasa, alterando la membrana fúngica (Li et al., 2017). En el presente estudio, Sedric 4X®, extracto de Y. schidigera mostró 86% de inhibición en la concentración más alta. Wulff et al. (2012) evaluaron el efecto del extracto de Y. schidigera contra C. lunata de sorgo, no se logró inhibición (0%) cuando se utilizó una concentración de 10.0% (v/v) del extracto de Y. schidigera. Estas plantas son ricas en saponinas, que pueden alterar las membranas celulares y tienen un efecto tóxico sobre los hongos. Maldonado-Michel et al. (2021) probaron hexano, acetato de etilo, diclorometano y metanol para extractos de Swietenia humilis contra este aislado de C. eragrostidis, siendo el acetato de etilo, a 500 mg L-1, el más efectivo con 68.0% de ICM. Los principales metabolitos secundarios de S. humilis son los limonoides, un tipo de triterpenoides que se encuentran en las semillas (Ovalle-Magallanes et al., 2015).
Se ha reportado la inhibición completa (100.0%) de la germinación de esporas de C. lunata usando extractos orgánicos de Cinnamomum zeylanicum a la concentración más baja (50 μg mL-1) y actividad fungicida completa a la concentración más alta (500 μg mL-1), pero los extractos acuosos no fueron eficientes (Mishra et al., 2009). Por otro lado, Akinbode (2010) evaluó in vitro la eficacia de extractos acuosos de hojas de Gliricidia sepium, Tithonia diversifolia, Phyllanthus amarus y Morinda lucida para controlar C. lunata. Al 100% de concentración, todos los extractos suprimieron el crecimiento del patógeno.
Por otro lado, BliteFree® logró una inhibición de 55.6-67.7% contra C. eragrostidis. Estos resultados son similares a los reportados por Evangelista-Martínez (2014), quien evaluó Streptomyces spp. contra Curvularia sp., logrando un 55.0% de inhibición del crecimiento del patógeno vegetal. Wonglom et al. (2019) confrontaron C. lunata aislada de Brassica rapa con S. angustmyceticus (NR8-2), logrando una inhibición del 69.0%. Los mecanismos de antagonismo de Trichoderma spp. contra patógenos vegetales incluyen antibiosis, micoparasitismo, resistencia inducida de la célula huésped, competencia por nutrientes y nicho (Ghazanfar et al., 2018). Tekade et al. (2017) evaluaron T. viride y T. harzianum contra C. lunata, logrando 60.8 y 50.7% de inhibición, respectivamente, en 7 días a 27 °C. Estos resultados son similares a los obtenidos con BioFungus Clean®, que provocó una inhibición del 54.8% contra C. eragrostidis después de 5 días. Bacillus spp. es uno de los géneros más estudiados como ACB ya que las presencias que comprende presentan una actividad bioquímica diversa contra patógenos de plantas (Layton et al., 2011). Se ha informado que Bacillus spp. induce defectos en la membrana celular y muerte celular en las hifas fúngicas, cuando la membrana celular se destruye, el núcleo y el protoplasto se exudan. Entre los metabolitos secundarios secretados por Bacillus spp., se han reportado proteínas antimicrobianas con componentes activos como paeonol, palmitato de etilo y ácido oxálico, que son capaces de inhibir la esporulación y el crecimiento micelial en hongos patógenos de plantas (Ku et al., 2021).
Basha y Ulaganathan (2002) evaluaron la cepa BC121 de Bacillus, productora de quitinasa, contra C. lunata, registrando una inhibición de hasta 60.0%. Las imágenes del microscopio electrónico de barrido mostraron una clara lisis de hifas y degradación de la pared fúngica. Orberá-Ratón et al. (2012) probaron cinco aislados de rizosfera de B. subtilis contra C. lunata, registrando una inhibición de hasta 61.0% (SR/A-1), y contra Curvularia gudauskasii, logrando una inhibición de hasta 71.0% (SR/B-16). Los autores observaron vacuolización, formación de bulbos, hinchazón de hifas, crecimiento e inhibición de la formación de conidios. Sin embargo, otras cepas han mostrado resultados diferentes. Por ejemplo, Fleitas-Centurion y Grabowsky-Ocampos (2015) evaluaron Bacillus sp. (500 uL) contra Curvularia sp., registrando 31.0% de inhibición. Los valores reportados anteriormente son heterogéneos, como ocurrió en el presente estudio con BioFungus Clean® y Tonka®.
Sunpapao et al. (2018) enfrentaron a C. oryzae contra S. hygroscopicus, T. harzianum y una especie endofítica de Trichoderma (V76-12). Este fue el tratamiento más efectivo para reducir la mancha foliar de plántulas de palma aceitera, con 85.71% de ICM. La formulación de Tonka® consta de tres consorcios de especies: un hongo (T. harzianum), una especie de Bacillus (B. subtilis) y una actinobacteria (S. lydicus). Estos resultados son interesantes, ya que BioFungus Clean® tiene cuatro especies, dos bacterias (B. subtilis y B. thuringiensis) y dos hongos (T. harzianum y T. viride). Esta situación sugiere que es más eficiente una composición más diversa en términos filogenéticos, bioquímicos y ecológicos que un alto número de microorganismos estrechamente relacionados. Esto es coherente con el concepto de suelos supresores, en los que las enfermedades de las plantas no se desarrollan incluso con la presencia de un patógeno vegetal en un huésped susceptible y en condiciones favorables. Los patógenos pueden o no establecerse, persistir, causar poco o ningún daño, o la enfermedad puede manifestarse, pero desaparecer con el tiempo, lo que se atribuye ampliamente a los microbiomas del suelo. La supresión general depende de una gran diversidad y abundancia de microorganismos compitiendo por espacio y recursos, mientras que la supresión específica depende del efecto directo de individuos o grupos de microorganismos sobre el ciclo de vida de un patógeno (Raaijmakers y Mazola, 2016).
La investigación de microorganismos con potencial como ACB es un desafío porque el comportamiento in vitro puede ser prometedor, pero la aplicación en tierras agrícolas da como resultado fluctuaciones en la efectividad. La producción de metabolitos es un fenómeno común en las relaciones antagónicas. Sin embargo, su síntesis conlleva un costo energético que debe ser compensado con los beneficios y que puede ser influenciado por sustancias tóxicas y la proporción de cepas. Por ejemplo, el antagonismo bacteriano aumenta con las similitudes del metabolismo de la fuente de carbono (Russel et al., 2017). Podemos diferenciar los microorganismos en cepas productivas y sensibles que interactúan según la diversidad microbiana y su entorno (Kelsic et al., 2015). La producción de metabolitos y sus procesos relacionados disminuyen la tasa de crecimiento. A pesar de ello, las cepas productivas aumentan frente a las sensibles, incluso con bajas tasas de crecimiento. La fuente de carbono no es un problema cuando las cepas se cultivan in vitro. Sin embargo, en las tierras agrícolas la materia orgánica fluctúa según el tipo de suelo y de su manejo. Asimismo, el uso de fungicidas y bactericidas afecta a los microorganismos nativos. Además de estudiar la diversidad de microorganismos del suelo para desarrollar productos biológicos, otra alternativa es el diseño de comunidades sintéticas de microorganismos “syncoms”. Estos consorcios altamente diversos resultan más cercanos a las comunidades naturales, con mayor complejidad y resiliencia (Rábago-Aguilar et al., 2020).
El presente estudio proporciona los valores de CE50 de cinco biofungicidas contra C. eragrostidis. Los valores de CE50 indican la cantidad de biofungicida requerida para inhibir el 50% del crecimiento fúngico. No existen muchos reportes de la CE50 de productos biológicos o biorracionales contra especies de Curvularia. El presente estudio proporciona estos valores, que son útiles para definir las dosis a evaluar en condiciones in situ. En un estudio previo, Kumar et al. (2020) evaluaron la actividad antifúngica del aceite esencial de Cedrus deodara contra C. lunata, Alternaria alternata y Bipolaris spicifera, reportando valores de EC50 de 2.22, 3.71 y 4.8 μL/mL para cada hongo, respectivamente. Por su parte, García-Ordaz et al. (2021) reportaron los valores de CE50 de fungicidas químicos contra C. eragrostidis. Los valores más bajos se registraron con System Cu®, Mancozeb® 80 WP y Tecto® 60 con 0.024, 0.066 y 0.076%, respectivamente. Se deben realizar más estudios para probar la CE50 en condiciones de campo en la producción de piña.
En conclusión, el hongo asociado a la enfermedad de la mancha foliar en plantas de piña correspondió a Curvularia eragrostidis según los análisis morfológicos y moleculares. Tonka® fue el mejor biofungicida contra C. eragrostidis, según la CE50. Mientras que Sedric 4X® logró el mayor% de ICM en la dosis más alta estudiada (1.0%).
Literature cited
Akinbode OA. 2010. Evaluation of antifungal efficacy of some plant extracts on Curvularia lunata, the causal organism of maize leaf spot. African Journal of Environmental Science and Technology 4(11):797-800. https://doi.org/10.4314/ajest.v4i11.71351 [ Links ]
Bahekar AM, Ingle RW and Kendre VP. 2017. Efficacy of fungicides and bioagent against fungal pathogens of Aloe vera. International Journal of Chemistry Studies 5(4):1540-1543. https://www.chemijournal.com/archives/?year=2017&vol=5&issue=4&ArticleId=845 [ Links ]
Basha S and Ulaganathan K. 2002. Antagonism of Bacillus species (strain BC121) towards Curvularia lunata. Current Science 82(12):1457-1463. https://www.jstor.org/stable/24106181 [ Links ]
Cerqueira-Sales MD, Barcellos-Costa H, Fernandes PMB, Aires-Ventura J and Dummer-Meira D. 2016. Antifungal activity of plant extracts with potential to control plant pathogens in pineapple. Asian Pacific Journal of Tropical Biomedicine 6 (1):26-31. https://doi.org/10.1016/j.apjtb.2015.09.026 [ Links ]
Evangelista-Martínez Z. 2014. Isolation and characterization of soil Streptomyces species as potential biological control agents against fungal plant pathogens. World Journal of Microbiology and Biotechnology 30(5):1639-1647. https://doi.org/10.1007/s11274-013-1568-x [ Links ]
Ferreira APS, Pinho DB, Machado AR and Pereira OL. 2014. First report of Curvularia eragrostidis causing postharvest rot on pineapple in Brazil. Plant Disease 98(9):1277-1277. https://doi.org/10.1094/PDIS-03-14-0288-PDN [ Links ]
Fleitas-Centurión A y Grabowski-Ocampos CJ. 2015. Control biológico del complejo de hongos causantes de la mancha foliar en maíz dulce (Zea mays var. saccharata) con bacterias benéficas. Investigación Agraria 16(2): 83-92. http://scielo.iics.una.py/scielo.php?script=sci_abstract&pid=S2305-06832014000200002&lng=es&nrm=iso&tlng=es [ Links ]
García-Osorio MS y Orozco-Gómez BA. 2016. Etiología de enfermedades en el cultivo de piña (Ananas comosus L. cv. Monte lirio) y pruebas de antagonismo “in vitro” con Trichoderma. Master Thesis, Universidad Nacional Agraria, Managua, Nicaragua. 51 pp. [ Links ]
Ghazanfar MU, Raza M, Raza W and Qamar MI. 2018. Trichoderma as potential biocontrol agent, its exploitation in agriculture. Plant Protection 2(3):109-135. https://esciencepress.net/journals/index.php/PP/article/view/3142/1571 [ Links ]
Heydari A and Pessarakli M. 2010. A review on biological control of fungal plant pathogens using microbial antagonists. Journal of Biological Science 10(4): 273-290. https://doi.org/10.3923/jbs.2010.273.290 [ Links ]
INEGI (2019). Instituto Nacional de Estadística y Geografía. 2019. https://www.inegi.org.mx. Accesed: May 5, 2021. [ Links ]
Kelsic ED, Zhao J, Vetsigian K and Kishony R. 2015. Counteraction of antibiotic production and degradation stabilizes microbial communities. Nature 521(7553): 516-519. https://doi.org/10.1038/nature14485 [ Links ]
Kimura M. 1980. A simple method for estimating evolutionary rate of base substitutions through comparative studies of nucleotide sequences. Journal of Molecular Evolution 16(2):111-120. https://doi.org/10.1007/BF01731581 [ Links ]
Kumar A, Suravajhala R and Bhagat M. 2020. Bioactive potential of Cedrus deodara (Roxb.) Loud essential oil (bark) against Curvularia lunata and molecular docking studies. SN Applied Sciences 2:1045. https://doi.org/10.1007/s42452-020-2837-6 [ Links ]
Ku Y, Yang N, Pu P, Mei X, Cao L, Yang X and Cao C. 2021. Biocontrol mechanism of Bacillus subtilis C3 against bulb rot disease in Fritillaria taipaiensis P.Y.Li. Frontiers in Microbiology 12:756329. https://doi.org/10.3389/fmicb.2021.756329 [ Links ]
La-Torre A, Caradonia F, Gianferro M, Molinu MG and Battaglia V. 2014. Activity of natural products against some phytopathogenic fungi. Communication in Agricultural and Applied Biological Sciences 79(3):439-449. https://pubmed.ncbi.nlm.nih.gov/26080478/ [ Links ]
Layton C, Maldonado E, Monroy L, Corrales LC, Sánchez LC. 2011. Bacillus spp.; perspectiva de su efecto biocontrolador mediante antibiosis en cultivos afectados por fitopatógenos. NOVA 9(15):177-187. https://doi.org/10.22490/24629448.501 [ Links ]
Li ZJ, Liu M, Dawuti G, Dou Q, Ma Y, Liu HG and Aibai S. 2017. Antifungal activity of gallic acid in vitro and in vivo. Phytotherapy Research 31(7):1039-1045. https://doi.org/10.1002/ptr.5823. [ Links ]
Maldonado-Michel MA, Muñiz-Valencia R, Peraza-Campos AL, Ramos RCP, Valadez-Ramírez P, Parra-Delgado H and Chan-Cupul W. 2021. Antifungal activity of Swietenia humilis (Meliaceae: Sapindales) seed extracts against Curvularia eragrostidis (Ascomycota: Dothideomycetes). Journal of Plant Disease and Protection 128:471-479. https://doi.org/10.1007/s41348-020-00410-1. [ Links ]
Manamgoda DS, Cai L, McKenzie EH, Crous PW, Madrid H, Chukeatirote E, Shivas RG, Tan YP and Hyde KD. 2012. A phylogenetic and taxonomic re-evaluation of the Bipolaris-Cochliobolus-Curvularia complex. Fungal Diversity 56(1):131-144. https://doi.org/10.1007/s13225-012-0189-2 [ Links ]
Manzo-Sánchez G, Ocón-Pérez R, Chan-Cupul W, Silva-Jiménez E, Sánchez-Rangel JC y Ayala-Zermeño MA. 2018. Actividad antifúngica de extractos etanólicos de propóleo contra Mycosphaerella fijiensis: un estudio in vitro. Scientia Fungorum 47:13-24. https://doi.org/10.33885/sf.2018.47.1189 [ Links ]
Mishra AK, Mishra A, Kehri HK, Sharma B and Pandey AK. 2009. Inhibitory activity of Indian spice plant Cinnamomum zeylanicum extracts against Alternaria solani and Curvularia lunata, the pathogenic dematiaceous moulds. Annals of Clinical Microbiology and Antimicrobials 8(1):1-7. https://doi.org/10.1186/1476-0711-8-9 [ Links ]
García-Ordaz HA, Chan-Cupul W, Buenrostro-Nava MT and Valadez-Ramírez P. 2021. Efectividad in vitro de fungicidas químicos contra Curvularia eragrostidis (Henn.) J. A. Mey, agente causal de la mancha foliar en piña. Scientia Agropecuaria 12(3):429-434. http://dx.doi.org/10.17268/sci.agropecu.2021.047 [ Links ]
Orberá-Ratón T, González-Giro Z, Serrat-Díaz M and Rodríguez-Pérez S. 2012. In vitro growth inhibition of Curvularia gudauskasii by Bacillus subtilis. Annals of Microbiology 62(2):545-551. https://doi.org/10.1007/s13213-011-0290-x [ Links ]
Orberá-Ratón T, Serrat-Diaz M y González-Giro Z. 2009. Potencialidades de bacterias aerobias formadoras de endosporas para el biocontrol en plantas ornamentales. Fitosanidad 13:95-100. https://doi.org/10.1007/s13213-011-0290-x. [ Links ]
Orozco-Santos M, Manzo-Sánchez G, Guzmán-González S, Farías-Larios J y Timmer LW. 2004. Crecimiento y cambios morfológicos de Colletotrichum acutatum Simmonds, agente causal de la antracnosis del Limón Mexicano (Citrus aurantifolia Christm. Swingle) incubado en diferentes medios. Revista Mexicana de Fitopatología 22(3):423-428. https://www.redalyc.org/pdf/612/61222316.pdf [ Links ]
Ovalle-Magallanes B, Medina-Campos ON, Pedraza-Chaverri J and Mata R. 2015. Hypoglycemic and antihyperglycemic effects of phytopreparations and limonoids from Swietenia humilis. Phytochemistry 110:111-119. https://doi.org/10.1016/j.phytochem.2014.11.004 [ Links ]
Raaijmakers JM and Mazzola M. 2016. Soil immune responses. Science 352(6292):1392-1393. https://doi.org/10.1126/science.aaf3252 [ Links ]
Rábago-Aguilar J, Hernández-Navarro E y Sepúlveda-Sánchez HE. 2020. Suelos supresores: ecología microbiana papara el control de enfermedades en plantas. In: Orozco-Mosqueda MC y Santoyo-Pizano G (eds.) Bacterias promotoras del crecimiento vegetal: Aspectos básicos y aplicaciones para una agricultura sustentable. 1rst ed. Fontamara, México. 131-148 pp. [ Links ]
Rocha-Santos PR, Urzêdo-Leão E, Souza-Aguiar RW, Pereira-Melo M and Rodrigues-Santos G. 2018. Morphological and molecular characterization of Curvularia lunata pathogenic to andropogon grass. Bragantia 77(2):326-332. https://doi.org/10.1590/1678-4499.2017258. [ Links ]
Russel J, Roder HL, Madsen JS, Burmolle M, Sorensen SJ. 2017. Antagonism correlates with metabolic similarity in diverse bacteria. Proceedings of the National Academy of Sciences114(40):10684-10688. https://doi.org/10.1073/pnas.1706016114. [ Links ]
Sanewski GM, Bartholomew DP and Paull RE. 2018. The pineapple: botany, production and uses. CABI. https://doi.org/10.1079/9780851995038.0000. [ Links ]
Söhretoglu D, Ekizoglu M, Kiliç E and Sakar MK. 2007. Antibacterial and antifungal activities of some Quercus species growing in Turkey. FABAD Journal of Pharmacy Science 32(3):127-130. https://dergipark.org.tr/en/download/article-file/2253125 [ Links ]
Sunpapao A, Chairin T and Ito SI. 2018. The biocontrol by Streptomyces and Trichoderma of leaf spot disease caused by Curvularia oryzae in oil palm seedlings. Biological Control 123:36-42. https://doi.org/10.1016/j.biocontrol.2018.04.017. [ Links ]
Tamura K, Stecher G, Peterson D, Filipski and Kumar S. 2013. MEGA6: Molecular evolutionary genetics analysis version 6.0. Molecular Biology and Evolution 30:2725-2729. https://doi.org/10.1093/molbev/mst19 [ Links ]
Tan YP, Crous PW and Shivas RG. 2018. Cryptic species of Curvularia in the culture collection of the Queensland Plant Pathology Herbarium. MycoKeys 35(11):1-25. https://doi.org/10.3897/mycokeys.35.25665. [ Links ]
Tekade A, Koche MD, Kothikar RB and Surpam AN. 2017. Efficacy of fungicides and bioagents against Curvularia lunata causing blight of coleus under laboratory conditions. Journal of Medicinal Plants Studies 5(2):189-191. https://doi.org/10.13140/RG.2.2.17611.13600 [ Links ]
Thompson JD, Gibson TJ and Higgins DG. 2003. Multiple sequence alignment using ClustalW and ClustalX. Current Protocols in Bioinformatics 2.3.1-2.3.22. https://doi.org/10.1002/0471250953.bi0203s [ Links ]
White TJ, Bruns T, Lee S and Taylor J. 1990. Amplification and direct sequencing of fungal ribosomal RNA gene for phylogenetics. In: MA Innis, DH Gelfand, J Sninsky, TJ White (Eds.). PCR protocols, a guide to methods and applications San Diego, California, E.U.A, Academic Press. pp. 315-322. https://doi.org/10.1016/b978-0-12-372180-8.50042-1. [ Links ]
Wonglom P, Suwannarach N, Lumyong S, Ito SI, Matsui K and Sunpapao A. 2019. Streptomyces angustmyceticus NR8-2 as a potential microorganism for the biological control of leaf spots of Brassica rapa subsp. pekinensis caused by Colletotrichum sp. and Curvularia lunata. Biological Control 138:104046. https://doi.org/10.1016/j.biocontrol.2019.104046. [ Links ]
Wulff EG, Zida E, Torp J and Lund OS. 2012. Yucca schidigera extract: a potential biofungicide against seedborne pathogens of sorghum. Plant Pathology 61(2):331-338. https://doi.org/10.1111/j.1365-3059.2011.02517.x [ Links ]
Yeo HD, Lee HC, Lim BK, Kim HK, Choi MS and Yang JK. 2008. Antifungal activity of the Quercus mongolica extracts against Botrytis cinerea. Journal of the Korean Wood Science and Technology 36(1):88-101. https://doi.org/10.5658/WOOD.2008.36.1.088. [ Links ]
Zhong LC, Ai YJ, Chun RH and Yi YD. 2016. Identification of Curvularia clavata causing leaf spot on pineapple (Ananas comosus) in China. Canadian Journal of Plant Pathology 38(2):250-253. https://doi.org/10.1080/07060661.2016.1158743. [ Links ]
Recibido: 10 de Junio de 2022; Aprobado: 14 de Diciembre de 2022











 text in
text in 


