Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.40 n.3 Texcoco Sep. 2022 Epub Nov 14, 2022
https://doi.org/10.18781/r.mex.fit.2206-7
Artículos científicos
Extracción de polifenoles de gobernadora, hojasén, y guanábana utilizando ultrasonido-microondas y su efecto contra Alternaria alternata y Fusarium solani
1 Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Campo Experimental Saltillo. Carretera Saltillo-Zacatecas km 8.5, No. 9515, Col. Hacienda de Buenavista, Saltillo, Coahuila, C.P. 25315;
2 Facultad de Ciencias Químicas, Universidad Autónoma de Coahuila, Unidad Saltillo. Blvd. Carranza y Ing. José Cárdenas V. s/n. Col. República Oriente. CP. 25280, Saltillo.
Los cultivos agrícolas se ven afectados por diferentes patógenos que ocasionan daños a la planta, pérdidas en la producción, además se pueden presentar restricciones cuarentenarias por la presencia de algún patógeno. Para el control de fitopatógenos en el mayor de los casos, se emplean productos químicos sintéticos, sin embargo, algunos de estos productos se han asociado a riegos a la salud humana o al ambiente. Por lo que es necesario la búsqueda de alternativas más sustentables de control de estos patógenos. Esta investigación se realizó bajo los siguientes objetivos: extraer polifenoles de hojas de gobernadora, hojasén y guanábana, utilizando: diferentes relaciones masa/volumen (m/v), diferentes concentraciones de etanol, simultáneamente ultrasonido-microondas y determinar el efecto de estos polifenoles contra Alternaria alternata y Fusarium solani. Se obtuvieron polifenoles de hojas de gobernadora, hojasén y guanábana mediante combinación de ultrasonido-microondas, y usando diferentes relaciones masa-volumen y porcentajes de etanol. Además, se observó que el grupo de polifenoles obtenido con la relación masa/volumen (m/v) 1:8 y etanol al 70% (CD) a partir de hojas de Gobernadora y el grupo de polifenoles obtenido con la relación m/v 1:16 y etanol al 70% (CA) a partir de hojas de hojasén fueron las más efectivos contra Fusarium solani inhibiendo 90.4 y 60.67%, respectivamente. En Alternaria alternata no se encontraron diferencias en el efecto de la inhibición por los diferentes grupos de polifenóles evaluados, y se mostraron valores de inhibición entre 50-60% en comparación con el testigo negativo (sin polifenoles). En el perfil de grupo de polifenoles CD obtenido de gobernadora se encontraron diversos compuestos polifenolicos reportados por tener actividad antimicrobiana entre los que destacan: epirosmanol, rosmadiol apigenina, catequina, procianidina C1. Los compuestos polifenolicos aislados de gobernadora, hojasen y guanábana utilizando métodos (ultrasonido-microondas) y disolventes (agua y etanol) amigables con el ambiente presentan actividad antifúngica contra F. solani y A, alternata.
Palabras clave: Inhibición micelial; microondas-ultrasonido; etanol; agua; amigables con él ambiente
Crops are affected by different pathogens that cause damage to the plant and production losses. Quarantine restrictions may also occur due to the presence of a pathogen. In most cases, synthetic chemical products are used to control phytopathogens. However, some of these products have been associated with risks to human health or the environment. Therefore, it is necessary to search for more sustainable alternatives to control these pathogens. This research was carried out under the following objectives: 1. To extract polyphenols from Creosote bush, Tarbush and Soursop leaves using: different mass/volume ratios (m/v), different concentrations of ethanol, simultaneous ultrasound-microwave and 2. To determine the effect of these polyphenols against Fusarium solani and Alternaria alternata. Polyphenols were obtained from Creosote bush, Tarbush and Soursop leaves by combining ultrasound-microwave, and using different mass-volume ratios and ethanol percentages. The group of polyphenols (CD) obtained with a mass/volume (m/v) ratio of 1:8 and 70% ethanol from Creosote bush leaves and the group of polyphenols (CA) obtained with a m/v ratio 1:16 and 70% ethanol from Tarbush leaves were the most effective against Fusarium solani, inhibiting 90.4 and 60.67%, respectively. For Alternaria alternata, no differences were found in the mycelial inhibition by the different groups of evaluated polyphenols, with inhibition values between 50-60% in comparison to the negative control (without polyphenols). In the profile of CD polyphenols group obtained from Creosote bush, different polyphenolic compounds reported to have antimicrobial activity were found, among which the following stand out: epirosmanol, rosmadiol, apigenin, catechin, and procyanidin C1. Polyphenolic compounds isolated from Creosote bush, Tarbush, and Soursop leaves using environmentally friendly methods (ultrasound-microwave) and solvents (water and ethanol) showed antifungal activity against F. solani and A. alternata.
Keywords: Mycelial inhibition; Ultrasound-Microwave; Ethanol; Water; Environment friendly
Alternaria alternata y Fusarium solani son hongos fitopatógenos que causan grandes pérdidas económicas en la agricultura y reducen la disponibilidad de alimentos (Pérez-Rodríguez et al., 2019; Martínez-de la Parte et al., 2021). Alternaria alternata se caracteriza por una infección acelerada (Mata-Santoyo et al., 2018). Cuando la temperatura esta entre 28-30 °C y la humedad relativa mayor a 80%, esta infección puede comenzar o agravarse en un tiempo aproximado de 4 h (Castrillo et al., 2021). La diseminación de las esporas de A. alternata ocurre principalmente por el viento o por salpicaduras de lluvia, y estas esporas pueden sobrevivir el invierno en residuos de cultivos, hasta que las condiciones son favorables para germinar (Abbas et al., 2021). Por otro lado, Fusarium solani ataca principalmente a las plantas en la zona de la base del tallo y raíz (Martínez-Martínez et al., 2020), lo que ocasiona marchitez y amarillamiento de las hojas, y hace que se retrase el crecimiento (Martínez-Solórzano et al., 2020). Bajo condiciones de alta humedad y temperatura de más de 20 °C en el suelo, las plantas se vuelven quebradizas, cuando el ataque de F. solani llega a ser severo. Este patógeno sobrevive en el suelo en restos del cultivo y en plantas vivas, y la maquinaria agrícola puede jugar un papel importante en su propagación (Reyes-Tena et al., 2019). Para el control de estos hongos fitopatógenos se utilizan principalmente funguicidas químicos sintéticos, los cuales, aunque son efectivos, pueden propiciar la generación de resistencia de los hongos hacia el compuesto activo, riesgos para la salud humana y para el ambiente (Abdel-Monaim et al., 2011; Mantecón, 2015). Por lo tanto, se han buscado alternativas más amigables con el ambiente, especialmente compuestos de origen vegetal.
Las plantas sintetizan fitoquímicos entre ellos fitoanticipinas o fitoalexinas, las cuales desempeñan un papel importante en el crecimiento y reproducción de las plantas, de modo que atraen polinizadores y como protección frente a depredadores. Así mismo, contribuyen a las características morfológicas y sensoriales de las plantas y subproductos (Takshak y Agrawal, 2019; Singh y Chandrawat, 2017). El grupo fitoquímico que más se ha estudiado son los compuestos fenólicos (Andrade-Andrade et al., 2018) que tienen capacidad para inhibir la germinación de esporas y el crecimiento de hongos (Rodríguez-Castro et al., 2020; Joaquín-Ramos et al., 2020; Oufensou et al., 2020). Estos compuestos son sintetizados por las vías shikimato, policétido y mevalonato, y se caracterizan por la presencia de uno o varios grupos hidroxilo (-OH) unido a un anillo aromático de 6 carbonos (Gutiérrez-Grijalva et al., 2016). Los polifenoles cuentan con uno o más grupos fenoles al derivar de la fenilalanina u ácido benzoico (Mutha et al., 2021). Una de las características de estos compuestos es su propiedad antioxidante o capacidad para contrarrestar radicales libres, mediante quelado de iones de metales que intervienen en su producción, y a su capacidad para donar un anión de hidrógeno, un electrón no apareado, y reubicarlo dentro de la estructura aromática (García et al., 2019). Dentro de la clasificación de los polifenoles, destacan los flavonoides, los cuales se subdividen en Flavonoles, Flavonas, Catequinas, Flavanonas, Antocianidinas e Isoflavonas (Mutha et al., 2021).
Las actividades biológicas (antimicrobianos, antiviral, anticancerígena, etc.,) atribuidas a los polifenoles, han dado lugar a un gran número de estudios enfocados a su extracción a partir de diversas fuentes vegetales (Zhang et al., 2022). Por otra parte, el potencial biológico de los polifenoles se encuentra limitado por su baja solubilidad y estabilidad frente a factores ambientales tales como: luz, temperaturas elevadas (>50 °C) y a cambios de pH (Costa et al., 2021). Generalmente, la extracción de estos compuestos se realiza a través de técnicas convencionales tales como Soxhlet, percolación, maceraciones, infusiones, etc., las cuales están asociadas a un alto consumo de solventes orgánicos, algunos de los cuales poco amigables para el medio ambiente, y cuyos remanentes limitan la aplicación industrial de los extractos, además estas técnicas convencionales requieren tiempos largos de extracción, implicando un alto consumo energético (Soto-García et al., 2016), y suelen ser laboriosas (Chemat et al., 2019). En las últimas décadas se han propuesto técnicas alternativas para la extracción de polifenoles, dentro de las que destacan el uso de microondas, donde se emplean radiaciones electromagnéticas para generar calor dentro del material vegetal, haciendo más permeables las membranas celulares (Bocker y Silva, 2022) y el ultrasonido que gracias a la cavitación, permite el incremento de transferencia de masa y velocidad de las reacciones químicas, lo que genera lisis celular y separación de los restos celulares por las fuerzas de cohesión del líquido (Chemat et al., 2017). La extracción de polifenoles se ha realizado por ultrasonido o microondas (Chemat et al., 2019), ya sea utilizando uno u otro proceso (Chemat et al., 2017), o bien de forma secuencial (Valdés et al., 2021), sin embargo, son pocos los estudios donde se usan estos procesos simultáneamente para la extracción de polifenoles. Bajo esta perspectiva, el presente estudio tuvo como objetivos: 1. Extraer polifenoles de hojas de gobernadora, hojasén y guanábana, utilizando simultáneamente ultrasonido-microondas, diferentes relaciones m/v y agua y etanol como disolventes y 2. Determinar la inhibición de crecimiento micelial de Alternaria alternata y Fusarium solani por estos polifenoles.
Materiales y métodos
Material vegetal. Hojas de guanábana (Annona muricata), gobernadora (Larrea tridentata), y hojasén (Flourensia cernua) se usaron para la extracción de polifenoles. Las hojas de guanábana de la marca “Frutas Nayarit” se adquirieron en un local de Saltillo Coahuila, México, mientras que las hojas de gobernadora y hojasén se recolectaron en el Campo Experimental de la Universidad Autónoma Agraria Antonio Narro (UAAAN) en Buenavista, Coahuila, México, posteriormente, se seleccionaron las hojas sanas, eliminando aquellas que tenían daños o malformaciones, así mismo, se desecharon los contaminantes en las muestras. Después, las hojas fueron deshidratadas por 3 días a temperatura ambiente y 24 h en un desecador (NWT-5, Northwest Tchnology®, Italy). A continuación, la materia prima fue molida en un molino Biobase, modelo MD-120, y el material vegetal en forma de polvo se tamizó utilizando mallas de 850 mm, número 20 (W.S. TAYLER®) (Valdez-Guerrero et al., 2021).
Preparación de extractos y extracción de fitoquímicos. Para la obtención de los extractos, se empleó agua destilada y mezclas de etanol/agua destilada (70/30 y 30/70), además se emplearon diferentes relaciones (m/v) masa (material vegetal) volumen (cantidad y concentración del solvente), específicamente se usaron las relaciones (m/v), 1:8, 1:12 y 1:16 acorde a la metodología de Valdez-Guerrero et al. (2021), con modificaciones menores. Las cinco (CA, CB, CC, CD y CE) soluciones producidas de cada material vegetal bajo estas condiciones (Cuadro 1) se colocaron en un reactor de vidrio (1 L) y simultáneamente se aplicaron los procesos ultrasonido y microondas en un equipo Ultrasonic Microwave Cooperative Workstation XO-SM 400, bajo los siguientes parámetros: Ultrasonic (Power Radio - 20, Ultrasonic on Relay - 10, Ultrasonic off Relay -3, Amplitude off Relay - 25 y Set Time - 20) y Microwave (Power Radio - 800, Display power - 0, Set Temp - 70°C y Holding Time - 5). Posteriormente, el extracto se filtró para remover el bagazo.
Cuadro 1 Relaciones masa/ volumen (m/v) y gradientes de etanol como condiciones utilizadas para la obtención de polifenoles por ultrasonido-microondas.
| Factor | Extraction condition | ||||
|---|---|---|---|---|---|
| CAz | CB | CC | CD | CE | |
| Vegetal material | 62.5g | 62.5g | 125g | 125g | 83.33 |
| Solvent | EtOH 70% | distilled H2O | distilled H2O | EtOH 70% | EtOH 30% |
| m/v ratio | 1:16 | 1:16 | 1:8 | 1:8 | 1:12 |
zEn el resto del documento se referirán como grupo de polifenoles.
Purificación y fraccionado de polifenoles. La metodología de Valdez-Guerrero et al. (2021) se empleó para la separación cromatográfica de los extractos. Primeramente, los extractos se filtraron usando papel Whatman No. 41, después, se separaron mediante cromatografía en columna de intercambio iónico, usando como fase estacionaria 200g de amberlita (Amberlite XAD16N) y como fase móvil agua y etanol 96%. Luego se decantó la muestra en la columna empacada con la resina Amberlita® XAD 16N (previamente activada con metanol durante 10 minutos) como fase estacionaria y agua (para eliminar compuestos hidrosolubles) y etanol (para recuperar el contenido polifenólico) como eluentes. Cabe mencionar que la columna fue resguardada de la luz para prevenir la fotosensibilidad de los compuestos de interés. La fracción acuosa se desechó una vez que su coloración fue clara, mientras que la fracción etanólica se colectó en un envase ámbar. Una vez obtenida la fracción etanólica, ésta se repartió en refractarios de vidrio, los cuales se secaron a temperatura ambiente (25- 30 °C), sin exponer a la luz durante 3 días. Finalmente se colectó el extracto seco de las cajas, en un frasco ámbar para su posterior análisis. A partir de este paso, los compuestos químicos de cada extracto seco se identificarán como grupo de polifenoles obtenido con alguna de las cinco (CA, CB, CC, CD y CE) soluciones de cada material vegetal (Cuadro 1).
Determinación de polifenoles hidrolizables. Los extractos en polvo se diluyeron en agua a un volumen de 400 µL. Posteriormente, se le agregaron 400 µL del reactivo Folin-Ciocalteu, dejándose reposar por 5 min. Después, se le añadieron 400 µL de Na2CO3 0.01 M, dejándose reaccionar por 5 min. Por último, se le agregaron 2.5 mL de agua destilada y se leyó la solución a 790 nm en el Espectrofotómetro UV-Vis marca Biomate (Gómez-Martínez et al., 2020).
Determinación de polifenoles condensados. En un tubo se añadieron 500 µL de muestra, después se le agregaron 3 mL de HCl-butanol al 10%, agitando muy bien la solución. Posteriormente, se le incorporaron a la solución, 100 µL del reactivo férrico, agitando vigorosamente la mezcla. Los tubos se traspasaron a un baño para someterlos a ebullición durante una hora, asegurándose que los tubos estuvieran perfectamente cerrados. Después, las muestras se dejaron enfriar a temperatura ambiente (25-30 oC), y finalmente se leyeron a 460 nm en un Espectrofotómetro UV-Vis marca Biomate (Gómez-Martínez et al., 2020).
Identificación de polifenoles. Primeramente, se pesaron 10 mg de cada extracto en polvo y se les disolvió en 1 mL de metanol, luego se sonicó por 5 min a temperatura ambiente, para posteriormente filtrar a través de membranas de 0.45 µm y depositar la muestra en viales para luego colocarlas en un equipo HPLC (marca Varian Prostar, modelo 330 con detector UV-visible de arreglo de diodos), acoplado a un detector de masas (marca Varian, modelo 500-Ms). Se empleó un flujo de 0.2 mL/min, una columna Denali C18 fase reversa (150 mm × 2.1 mm, 3μm, Grace, Albany, OR USA), así como un límite de detección de masas de 100 a 2000 m/z. Todos los experimentos fueron realizados en el modo negativo y [M-H] se empleó nitrógeno como gas nebulizador y helio como gas amortiguador. La fuente de iones tuvo los siguientes parámetros: voltaje de pulverización (5,0 kV), voltaje capilar (90,0 V), y temperatura (350 °C). Los datos fueron recolectados y procesados usando el M.S. Workstation software (V 6.9). Las muestras se analizaron en primer lugar en modo de exploración completa adquirida en el rango m/z 50-2000. Los análisis MS/MS se realizaron en una serie de iones precursores seleccionados. Por último, los compuestos se compararon utilizando una base de datos de compuestos bioactivos (base de datos WorkStation versión 2.0, VARIAN, Palo Alto, CA, EE. UU.).
Aislamiento de hongos fitopatógenos. Los hongos fitopatógenos Fusarium solani y Alternaria alternata se aislaron de plantas enfermas (amarillamiento, encorvamiento de las hojas, roñas, pudrición en tallo y fruto). Del material enfermo, se cortaron trozos de 5 mm de material vegetal, posteriormente se desinfectó con NaClO al 2% por 1 min, después se sumergió en agua destilada estéril por 1 min dos veces, para finalmente colocarlos en cajas Petri con medio PDA (DifcoTM), las cuales se incubaron a 28±2 °C durante 7 días. Después de la germinación de cultivos monospóricos, los hongos con características de A. alternata y F. solani fueron purificados por medio de punta de hifa (Morales et al., 2007). Para la determinación taxonómica de las especies, se realizó observaciones del crecimiento de las colonias fúngicas en el medio de cultivo para determinar la pigmentación, la forma y la velocidad del crecimiento de las colonias, la formación de esporodoquios y el número de septos en los conidios; la presencia de clamidosporas y la forma de conidias (micro y macroconidios). La identificación especifica se realizó bajo microscopio compuesto (10x, 40X y 100x) al observar laminillas con estructuras morfológicas y criterios taxonómicos propios de la especie, empleando las claves taxonómicas de Simmons (2007) para A. alternata, y de Leslie y Summerell (2006) para Fusarium solani.
Determinación preliminar de la concentración de polifenoles. Se realizó un ensayo preliminar para determinar el efecto de la concentración (6000, 8000 y 10000 ppm) de dos grupos de polifenoles (CD = m/v (1:8) y EtOH-70%, y CE= m/v (1:12) y EtOH-30%) de Larrea tridentata, sobre la inhibición micelial de Fusarium solani vs tres testigos, 1) sin polifenoles (negativo), 2) EtOH 70% (positivo) y 3) fungicida [TectoR 60 al 1%] (positivo). La evaluación se realizó bajo un diseño completamente al azar con tres repeticiones, utilizando cajas Petri de 100 x 20 mm con agar PDA (DifcoTM). A cada caja se le agregó por separado, 500 μL de cada concentración especificada de cada grupo de polifenóles (CD y CE) suspendidos en etanol al 70%, y se incluyeron los tres tratamientos testigo. Los polifenoles se extendieron por toda la superficie del agar con la ayuda de una varilla de vidrio adaptada al tamaño de la caja Petri. Se dejó en reposo durante 30 min, tiempo en el cual los polifenoles se absorbieron en el agar, y en seguida se colocó un disco de 0.5 cm de diámetro con micelio de F. solani (Berlanga-Padilla et al., 2011). Las cajas se sellaron e incubaron a 25 °C, hasta que el micelio creciendo con el testigo negativo, cubrió totalmente la caja. En ese momento se midió el diámetro de la colonia de cada tratamiento (9 tratamientos). La disposición de las cajas de Petri en la incubadora permitió tener un diseño experimental completamente al azar. Dicho diámetro fue convertido a porcentaje de inhibición (ICM), en relación con el testigo 1 por la siguiente expresión matemática (Apolonio-Rodríguez et al, 2017):
Donde dTa y dt representan el diámetro del crecimiento micelial del testigo 1 y de cada uno del resto de los tratamientos, respectivamente.
Después de analizar en el ensayo preliminar el efecto de concentración, se seleccionó la concentración de 8000 ppm para evaluar los grupos de polifenoles (CA, CB, CC, CD y CE) obtenidos de hojasén, gobernadora y guanábana. Las condiciones de siembra y de temperatura fueron similares a las empleadas en el estudio preliminar. Todos los grupos de polifenoles fueron evaluados contra F. solani y A. alternata; y se usaron como testigos para Fusarium 1) sin polifenoles (negativo), 2) EtOH 70% (positivo) y 3) fungicida [TectoR 60 al 1%] (positivo). Mientras que para Alternaria como testigo se empleó: 1) sin polifenoles (negativo) y 2) EtOH 70% (positivo). La variable de respuesta fue crecimiento micelial, convertido a porcentaje de inhibición de igual manera por la fórmula señalada anteriormente (ICM).
Análisis estadísticos. Los datos resultantes de todos los bioensayos fueron analizados utilizando el análisis de varianza, y la significancia se determinó con una probabilidad de (p<0.05), cuando fue necesario, las medias de los tratamientos se compararon utilizando la prueba de Tukey. Todos los análisis estadísticos se realizaron usando el software SAS (versión 9.0).
Resultados y discusión
Determinación preliminar de la concentración de polifenoles. El análisis de varianza no mostró diferencias (P< 0.00001) en la inhibición micelial entre las concentraciones dentro de cada uno de los dos grupos de polifenoles (CD y CE) obtenidos de gobernadora. Sin embargo, si se observó que la inhibición del crecimiento micelial fue diferente entre los dos grupos de polifenoles y entre estos grupos y el testigo negativo (Figura 1) (P< 0.00001). Se apreció que la inhibición micelial de Fusarium solani fue mayor cuando se usó el grupo de polifenoles CD (obtenido con una relación de m/v 1:8 y etanol al 70%), el rango de afectación en la respuesta del crecimiento micelial con el grupo de polifenoles CD varió entre 88 - 90 %. En contraste el grupo de polifenoles obtenidos con la relación m/v de 1:12 y etanol al 30% solo inhibió el crecimiento micelial entre 43-50%, mientras que el testigo positivo (Tecto 60® (tiabendazol) al 1%) solo inhibió el crecimiento micelial de F. solani en 27%.
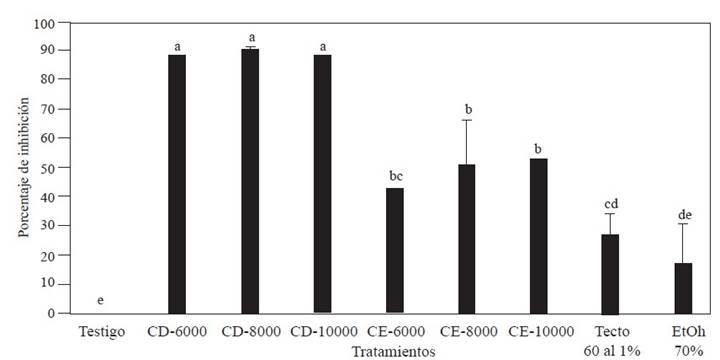
Figura 1 Porcentaje de inhibición del crecimiento de Fusarium solani por diferente concentración (ppm) de polifenoles de gobernadora (Larrea tridentata) obtenidos con diferentes relaciones m/v y concentraciones de etanol, y usando ultrasonido-microondas. Grupos de polifenoles CD obtenido con la relación m/v (1:8) y EtOH-70% y CE obtenido con la relación m/v (1:12) y EtOH-30%. Columnas con la misma letra no son diferentes de acuerdo con la prueba de rango múltiple de Tukey.
Los resultados muestran que hay actividad biológica de los polifenoles obtenidos de hojas de gobernadora por ultrasonido-microondas contra el hongo F. solani, donde por el porcentaje de inhibición del crecimiento micelial se formaron 4 grupos: un grupo formado por el testigo negativo (sin polifenoles), otro integrado por el testigo positivo (Tecto 60® (tiabendazol) al 1%), y otro por los grupos polifenólicos CD y CE, lo cual coincide con lo reportado con Peñuelas-Rubio et al. (2017), quienes mencionan que el efecto inhibitorio del crecimiento fúngico por los extractos de L. tridentata, puede atribuirse a que las sustancias fenólicas presentes en los extractos, reaccionan con las enzimas fúngicas, volviéndolas catalíticamente inactivas. Farag et al. (2011), sugieren que los extractos con altas cantidades de polifenoles previenen el desarrollo de F. oxysporum debido a la reducción de los niveles de peroxidación lipídica. Por otra parte, en el presente estudio se apreció la inhibición en el crecimiento fúngico fue mayor con el grupo de polifenoles CD que cuando se usó el grupo CE, esto pude ser debido a la presencia de diferentes compuestos polifenólicos en cada extracto (Oufensou et al., 2020).
Inhibición de Fusarium y Alternaria por polifenoles de gobernadora, hojasén y guanábana. Para Fusarium, el análisis de varianza mostró diferencias en la inhibición micelial de F. solani entre los dos grupos de polifenoles (CD y CE) obtenidos de gobernadora (L. tridentata) vs testigos (negativo y positivo (tecto-60® y etanol-70%)) (Figura 2a). Se apreció que a 8000 ppm los polifenoles obtenidos con la relación m/v 1:8 y etanol 70% (CD), inhibieron el crecimiento micelial en 90 %, mientras que los polifenoles obtenidos con la relación m/v 1:12 y etanol 30%, y el testigo positivo (Tecto 60® (tiabendazol) al 1%) solo inhibieron el crecimiento micelial en 50% y 27 %, respectivamente. Los resultados de este estudio coinciden con los reportados por Peñuelas-Rubio et al. (2017) quienes mencionan que extractos a 500 ppm y obtenidos por el sistema Soxhlet y etanol 70%, inhibieron F. oxysporum en un 98%, sin embargo, en el presente trabajo se necesitaron 8000 ppm de polifenoles para inhibir el crecimiento micelial en 90%, cuando los polifenoles se extrajeron con EtOH-70% y 50% cuando se usó EtOH-30%. En este estudio los polifenoles se extrajeron en 20 minutos usando simultáneamente ultrasonido-microondas, mientras que la extracción empleando Soxhlet tarda al menos 36 horas (Sepúlveda-Rincón et al., 2016).
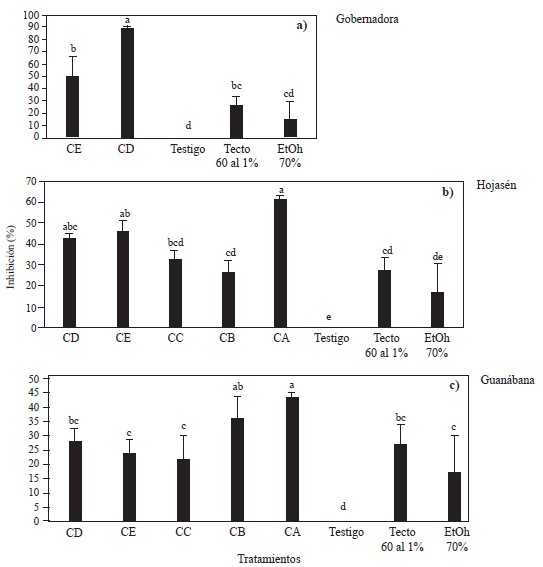
Figura 2 Inhibición micelial de Fusarium solani por diferentes grupos de polifenoles de a) gobernadora (Larrea tridentata), b) hojasén (Flourensia cernua) y c) guanábana (Anona muricata) a 8000 ppm obtenidos por ultrasonido-microondas vs testigos (negativo y positivo (tecto-60® y etanol-70%). Grupos de polifenoles CA obtenido con la relación m/v (1:16) y EtOH-70%, CB obtenido con la relación m/v (1:16) y EtOH-0%, CC obtenido con la relación m/v (1:8) y EtOH-0%, CD obtenido con la relación m/v (1:8) y EtOH-70%, CE obtenido con la relación m/v (1:12) y EtOH-30%. Columnas con la misma letra dentro de una misma grafica no son diferentes de acuerdo con la prueba de rango múltiple de Tukey.
Respecto a hojasén (F. cernua), el análisis de varianza mostró diferencias significativas en la inhibición del crecimiento micelial de F. solani entre los diferentes grupos de polifenoles vs el testigo negativo (Figura 2b). Los grupos de polifenoles (CA, CC, CD y CE) inhibieron en una mayor proporción que el testigo positivo (tecto-60®). Se apreció que los grupos de polifenoles extraídos usando etanol como disolvente (CA, CD y CE) tuvieron mayor efecto inhibitorio en el crecimiento micelial, seguidos por los grupos de polifenoles obtenidos empleando agua (CB y CC). Así mismo, se observó que la eficiencia en la inhibición por los grupos polifenólicos extraidos con etanol, es proporcional a la relación m/v, es decir, los polifenoles con mayor relación m/v promueven más la inhibición fúngica. Mientras que los grupos de polifenoles extraídos con agua inhibieron de manera similar al testigo positivo (Tecto-60®). En este sentido el grupo de polifenoles que más afectó la inhibición fue el obtenido con etanol al 70% en la relación m/v 1:16 (CA) con un valor superior a 60% de inhibición, seguido de los grupos de polifenoles CE y CD con 46.5 y 42.8%, respectivamente. Los polifenoles obtenidos empleando agua (CC y CB) presentaron un porcentaje de inhibición muy similar al testigo positivo (Tecto-60®), con valores de 32% y 26 %, respectivamente.
Son escasos los estudios que involucran los extractos de F. cernua contra F. solani y en su mayoría se ha trabajado con F. oxysporum. Por otra parte, el porcentaje de inhibición en el crecimiento micelial observado con los grupos polifenólicos de F. cernua en este estudio, son mayores a lo reportado por Gamboa-Alvarado et al. (2003), quienes no encontraron ningún efecto inhibitorio del crecimiento de F. oxysporum en ninguna de las concentraciones de 4,000, 8,000, 12,000, 16,000 y 20,000 ppm del extracto. Esto puede ser explicado por el método (extracción Soxhlet) y disolvente (metanol) empleados por Gamboa-Alvarado et al. (2003), quienes utilizaron un sistema de extracción con una duración de 10 días, el cual resulta ser menos eficiente y efectivo que la tecnología de ultrasonido-microondas, que logra la extracción en 20 minutos y con una transferencia de masa más controlada y eficiente. Hay reportes de inhibición completa de Fusarium utilizando extractos de hojasén, sin embargo, estos reportes son contra F. oxysporum (Peñuelas et al., 2017).
Para los grupos polifenólicos de guanábana (A. muricata) a 8000 ppm, el análisis de varianza mostró diferencias significativas entre los tratamientos (Figura 2c). Se apreció que los grupos de polifenoles CA y CB presentaron una mayor inhibición del crecimiento fúngico, el cual fue aún mayor que los testigos positivos (Tecto-60® y etanol 70%). Además, se observó una mayor inhibición de F. solani con los polifenoles obtenidos con la relación m/v 1:16 sin importar si se obtuvo con etanol o agua. En este sentido, el grupo de compuestos polifenólicos CA promovió la mayor inhibición (43.7%) del crecimiento micelial de F. solani, dicho grupo de polifenoles fue obtenido por la relación m/v (1:16) y EtOH-70%, este efecto fue seguido por los grupos de compuestos polifenólicos CB y CD, con 36 y 27% de inhibición, respectivamente. Los grupos de polifenoles CE y CC, causaron un porcentaje de inhibición inferior al testigo positivo (Tecto-60®), 23% y 21 %, respectivamente. Aunque, los polifenoles de guanábana mostraron un efecto inhibitorio contra F. solani superior al testigo positivo (Tecto-60®), no se inhibió más del 50% el crecimiento de este hongo a la concentración de 8000 ppm, por lo que su potencial fungicida podría determinarse a mayores concentraciones (Figura 2c). No fue posible encontrar reportes acerca de las propiedades antifúngicas de polifenoles obtenidos de guanábana contra Fusarium solani, por lo que los resultados obtenidos en este trabajo no se pueden comparar.
Para Alternaría alternata se aplicaron los cinco grupos de polifenóles obtenidos de hojasén (F. cernua) y de guanábana (A. muricata). El análisis de varianza mostró diferencias significativas entre estos grupos de polifenoles vs el testigo negativo (Figura 3 a y 3b). Es decir, los grupos de polifenoles obtenidos a partir de hojasén y de guanábana, afectaron el crecimiento micelial con valores entre 51 y 58% de inhibición, en contraste al testigo negativo. Los resultados de este ensayo fueron inferiores a los reportados por Guerrero et al. (2007), quienes mencionaron que los extractos de hojasén causaron un 81.6-82.0% de inhibición del crecimiento micelial de A. alternata, sin embargo, estos autores utilizaron solventes como metanol: cloroformo (1:1) y hexano, respectivamente, este último siendo de naturaleza polar y alcalina, características que lo convierten en un solvente muy eficiente, sin embargo también es altamente inflamable, dañino para el ambiente y tiene efectos sobre la salud de quien respire o esté en contacto directo con este compuesto (Pan et al., 2017), esto mismo ocurre con el cloroformo, siendo útil su enlace C-Cl para la polarización y síntesis de moléculas orgánicas y con el metanol, gracias a su capacidad de remover agua de las soluciones en síntesis o en procesos de separación (Sridhar et al., 2011; Ashurst y Nappe, 2022), siendo los tres compuestos, opciones destacables para la extracción, sin embargo sus inconvenientes a la salud y el ambiente no son comparables con las del etanol y agua, usados en este trabajo, debido a que son baratos, son eficientes en la extracción de compuestos, no representa un daño a las personas o al ambiente, además, el etanol puede ser producido por fermentación, y es altamente volátil (Baümler et al., 2016). Guerrero et al. (2007), también reportan una inhibición de 80.3% a 2,000 ppm, utilizando etanol como disolvente de extracción. Las diferencias de estos resultados con los obtenido en el presente estudio, pueden ser explicadas por la metodología de obtención de los extractos, cantidad de moléculas con actividad fungicida, afinidad de los polifenoles con el disolvente empleado, polaridad y tipo de disolvente empleado, temperatura en el proceso de obtención, y formas de recuperación (Gómez-Martínez et al., 2020).

Figura 3 Inhibición micelial de Alternaria alternata por 5 grupos de compuestos polifenólicos a 8000 ppm de a) hojasén (Flourensia cernua) y b) guanábana obtenidos por ultrasonido-microondas. Grupos de polifenoles CA obtenido con la relación m/v (1:16) y EtOH-70%, CB obtenido con la relación m/v (1:16) y EtOH-0%, CC obtenido con la relación m/v (1:8) y EtOH-0%, CD obtenido con la relación m/v (1:8) y EtOH-70%, CE obtenido con la relación m/v (1:12) y EtOH-30%. Columnas con la misma letra dentro de la misma gráfica, no son diferentes de acuerdo con la prueba de rango múltiple de Tukey.
Con todos los grupos polifenólicos de guanábana (A. muricata) obtenidos mediante ultrasonido-microondas se apreció una inhibición (entre 55 y 61%) del crecimiento micelial de A. alternata en comparación al testigo negativo (Figura 3b). A la fecha, no se encontraron reportes acerca de las propiedades antifúngicas de polifenoles obtenidos de guanábana contra A. alternata. Los valores de inhibición fúngica in vitro observados en este estudio son prometedores (Vitola y Pérez, 2016).

Figura 4 Actividad antifúngica de diversos grupos de compuestos polifenólicos a 8000 ppm obtenidos con diferentes relaciones m/v y porcentaje de etanol contra Fusarium solani y Alternaria alternata. Grupos de polifenoles CA obtenido con la relación m/v (1:16) y EtOH-70%, CB obtenido con la relación m/v (1:16) y EtOH-0%, CC obtenido con la relación m/v (1:8) y EtOH-0%, CD obtenido con la relación m/v (1:8) y EtOH-70%, CE obtenido con la relación m/v (1:12) y EtOH-30%.
En términos generales, se puede mencionar que la metodología de extracción empleando simultáneamente ultrasonido-microondas es eficiente para obtener compuestos con propiedades antifúngicas al menos para los patógenos Alternaria alternata y Fusarium solani, ya que la inhibición del crecimiento micelial a 8000 ppm superó el 50% en ambos fitopatógenos en contraste al testigo negativo, en este caso, el 16% de los grupos de polifenoles evaluados presentaron una tasa de inhibición superior o igual a 50% en F. solani, y un 90.9% de los grupos de polifenoles presentaron una tasa de inhibición superior o igual a 50% en A. alternata (Figura 4). Lo anterior, significa que solo 3 grupos de polifenoles (CD, CE y CA) a 8000 ppm tienen compuestos polifenólicos con capacidad de inhibición micelial (entre 50-90%) en F. solani, siendo estos los obtenidos de L. tridentata y F. cernua con la relación m/v y disolvente de 1:8 / EtOH-70% (CD) y 1:12 / EtOH-30% (CE) para la primera especie vegetal, y 1:16 / EtOH-70% (CA) para la segunda. Se puede observar que en los tres grupos de polifenoles (CA, CD, y CE) fue usado el etanol como disolvente en 70, 70 y 30 %, respectivamente, sin embargo, las diferencias en la inhibición fúngica pudieran estar asociadas a la cantidad de material vegetal utilizado, ya que en el caso de la gobernadora, los grupos polifenolicos más eficientes fueron aquellos donde se usó el etanol a mayor concentración (70%), y la mayor cantidad de biomasa vegetal (125 g L-1), y respecto a hojasén, se observó que la mayor eficiencia ocurre inversamente a la biomasa vegetal utilizada, menor biomasa (62.5 g L-1), mayor efecto inhibitorio (Figura 2). Por otro lado, también se observa que el crecimiento micelial de A. alternata es inhibido por todos los grupos de polifenoles evaluados, sin importar la relación m/v y el tipo de disolvente (Figura 4).
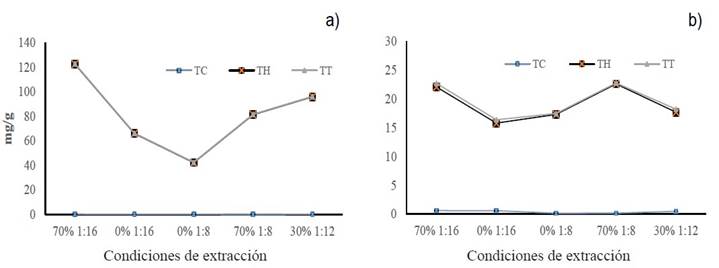
Figura 5 Concentración de polifenoles totales (condensados e hidrosolubles) obtenidos con las diferentes relaciones m/v y porcentaje de etanol; a) Polifenoles de gobernadora, b) Polifenoles de hojasén.
Las diferentes relaciones m/v y concentraciones de los disolventes empleados en la extracción permitieron obtener cantidad diferentes de polifenoles totales (condensados e hidrosolubles) en mg por gramo de material vegetal. En la Figura 5 se observa que con la relación m/v 1:16 /EtOH-70% (CA) se logró recuperar la mayor proporción de ambos tipos de polifenoles, en ambas especies vegetales. Sin embargo, los grupos de polifenoles de gobernadora que tuvieron el más alto grado de inhibición del crecimiento micelial de F. solani fueron aquellos obtenidos con las relaciones m/v 1:8/EtOH-70% (CD) y 1:12/ EtOH-30% (CE). Mientras que cuando se usó hojasén, la más alta inhibición coincide con uno de los grupos que presento mayor cantidad de polifenoles (CA). Por otro lado, todos los grupos de polifenoles mostraron similar nivel de inhibición en el crecimiento micelial de A. alternata, por lo tanto, no importo la relación m/v y disolvente en el grado de inhibición micelial.
La actividad inhibitoria del crecimiento micelial pude estar dada más por los compuestos polifenólicos presentes en cada grupo que por las cantidades de polifenoles hidrolizables o condensados, la diferencia en el perfil de compuestos polifenólicos encontrados en cada grupo (Cuadros 2 y 3) están dados por la relación m/v, afinidad de los polifenoles con el disolvente empleado, polaridad y tipo de disolvente empleado, temperatura en el proceso de obtención, y formas de recuperación (Gómez-Martínez et al., 2020). En el grupo de polifenoles CD obtenido de gobernadora se observaron mayor número de compuestos polifenólicos, que en el grupo CE; algunos compuestos que están en el grupo CD se han reportado que tienen efecto antimicrobiano o antioxidante como el epirosmanol, el cual es el resultado de la oxidación del ácido carnósico y que posee una alta capacidad antioxidante, además de la detección de moléculas con actividades no solo altamente antioxidantes sino que también antimicrobianas como el rosmadiol (Quintana et al., 2019; Ávila et al., 2011). También en el grupo de polifenoles CD se encontró apigenina, un compuesto el cual ha sido descrito como uno de los flavonoides más abundantes que poseen una relación positiva entre su consumo y la baja en la mortalidad debido al cáncer de estómago y a que tiene además una actividad antiviral y antibacterial (Álvarez y Orallo, 2003), mientras que, catequina presentan un alto potencial antioxidante y tiene capacidad de entrecruzarse con muchas proteínas, lo que le confiere actividad antimicrobiana, posiblemente dañando los lípidos y proteínas citoplasmáticos microbianos (Rahardiyan, 2019). Además, se ha mencionado la actividad antifúngica de la catequina contra hongos fitopatógenos (Istúriz et al., 2019). Por otra parte, se ha reportado que procianidina C1 tiene capacidad de inhibir el crecimiento microbiano a través de la inhibición de enzimas extracelulares, privación de sustratos microbianos esenciales, desintegración de la membrana externa bacteriana y afectar negativamente el metabolismo microbiano (Dasiman et al., 2022). En la comparación de los grupos de polifenoles CA y CB obtenidos de hojasén, el grupo CA además de contener apigenina también cuenta con ácido rosmarínico el cual tiene capacidad de destruir células y proteínas bacterianas e inhibir la actividad de la Na+/K+ -ATP-asa en las células (Zhang et al., 2021). El grupo de polifenoles CA también contiene nepetin, el cual puede disminuir la virulencia de diversos patógenos al unirse a la proteína caseinolítica peptidasa P (ClpP), mediante la unión de este polifenol a los aminoácidos Ser-22 y Gln-47 de la proteína CLpP (Shisong et al., 2022) y quercetina, el cual es un flavonoide aprobado por la FDA con que cuenta con capacidades antimicrobianas al dañar la membrana celular, modificar la permeabilidad de la membrana, inhibir tanto síntesis de ácidos nucleicos como de proteínas, reducir la expresión de factores de virulencia, inducir disfunción mitocondrial y prevenir la formación de biopelículas (Nguyen et al., 2022). Se ha reportado la actividad de la quercetina contra hongos fitopatógenos como Penicillium expansum (Sanzani et al., 2009). La actividad antifúngica de compuestos polifenólicos ha sido de interés gracias a su baja toxicidad y efímera persistencia en el ambiente, siendo de utilidad en la agricultura orgánica (López et al., 2019).
Cuadro 2 Compuestos identificados según la relación de masa volumen para polvos de Gobernadora.
| Compuestos | ||||
|---|---|---|---|---|
| T.R (min) | Masa (m/z) | Grupo CD (70% 1:8) | Grupo CE (30% 1:12) | Familia |
| 39.23 | 346.9 | 5- heptadecil resorcinol | Alquilfenoles | |
| 34.09 | 504.8 | Peonidin 3-O-(6-acetil-glucòsido) | Antocianinas | |
| 27.6 | 288.8 | Catequina | Catequina | |
| 33.42 | 304.9 | Epigalocatequina | Catequina | |
| 22.61 | 304.8 | Galocatequina | Catequina | |
| 25.7 | 304.9 | (+) Galocatequina | Catequinas | |
| 35.08 | 302.8 | Taxifolina o dihidroquercetia | Dihidroflavonol | |
| 44.21 | 268.8 | Apigenina | Flavones | |
| 30.45 | 592.9 | Apigenina 6,8- di glucósido | Flavones | |
| 27.97 | 592.8 | Luteolin 7- rutinoside | Flavones | |
| 22.64 | 284.9 | Luteolina | Flavones | |
| 24.2 | 284.9 | Scutellarina | Flavones | |
| 34.37 | 608.9 | Quercetina 3-O glucósido 7-O rhamnoside | Flavonoles | |
| 32.05 | 608.8 | Quercetina 3-O-glucòsido 7-O-rhamnoside | Flavonoles | |
| 35.82 | 770.7 | Quercetina 3-O-glucosyl-ramnosil-galactòsido | Flavonoles | |
| 32.28 | 754.9 | Quercetina 3-O-ramnosil glucósido | Flavonoles | |
| 30.17 | 754.8 | Quercetina 3-O-ramnosil-glucòsido | Flavonoles | |
| 49.52 | 300.9 | NDGA | Lignanos | |
| 51.69 | 301 | NDGA | Lignanos | |
| 28.05 | 542.8 | Ácido 3,4- feruloiquínico | Ácido metoxicinámico | |
| 48.16 | 298.9 | Hispidulina | Methoxiflavones | |
| 48.46 | 298.9 | Hispidulina | Methoxiflavones | |
| 40.95 | 314.8 | Nepetin | Methoxiflavones | |
| 43.03 | 314.8 | Nepetin | Methoxiflavones | |
| 29.46 | 370.8 | Sinensetina | Methoxiflavones | |
| 27.59 | 328.9 | 3,7- Dimetil quercetina | Methoxiflavones | |
| 44.96 | 328.8 | 3,7- Dimetil quercetina | Methoxiflavones | |
| 52.48 | 283 | Metil galadin | Methoxiflavones | |
| 50.31 | 282.9 | Metil galadin | Methoxiflavones | |
| 38.28 | 330.8 | Ácido carnósico | Diterpeno fenólico | |
| 40.39 | 330.8 | Ácido carnósico | Diterpeno fenólico | |
| 42.39 | 344.7 | Epirosmanol | Diterpeno fenólico | |
| 41.58 | 344.8 | Rosmadial | Diterpeno fenólico | |
| 28.74 | 862.7 | Procianidina C1 | Trímeros de protoantocianidinas | |
En negritas compuestos similares encontrados en cada grupo obtenido con unas condiciones de extracción diferente
Cuadro 3 Compuestos identificados según la relación de masa volumen para polvos de hojasén.
| Compuestos | ||||
|---|---|---|---|---|
| T.R (min) | Masa (m/z) | Grupo CA (70% 1:16) | Grupo CB (0% 1:16) | FAMILIA |
| 242.8 | Dihidroquercetina | Dihidroflavonoles | ||
| 44.19 | 268.7 | Apigenina | Flavones | |
| 28.19 | 592.8 | Apigenina 6,8 glucósido | Flavones | |
| 28.06 | 592.8 | Apigenina 6,8 glucósido | Flavones | |
| 29.9 | 562.8 | Apigenina glucósido- arabinósido | Flavones | |
| 29.92 | 562.8 | Apigenina glucósido-arabinòsido | Flavones | |
| 40.66 | 676.7 | Metoxiflavona | Flavones | |
| 44.97 | 298.7 | Quercetina | Flavonol | |
| 34.74 | 514.7 | Ácido 1,3- dicafeoilquínico | Ácido hidroxicinámico | |
| 35.79 | 514.7 | Àcido 1,3- dicafeoilquìnico | Ácido hidroxicinámico | |
| 18.51 | 352.8 | Ácido 1- cafeoilquínico | Ácido hidroxicinámico | |
| 24.16 | 352.8 | Ácido 1- cafeoilquìnico | Ácido hidroxicinámico | |
| 24.66 | 352.7 | Ácido 3- cafeoilquínico | Ácido hidroxicinámico | |
| 25 | 352.8 | Ácido 3-cafeoilquìnico | Ácido hidroxicinámico | |
| 47.11 | 358.7 | Ácido rosmarínico | Ácido hidroxicinámico | |
| 26.88 | 310.8 | Cafeoil ácido tartárico | Ácido hidroxicinámico | |
| 26.56 | 310.8 | Cafeoil ácido tartárico | Ácido hidroxicinámico | |
| 35.74 | 514.7 | Ácido 1,5- dicafeoilquìnico | Ácido hidroxicinámico | |
| 39.59 | 312.7 | Cirsimaritina | Methoxiflavona | |
| 45.72 | 314.7 | Nepetin | Methoxiflavona | |
| 32.01 | 370.9 | Tangeretina | Methoxiflavona | |
| 31.8 | 370.9 | Tangeretina | Methoxiflavona | |
| 42.59 | 344.7 | Rosmanol | terpenos fenólicos | |
En negritas compuestos similares encontrados en cada grupo obtenido con diferentes condiciones de extracción.
Conclusiones
En el presente estudio se logró extraer compuestos polifenolicos a partir de hojas de gobernadora, hojasén y guanábana, en muy corto tiempo (20 minutos) utilizando simultáneamente métodos (ultrasonido-microondas) y disolventes (agua y etanol) amigables con el medio ambiente. Dependiendo del material vegetal, la relación m/v, el disolvente y su concentración se lograron extraer diferentes compuestos polifenólicos. El grupo de polifenoles CD extraído de gobernadora mostro niveles de inhibición del crecimiento micelial de F. solani de 90%. Mientras que el crecimiento micelial de Alternaria alternata fue inhibido en un 50-60% por los grupos de polifenoles obtenidos de hojasen y guanábana. En el perfil de grupo de polifenoles CD obtenido de gobernadora se encontraron diversos compuestos polifenólicos reportados por tener actividad antioxidante y antimicrobiana entre los que destacan: epirosmanol, rosmadiol Apigenina, catequina, procianidina C1.
Agradecimientos
Este estudio fue financiado por la Secretaria de Agricultura, Pesca y Ganadería - México, a través del proyecto: FON.SEC. SAGARPA-CONACYT CV-2015-4-266936.
REFERENCIAS
Abbas MF, Rafiq M, Al-Sadi AM, Alfarraj S and Alharbi SA. 2021. Molecular characterization of leaf spot caused by Alternaria alternata on buttonwood (Conocarpus erectus L.) and determination of pathogenicity by a novel disease rating scale. PLoS ONE 16 (5): e0251471. https://doi.org/10.1371/journal.pone.0251471 [ Links ]
Abdel MF, Abo EK, and Morsy KM. 2011. Effectiveness of plant extracts on suppression of damping-off and wilt diseases of lupine (Lupinus termis Forsik). Crop Protection 30(2): 185-191. https://doi.org/10.1016/j.cropro.2010.09.016 [ Links ]
Álvarez CE y Orallo CF. 2003. Actividad biológica de los flavonoids (I). 2003. Acción frente al cancer. Offarm 22(10): 130-140. https://www.elsevier.es/es-revista-offarm-4-pdf-13054406 [ Links ]
Andrade AG, Delgado AA, Herrera CB, Arévalo GLL y Caso BL. 2018. Variación de compuestos fenólicos totales, flavonoides y taninos en Vanilla planifolia jacks. ex Andrews de la Huasteca Hidalguense, México. Agrociencia 52(1): 55-66. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-31952018000100055&lng=es&tlng=es [ Links ]
Apolonio RI, Franco MO, Salgado SM and Aquino MJ. 2017. In vitro inhibition of Botrytis cinérea with extracts of wild grape vine (Vitis spp.) leaves. Mexican Journal of Phytopathology 35(2): 170-185. https://doi.org/10.18781/r.mex.fit.1611-1 [ Links ]
Ashurst JV and Nappe TM. 2022. Methanol Toxicity. StatPearls Publishing. https://www.ncbi.nlm.nih.gov/books/NBK482121/ [ Links ]
Ávila SR, Navarro CAR, Aguilar AP, Vera LO y Dávila MRM. 2011. Romero: una revisión de sus usos no culinarios. Ciencia y Mar 15(43): 23-36. http://cienciaymar.mx/Revista/index.php/cienciaymar/issue/view/22/ART43_2 [ Links ]
Baümler ER, Carrín ME and Carelli AA. Extraction of sunflower oil using ethanol as solvent. Journal of Food Engineering 178: 190-197. https://doi.org/10.1016/j.jfoodeng.2016.01.020 [ Links ]
Berlanga PAM, Gallegos MG, Cepeda SM, Rodríguez HR, Aguilar CN, Castillo RF and Hernández CFD. 2011. In vitro antagonist action of Trichoderma strains against Sclerotinia sclerotiorum and Sclerotium cepivorum. American Journal of Agricultural and Biological Sciences 6(3): 410-417. https://doi.org/10.3844/ajabssp.2011.410.417. [ Links ]
Bocker R and Silva EK. 2022. Innovative technologies for manufacturing plant-based non-dairy alternative milk and their impact on nutritional. Sensory and Safety Aspects 5: 100098. https://doi.org/10.1016/j.fufo.2021.100098 [ Links ]
Castrillo M, Bich G, Sioli G, Zapata P and Villalba L. 2021. Biocontrol capacity of native isolates of Trichoderma sp. against the phytopathogenic fungus Alternaria alternata isolated from yerba mate (Ilex paraguariensis Saint Hil.). Chilean Journal of Agricultural & Animal Sciences 37(3): 244-256. https://dx.doi.org/10.29393/chjaas37-26cbml50026 [ Links ]
Chemat F, Rombaut N, Anne-Gaëlle S, Meullemiestre A, Fabiano-Tixier AS and Abert-Vian M. 2017. Ultrasound assisted extraction of food and natural products. Mechanisms, techniques, combinations, protocols and applications. A review. Ultrasonics Sonochemistry 34: 540-560. https://doi.org/10.1016/j.ultsonch.2016.06.035 [ Links ]
Chemat F, Abert Vian M., Ravi HK., Khadhraoui B, Hilali S, Perino S, and Tixier AF. 2019. Review of alternative solvents for green extraction of food and natural products: Principles, Applications and Prospects. Molecules 24(16): 3007. https://doi.org/10.3390/molecules24163007 [ Links ]
Costa M, Sezgin BZ, Losada BS, Paiva MF, Saso L, and Bravo DC. 2021. Polyphenols as antioxidants for extending food shelf-life and in the prevention of health diseases.: Encapsulation and Interfacial Phenomena. Biomedicines 9(12) 1909. https://doi.org/10.3390/biomedicines9121909 [ Links ]
Dasiman R, Nor NM, Eshak Z, Mutalip SSM, Suwandi NR and Bidin H, 2022. A Review of Procyanidin: Updates on current bioactivities and potential health benefits. Biointerfase Research in Applied Chemistry 12(5):5918 - 5940. https://doi.org/10.33263/BRIAC125.59185940 [ Links ]
Farag HR, Zeinab AA, Dawlat AS, Mervat ARI and Sror HAM. 2011. Effect of neem and willow aqueous extracts on Fusarium wilt disease in tomato seedlings: Induction of antioxidant defensive enzymes. Annals of Agricultural Sciences 56(1): 1-7 http://dx.doi.org/10.1016/j.aoas.2011.05.007 [ Links ]
Gamboa-Alvarado R, Hernández CFD, Guerrero RE, Sánchez AA y Lira SRH. 2003. Inhibición del crecimiento micelial de Rhizoctonia solani Kuhn y Phytophthora infestans Mont. (De Bary) con extractos vegetales metanólicos de Hojasén (Flourensia cernua DC.), Mejorana (Origanum majorana L.) y Trompetilla (Bouvardia ternifolia (Ca.) Schlecht.). Revista Mexicana de Fitopatología 21(1): 13-18. https://www.redalyc.org/articulo.oa?id=61221102 [ Links ]
García W, Lezama H y Pumachagua P. 2019. Estudio teórico de la actividad antioxidante de compuestos aromáticos con bases de schiff heterocíclicas sustituidos en posiciones meta y para. Rev Soc Quím Perú 85(2): 242-257. http://www.scielo.org.pe/pdf/rsqp/v85n2/a11v85n2.pdf [ Links ]
Gómez-Martínez M, Ascacio-Valdés JA, Flores-Gallegos AC, González-Domínguez J, Gómez-Martínez S, Aguilar CN and Rodríguez-Herrera R. 2020. Location and tissue effects on phytochemical composition and in vitro antioxidant activity of Moringa oleifera. Industrial Crops and Products 151: 1124-1139. https://doi.org/10.1016/j.indcrop.2020.112439 [ Links ]
Guerrero RE, Solís GS, Hernández CF, Flores OA, Sandoval LV, y Jasso CD. 2007. Actividad biológica in vitro de extractos de Flourensia cernua D.C. en patógenos de postcosecha: Alternaria alternata (Fr.:Fr.) Keissl., Colletotrichum gloeosporioides (Penz.) Penz. y Sacc. y Penicillium digitatum (Pers.:Fr.) Sacc.. Mexican Journal of Phytopathology 25(1): 48-53. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0185-33092007000100007&lng=es&tlng=es [ Links ]
Gutiérrez GE, Ambriz PD, Leyva LN, Castillo LR and Heredia JB. 2016. Bioavailability of dietary phenolic compounds: review. Revista Española de Nutrición Humana y Dietética 20(2): 140-147. https://dx.doi.org/10.14306/renhyd.20.2.184 [ Links ]
Istúriz ZMA, Pérez PM, Contreras SS, and Barrera NLL. 2019. Effect of ethanol extract of fig residue (Ficus carica) on growth of postharvest fungi. Mexican Journal of Phytopathology 37(1):72-79. http://dx.doi.org/10.18781/R.MEX.FIT.1904-6 [ Links ]
Joaquín RAJ, López PCU, Pinedo EJM, Altamirano RSE, Santiago SYO, Aguirre MCL, and Gutiérrez TJ. 2020. Phenolic compounds, antioxidant properties and antifungal activity of jarilla (Barkleyanthus salicifolius Rob & Brettell). Chilean Journal of Agricultural Research 80(3): 352-360. https://dx.doi.org/10.4067/S0718-58392020000300352 [ Links ]
Leslie J and Summerell A. 2006. The Fusarium Lab Manual. Blackwell Publishing, Ames. 278p. https://onlinelibrary.wiley.com/doi/book/10.1002/9780470278376 [ Links ]
López MNR, Romero BM, Arce APM and Hernández RJS. 2019. Actividad antifúngica de antioxidantes derivados de cuatro cultivares de Capsicum spp. contra hongos fitopatógenos. Ecosistemas y Recursos Agropecuarios 6(18): 487-498. https://doi.org/10.19136/era.a6n18.2174 [ Links ]
Mantecón JD. 2015. Fungicidas aplicados al suelo como estrategia de manejo integrado de enfermedades en papa, bajo escenarios de elevada infestación inicial y residual. Revista Latinoamericana de la Papa 19(1): 29-39. https://doi.org/10.37066/ralap.v19i1.224 [ Links ]
Martínez MT, Guerrero AB, Pecina QV, Rivas VP, González PE y Angeles NJ. 2020. Antagonismo de Trichoderma harzianum contra la fusariosis del garbanzo y su efecto biofertilizante. Revista Mexicana de Ciencias Agrícolas 11(5): 1135-1147. https://doi.org/10.29312/remexca.v11i5.2325 [ Links ]
Martínez PE, Abreu FJ and Cantillo PT. 2021.Incidence of Alternaria spp. on cereal, vegetable, fruit and ornamental sedes. Revista de Protección Vegetal 36(1): 2224-4697. http://revistas.censa.edu.cu/index.php/RPV/article/view/1123/1754 [ Links ]
Martínez SG, Rey BJ, Pargas PR y Manzanilla EE. 2020. Marchitez por Fusarium raza tropical 4: Estado actual y presencia en el continente americano. Agronomía Mesoamericana 31(1): 259-276. https://doi.org/10.15517/am.v31i1.37925 [ Links ]
Mata SC, Leyva MS, Camacho TM, Tovar PM, Huerta EJ, Villaseñor MH and García LE. 2018. Agresividad de aislados de Bipolaris sorokiniana y Alternaria alternata en variedades de trigo en México. Mexican Journal of Phytopathology 36(3): 432-443. https://doi.org/10.18781/r.mex.fit.1803-3 [ Links ]
Morales RI, Yañez MM, Silva RH, García DG Guzmán PD. 2007. Biodiversity of Fusarium species in México associated with ear rot in maize, and their identification using a phylogenetic approach. Mycopathologia 163:31-39. https://doi.org/1007/s11046-006-0082-1. [ Links ]
Mutha RE, Tatiya AU and Surana SJ. 2021. Flavonoids as natural phenolic compounds and their role in therapeutics: an overview. Future Journal of Pharmaceutical Sciences 7(1): 25. https://doi.org/10.1186/s43094-020-00161-8 [ Links ]
Nguyen TLA and Bhattacharya D. 2022. Antimicrobial activity of quercetin: an approach to its mechanistic principle. Molecules 27:2494. https://doi.org/ 10.3390/molecules27082494. [ Links ]
Oufensou S, Balmas V, Azara E, Fabbri D, Dettori MA, Schüller C, Zehetbauer F, Strauss J, Delogu G, and Migheli Q. 2020. Naturally occurring phenols modulate vegetative growth and deoxynivalenol biosynthesis inFusarium graminearum. ACS Omega 5(45): 29407-29415. https://doi.org/10.1021/acsomega.0c04260 [ Links ]
Pan JH, Peng CY, Lo CT, Dai CY, Wang CL and Chuang HY. 2017. n-Hexane intoxication in a Chinese medicine pharmaceutical plant: a case report. Journal of Medical Case Reports 11: 120. https://doi.org/10.1186/s13256-017-1280-9 [ Links ]
Peñuelas RO, Arellano GM, Verdugo FAA, Chaparro- ELA, Hernández RSE, Martínez CJL y Vargas AIC. 2017. Extractos de Larrea tridentata como una estrategia ecológica contra Fusarium oxysporum radicis-lycopersici en plantas de tomate bajo condiciones de invernadero. Mexican Journal of Phytopathology 35(3): 360-376. https://doi.org/10.18781/r.mex.fit.1703-3 [ Links ]
Pérez RL, Pérez ML, Guzmán MR, Sanzón GD y Belmonte VJ. 2019. Sensibilidad in vitro de hongos fitopatógenos causantes de enfermedades en fresa a controladores biológicos y fungicidas, en el estado de Guanajuato, México. Acta universitaria 29: 1-11. https://doi.org/10.15174/au.2019.2339 [ Links ]
Quintana SE, Villanueva BD, Reglero G, García RMR and Fornari T. 2019. Supercritical antisolent particle precipitation and fractionation of rosemary (Rosmarinus officinalis L.). Journal of CO2 Utilization 34: 479-489. https://doi.org/10.1016/j.jcou.2019.07.032 [ Links ]
Rahardiyan D. 2019. Antibacterial potential of catechin of tea (Camellia sinensis) and its applications. Food Research 3 (1): 1 - 6. https://doi.org/10.26656/fr.2017.3(1).097 [ Links ]
Reyes TA, Rodríguez AG, Santillán MR, Díaz CM y Fernández PS. 2019. Marchitez causada por Fusarium solani en chile chilaca (Capsicum annuum) en Michoacán. Mexican Journal of Phytopathology 37 (No. Esp. 1): 43-47. http://dx.doi.org/10.18781/R.MEX.FIT.1904-1 [ Links ]
Rodríguez CA, Torres HS, Domínguez CA, Romero GA and Silva FM. 2020. Plant extracts to control Fusarium oxysporum, Fusarium solani y Rhizoctonia solani: a sustainable alternative for agriculture. Abanico Agroforestal 2:1-13. https://abanicoacademico.mx/revistasabanico/index.php/abanico-agroforestal/article/view/265 [ Links ]
Sanzani SM, De Girolamo A, Schena L, Solfrizzo M, Ippolito A and Visconti A. 2009. Control of Penicillium expansum and patulin accumulation on apples by quercetin and umbelliferone European Food Research and Technology 228: 381-389. https://doi.org/10.1007/s00217-008-0944-5 [ Links ]
Sepúlveda-Rincón CT, Ciro-Gómez GL y Zapata-MontoyaI JE, 2016. Extracción de compuestos fenólicos y actividad antioxidante de hojas de Bixa orellana L. (achiote). Revista Cubana de Plantas Medicinales, 21(2):133-144. http://scielo.sld.cu/pdf/pla/v21n2/pla02216.pdf [ Links ]
Shisong J, Xinran R, Li W, Xiangri K, Xingye W, Xiren C, Xuerui G, Yan S, Jiyu G, Tiedong W, Bingmei W, Wu S and Yicheng Z. 2022. Nepetin reduces virulence factors expression by targeting ClpP against MRSA-induced pneumonia infection. Virulence 13(1):578-588, http://dx.doi.10.1080/21505594.2022.2051313 [ Links ]
Simmons EG. 2007. Alternaria: an identification manual. CBS Fungal Biodiversity Centre, Utrecht, the Netherlands. 775 pp. https://www.nhbs.com/alternaria-an-identification-manual-book. [ Links ]
Singh R and Chandrawat KS. 2017. Role of phytoalexins in plant disease resistance. International Journal of Current Microbiology and Applied Sciences 6(1): 125-129. http://dx.doi.org/10.20546/ijcmas.2017.601.016 [ Links ]
Soto GM y Rosales CM. 2016. Efecto del solvente y de la relación masa/solvente, sobre la extracción de compuestos fenólicos y la capacidad antioxidante de extractos de corteza de Pinus durangensis y Quercus sideroxyla. Maderas. Ciencia y Tecnología 18(4): 701-714. https://dx.doi.org/10.4067/S0718-221X2016005000061 [ Links ]
Sridhar N, Krishnakishore C, Sandeep Y, Sriramnaveen P, Manjusha Y and Sivakumar V. 2011. Chloroform Poisoning - A Case Report. Renal Failure 33(10): 1037-1039. https://doi.org/10.3109/0886022X.2011.618920 [ Links ]
Takshak S and Agrawal SB. 2019. Defense potential of secondary metabolites in medicinal plants under UV-B stress. Journal of Photochemistry and Photobiology B: Biology 193: 51-88. https://doi.org/10.1016/j.jphotobiol.2019.02.002 [ Links ]
Valdez GD, Esparza GS, Morlett CJ, Nery FS, Flores GA, Ascacio VJ and Rodríguez-Herrera R 2021. Isolation of polyphenols from soursop (Annona muricata L.) leaves using green chemistry techniques and their anticancer effect. Biological and Applied Sciences 64: e21200163. https://doi.org/10.1590/1678-4324-2021200163 [ Links ]
Vitola RD and Pérez CA. 2016. Bioactivity from Annona muricata extracts and essentials oils from Citrus aurantium against Phytophthora cinnamomi. Revista Colombiana de Ciencia Animal 8(s): 325-334. https://doi.org/10.24188/recia.v8.n0.2016.388 [ Links ]
Zhang Y, Cai P, Cheng G and Zhang Y. 2022. A brief review of phenolic compounds identified from plants: Their extraction, analysis, and biological activity. Natural Product Communications 17(1): 1-14. https://doi.org/10.1177/1934578X211069721 [ Links ]
Zhang J, Cui X, Zhang M, Bai B, Yang Y and Fan S. 2021. The antibacterial mechanism of perilla rosmarinic acid. Biotechnology Applied Biochemistry. https://doi.org/10.1002/bab.2248. [ Links ]
Recibido: 27 de Junio de 2022; Aprobado: 19 de Agosto de 2022











 text in
text in 


