Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.40 n.1 Texcoco Jan. 2022 Epub Oct 03, 2022
https://doi.org/10.18781/r.mex.fit.2106-8
Artículos científicos
Respuesta de variedades de jitomate (Solanum lycopersicum) a la infección con Clavibacter michiganensis subsp. michiganensis
1 Instituto Tecnológico Superior de la Sierra Norte de Puebla. Avenida José Luis Martínez Vázquez No. 2000 Jicolapa, Zacatlán, Puebla, CP 73310, México
2 Postgrado en Estadística. Colegio de Postgraduados, Campus Montecillo, Texcoco, Estado de México, CP 56230, México
3 Postgrado en Genética. Colegio de Postgraduados, Campus Montecillo, Texcoco, Estado de México, CP 56230, México
4 Postgrado en Fitopatología. Colegio de Postgraduados, Campus Montecillo, Texcoco, Estado de México, CP 56230, México
Clavibacter michiganensis subsp. michiganensis (Cmm) causa la enfermedad marchitez y cancro del jitomate. Los objetivos de esta investigación fueron i) caracterizar e identificar a Cmm más agresivo en Chignahuapan, Puebla, ii) evaluar la tolerancia en dos etapas fenológicas de 10 variedades de jitomate a la infección por CP_Cmm-1 en invernadero y la sensibilidad in vitro de la bacteria a bactericidas. Se colectaron 12 aislamientos de Cmm de plantas de jitomate y se seleccionó una cepa (CP_Cmm-1) con mayor agresividad de acuerdo al tiempo de manifestación de síntomas en plantas de la var. Reserva. Después, la cepa se inoculó por el corte con tijeras embebidas en una suspensión con 3 x 108 UFC mL-1 en dos etapas fenológicas (a los cinco y 10 hojas verdaderas). Se evaluó la sintomatología durante 30 días después de la inoculación. Adicionalmente, se evaluó la sensibilidad de CP_Cmm-1 ante ocho bactericidas comerciales in vitro. Los resultados mostraron que la cepa CP_Cmm-1 se identificó con 97% de similitud con el sistema API20 E, positivo con DAS-ELISA y por PCR mostró 96.6% de identidad con Clavibacter michiganensis subsp. michiganensis. La variedad Saher mostró mayor tolerancia a la infección (*= p≤0.05) tanto en la etapa de cinco como 10 hojas; las variedades Sv4401, Nápoles y Súper óptimo mostraron mayor susceptibilidad en la etapa de cinco hojas. La variedad Sv4401 fue altamente susceptible en ambas etapas. Ninguna variedad fue resistente a la infección por CP_Cmm-1. El uso de la variedad Sahel y kasugamicina podría reducir el daño de esta bacteria.
Palabras clave: bactericidas; infección vascular; tolerancia; bacteria; variedades
Clavibacter michiganensis subsp. michiganensis causes bacterial wilt and canker disease of tomato. The objectives of this research were i) to characterize and identify the most aggressive Cmm in Chignahuapan, Puebla, ii) to evaluate the tolerance in two phenological stages of 10 tomato varieties to infection by CP_Cmm-1 in the greenhouse and the in vitro sensitivity of the bacteria to bactericides. 12 Cmm isolates were collected from tomato plants and a strain (CP_Cmm-1) with greater aggressiveness was selected according to the time of manifestation of symptoms in plants of var. Reserva. Afterward, the strain was inoculated by cutting with scissors embedded in a suspension with 3 x 108 UFC mL-1 in two phenological stages (at five and 10 true leaves). Symptoms were evaluated for 30 days after inoculation. Additionally, the sensitivity of CP_Cmm-1 to eight commercial bactericides in vitro was evaluated. The results showed that the CP_Cmm-1 strain was identified with 97% similarity with the API20 E system, positive with DAS-ELISA, and by PCR it showed 96.6% identity with Clavibacter michiganensis subsp. michiganensis. The Saher variety showed greater tolerance to infection (* = p≤0.05) both in the stage of five and 10 leaves; the varieties Sv4401, Nápoles, and Súper óptimo showed greater susceptibility in the five-leaf stage. The Sv4401 variety was highly susceptible in both stages. Neither variety was resistant to infection by CP_Cmm-1. The use of the Sahel variety and kasugamycin could reduce the damage of this bacteria.
Key words: bactericides; vascular infection; tolerance; bacteria; varieties
El jitomate (Solanum lycopersicum) es la segunda hortaliza de mayor consumo en el mundo y en México es la más importante en el ámbito agroalimentario (SADER, 2020). Clavibacter michiganensis subsp. michiganensis (Cmm) causa la “marchitez” y “cancro bacteriano” y es la enfermedad más destructiva y recurrente en el cultivo de jitomate; en México, causa pérdidas económicas estimadas en 40 millones de dólares anuales (Borboa-Flores et al., 2009). Cmm es un patógeno de cuarentena internacional (EFSA, 2014; EPPO, 2016). La marchitez y cancro son más severos en los sistemas de producción bajo cubierta debido a las condiciones ambientales y continuas prácticas de cultivo que favorecen la infección (Martínez-Castro et al., 2018; Yuqing et al., 2018). Cmm infecta los vasos del xilema y causa síntomas de marchitez, clorosis marginal de hojas y grietas (cancro) en el tallo (Bae et al., 2015), se disemina principalmente por semilla (Nandi et al., 2018), uso de plántula infectada, herramientas, suelo y agua (Tancos et al., 2013), contacto del fluido de gutación entre plantas sanas y enfermas (Sharabani et al., 2013a) y solución nutritiva en cultivos hidropónicos (Huang y Tu, 2001).
Las cepas de Cmm con mayor virulencia albergan los plásmidos pCM1(27.4 kb) y pCM2 (70.0 kb), que codifican para la producción de polisacáridos (EPS) y enzimas extracelulares (Dreier et al., 1997; Gartemann et al., 2008); que confieren patogenicidad, diferente grado de virulencia y agresividad entre cepas aisladas de distintas regiones en el mundo (Wasserman et al., 2020; Yuqing et al., 2018), así como la habilidad para adaptarse a nuevos hábitats (Nandi et al., 2018).
Hasta la fecha no se han desarrollado variedades comerciales con resistencia completa a Cmm, ni otra medida de control efectiva lo cual ocasiona severas epidemias (Nandi et al., 2018). En otros países, se han identificado variedades de jitomate con mayor tolerancia a la enfermedad (Eichenlaub y Gatermann, 2011). Formas silvestres de jitomate albergan genes de resistencia contra Cmm; sin embargo, la herencia de estos genes es compleja y expresan caracteres indeseables como fruto pequeño y bajo rendimiento durante el mejoramiento genético (Bae et al., 2015; Coaker et al., 2004). Se han estudiado diversas estrategias de control las cuales incluyen el control químico principalmente con antibióticos y compuestos a base cobres (de León et al., 2008; Milijašević et al., 2009), biológico (Nandi et al., 2018), uso de extractos de plantas (Muhammad et al., 2020), bacteriocinas (Mirzaee et al., 2021) con limitada eficacia en muchos casos debido a la alta variación en la agresividad y virulencia del patógeno, así como su adaptación a ciertos genotipos y sistemas de producción de jitomate (Croce et al., 2016).
En los últimos cinco años, en la localidad de Chignahuapan, Puebla se identificaron brotes de la enfermedad en jitomate cultivados en invernadero; hasta la fecha, no hay ningún estudio sobre la respuesta a la infección por Cmm en las variedades cultivadas en esta región. Nuestra hipótesis establece que hay variedades de jitomate con mayor tolerancia a la infección por cepas agresivas de Cmm y que este patógeno es sensible a bactericidas comerciales disponibles en esta región. La identificación de variedades de jitomate con mayor tolerancia a la infección por Cmm y el uso de bactericidas efectivos puede contribuir a un mejor manejo y reducir el daño económico causado por esta enfermedad. Por lo anterior, los objetivos de esta investigación fueron: i) caracterizar e identificar a Cmm más agresivo en Chignahuapan, Puebla, ii) evaluar la tolerancia en dos etapas fenológicas de 10 variedades de jitomate a la infección por Cmm más agresivo en invernadero y la sensibilidad in vitro de la bacteria a bactericidas.
Materiales y métodos
Aislamiento del patógeno y condiciones de crecimiento
En 2019, se recolectaron tallos y hojas de plantas de jitomate en invernaderos de las variedades Benedetti (19° 52’ 11.2” N 98° 02’ 10.7” W), Reserva (19° 52’ 12.9” N 98° 02’ 12.8” W) y Pai Pai (19° 52’ 17.4” N 98° 02’ 15.3” W) con síntomas de marchitez en la localidad de Chignahuapan, Puebla. Las muestras de tejido (0.5 cm) se desinfestaron con hipoclorito de sodio al 1% y se lavaron tres veces con agua destilada estéril; después se colocaron en tubos con 3 mL de solución salina (0.85%) estéril durante 1 h. 20 µL de esta suspensión se sembró en medio de cultivo agar nutritivo (AN) (Sigma-Aldrich) y se incubó a 28 °C por 48 h. Las bacterias purificadas se identificaron morfológicamente de acuerdo a Cmm (EPPO, 2016). Las bacterias se preservaron en cultivo criogénico a -80 °C en medio Luria Bertani (Merck) y 40% de glicerol.
Agresividad de Clavibacter michiganensis subsp. michiganensis
Los aislamientos de Cmm (CP_Cmm-1 a CP_Cmm-12) se inocularon individualmente en tres plántulas de jitomate var. Reserva en invernadero en estado fenológico de cuatro hojas verdaderas; la inoculación se realizó mediante el corte de la hoja apical con tijeras embebidas (Thyr, 1968) en una suspensión celular con 3 x 108 UFC mL-1 basado en el patrón de turbidez de la escala de McFarland (McFarland, 1907). La aparición de síntomas de marchitez en las plantas inoculadas se registró durante 13 días y se seleccionó el aislamiento más agresivo (cepa CP_Cmm-1 en este estudio) basado en el periodo de incubación (PI) el cual se consideró como el tiempo (días) transcurrido entre la inoculación y la aparición de síntomas de marchitez en las plantas inoculadas. Las plantas testigo se inocularon con agua destilada estéril. Del tejido interno del tallo de las plantas con síntomas de marchitez se reaislaron bacterias con las mismas características fenotípicas de la cepa inoculada y se identificó como Cmm por PCR.
Caracterización e identificación de Clavibacter michiganensis subsp. michiganensis
El aislamiento CP_Cmm-1 se caracterizó de acuerdo a los protocolos descritos por Schaad et al. (2001). Además, se utilizaron los sistemas API20 E (Biomerieux, Durhan, NC, U.S.A.) y el kit comercial DAS-ELISA (Double Antibody Sandwich Enzyme Linked Immunosorbent Assay) (Agdia® Inc, SRA 44000/0096) con anticuerpos específicos para Cmm. Así mismo, se infiltró una suspensión con 3 x 108 UFC mL-1 de la cepa CP_Cmm-1 en el envés de hojas de tabaco (Nicotiana tabacum) y maravilla (Mirabilis jalapa).
Para la identificación por PCR, el ADN de la cepa CP_Cmm-1 se obtuvo de colonias individuales con 72 h de crecimiento a 28 °C en medio AN con el kit PureLink Genomic DNA Kits (Invitrogen Life Technologies, Carlsbad, CA, U.S.A.) siguiendo el protocolo del fabricante. Por PCR se amplificó el plásmido pCM2 que alberga el fragmento específico del gen pat-1 (serina proteasa) de 614 pb de Clavibacter michiganensis subsp. michiganensis con los iniciadores CMM5F-5´GCGAATAAGCCCATATCAA 3´ y CMM6R-5´ CGTCAGGAGGTCGCTAATA 3´ y condiciones de PCR descritos por Dreier et al. (1997). La PCR se realizó en un termociclador (C1000 Touch TM Thermal Cycler) y los fragmentos amplificados se secuenciaron en el Instituto de Biotecnología de la UNAM (IBT). Las secuencias se compararon en el banco de genes (Gen Bank) del Centro Internacional para la Información en Biotecnología (NCBI-National Center of Biotechnology Information), empleando el algoritmo Blastx (Altschul et al., 1990) del Centro Nacional de Información Biotecnológica (NCBI) (http://www.ncbi.nlm.nih.gov/Blast).
Inoculación de Clavibacter michiganensis subsp. michiganensis en variedades de jitomate
Este estudio se realizó como un factorial en un diseño bloques completos al azar con cuatro repeticiones; el primer factor utilizó 10 variedades de jitomate: 1) Benedetti, 2) Reserva, 3) Malvia, 4) USATX12227, 5) Sahel, 6) Pai-Pai, 7) Súper óptimo, 8) Nápoles 9) Sv4401 y 10) Tobalá. Después de la germinación de la semilla; las plántulas se trasplantaron en bolsas de plástico negro (2 kg), con una mezcla de peat moss, tierra vega y tepezil (2:1:1) y se mantuvieron en invernadero con una humedad relativa >70 y temperatura entre 30 y 33 °C. Las plantas se regaron diariamente y se fertilizaron dos veces por semana con la formulación nutritiva Steiner (Steiner, 1984).
La cepa CP_Cmm-1 se inoculó en la hoja apical de cada variedad de jitomate (n=10) mediante el corte con tijeras embebidas en una suspensión celular (Thyr, 1968) ajustada con 3x108 UFC mL-1 utilizando la escala de McFarland y confirmado por recuento en placa en medio AN después de 72 h a 28 oC (Klement et al., 1990). El segundo factor contempló dos etapas de desarrollo fenológico en tratamientos independientes, al desarrollo de 1) cinco hojas verdaderas, 2) 10 hojas verdaderas. Cada variedad se inoculó en 10 plantas (repeticiones). La inoculación de todas las variedades fue simultánea y se realizó en un periodo de 60 min. Las plantas testigo se inocularon con agua destilada estéril. La aparición de síntomas se registró diariamente durante 30 días después de la inoculación (ddi); para evaluar la severidad, se diseñó una escala visual arbitraria de 0 a 4 donde 0= planta sana, 1= marchitez de hojas, 2= epinastia, clorosis de hojas, 3= colonización vascular de tallo y 4=cancro en tallo y colonización interna del fruto. La variable analizada fue el tiempo (número de días en llegar al grado 4 de severidad) con la interacción de los factores: variedad de jitomate-etapa fenológica- desarrollo de síntomas. Los datos se analizaron con el programa estadístico R versión 4.0.5 (Avello y Seisdedo, 2017). Del tejido interno del tallo de cada variedad se reaisló la bacteria inoculada y se identificó por PCR.
Sensibilidad in vitro a bactericidas
Se evaluaron ocho bactericidas comerciales a la concentración recomendada en etiqueta, en stock de 25 mL de agua: 1) Sulfato de estreptomicina + Oxitetraciclina + Sulfato tribásico de cobre monohidratado, 1.5 g (Cuprimicin 500) (Ingeniería Industrial); 2) Estreptomicina + Oxitetraciclina, 0.2 g (Bactrol 2x) (Ingeniería industrial); 3) Clorhidrato de oxitetraciclina, 0.5 g (Cuprimicin Agrícola 5%) (Ingeniería Industrial); 4) Estreptomicina + Oxitetraciclina, 1 g (Bactiomicin Agrícola) (AgriBest); 5) Cuaternario de Amonio, 3.5 mL (Quatz IV) (Alterna Agro); 6) Kasugamicina, 0.17 mL (Kasumin) (Gowan Mexicana); 7) Sulfato de estreptomicina, 0.2 g (Cuprimicin 17) (Ingeniería Industrial); 8) Sulfato de Gentamicina + Clorhidrato de Oxitetraciclina, 1.5 g (Final Bacter) (FormulAbagro de México).
La sensibilidad in vitro contra la cepa CP_Cmm-1 se realizó por el método descrito por Jung et al. (2014) modificado: El inóculo de Clavibacter se obtuvo de un cultivo puro de 48 h a 28 oC en medio agar nutritivo; de aquí, se preparó una suspensión acuosa con 1 x 108 UFC mL-1. La sensibilidad se evaluó en microplacas de poliestireno (Thermo Scientific™) con 96 pocillos; a cada pocillo con 80 µL de medio caldo nutritivo se le agregó 10 µL de inóculo de Clavibacter y 10 µL de la solución bactericida; el testigo consistió de la inoculación de Clavibacter en caldo nutritivo sin bactericida. Las microplacas se incubaron a 28 oC y se registró la absorbancia a una densidad óptica (DO) de 600 nm a las 0, 12, 24, 48, 60, 72 y 84 h de crecimiento en un lector Multiskan Ascent V1.24 354-01843 Version-1.9.1. La sensibilidad a los bactericidas por Cmm se determinó por el menor valor de DO en el co-cultivo del patógeno con el bactericida con respecto al testigo. Se realizó un diseño factorial con medidas repetidas utilizando un modelo mixto donde los bloques y unidades experimentales son aleatorios, el modelo se ajustó con una función de correlación sin estructura entre tiempos, se contempló la heterogeneidad de varianza entre tratamientos en el modelo; todos los tratamientos se evaluaron por triplicado. Los datos de la interacción de Cmm con el bactericida se analizaron con el programa estadístico InfoStat versión 1.5 (Grupo Infostat 2003).
Resultados y discusión
Caracterización e identificación de Clavibacter michiganensis subsp. michiganensis
Los 12 aislamientos de Cmm inoculados en jitomate var. Reserva causaron marchitez; sin embargo, el periodo de incubación (PI) fue diferente entre los aislamientos. Los síntomas de marchitez en las plántulas inoculadas se observaron en un rango entre 5 y 12 ddi. El aislamiento CP_Cmm-1 de Clavibacter michiganensis subsp. michiganensis (aislado de la var. Reserva) mostró mayor agresividad causando marchitez a los 5 ddi (PI) por lo que se seleccionó para este estudio. En las plantas testigo no se observó el desarrollo de ningún síntoma. Estos resultados coinciden con lo reportado por Tancos et al. (2013) quienes demostraron diferencias en la virulencia entre cepas de Cmm. Otros estudios identificaron haplotipos de Cmm con mayor virulencia y agresividad en algunas zonas productoras de jitomate que en otras y sugieren la existencia de tipos de secuencia que se adaptan a determinada región, genotipo de jitomate, condiciones de clima y sistema de producción (Croce et al., 2016; Martínez-Castro et al., 2018; Thapa et al., 2017). Esta diversidad puede ser consecuencia de la introducción de nuevas cepas de Cmm de diferente origen principalmente por la importación de semilla (Yuqing et al., 2018). La caracterización fenotípica de la cepa CP_Cmm-1 mostró el crecimiento de colonias amarillo-naranja en medio YDC, Gram positivas, no mótiles, metabolismo oxidativo de glucosa, oxidasa negativa, produjeron ácido a partir de manosa, pero no de manitol, ribosa, sorbitol e inulina, hidroliza esculina pero no caseína, utilizan como fuente de carbono acetato y succinato de sodio; estas características se reportaron previamente para Clavibacter michiganensis subsp. michiganesis (EPPO, 2016; Schaad et al., 2001).
El fenotipo de la cepa CP_Cmm-1 coincidió 97% con el sistema API20 E, y fue positivo por serología con el sistema DAS-ELISA. Por PCR se amplificó el fragmento del gen pat-1 (serina proteasa) de 614 pb del plásmido pCM2 de Clavibacter michiganensis subsp. michiganensis con los iniciadores CMM5F y CMM6R. El gen pat-1 (serina proteasa) confiere patogenicidad en Cmm y es un importante determinante de virulencia para la producción de polisacáridos extracelulares, celulasas, glucanasas y otras enzimas, que inducen enfermedad en jitomate por la degradación de la pared celular en los vasos del xilema, causando el síntoma de marchitez (Eichenlaub y Gatermann, 2011; Wassermann et al., 2020). La comparación de la secuencia en el GenBank del producto amplificado de PCR de la cepa Cp_Cmm-1, mostró 96.6% de identidad con C. michiganensis subsp. michiganensis NCPPB 382 plásmido pCM2 (accesión AM711866.1). La infiltración de la cepa CP_Cmm-1 en el envés de hojas de tabaco y maravilla indujo una reacción de hipersensibilidad lo cual coincide con lo reportado por Alarcón et al. (1998) y Lu et al. (2015), quienes demostraron la inducción de hipersensibilidad en estas mismas especies de plantas por la expresión de la proteína ChpG con cepas de Cmm virulento. Los resultados de la identificación de la cepa CP_Cmm-1 cumplen con el protocolo oficial para la caracterización e identificación de Cmm en muestras sintomáticas de jitomate, el cual sugiere la combinación de pruebas bioquímicas, serológicas, moleculares y patogenicidad de acuerdo con EPPO (2016).
Respuesta de jitomate a Clavibacter michiganensis subsp. michiganensis
La respuesta de las 10 variedades de jitomate inoculadas con la cepa Cp_Cmm-1 fue diferente. La técnica de inoculación mediante el corte del peciolo con tijeras embebidas en el inóculo se considera rápida y adecuada para la evaluación de tolerancia a la infección sistémica por Cmm (van Steekelenburg, 1985). Los síntomas y la severidad de la enfermedad fueron diferente a través del tiempo y dependiente de la etapa fenológica (edad de la planta y número de hojas). En todas las variedades, excepto una, la aparición de síntomas fue con mayor rapidez y severidad en las plantas inoculadas con cinco que con 10 hojas verdaderas. Lo anterior sugiere que las características genéticas y la etapa fenológica de cada variedad son factores importantes para la expresión de virulencia por Cmm; estos resultados sugieren que a menor desarrollo de la planta la susceptibilidad y severidad por la infección de este patógeno es mayor.
Los síntomas en ambas etapas fenológicas (cinco y 10 hojas) durante y al final de la evaluación (30 ddi) incluyeron todos los grados de severidad (marchitez de hojas, clorosis, infección vascular, cancro en tallo y colonización del fruto) en todas las variedades. Sin embargo, los resultados del análisis estadístico con la interacción de los factores: variedad de jitomate-etapa fenológica- desarrollo de síntomas, indicaron que la variedad Sahel fue diferente significativamente del resto (*= p≤0.05) con el mayor promedio de días (13.7 y 14.5 ) para la aparición y desarrollo de todos los síntomas tanto en la etapa de cinco como 10 hojas verdaderas respectivamente. Así mismo, esta variedad mostró la menor severidad de síntomas, lo que sugiere mayor tolerancia a la infección por Cmm en ambas etapas fenológicas que el resto de las variedades. En contraste, las variedades Sv4401, Nápoles y Súper óptimo fueron altamente susceptibles en la etapa de cinco hojas. Entre estas, la variedad Sv4401 mostró la mayor susceptibilidad y severidad entre todas las variedades en las dos etapas fenológicas (cinco y 10 hojas), con el menor promedio (5.5 y 9 días) respectivamente para la aparición y desarrollo de los síntomas (Cuadro 1); además, las plantas de esta variedad mostraron un porte de menor altura, abundante exudado bacteriano en peciolos, tallos con cancro severo, y extensiva colonización interna del fruto.
Estos resultados son similares a otras investigaciones; Stüwe y Tiederman et al. (2013), en ensayos de invernadero identificó genotipos de jitomate que mostraron mayor severidad de síntomas causados por Cmm en contraste con otros bajo las mismas condiciones experimentales de inoculación. Así mismo, los resultados de nuestro estudio evidencian la dificultad de encontrar variedades de jitomate tolerantes a la infección causado por Cmm; en un estudio en China, cinco de 25 genotipos de jitomate se catalogaron como moderadamente resistentes y ninguno con alta resistencia o resistencia completa a la infección por Cmm (Yuqing et al., 2018); en tanto Kabas et al. (2018) de 78 genotipos clasificó 55% como muy susceptibles, 39% susceptibles, 4% moderadamente resistentes y únicamente 2% como tolerantes a la infección por Cmm.
Cuadro 1 Interacción de variedad, etapa fenológica, días de aparición de síntomas y severidad en 10 variedades de jitomate inoculados con la cepa CP_Cmm-1 de Clavibacter michiganensis subsp. michiganensis.
| Inoculación etapa fenológica cinco hojas verdaderas | Inoculación etapa fenológica 10 hojas verdaderas | ||
|---|---|---|---|
| Variedad Jitomate | Media días desarrollo de síntomas | Variedad Jitomate | Media días desarrollo de síntomas |
| Sahel | 13.75 az | Sahel | 14.50 az |
| Tobalá | 10.50 b | Malvia | 14.00 b |
| Benedetti | 10.50 b | USA12227 | 12.75 c |
| Reserva | 10.25 bc | Benedetti | 12.75 c |
| Malvia | 10.00 c | Reserva | 12.50 c |
| Pai-Pai | 9.75 h | Tobalá | 12.50 c |
| USA12227 | 9.75 h | Súper óptimo | 11.75 d |
| Súper óptimo | 8.75 i | Pai-Pai | 11.50 de |
| Nápoles | 7.50 j | Nápoles | 11.25 e |
| Sv4401 | 5.50k | Sv4401 | 9.00 f |
Test: LSD Fisher Alfa=0.05 DMS= 0. 44431. Error: 0.0985 gl: 57.
z Medias con una letra común no son significativamente diferentes (*= p≤0.05).
Diversos factores explican la severidad de los síntomas causados por la infección de Cmm entre diferentes genotipos de jitomate; uno de ellos es la edad de la planta; Nandi et al. (2018) y Sharabani et al. (2013b) mostraron que algunas variedades de jitomate que se infectan en etapas de desarrollo tardías, pueden ser asintomáticas o desarrollar marchitez lenta; sin embargo, en infecciones tempranas, la bacteria se multiplica en los vasos del xilema y forma biopelículas (Lelis et al., 2014) que le permite colonizar con altas densidades y causar una infección sistémica que origina síntomas severos de marchitez, cancro en tallo, discoloración vascular e infección del fruto (Bae et al., 2015; Chalupowicz et al., 2012; Tancos et al., 2013); en este estudio, estos mismos síntomas se observaron en las variedades más susceptibles con la inoculación de la cepa CP_Cmm-1 (Figura 1).
Infección sistémica en variedades de jitomate
La infección sistémica por Cmm produce los síntomas de marchitez y clorosis de hojas, daño en el xilema, cancro en tallo e infección del fruto. En esta investigación, las 10 variedades inoculadas con la cepa Cp_Cmm-1 desarrollaron todos estos síntomas excepto la variedad Sahel. La diferencia en la severidad de los síntomas fue evidente entre la variedad con mayor tolerancia y las de mayor susceptibilidad (Figura 1). El desarrollo del síndrome está relacionado con la infección de cepas altamente virulentas de Cmm (Chalupowicz et al., 2017), lo que sugiere que la cepa Cp_Cmm-1, utilizada en este estudio, podría encontrarse en este grupo.
La infección sistémica, marchitez y clorosis de hojas, cancro en tallo e infección del fruto fue más severa en las variedades susceptibles Súper óptimo, USATX12227 y Sv4401; en contraste con la variedad con mayor tolerancia (Sahel) en la cual todos los síntomas fueron notoriamente menos severos y no hubo infección de frutos en ambas etapas fenológicas. En las variedades susceptibles, el xilema del tallo mostró síntomas desde decoloración de tejidos vasculares entre amarillo, café claro y café obscuro hasta la degradación de la médula del tallo (Figura 1).

Figura 1 Severidad de síntomas desarrollados a los 30 ddi con Clavibacter michiganensis subsp. michiganensis (cepa CP_Cmm-1) en variedades de jitomate con mayor tolerancia y susceptibilidad: A) testigo, B y C) clorosis y marchitez en hojas, D) infección sistémica en el xilema del tallo, E) cancro en tallo y F) colonización interna de fruto.
Los mecanismos moleculares relacionados con la respuesta de la planta de jitomate a la infección por Cmm son complejos y muchos aspectos actualmente no están completamente dilucidados. Stüwe y Tiedemann et al. (2013) observaron mayor oclusión de los vasos del xilema y menos tílides en variedades de jitomate susceptibles a Cmm. Así mismo, Eichenlaub y Gatermann (2011) demostraron que en el periodo de incubación y severidad de la enfermedad influyó la temperatura, variedad, edad de la planta y concentración del inóculo. La infección sistémica por Cmm se relacionó con alta densidad de población (>108 UFC g-1 tejido) en la planta infectada (Gartemann et al., 2003), producción de las enzimas pectato liasa, celulasas y xilanasa que degradan las células del xilema y originan el cancro en tallo (Chalupowicz et al., 2012; Gartemann et al., 2008); inducción por la planta de proteínas relacionadas a la patogénesis (PR) (Savidor et al., 2012), así como la concentración de amonio y ácidos carboxílicos en el fluido del xilema en ciertas variedades de jitomate (Bialczyk et al., 2004; Yadeta et al., 2013), respuesta de la planta a concentraciones de etileno inducido por la infección de Cmm (Balaji et al., 2008) y a las concentraciones del compuesto antimicrobiano α-toamtina producido por la planta que afecta el crecimiento de Cmm (Eichenlaub y Gatermann, 2011).
Estudios previos con jitomate silvestre sugirieron que la morfología vascular es un factor importante en la tolerancia a Cmm (Coaker et al., 2004). Muchos de los factores anteriores podrían explicar la mayor tolerancia de la variedad Sahel identificada en esta investigación, la cual destacó por la menor severidad de infección vascular, cancro en tallo y sin infección aparente en fruto. Por lo anterior, investigaciones futuras podrían profundizar en la interacción de esta variedad con Cmm y las bases genéticas de la tolerancia observada en este estudio.
Infección en fruto en variedades de jitomate
Al realizar un corte transversal del fruto, se observaron diferencias en la agresividad y severidad de la colonización e infección interna del fruto entre la variedad con mayor tolerancia (Sahel) en donde los síntomas de marchitez y cancro fueron menos severos y sin colonización interna del fruto; en contraste, en las variedades susceptibles (Súper óptimo, Nápoles y Sv4401) se observó mayor severidad de los síntomas de marchitez, daño en el xilema, cancro en tallo y una extensiva colonización interna del patógeno en el fruto. El tejido interno en estos frutos mostró decoloración de tejido vascular y degradación de la médula (Figura 1).
Estos mismos patrones de colonización en fruto son similares con los observados en otras investigaciones (Tancos et al., 2013). La infección en frutos es resultado de la extensiva colonización de Cmm en el xilema de la planta de donde se dispersa hasta ingresar a través del pedicelo e infectar frutos y semillas (de León et al., 2011; Eichenlaub y Gartemann, 2011). En esta investigación, en los frutos con alta colonización interna en las variedades más susceptibles no se observaron síntomas externos, aparentemente aptos para su comercialización; sin embargo, representan una eficiente fuente de inóculo para sucesivas estaciones de crecimiento (Nandi et al., 2018), principalmente a través de la semilla infectada (de León et al., 2011).
Del tejido interno del tallo con síntomas de degradación y necrosis del xilema de cada variedad, se re-aislaron en cultivo puro colonias con las mismas características morfológicas de Cmm. La identidad de la cepa Cp_Cmm-1 inoculada se confirmó por PCR con la amplificación del plásmido pCM2 con el protocolo previamente descrito (Figura 2).
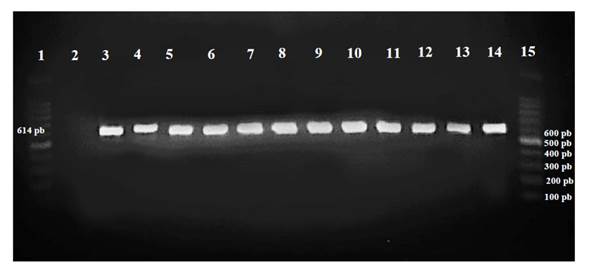
Figura 2 Amplificación del plásmido pCM2 -1 por PCR de la cepa Cp_Cmm-1 inoculada en 10 variedades de jitomate. Líneas: 1: marcador molecular de 100pb, 2: control (-), 3: control (+) 14: control (+), 4: Benedetti, 5: Reserva, 6: Malvia, 7: USATX12227, 8: Sahel, 9: Pai-Pai, 10: Súper óptimo, 11: Nápoles, 12: Sv4401, 13: Tobalá y 15: marcador molecular de 100pb.
Sensibilidad in vitro a bactericidas
Los resultados de la sensibilidad de la cepa CP_Cmm-1 a los bactericidas evaluados mostraron diferencias significativas (*= p≤0.05) con las formulaciones de Sulfato de estreptomicina + Oxitetraciclina + Sulfato tribásico de cobre monohidratado (Cuprimicin 500) y Kasugamicina (Kasumin) en la reducción del crecimiento celular. Los valores de la DO del co-cultivo de Clavibacter con estos bactericidas fueron significativamente menores que el testigo, donde se verificó la normalidad con la prueba de Shapiro-wilks. El porcentaje de crecimiento celular de Cmm decreció 19 y 18 % con los tratamientos: sulfato de estreptomicina + oxitetraciclina + sulfato tribásico de cobre monohidratado (Cuprimicin 500) y kasugamicina (Kasumin) respectivamente a las 84 h de interacción (Figura 3).
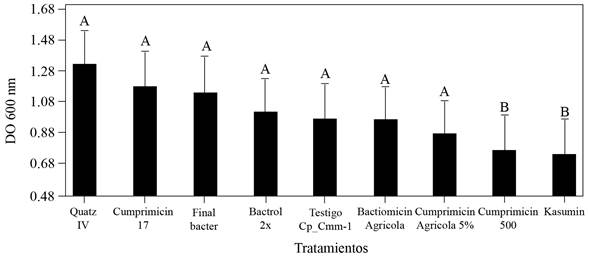
Figura 3 Sensibilidad in vitro a bactericidas de Clavibacter michiganensis subsp. michiganensis cepa CP_Cmm-1. Interacción del co-cultivo con bactericidas a las 84 h a 28 o C. Lecturas de la densidad de crecimiento celular, absorbancia 600 nm (DO). Medias con una letra común no son significativamente diferentes (*= p≤0.05).
Los resultados coinciden con de León et al. (2008); Milijašević et al. (2009) y Werner et al. (2002); quienes reportan que el sulfato de cobre, oxitetraciclina y kasugamicina es efectivo contra Cmm y redujo la severidad de los síntomas foliares y daño al fruto (Theodoro y Maringoni, 2000). Actualmente el uso de bactericidas en la agricultura es limitado; las aplicaciones de cobres y antibióticos, principalmente la estreptomicina y oxitetraciclina, están autorizados solo para algunos cultivos en muchos países y se ha demostrado la generación de resistencia por Cmm (Lyu et al., 2019; Valenzuela et al., 2019). La kasugamicina solo se usa en la agricultura y su espectro es reducido (Sundin et al., 2016); así mismo, en otras investigaciones se ha evidenciado que la kasugamicina reduce las poblaciones de patógenos bacterianos vasculares (Dias et al., 2019; McGhee y Sundin, 2011). La estreptomicina ha sido usada para el control de enfermedades bacterianas en México disminuyendo la dispersión secundaria de inóculo (Félix-Gastélum et al., 2012). La mejor estrategia de control de Cmm en jitomate se basa principalmente en estrictas medidas preventivas y prácticas culturales que incluyen el uso de variedades menos susceptibles, semilla certificada, plántula sana, desinfestación de herramientas e invernaderos y manejo con bactericidas que disminuyan el inóculo secundario del patógeno (de León et al., 2011; EFSA, 2014; Sundin et al., 2016). Los resultados de esta investigación sugieren que la combinación del uso de la variedad Sahel, la kasugamicina, en conjunto con las medidas de manejo anteriores podría ser una estrategia útil para reducir el daño causado por Cmm.
Conclusiones
Existe variación en la agresividad entre las cepas de Clavibacter michiganensis subsp. michiganensis en Chignahuapan, Puebla. La cepa CP_Cmm-1 es más agresiva entre las cepas aisladas de tres variedades de jitomate. Esta cepa se identificó como Clavibacter michiganensis subsp. michiganensis por métodos bioquímicos, serológicos y PCR y es sensible a la kasugamicina. Ninguna de las 10 variedades de jitomate cultivadas en esta localidad son resistentes a la infección por este patógeno. La mayoría de las variedades son más susceptibles a la infección en etapas fenológicas iniciales de la planta. Entre estas, hay variedades con mayor tolerancia y susceptibilidad a la infección; la variedad Sahel es más tolerante a la infección en distintas etapas fenológicas de la planta. Las variedades Sv4401, Nápoles y Súper óptimo son más susceptibles a la infección; entre estas, la variedad Sv4401 es altamente susceptible en diferentes etapas fenológicas. El uso de la variedad Sahel y la kasugamicina podría reducir el daño por este patógeno.
Literature cited
Alarcón C, Castro J, Muñoz F, Arce-Johnson P and Delgado J. 1998. Protein(s) from the gram-positive bacterium Clavibacter michiganensis subsp. michiganensis induces a hypersensitive response in plants. Phytopathology 88: 306-310. https://doi.org/10.1094/phyto.1998.88.4.306 [ Links ]
Altschul SF, Gish W, Miller W, Myers EW and Lipman DJ. 1990. Basic local alignment search tool. Journal of Molecular Biology 215:403-410. [ Links ]
Avello MR and Seisdedo LA. 2017. El procesamiento estadístico con R en la investigación científica. MediSur 15(5): 583-586. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1727- 897X2017000500001&lng=es&tlng=es. [ Links ]
Bae C, Han SW, Song YR, Kim BY, Lee HJ, Lee JM, Yeam I, Heu S and Oh CS. 2015. Infection processes of xylem-colonizing pathogenic bacteria: possible explanations for the scarcity of qualitative disease resistance genes against them in crops. Theoretical and Applied Genetics 128(7): 219-1229. https://doi.org/10.1007/s00122-015-2521-1 [ Links ]
Balaji V, Mayrose M, Sherf O, Jacob-Hirsch J, Eichenlaub R, Iraki N, Manulis-Sasson S, Rechavi G, Barash I and Sessa G. 2008. Tomato transcriptional changes in response to Clavibacter michiganensis subsp. michiganensis reveal a role for ethylene in disease development. Plant Physiology 146:1797-1809. https://doi.org/10.1104/pp.107.115188 [ Links ]
Bialczyk J, Lechowski Z and Dziga D. 2004. Composition of the xylem sap of tomato seedlings cultivated on media with HCO 3− and nitrogen source as NO 3− or NH 4+. Plant and Soil 263(1): 265-272. https://doi.org/10.1023/b:plso.0000047739.11698.ca [ Links ]
Borboa-Flores J, Rueda Puente EO, Acedo Félix E, Ponce JF, Cruz M, Grimaldo JO and García Ortega, AM. 2009. Detección de Clavibacter michiganensis subespecie michiganensis en el tomate del estado de Sonora, México. Revista Fitotecnia Mexicana 32(4): 319-326. https://doi.org/10.35196/rfm.2009.4.319-326 [ Links ]
Chalupowicz L, Zellermann EM, Fluegel M, Dror O, Eichenlaub R, Gartemann KH, Savidor A, Sessa G, Iraki N, Barash I and Manulis-Sasson S. 2012. Colonization and movement of GFP-labeled Clavibacter michiganensis subsp. michiganensis during tomato infection. Phytopathology 102(1): 23-31. https://doi.org/10.1094/phyto-05-11-0135 [ Links ]
Chalupowicz L, Barash I, Reuven M, Dror O, Sharabani G, Gartemann KH, Eichenlaub R, Sessa G and Manulis-Sasson S. 2017. Differential contribution of Clavibacter michiganensis ssp. michiganensis virulence factors to systemic and local infection in tomato. Molecular Plant Pathology 18: 336-346. https://doi.org/10.1111/mpp.12400 [ Links ]
Coaker GL, Willard B, Kinter M, Stockinger EJ and Francis DM. 2004. Proteomic analysis of resistance mediated by Rcm 2.0 and Rcm 5.1, two loci controlling resistance to bacterial canker of tomato. Molecular Plant-Microbe Interactions 17(9): 1019-1028. https://doi.org/10.1094/mpmi.2004.17.9.1019 [ Links ]
Croce V, Pianzzola MJ, Durand K, González-Arcos M, Jacques MA and Siri MI. 2016. Multilocus sequence typing reveals high variability among Clavibacter michiganensis subsp. michiganensis strains affecting tomato crops in Uruguay. European Journal of Plant Pathology 144(1): 1-13. https://doi.org/10.1007/s10658-015-0738-0 [ Links ]
de León L, Siverio F, López MM and Rodríguez A. 2008. Comparative efficiency of chemical compounds for in vitro and in vivo activity against Clavibacter michiganensis subsp. michiganensis, the causal agent of tomato bacterial canker. Crop Protection 27(9): 1277-1283. https://doi.org/10.1016/j.cropro.2008.04.004 [ Links ]
de León L, Siverio F, López MM and Rodríguez A. 2011. Clavibacter michiganensis subsp. michiganensis a seedborne tomato pathogen: healthy seeds are still the goal. Plant Disease 95(11): 1328-1338. https://doi.org/10.1094/pdis-02-11-0091 [ Links ]
Dias VD, Carrer Filho R and Cunha MGD. 2019. Comparison of Leifsonia xyli subsp. xyli molecular detection in heat-treated sugarcane setts1. Pesquisa Agropecuária Tropical 49. https://doi.org/10.1590/1983-40632019v4955132 [ Links ]
Dreier J, Meletzus D and Eichenlaub R. 1997. Characterization of the plasmid encoded virulence region pat-1 of phytopathogenic Clavibacter michiganensis subsp. michiganensis. Molecular Plant-Microbe Interactions 10(2): 195-206. https://doi.org/10.1094/mpmi.1997.10.2.195 [ Links ]
EFSA PLH Panel (EFSA Panel on Plant Health). 2014. Scientific Opinion on the pest categorisation of Clavibacter michiganensis subsp. michiganensis (Smith) Davis et al. EFSA Journal. https://doi.org/10.2903/j.efsa.2014.3721 [ Links ]
Eichenlaub R and Gartemann KH. 2011. The Clavibacter michiganensis subspecies: molecular investigation of gram-positive bacterial plant pathogens. Annual review of phytopathology 49:445-464. https://doi.org/10.1146/annurev-phyto-072910-095258 [ Links ]
EPPO. 2016. PM 7/42 (3) Clavibacter michiganensis subsp. michiganensis. EPPO Bulletin 46: 202-225. https://doi.org/10.1111/epp.12302 [ Links ]
Félix-Gastélum R, Maldonado-Mendoza IE, Espinoza-Mancillas MG, Leyva-López NE, Martínez-Valenzuela C, Martínez-Álvarez JC and Herrera-Rodríguez G. 2012. Halo-spot and external stem necrosis of tomato caused by Pseudomonas syringae in Sinaloa, Mexico. Phytoparasitica 40(4): 403-412. https://doi.org/10.1007/s12600-012-0242-4 [ Links ]
Gartemann KH, Kirchner O, Engemann J, Grafen I, Eichenlaub R and Burger A. 2003. Clavibacter michiganensis subsp. michiganensis: first steps in the understanding of virulence of a Gram-positive phytopathogenic bacterium. Journal of Biotechnology 106(2-3): 179-191. https://doi.org/10.1016/j.jbiotec.2003.07.011 [ Links ]
Gartemann KH, Abt B, Bekel T, Burger A, Engemann J, Flügel M, Gaigalat L, Goesmann A, Gräfen I, Kalinowski J, Kaup O, Olaf Kaup, Kirchner O, Krause L, Linke B, Burkhard Linke, McHardy A, Meyer F, Pohle S, Rückert C, Schneiker S, Zellermann EM, Pühler A, Eichenlaub R, Kaiser O and Bartels D. 2008. The genome sequence of the tomato-pathogenic actinomycete Clavibacter michiganensis subsp. michiganensis NCPPB382 reveals a large island involved in pathogenicity. Journal of Bacteriology 190: 2138-2149. https://doi.org/10.1128/jb.01595-07 [ Links ]
Gleason ML, Gitaitis RD and Ricker MD.1993. Recent progress in understanding and controlling bacterial canker of tomato in eastern North America. Plant Disease 77: 1069-1076. https://doi.org/10.1094/pd-77-1069 [ Links ]
Huang R and Tu JC. 2001. Effects of nutrient solution pH on the survival and transmission of Clavibacter michiganensis subsp. michiganensis in hydroponically grown tomatoes. Plant Pathology 50(4): 503-508. https://doi.org/10.1046/j.1365-3059.2001.00586.x [ Links ]
INFOSTAT. 2003. InfoStat version 1.5. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina, 232 p. [ Links ]
Jung WJ, Mabood F, Souleimanov A, Whyte LG, Niederberger TD and Smith DL. 2014. Antibacterial activity of antagonistic bacterium Bacillus subtilis DJM-51 against phytopathogenic Clavibacter michiganense subsp. michiganense ATCC 7429 in vitro. Microbial Pathogenesis 77: 13-16. https://doi.org/10.1016/j.micpath.2014.10.008 [ Links ]
Kabas A, Boyaci HF, Horuz S, Aysan Y and Ilbi H. 2018. Investigation on identification of new resistant resources to bacterial canker and wilt disease. Feb-Fresenius Environmental Bulletin, 8498. [ Links ]
Klement Z, Mavridis A, Rudolph K, Vidaver A, Perombelon MCM, Moore LW and Rudolph K. 1990. Inoculation of plant tissue. In: Klement Z, Rudolph K, Sands DC. (Eds.), Methods in Phytobacteriology. Akademiai Kiado, Budapest, pp. 99-100. [ Links ]
Lelis FMV, Czajkowski R, de Souza RM, Ribeiro D H and van der Wolf J M. 2014. Studies on the colonization of axenically grown tomato plants by a GFP-tagged strain of Clavibacter michiganensis subsp. michiganensis. European Journal of Plant pathology 139(1): 53-66. https://doi.org/10.1007/s10658-013-0362-9 [ Links ]
Lu Y, Hatsugai N, Katagiri F, Ishimaru CA and Glazebrook J. 2015. Putative serine protease effectors of Clavibacter michiganensis induce a hypersensitive response in the apoplast of Nicotiana species. Molecular Plant-Microbe Interactions 28(11): 1216-1226. https://doi.org/10.1094/mpmi-02-15-0036-r [ Links ]
Lyu Q, Bai K, Kan Y, Jiang N, Thapa SP, Coaker G, Li J and Luo L. 2019. Variation in Streptomycin Resistance Mechanisms in Clavibacter michiganensis. Phytopathology 109(11): 1849-1858. https://doi.org/10.1094/phyto-05-19-0152-r [ Links ]
Martínez-Castro E, Jarquin-Gálvez R, Alpuche-Solís, Vallejo-Pérez MR, Colli-Mull JG and Lara-Ávila JP. 2018. Bacterial wilt and canker of tomato: fundamentals of a complex biological system. Euphytica 214: 72. https://doi.org/10.1007/s10681-018-2140-4 [ Links ]
McFarland J. 1907. The nephelometer: an instrument for estimating the number of bacteria in suspensions used for calculating the opsonic index and for vaccines. JAMA XLIX: 1176-1178. [ Links ]
McGhee GC and Sundin GW. 2011. Evaluation of kasugamycin for fire blight management, effect on nontarget bacteria, and assessment of kasugamycin resistance potential in Erwinia amylovora. Phytopathology 101(2): 192-204. https://doi.org/10.1094/phyto-04-10-0128 [ Links ]
Milijašević S, Todorović B, Potočnik I, Rekanović E and Stepanović M. 2009. Effects of copper-based compounds, antibiotics and a plant activator on population sizes and spread of Clavibacter michiganensis subsp. michiganensis in greenhouse tomato seedlings. Pesticidi i Fitomedicina 24(1): 19-27. https://doi.org/10.2298/pif0901019m [ Links ]
Mirzaee H, Peralta NLN, Carvalhais LC, Dennis PG and Schenk PM. 2021. Plant-produced bacteriocins inhibit plant pathogens and confer disease resistance in tomato. New Biotechnology 63: 54-61. https://doi.org/10.1016/j.nbt.2021.03.003 [ Links ]
Muhammad S, Naseerud D, Musharaf A, Ali A, Ishrat N, Alam SS and Najeeb U. 2020. Bioefficacy of some aqueous phytoextracts against Clavibacter michiganensis subsp. michiganensis (Smith), the cause of bacterial canker of tomato. Gesunde Pflanzen 72(3): 207-217. https://doi.org/10.1007/s10343-020-00503-9 [ Links ]
Nandi M, Macdonald J, Liu P, Weselowski B and Yuan ZC. 2018. Clavibacter michiganensis ssp. michiganensis: bacterial canker of tomato, molecular interactions and disease management. Molecular Plant Pathology 19(8): 2036-2050. https://doi.org/10.1111/mpp.12678 [ Links ]
SADER, 2020. El jitomate, hortaliza mexicana de importancia mundial. Secretaría de Agricultura y Desarrollo Rural. Fecha de publicación 10 de octubre de 2020. https://www.gob.mx/agricultura/articulos/el-jitomate-hortaliza-mexicana-de-importancia-mundial?idiom=es [ Links ]
Savidor A, Teper D, Gartemann KH, Eichenlaub R, Chalupowicz L, Manulis-Sasson S, barash I, Tews H, Mayer K, Giannone RJ, Hettich RL and Seesa G. 2012. The Clavibacter michiganensis subsp. michiganensis-tomato interactome reveals the perception of pathogen by the host and suggests mechanisms of infection. Journal of Proteome Research 11(2): 736-750. https://doi.org/10.1021/pr200646a [ Links ]
Schaad NW, Jones JB and Chun W. 2001. Laboratory Guide for Identification of Plant Pathogenic Bacteria. 3rd edn. St Paul, MN, USA: APS. [ Links ]
Sharabani G, Manulis-Sasson S, Borenstein M, Shulhani R, Lofthouse M, Chalupowicz L and Shtienberg D. 2013a. The significance of guttation in the secondary spread of Clavibacter michiganensis subsp. michiganensis in tomato greenhouses. Plant Pathology 62(3): 578-586. https://doi.org/10.1111/j.1365-3059.2012.02673.x [ Links ]
Sharabani G, Shtienberg D, Borenstein M, Shulhani R, Lofthouse M, Sofer ML, Chalupowicza Barela V and Manulis-Sassona S. 2013b. Effects of plant age on disease development and virulence of Clavibacter michiganensis subsp. michiganensis on tomato. Plant Pathology 62(5): 1114-1122. https://doi.org/10.1111/ppa.12013 [ Links ]
Steiner AA. 1984. The universal nutrient solution. In: Proceedings 6th International Congress on Soilless Culture. International Society for Soilless Culture (ed)., Lunteren, Netherlands. pp:633-649. [ Links ]
Stüwe B and von Tiedemann A. 2013. Bacterial canker of tomatoes-histological characterization of cultivar resistance and seed transmission. Journal of Plant Disease and Protection 120(5-6): 194-200. https://doi.org/10.1007/bf03356474 [ Links ]
Sundin GW, Castiblanco LF, Yuan X, Zeng Q and Yang CH. 2016. Bacterial disease management: challenges, experience, innovation and future prospects: challenges in bacterial molecular plant pathology. Molecular Plant Pathology 17(9): 1506-1518. https://doi.org/10.1111/mpp.12436 [ Links ]
Tancos MA, Chalupowicz L, Barash I, Manulis-Sasson S and Smart CD. 2013. Tomato fruit and seed colonization by Clavibacter michiganensis subsp. michiganensis through external and internal routes. Applied and Environmental Microbiology 79(22): 6948-6957. https://doi.org/10.1128/aem.02495-13 [ Links ]
Thapa SP, Pattathil S, Hahn MG, Jacques MA, Gilbertson RL and Coaker G. 2017. Genomic analysis of Clavibacter michiganensis reveals insight into virulence strategies and genetic diversity of a Gram-positive bacterial pathogen. Molecular Plant-Microbe Interaction 30: 786-802. https://doi.org/10.1094/mpmi-06-17-0146-r [ Links ]
Theodoro G and Maringoni AC. 2000. In vitro and in vivo action of chemicals on Clavibacter michiganensis subsp. michiganensis, causal agent of the bacterial canker of tomato. Scientia Agricola 57: 439-443. https://doi.org/10.1590/s0103-90162000000300011 [ Links ]
Thyr BD. 1968. Resistance to bacterial canker in tomato, and its evaluation. Phytopathology 58: 279-81. [ Links ]
Valenzuela M, Méndez V, Montenegro I, Besoain X and Seeger M. 2019. Streptomycin resistance in Clavibacter michiganensis subsp. michiganensis strains from Chile is related to an rpsL gene mutation. Plant Pathology 68(3): 426-433. https://doi.org/10.1111/ppa.12971 [ Links ]
van Steekelenburg NAM. 1985. Resistance to Corynebacterium michiganense in tomato genotypes. Euphytica 34(2): 245-250. https://doi.org/10.1007/bf00022916 [ Links ]
Wassermann E, Montecchia MS, Garaventa VS, Correa OS and Romero AM. 2020. Virulence and pCM1 plasmid carriage are related to BOX‐PCR fingerprint type in strains of Clavibacter michiganensis subsp. michiganensis that cause bacterial wilt and canker of tomato in Argentina. Plant Pathology 69(4): 723-732. https://doi.org/10.1111/ppa.13163 [ Links ]
Werner NA, Fulbright DW, Podolsky R, Bell J and Hausbeck MK. 2002. Limiting populations and spread of Clavibacter michiganensis subsp. michiganensis on seedling tomatoes in the greenhouse. Plant Disease 86: 535-542. https://doi.org/10.1094/pdis.2002.86.5.535 [ Links ]
Yadeta K and Thomma B. 2013. The xylem as battleground for plant hosts and vascular wilt pathogens. Frontiers in Plant Science 4: 97. https://doi.org/10.3389/fpls.2013.00097 [ Links ]
Yuqing W, Zhang Y, Zhipeng G and Wencai Y. 2018. Breeding for resistance to tomato bacterial diseases in China: challenges and prospects. Horticultural Plant Journal 4(5): 193-207. https://doi.org/10.1016/j.hpj.2018.08.004 [ Links ]
Recibido: 29 de Junio de 2021; Aprobado: 09 de Diciembre de 2021











 text in
text in 


