Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.40 n.1 Texcoco Jan. 2022 Epub Oct 03, 2022
https://doi.org/10.18781/r.mex.fit.2106-3
Artículos científicos
Fusarium sp., agente causal de la marchitez vascular en cítricos y su sensibilidad a fungicidas
1 Postgrado en Fitosanidad-Fitopatología, Colegio de Postgraduados, Km 36.5 Carretera México-Texcoco, Montecillo, Texcoco, México, CP 56230
2 Postgrado en Edafología, Colegio de Postgraduados, Km 36.5 Carretera México-Texcoco, Montecillo, Texcoco, México, CP 56230
3 Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria-SENASICA, Km 37.5 Carretera México-Pachuca, Tecámac, Estado de México, México, CP 55740
4 Parasitología Agrícola, Universidad Autónoma Chapingo, Km 38.5 Carretera México-Texcoco, Chapingo, Texcoco, México, CP 56230
5 Laboratorio Nacional de Investigación y Servicio Agroalimentario y Forestal, Universidad Autónoma Chapingo Km 38.5 Carretera México-Texcoco, Chapingo, Texcoco, México, CP 56230
La marchitez y muerte de los cítricos es una enfermedad de reciente aparición en la zona norte de Veracruz, que ocasiona pérdidas económicas a los productores de la región. Por lo anterior, el objetivo de este trabajo fue identificar al agente causal de esta enfermedad y evaluar diferentes fungicidas para determinar su sensibilidad in vitro. De manera consistente se aisló un hongo en plantas con síntomas de marchitez, se identificó morfológicamente en diferentes medios de cultivo y molecularmente con los iniciadores EF1-728F/EF1-986R mediante PCR. El hongo se inoculó en tres variedades de cítricos bajo condiciones de invernadero. La prueba de sensibilidad se realizó con los fungicidas clorotalonil, benomil tiabendazol, procloraz y un biológico (Bacillus subtilis) a diferentes concentraciones, más un testigo negativo. Se identificó morfológica y molecularmente a Fusarium sp. (No. de accesión MW438335) como agente causal de la marchitez vascular de los cítricos, mismo que ocasionó retraso de crecimiento, disminución de cantidad de raíces, marchitez del brote apical y necrosis en el sistema vascular en las tres variedades inoculadas. Los fungicidas con mayor eficacia en inhibir el crecimiento micelial fueron tiabendazol, procloraz y el biológico Bacillus subtilis.
Palabras clave: Identificación; morfología; postulados de Koch; control in vitro.
Citrus wilt is a disease of recent appearance in the northern area of Veracruz that causes economic losses to producers in the region. The present work aimed to identify the causative agent of this disease and evaluate different fungicides to determine its in vitro sensitivity. A fungus was consistently isolated in plants with wilt symptoms; it was morphologically identified in different culture media and molecularly identified by PCR using the EF1-728F/EF1-986R primers. The fungus was inoculated in three varieties of citrus under greenhouse conditions. The sensitivity test was carried out with the fungicides chlorothalonil, benomyl thiabendazole, prochloraz, and a biological agent (Bacillus subtilis) at different concentrations, plus a negative control. Fusarium sp. (Accession No. MW438335) was morphologically and molecularly identified as the causal agent of vascular wilt in citrus fruits, causing growth retardation, decreased number of roots, wilting of the apical bud, and necrosis in the vascular system of the three varieties inoculated. The most effective fungicides in inhibiting mycelial growth were thiabendazole, prochloraz, and the biological agent Bacillus subtilis.
Key words: Identification; morphology; Koch’s postulates; in vitro control
Los cítricos, en especial la naranja (Citrus sinensis), lima persa (C. latifolia), limón mexicano (C. aurantifolia), mandarina (C. reticulata) y pomelo (C. paradisi), son las frutas más cultivadas y consumidas en todo el mundo (Iqbal et al., 2018). Son considerados frutales universales ya que están presentes en más de 100 países y son el grupo de frutas más importantes económicamente, abarcando un 20% del mercado mundial de frutas (Franco et al., 2015). México es el cuarto productor de cítricos mundialmente (FAOSTAT, 2019); sus áreas citrícolas se encuentran en zonas tropicales y subtropicales, lo que propicia problemas fitosanitarios. Dentro de las enfermedades más importantes, están las causadas por bacterias, virus, viroides y hongos (Holguín et al., 2012).
En 2018, en Papantla, Veracruz, se observaron árboles de naranjo ‘Valencia’ (Citrus sinensis) con síntomas de clorosis, defoliación y marchitez de ramas (Figura 1). Esta enfermedad es un problema alarmante para los citricultores por las pérdidas económicas que ocasiona y se desconoce el agente causal.
Las principales enfermedades que inducen la caída de hojas y marchitez en cítricos, en especial aquellas causadas por oomicetes y ascomicetes, son ocasionadas por los siguientes géneros: Lasiodiplodia spp., Phytophthora spp. y Fusarium spp. (Hannachi et al., 2014; Savita y Nagpal, 2012; Valle-De la Paz et al., 2019). Los hongos del género Fusarium pertenecen al reino fungi, phylum ascomycota y orden hipocreales, comprenden una gran diversidad de especies de hongos que pueden ser saprófitas o patógenas de las plantas, animales y humanos (Moretti, 2009). Son filamentosos, cosmopolitas, tienen un micelio bien desarrollado, septado y conidióforos característicos (Villa-Martínez et al., 2014). El complejo de especies de Fusarium se encuentra en el top 10 de los principales patógenos fúngicos de plantas (Dean et al., 2012), esto se debe al impacto económico negativo que provoca en la agricultura mundial, ya que son agentes causales del marchitamiento vascular y pudrición basal en una gran variedad de plantas. La pudrición de raíz causada por Fusarium spp., es una enfermedad destructiva en el cultivo de cítricos (Yaseen y D’Onghia, 2012). Actualmente, se reportan más de 40 cepas filogenéticas de Fusarium afectando cítricos (Sandoval-Denis et al., 2018). En México, Parra-Cota et al. (2018) realizaron el primer reporte de marchitamiento en naranja ‘Valencia’ ocasionado por siete aislados del complejo de especies de Fusarium solani en el Valle del Yaqui, Sonora. Este hongo puede asociarse con otros microorganismos y actuar de forma sinérgica (Lamichhane y Venturi, 2015), por lo tanto, la determinación de patogenicidad es fundamental en la identificación de los microorganismos asociados a plantas enfermas. Cuando la asociación constante de un organismo con una enfermedad se hace evidente, es importante cumplir con los postulados de Koch para confirmar su patogenicidad.

Figura 1 Árbol de naranjo ‘Valencia’ (Citrus sinensis) con marchitez y defoliación severa en Papantla, Veracruz.
El control químico es la principal estrategia para el manejo de enfermedades fúngicas (Villa-Martínez et al., 2014). La desinfestación de sustratos con peróxido de hidrógeno, hipoclorito de sodio, sales cuaternarias de amonio y formaldehído, son la primera barrera preventiva para eliminar fuentes de inóculo de Fusarium (Vásquez-Ramírez y Castaño-Zapata, 2017). La aplicación de fungicidas a base de benzimidazoles como benomil, carbendazim, tiabendazol y tiofanato en las plantas ayuda a reducir las pudriciones causadas por Fusarium avenaceum, Fusarium culmorum, Fusarium equiseti y Fusarium solani (Voigt, 2002). Asimismo, se ha reportado que los fungicidas a base de organomercurio y formalina son inhibidores de Fusarium spp. (Cook, 1981). La utilización de fumigante bromuro de metilo era la práctica más común para el manejo de la enfermedad, hasta que se retiró del mercado en 2005; actualmente, la aplicación de fumigantes, como 1,3-dicloropropeno, cloropicrina, N-metil ditiocarbamato de sodio y metil isotiocianato, son mayormente empleados en presiembra (McGovern, 2015; Vásquez-Ramírez y Castaño-Zapata, 2017). Debido a lo anterior, el objetivo de la presente investigación se orientó a identificar morfológica y molecularmente al agente causal de la marchitez de los cítricos en el municipio de Papantla, Veracruz; realizar los postulados de Koch en tres variedades bajo condiciones de invernadero y evaluar la sensibilidad in vitro del patógeno a diferentes fungicidas.
Materiales y métodos
El experimento se realizó en el laboratorio de Parasitología Agrícola, Universidad Autónoma Chapingo, México.
Aislamiento y purificación. Se colectaron raíces y tallos de ocho árboles enfermos de naranja ‘Valencia’ en cuatro fincas ubicadas en el ejido San Pablo, municipio de Papantla, Veracruz, México; en las coordenadas 20° 27’ latitud N y 97° 11’ longitud W, a 45 msnm. En laboratorio, se cortaron trozos de 1 cm de longitud y se desinfestaron en una solución de hipoclorito de sodio al 1% durante un minuto, se enjuagaron dos veces con agua estéril y se secaron con toallas de papel estériles. En condiciones asépticas, se colocaron seis trozos de tejido por muestra en cada caja Petri con medio de cultivo Papa Dextrosa Agar (PDA) (200 g papa, 15 g dextrosa, 20 g agar en 1000 mL de agua destilada) y se incubaron a temperatura ambiente por 24 h, bajo un régimen de 12 h luz / 12 h de oscuridad. Para la obtención de aislados puros, se transfirió un fragmento de micelio en el medio de cultivo Agua agar, y después de 24 h se tomaron pequeños trozos de medio que contenían puntas de hifas y se transfirieron en cajas Petri individuales con medio PDA.
Caracterización morfológica. Para identificar la especie de estudio, se usaron tres medios de cultivo estándares establecidos por Leslie y Summerell (2006), Carnation Leaf-piece Agar (CLA), Spezieller Nährstoffarmer Agar (SNA) y PDA. Se hicieron preparaciones semipermanentes con glicerina al 50% de ocho aislados del hongo y cinco repeticiones por aislado. Las estructuras se examinaron en un microscopio compuesto (Nikon SMZ800®, EE. UU.) con cámara digital integrada, usando el objetivo de 40x para tomar fotografías, las cuales se analizaron con el programa Motic Imagen v. 3.0 (Motic Group, 2018) para realizar la caracterización cualitativa (forma) y cuantitativa (largo por ancho) de 50 macroconidos, 50 microconidos y 20 clamidosporas por preparación. Los ocho aislados fúngicos presentaron las mismas características morfológicas, en consecuencia, se decidió trabajar con un solo aislado para posteriores estudios.
Prueba de patogenicidad. Para determinar el potencial infectivo del aislado fúngico en cítricos, se inocularon en tres variedades de 14 meses de edad: naranja ‘Valencia’ portainjerto ‘Volkameriano’ (T4), mandarina ‘Delicias’ portainjerto ‘Agrio’ (T5) y naranja ‘Valencia’ portainjerto ‘Agrio’ (T6), con sus respectivos controles negativos T1, T2, T3, con tres repeticiones cada uno, en un diseño experimental completamente al azar. Una vez montado el ensayo en invernadero, se procedió a realizar la inoculación por inmersión de raíces (Güler y Güldür, 2018; Herman y Perl-Treves, 2007): se extrajeron todas las plantas del sustrato tratando de hacer el menor daño posible; con agua común se lavaron las raíces, se indujeron heridas leves en las raíces con la ayuda de tijeras para crear la vía de ingreso del aislado de Fusarium, posteriormente las raíces de las plantas se colocaron por 24 h en una suspensión de conidios (1 x 106 esporas mL-1). Los controles negativos se sometieron al mismo método, pero sus raíces se sumergieron en agua estéril. Las plantas se colocaron individualmente en macetas con Peat Moss estéril (PRO-MIX FLEX), se mantuvieron en invernadero con una temperatura diurna y nocturna de 39 ± 2 °C y 15 ± 2 °C, respectivamente y humedad relativa del 40 - 83%. El crecimiento de los brotes vegetativos y la altura de la planta se registraron los días 1, 15, 60 y 110 días después de la inoculación. A los 110 días, se realizó la, purificación y descripción del microorganismo, para comprobar si éste correspondía al aislado de Fusarium sp. previamente inoculado y confirmar su patogenicidad. El aislamiento del hongo en el tejido vegetal se realizó por siembra directa en medio de cultivo PDA, según la metodología propuesta por Leslie y Summerell (2006), para cumplir con los postulados de Koch.
Prueba de sensibilidad a fungicidas in vitro. Se evaluaron cinco fungicidas a diferentes concentraciones: Clorotalonil (1, 5, 10, 100 y 300 mg L-1), Benomil (1, 5, 10 y 100 mg L-1), Tiabendazol (0.1, 1, 5, 10 mg L-1), Bacillus subtilis (0.005, 0.05, 0.1 y 1 mg L-1) y Procloraz (1, 5 y 10 mg L-1), más un testigo negativo que consistió en medio PDA sin fungicida. Cada tratamiento consistió en tres repeticiones y se utilizó un diseño experimental completamente al azar. Para evaluar la eficacia de los fungicidas, se sembraron discos de 5 mm de diámetro de micelio con cinco días de edad en el centro de las cajas Petri con medio de cultivo PDA mezclado con la solución acuosa del fungicida correspondiente. Todas las cajas sembradas se etiquetaron, sellaron e incubaron a temperatura ambiente (26 ± 1 °C) en oscuridad continua, el diámetro del crecimiento micelial se midió cada 48 h, hasta que el testigo negativo cubrió totalmente la caja Petri. El porcentaje de inhibición del crecimiento radial del micelio se calculó con la fórmula de Abbot: (Testigo-Tratamiento)/Testigo x 100 (Miranda-Granados et al., 2018).
Extracción de ADN, PCR y secuenciación. La extracción de ADN se realizó con el kit Plant DNeasy Mini Kit (Qiagen), de acuerdo con las instrucciones del fabricante. Para la PCR se utilizaron los iniciadores EF1-728F/EF1-986R, que amplifican un fragmento de 320 pares de bases (pb) (Carbone y Kohn, 1999) y la mezcla de reacción se preparó en un volumen final de 50 µL, buffer de PCR IX, 2.5 mM MgCl2, 0.2 mM dNTP, 0.8 µM de cada oligo, 0.04 U DNA polimerasa (Promega, EE.UU.) y 4 ng de ADN. La PCR se llevó a cabo en un termociclador C-1000 (Bio-Rad, EE.UU.), se realizó una desnaturalización inicial a 95 °C por 3 min, 35 ciclos de 95 °C por 30 s, 54 °C por 30 s, 72 °C por 1 min; y una extensión final de 72 °C por 10 min. Los productos amplificados se verificaron por electroforesis en gel de agarosa al 1%. El gel se analizó con luz ultravioleta con un transiluminador M-26X usando un sistema de imágenes GelDoc-ItTM 300 (UVP, EE.UU.). Los fragmentos amplificados se purificaron mediante el protocolo de DNA clean & concentratorTM-5 (Zymo Research, EE. UU.). Dichos fragmentos de ADN purificados se mandaron a secuenciar a la empresa Macrogen®.
Árbol filogenético. Para confirmar la identidad del patógeno, se realizó el ensamble de las secuencias sentido y antisentido con el software MEGA X 10.0.5 (Kumar et al., 2018). La secuencia consenso obtenida se comparó con aquellas registradas en el Basic Local Alignment Search Tools (BLAST) del National Center for Biotechnology Information (NCBI). Para realizar el árbol filogenético e identificar el clado donde se agrupa la secuencia consenso (Fusarium sp. aislado Veracruz), se descargaron del GenBank las secuencias del factor de elongación de traducción 1 alfa (TEF-1ɑ) del complejo de especies de Fusarium solani, F. oxysporum y F. citricola que afectan al cultivo de cítricos (Liu et al., 2020; Sandoval-Denis et al., 2018; Yaseen y D’Onghia, 2012), así como las secuencias que tuvieron mayor similitud con la especie en estudio (Cuadro 1). Se utilizó como grupo externo a la especie Colletotrichum truncatum (KM818513). El alineamiento múltiple de secuencias se realizó con MUSCLE. El árbol filogenético se obtuvo mediante el método de Maximum Likelihood (ML) con 1500 repeticiones de bootstrap, basado en el modelo de Kimura de dos parámetros y distribución gamma. El modelo utilizado se obtuvo mediante una prueba de modelos con el software MEGA X.
Cuadro 1 Secuencias de aislados de Fusarium obtenidas de GenBank y utilizadas en el árbol filogenético (Sandoval-Denis et al., 2018).
| Species | Strain | Host | GenBank Access Number |
|---|---|---|---|
| TEF-1ɑ | |||
| F. solani | CPC 28189 | Citrus sinensis | LT746226 |
| F. solani | CPC 27193 | C. sinensis | LT746222 |
| F. solani | CPC 27198 | C. sinensis | LT746223 |
| F. solani | CPC 27192 | C. sinensis | LT746221 |
| F. macrosporum | C. sinensis | LT746218 | |
| F. croci | C. sinensis | LT746216 | |
| F. oxysporum | CPC 28190 | C. sinensis | LT746206 |
| F. oxysporum | CPC 27700 | C. sinensis | LT746203 |
| F. oxysporum | CPC 27196 | C. sinensis | LT746202 |
| F. oxysporum | CPC 27194 | C. sinensis | LT746201 |
| F. citricola | CPC 27813 | C. reticulata | LT746198 |
| F. citricola | CPC 27709 | C. sinensis | LT746196 |
| F. citricola | CPC 27069 | C. sinensis | LT746195 |
| F. citricola | CPC 27067 | C. limon | LT746194 |
| F. polyphialidicum | Vanilla planifolia | GQ425229 | |
| F. concolor | KY794889 |
Diseño experimental y análisis estadístico. A partir de los datos obtenidos, se realizó un análisis de varianza para las variables de altura de la planta y porcentaje de inhibición en el crecimiento micelial con el diseño experimental completamente al azar, así como una comparación múltiple de medias Tukey (P≤0.05) para variables cuyo efecto fue significativo, en el cual se usó el paquete estadístico SAS 9.0 (SAS Institute, 2002).
Resultados y discusión
Identificación morfológica. Se aislaron ocho aislados, los cuales presentaron un borde circular, micelio de color blanco y anaranjado, con un diámetro de 2.6 cm de tres días de crecimiento en medio PDA. En medio CLA se observaron macroconidios con dos a tres septos, con el lado dorsal más curvo que el ventral y midieron de 16-30 x 3-6 μm. Los microconidios presentaron entre cero y un septo, de forma oval, de 9-17 x 3-5 μm. En medio CLA, las clamidosporas midieron 6-10 x 6-10 μm y se formaron esporodoquios de color amarillo pálido (Figura 2). De acuerdo con las características culturales y morfológicas aquí observadas, los ocho aislados corresponden al género Fusarium (Leslie y Summerell, 2006). Asimismo, los aislados fúngicos presentaron las mismas características morfológicas, en consecuencia, se decidió trabajar con un solo aislado para posteriores estudios.
Prueba de patogenicidad. Diez días después de la inoculación, todas las plantas que estuvieron en contacto con la suspensión de esporas exhibieron síntomas de marchitez en los brotes vegetativos. Sandoval-Denis et al. (2018) reportaron que Fusarium sarcochroum causa muerte regresiva en ramas de limón y mandarina, en Italia y España. Por otra parte, las plantas inoculadas presentaron escaso crecimiento en el sistema radical y en el haz vascular se observó una coloración marrón o café rojizo oscuro. Lo cual concuerda parcialmente con lo reportado por Hannachi et al. (2015) quienes observaron una reducción de crecimiento y número limitado de raíces en plantas de cítricos inoculados con Fusarium oxysporum f. sp. citri, tres semanas después de la inoculación. A partir de tejido de raíz con necrosis vascular, se logró aislar el hongo y cumplir con los postulados de Koch (Figura 3).
Los tratamientos no inoculados de naranja ‘Valencia’ portainjerto ‘Volkameriano’ (T1), mandarina ‘Delicias’ portainjerto ‘Agrio’ (T2) y naranja ‘Valencia’ portainjerto ‘Agrio’ (T3), tuvieron una altura de 103 a 112 cm a los 110 días después de la inoculación, mientras que los tratamientos inoculados (T4, T5 y T6) presentaron una altura entre 85 y 93 cm, esto significó una reducción del 16.9 al 17.4% de la altura respecto a los tratamientos no inoculados (Figura 4). De acuerdo con los resultados, se concluyó que el patógeno tiene la capacidad de afectar el crecimiento de los cítricos. Lo cual concuerda con lo reportado por Baysal-Gurel y Cinar (2015) para árboles de pomelo infectados con F. oxysporum, los cuales mostraron un reducido vigor y clorosis en el follaje.
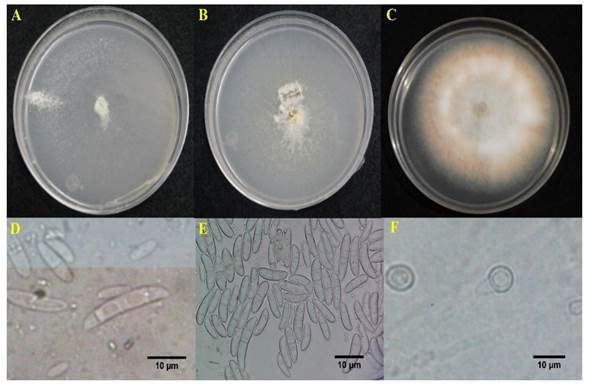
Figura 2 Fusarium sp. aislado de naranjo ‘Valencia’ (Citrus sinensis). A) Crecimiento de Fusarium sp., en medio SNA, B) en medio CLA, C) en PDA, D) macroconidios, E) microconidios y F) clamidosporas.
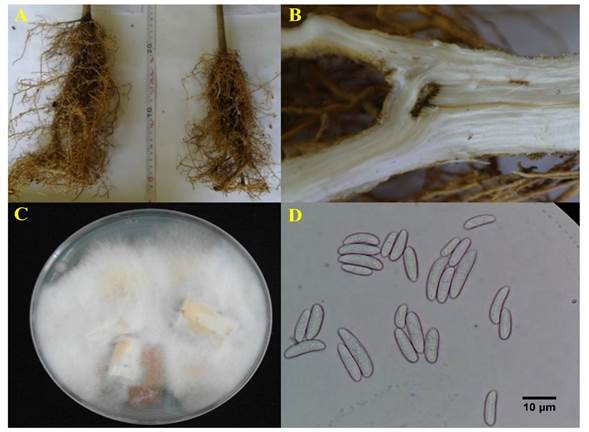
Figura 3 A) Sistema radical de plantas de naranja ‘Valencia’ portainjerto ‘Volkameriano’ no inoculado (izquierda) vs naranja ‘Valencia’ portainjerto ‘Volkameriano’ inoculado con Fusarium sp. (derecha), B) necrosis en el sistema vascular en la planta inoculada, C) recuperación del aislado inoculado en cítricos y D) microconidios del aislado recuperado.
Prueba de sensibilidad a fungicidas. El análisis de varianza mostró diferencias significativas en los tratamientos. Los tratamientos que inhibieron el crecimiento micelial fueron, tiabendazol, B. subtilis y procloraz (Cuadro 2). Tiabendazol inhibió 100% del crecimiento micelial a partir de 5 mg L-1. Lo cual es similar a lo reportado por Yossen y Conles (2014) quienes detectaron con tiabendazol un 99.8% de eficacia en el control de F. oxysporum a 4 mg L-1 en condiciones in vitro. B. subtilis presentó 100% de inhibición a partir de 1 mg L-1 y Romero-Velázquez et al. (2015) encontraron que B. subtilis inhibió 100% a F. oxysporum a partir de 0.01 mg L-1. La diferencia encontrada en la sensibilidad a B. subtilis en este estudio y la reportada por Romero-Velázquez et al. (2015), puede deberse a las cepas de B. subtilis utilizadas en los estudios, los hongos pertenecen a diferentes especies de Fusarium o el aislado de esta investigación puede presentar resistencia a B. subtilis (Bardin et al., 2015), aunque es preciso realizar más estudios para corroborar dichos supuestos.
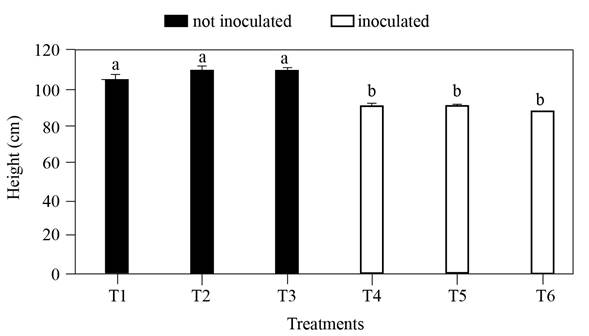
Figura 4 Altura de las plantas de cítricos inoculados con Fusarium sp., a los 110 días después de la inoculación. T1, T4: naranja ‘Valencia’ portainjerto ‘Volkameriano’; T2, T5: mandarina ‘Delicias’ portainjerto ‘Agrio’; T3, T6: naranja ‘Valencia’ portainjerto ‘Agrio’. Medias con letras distintas son estadísticamente diferentes (Tukey, P≤ 0.05).
Cuadro 2 Porcentaje de inhibición en el crecimiento micelial de Fusarium sp. tratado con fungicidas y B. subtilis.
| Concentration (mg L-1) | Control | Chlorothalonil | Benomyl | Thiabendazole | B. subtilis | Prochloraz |
|---|---|---|---|---|---|---|
| 0.0 hx | ||||||
| 0.005 | 81.0 bc | |||||
| 0.05 | 82.3 bc | |||||
| 0.1 | 0.0 h | 80.6 bc | ||||
| 1 | 24.3 g | 10.0 h | 33.3 gf | 100.0 a | 75.3 dc | |
| 5 | 36.6 gf | 73.0 dce | 100.0 a | 84.6 bc | ||
| 10 | 40.6 f | 74.0 dce | 100.0 a | 92. 3 ba | ||
| 100 | 61.3 e | 85.3 bc | ||||
| 300 | 62.0 de | |||||
| DMSHy | 13.6 | |||||
| CVz (%) | 6.7 | |||||
| Media | 64.8 |
Estudios similares han encontrado que los aislados de B. subtilis producen sustancias como el amoníaco y ácido indol acético (IAA) que inhiben el crecimiento micelial de F. oxysporum (Mohammed et al., 2019; Sharifi y Ramezani, 2003). Procloraz inhibió 92% del crecimiento micelial a partir de 10 mg L-1. Estos resultados concuerdan con lo reportado por Song et al. (2004), donde encontraron que los fungicidas más efectivos para inhibir el crecimiento micelial de F. oxysporum fueron procloraz y carbendazim. Resultados similares mostraron que procloraz inhibió 100% a F. oxysporum en condiciones in vitro a una concentración de 100 - 1000 mg L-1 (Romero-Velázquez et al., 2015). Mientras que, en condiciones de campo, Amini y Sidovich (2010) demostraron que la aplicación de 10 mg L-1 de bromuconazole y procloraz, redujeron completamente la severidad ocasionada por F. oxysporum f. sp. lycopersici, agente causal de la marchitez vascular en jitomate.
Identificación molecular y árbol filogenético. Búsquedas en BLASTN usando secuencias parciales TEF1 del aislado patogénico, generó 98.7% de similitud con F. polyphialidicum (No. de accesión GQ425229). El árbol filogenético arrojó cuatro linajes altamente contrastantes, de los cuales, tres correspondieron al complejo especies de F. oxyporum, F. citricola y F. solani, actualmente conocidos como agentes patógenos de cítricos (Liu et al., 2020; Sandoval-Denis et al., 2018; Yaseen y D’Onghia, 2012). Mientras que el cuarto linaje agrupó a Fusarium sp. aislado Veracruz, F. polyphialidicum y Fusarium cf. concolor (Figura 5).
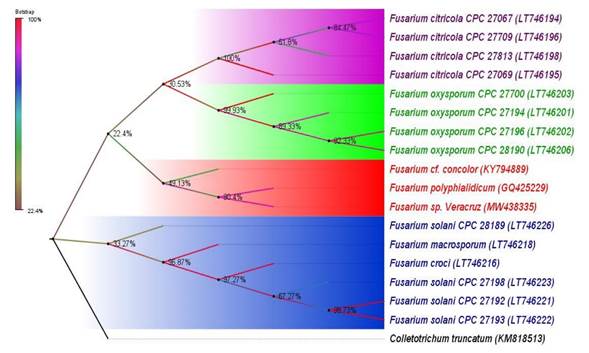
Figura 5 Árbol filogenético basado en la comparación de las secuencias del TEF-1ɑ de especies de Fusarium . Maximum Likelihood (ML) con 1500 repeticiones de bootstrap, basado en el modelo de Kimura de 2 parámetros y distribución gamma. El aislado de estudio es Fusarium sp. aislado Veracruz. Entre paréntesis se indican los números de acceso de las secuencias registradas en la base de datos del NCBI.
Conclusiones
De acuerdo con la caracterización morfológica, la identificación molecular y las pruebas de patogenicidad, se confirma a Fusarium sp., posiblemente F. polyphialidicum como agente causal de la marchitez vascular de los cítricos en Papantla, Veracruz. Los síntomas que presentaron los árboles de cítricos infectados fue marchitez de brote apical, retraso de crecimiento, disminución de cantidad de raíces y necrosis del sistema vascular. Las tres variedades de cítricos fueron afectadas por el patógeno. Los fungicidas con mayor eficacia para inhibir el crecimiento micelial fueron tiabendazol (100%), B. subtilis (100%) y procloraz (92%) bajo condiciones in vitro.
Literature cited
Amini J and Sidovich DF. 2010. The effects of fungicides on Fusarium oxysporum f. sp. lycopersici associated with Fusarium wilt of tomato. Journal of Plant Protection Research 50:172-178. http://www.plantprotection.pl/The-effects-of-fungicides-on-Fusarium-oxysporum-f-sp-lycopersici-associated-with,91523,0,2.html [ Links ]
Bardin M, Ajouz S, Comby M, Lopez-Ferber M, Graillot B, Siegwart M and Nicot PC. 2015. Is the efficacy of biological control against plant diseases likely to be more durable than thatof chemical pesticides? Frontiers in Plant Science 6: 566. https://doi.org/10.3389/fpls.2015.00566 [ Links ]
Baysal-Gurel F and Cinar A. 2015. First report of Fusarium root rot caused by Fusarium oxysporum infecting pigmented grapefruit trees in Turkey. Plant Disease 99: 553. https://doi.org/10.1094/PDIS-07-14-0746-PDN [ Links ]
Carbone I and Kohn LM. 1999. A method for designing primer sets for speciation studies in filamentous ascomycetes. Mycologia 91(3):553-556. https://doi.org/10.1080/00275514.1999.12061051 [ Links ]
Cook RJ. 1981. Fusarium diseases in the People’s Republic of China. Pp:53-55. In: Fusarium: Diseases, Biology, and Taxonomy (eds PE Nelson TA Toussoun y RJ Cook). University Park, Pennsylvania: The Pennsylvania State University Press. [ Links ]
Dean R, Van Kan JAL, Pretorius ZA, Hammond-Kosack KE, Di Pietro A, Spanu PD, Rudd JJ, Dickman M, Kahmann R, Ellis J and Foster GD. 2012. The Top 10 fungal pathogens in molecular plant pathology. Molecular Plant Pathology 13: 414-430. https://doi.org/10.1111/j.1364-3703.2011.00783.x [ Links ]
FAOSTAT. 2019. Food and agriculture data. Food and Agriculture Organization of the United Nations. http://www.fao.org/faostat/es/#data/QC (consulta, diciembre 2020). [ Links ]
Franco VA, Castillo LS, García OJ y Rodríguez NE. 2015. Situación de la citricultura en el Estado de Nuevo León. Corporación para el Desarrollo Agropecuario de Nuevo León. Monterrey, N.L. México. https://docplayer.es/28330442-Situacion-de-la-citricultura-en-nuevo-leon-cdanl-%20corporacion-para-el-desarrollo-agropecuario-gobierno-del-estado-de-nuevo-leon.html (consulta, noviembre 2020). [ Links ]
Güney IG and Güldür ME. 2018. Inoculation techniques for assessing pathogenicity of Rhizoctonia solani, Macrophomina phaseolina, Fusarium oxysporum and Fusarium solani on pepper seedlings. Türkiye Tarımsal Araştırmalar Dergisi 5(1): 1-8. https://dergipark.org.tr/tr/download/article-file/402109 [ Links ]
Hannachi I, Poli A, Rezgui S, Prassad RD and Cherif M. 2015. Genetic and phenotypic differences of Fusarium oxysporum f. sp. citri isolated from sweet orange and tangerine. European Journal of Plant Pathology 142: 269-280. https://doi.org/10.1007/s10658-015-0611-1 [ Links ]
Hannachi I, Rezgui S and Cherif M. 2014. First report of mature citrus trees being affected by Fusarium wilt in Tunisia. Plant Disease 98: 566. https://doi.org/10.1094/PDIS-12-12-1134-PDN [ Links ]
Herman R and Perl-Treves R. 2007. Characterization and inheritance of a new source of resistance to Fusarium oxysporum f. sp. melonis Race 1.2 in Cucumis melo. Plant Disease 91:1180-1186. https://doi.org/10.1094/PDIS-91-9-1180 [ Links ]
Holguín PRJ, Hernandez MLG y Zulueta RR. 2012. El huanglongbing: la tristeza de los cítricos. La ciencia y el hombre 25:3. https://www.uv.mx/cienciahombre/revistae/vol25num3/articulos/huanglongbing/ [ Links ]
Iqbal Z, Khan MA, Sharif M, Shah JH, ur Rehman MH and Javed K. 2018. An automated detection and classification of citrus plant diseases using image processing techniques: a review. Computers and Electronics in Agriculture 153: 12-32. https://doi.org/10.1016/j.compag.2018.07.032 [ Links ]
Kumar S, Stecher G, Li M, Knyaz C and Tamura K. 2018. MEGA X: Molecular evolutionary genetics analysis across computing platforms. Molecular Biology and Evolution 35: 1547-1549. https://doi.org/10.1093/molbev/msy096 [ Links ]
Lamichhane JR and Venturi V. 2015. Synergisms between microbial pathogens in plant disease complexes: a growing trend. Frontiers in Plant Science. 6:385. https://doi.org/10.3389/fpls.2015.00385 [ Links ]
Leslie JF and Summerell B. 2006. The Fusarium Laboratory Manual. Blackwell Publishing. Manhattan, USA. 388p. https://doi.org/10.1002/9780470278376 [ Links ]
Liu HF, Zhou J, Liao J, Yi JP, Ma DF and Deng JX. 2020. Grafted twig rot on Citrus sinensis caused by a member of the Fusarium solani species complex. Canadian Journal of Plant Pathology 42: 133-139. https://doi.org/10.1080/07060661.2019.1633412 [ Links ]
McGovern RJ. 2015. Management of tomato diseases caused by Fusarium oxysporum. Crop Protection 73:78-92. https://doi.org/10.1016/j.cropro.2015.02.021 [ Links ]
Miranda-Granados J, Chacón C, Ruiz-Lau N, Vargas-Díaz ME, Zepeda LG, Álvarez-Gutiérrez P, Meza-Gordillo R and Lagunas-Rivera S. 2018. Alternative use of extracts of chipilín leaves (Crotalaria longirostrata Hook. & Arn) as antimicrobial. Sustainability 10: 883. https://doi.org/10.3390/su10030883 [ Links ]
Mohammed BL, Hussein RA and Toama FN. 2019. Biological control of Fusarium wilt in tomato by endophytic rhizobactria. Energy Procedia 157:171-179. https://doi.org/10.1016/j.egypro.2018.11.178 [ Links ]
Moretti A. 2009. Taxonomy of Fusarium genus: A continuous fight between lumpers and splitters. Matica Serbian Journal for Natural Sciences 117:7-13. https://doi.org/10.2298/zmspn0917007m [ Links ]
Motic Group. 2018. Motic images plus for windows 64 bit. Release 3.0. Motic Group. Hong Kong, China. https://moticeurope.com/en/news-and-events/post/motic-images-plus-3-0-user-manual.html [ Links ]
Parra-Cota FI, García-Pereyra J, Aviña-Martínez GN, y Santos-Villalobos S. 2018. Primer reporte de marchitamiento por Fusarium en Citrus sinensis var. valencia en el Valle del Yaqui, México. Revista Mexicana de Fitopatología 37(1): 193-201. https://doi.org/10.18781/R.MEX.FIT.1810-3 [ Links ]
Romero-Velázquez SD, Tlalpan-Bolaños B, Cadena-Iñiguez J, Nieto-Ángel D, y Arévalo-Galarza ML. 2015. Hongos causantes de enfermedades postcosecha en chayote (Sechium edule (Jacq.) SW.) y su control in vitro. Agronomía Costarricense 39:19-32. https://www.redalyc.org/jatsRepo/436/43642603002/43642603002.pdf [ Links ]
Sandoval-Denis M, Guarnaccia V, Polizzi G and Crous PW. 2018. Symptomatic Citrus trees reveal a new pathogenic lineage in Fusarium and two new Neocosmospora species. Persoonia 40:125. https://doi.org/10.3767/persoonia.2018.40.01 [ Links ]
SAS Institute. 2002. The SAS system for windows. Release 9.0. SAS Institute. North Carolina, USA. [ Links ]
Savita GVS and Nagpal A. 2012. Citrus diseases caused by Phytophthora species. GERF Bulletin of Biosciences 3:18-27. https://www.academia.edu/5763877/Citrus_diseases_caused_by_Phytophthora_species [ Links ]
Sharifi TA and Ramezani M. 2003. Biological control of Fusarium oxysporum, the causal agent of onion wilt by antagonistic bacteria. Communications in Agricultural and Applied Biological Sciences 68:543-547. https://pubmed.ncbi.nlm.nih.gov/15151288/ [ Links ]
Song W, Zhou L, Yang C, Cao X, Zhang L and Liu X. 2004. Tomato Fusarium wilt and its chemical control strategies in a hydroponic system. Crop Protection 23:243-247. https://doi.org/10.1016/j.cropro.2003.08.007 [ Links ]
Valle-De la Paz M, Guillén-Sánchez D, Gijón-Hernández AR, Alía-Tejacal I, López- Martínez V, Juárez-López P, Martínez-Fernández V, Hernández-Arenas M y Ariza-Flores F. 2019. Especies de Lasiodiplodia en lima ‘Persa’ (Citrus latifolia Tanaka) en Morelos, México. Revista Bio Ciencias 6: e595. https://doi.org/10.15741/revbio.06.e595 [ Links ]
Vásquez-Ramírez LM and Castaño-Zapata J. 2017. Manejo integrado de la marchitez vascular del tomate [Fusarium oxysporum f. sp. lycopersici (Sacc.) W.C. Snyder & H.N. Hansen]: una revisión. Revista U.D.C.A Actualidad y Divulgación Científica 20:363-374. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0123-42262017000200014 [ Links ]
Villa-Martínez A, Pérez-Leal R, Morales-Morales HA, Basurto-Sotelo M, Soto-Parra JM y Martínez-Escudero E. 2014. Situación actual en el control de Fusarium spp. y evaluación de la actividad antifúngica de extractos vegetales. Acta Agronómica 64:194-205. https://doi.org/10.15446/acag.v64n2.43358 [ Links ]
Voigt K. 2002. Management of Fusarium Diseases. Pp:217-242. In: Kempken F (eds.). Agricultural Applications. Vol. 11. Springer. Berlin, Germany. https://doi.org/10.1007/978-3-662-03059-2. 388p [ Links ]
Yaseen T and D’Onghia AM. 2012. Fusarium spp. associated to citrus dry root rot: an emerging issue for mediterranean citriculture. Acta Horticulturae 940:647-655. https://doi.org/10.17660/ActaHortic.2012.940.89 [ Links ]
Yossen VE y Conles MY. 2014. Eficacia de fungicidas in vitro para el control de Fusarium oxysporum y F. proliferatum, agentes causales de marchitamiento en el cultivo de orégano en la Argentina. Revista Industrial y Agrícola de Tucumán 91:19-25. https://nanopdf.com/download/eficacia-de-fungicidas-in-vitro-para-el-control-de-fusarium_pdf. [ Links ]
Recibido: 28 de Junio de 2021; Aprobado: 03 de Diciembre de 2021











 text in
text in 


