El ajo (Allium sativum) es una hortaliza de gran importancia en el mundo, utilizada principalmente como condimento, pero en medicina por su contenido de adenosina y ajoeno se usa como antioxidante, así como para reducir el bloqueo de las arterias, la presión arterial y el colesterol (Ramírez et al., 2016), y en el control de plagas se usa como insecticida por su acción repelente (Plata et al., 2017). A pesar de esto, en Colombia en la última década su cultivo ha disminuido pasando en 2013 de 527 ha a 231 ha en 2018 con una reducción en la producción de 9.309 t a 2.991 t (AGRONET, 2019), comportamiento que se asocia a la diseminación e incremento de problemas fitosanitarios, siendo la mayor limitante la pudrición blanca causada por el hongo Sclerotium cepivorum (Prato, 2016).
Este patógeno exclusivamente afecta a las especies del género Allium, distribuyéndose en todas las regiones donde éstas se cultivan, disminuyendo su producción, ya que puede causar pérdidas superiores al 50%, siendo así la mayor limitante de este género (Amin et al., 2014; Lourenço et al., 2018). Sclerotium cepivorum produce esclerocios, estructuras de resistencia que pueden permanecer viables en el suelo por más de 20 años, así como su inóculo primario, de esta manera los campos infestados quedan arruinados para el cultivo de ajo o cualquier otra aliácea susceptible (Velásquez et al., 2012; Amin et al., 2014; Lourenço et al., 2018). El manejo de la pudrición blanca se realiza principalmente con fungicidas de síntesis química como Benomil y Tebuconazol, cuyo uso continuo puede generar problemas de resistencia, reducción de la microbiota del suelo, además de ser un riesgo para la salud humana (Pérez et al., 2009; Hussain et al., 2017). De acuerdo con esto y con una visión sostenible del cultivo, es prioritario evaluar e integrar al manejo de la enfermedad, alternativas eficientes que tengan un bajo impacto ambiental, en este sentido, el control biológico mediante el uso de microorganismos antagonistas o aceites esenciales pueden constituirse como herramientas en estrategias de manejo integrado de la pudrición blanca (Lourenço et al., 2018).
Especies de los géneros Trichoderma sp., Bacillus sp. o Pseudomonas sp., se destacan en el control biológico de fitopatógenos por su amplia distribución y sus diferentes mecanismos de acción. En el mercado se encuentran diferentes bioplaguicidas con registro de uso, los cuales, son utilizados para el control de patógenos del suelo o foliares, adicionalmente, algunas cepas tienen la capacidad de promover el crecimiento vegetal, influyendo en el desarrollo y producción de las plantas (Schuster y Schmoll, 2010; Santoyo et al., 2012), por lo cual pueden ser considerados en el desarrollo de estrategias de manejo integrado previa evaluación y selección.
En el mismo sentido se encuentran aceites esenciales obtenidos de plantas como canela, eucalipto y orégano, los cuales presentan propiedades antimicrobianas contra patógenos como Botrytis cinerea o Fusarium oxysporum, particularmente por presentar compuestos a base de fenoles, taninos o terpenos los cuales presentan acción sobre el crecimiento o el metabolismo de los patógenos (Gurjar et al., 2012; Kottearachchia et al., 2012). De acuerdo con esto, el objetivo de este estudio fue determinar bajo condiciones controladas el potencial de uso en el control de S. cepivorum para el cultivo de ajo de los hongos Trichoderma koningiopsis (Th003), T. asperellum (Th034), las bacterias Bacillus amyloliquefaciens (Bs006) y Pseudomonas fluorescens (Pf014) y de los aceites esenciales de canela, clavo, eucalipto, limón, orégano y tomillo.
Materiales Y Métodos
Este trabajo se realizó en el Laboratorio de Microbiología Agrícola del Centro de Investigación Tibaitatá de la Corporación Colombiana de Investigación Agropecuaria AGROSAVIA.
Material vegetal. Se usaron bulbillos sanos de ajo morado obtenida de un cultivo comercial, previó a su uso, la semilla se desinfestó mediante lavado con una solución de hipoclorito de sodio al 2% (NaCl) por tres min y tres lavados con agua estéril.
Microorganismos. El patógeno utilizado correspondió al aislamiento S10 de S. cepivorum, aislado de una planta de ajo con signos de la enfermedad colectada de un foco de plantas enfermas en un cultivo del municipio de Sopo (departamento de Cundinamarca), obteniendo su inóculo a partir de la producción y cosecha de esclerocios en cultivos del hongo en Agar Papa Dextrosa (PDA OxoidÒ), incubados a 18 °C durante 24 días. Los esclerocios se cosecharon mediante el raspado del medio, se almacenaron en tubos Falcon y cuando se utilizaron fueron desinfestados mediante lavado con NaCl al 2%, secándolos a 30 °C por 24 horas. En cuanto a los microorganismos antagonistas, el Banco de Germoplasma de Microorganismos de AGROSAVIA proporcionó la cepa Th034 de T. asperellum y la cepa Pf014 de P. fluorescens, cuya producción se realizó en PDA y caldo Luria Bertani (LB), respectivamente. Igualmente se utilizó el biofungicida Tricotec® a base de T. koningiopsis cepa Th003 y un prototipo de formulación a base de B. amyloliquefaciens cepa Bs006 (desarrollados por Agrosavia). El inóculo consistió en suspensiones en agua a concentraciones de 1x106 conidios mL-1 para hongos y 1x108 células mL-1 para bacterias.
Aceites esenciales. De acuerdo con una revisión de literatura se seleccionaron por su potencial de control sobre S. cepivorum los aceites esenciales de canela, clavo, eucalipto, limón, orégano y tomillo. El aceite de orégano fue producido en Agrosavia (anteriormente Corpoica) por Betancourt et al. (2012), mientras que el resto de los aceites se obtuvo de concentrados comerciales.
Actividad sobre la degradación de esclerocios. Para determinar la capacidad de los antagonistas para degradar los esclerocios de S. cepivorum, se modificó la metodología descrita por Clarkson et al. (2002), para lo cual se dispusieron 100 esclerocios en bolsas de muselina de 1 cm2, ubicándolos posteriormente a una profundidad de 2 cm en recipientes plásticos de 6 onzas que contenían una mezcla estéril de suelo y arena (3:1), inmediatamente se realizó la inoculación del sustrato mediante la aplicación de 10 mL de las suspensiones de cada microorganismo en las concentraciones ya descritas. Durante el período de evaluación se realizó el riego de los recipientes cada tres días para conservar su humedad.
Después de 30 días se colectaron las bolsas de muselina, tomando de cada una, 30 esclerocios, los cuales se sembraron en cajas Petri con PDA o agar Luria Bertani (LB) de acuerdo con el tratamiento aplicado. Posteriormente, las cajas Petri fueron incubadas a 18 °C durante seis días para determinar su viabilidad o parasitismo; los esclerocios restantes se observaron al estereoscopio para identificar daños en su estructura. El ensayo se realizó en un invernadero a 23 °C bajo un diseño completamente al azar donde la unidad experimental consistió en un recipiente con una bolsa teniendo tres repeticiones, como control se utilizaron esclerocios sin tratamiento.
Efecto de aceites esenciales sobre el crecimiento de S. cepivorum in vitro. Se evaluaron los aceites esenciales en tres concentraciones (Cuadro 1) con el fungicida Tebuconazol (1 L / 200 L) como control químico y un testigo absoluto. Para esto, se suplementó el PDA con cada aceite en la concentración determinada sirviéndolos en cajas Petri, posteriormente se realizó la siembra de un disco de agar de 5 mm con micelio de S. cepivorum (obtenido de un cultivo en PDA de 12 días) en el centro de la caja, se incubó a 18 °C durante 12 días, período en el que se registró el crecimiento y se determinó el porcentaje de inhibición del crecimiento micelial (ICM) de colonias en presencia de los aceites, calculado en relación al control, una vez el hongo cubrió la totalidad de la caja Petri, aplicando la fórmula de Philippe et al. (2012) citado por Gakuubi et al. (2017), ICM(%)= dc - dt / dc x 100; donde: dc= Diámetro de la colonia del patógeno en el control, y dt= Diámetro de la colonia del patógeno en el tratamiento.
Control de S. cepivorum en condiciones controladas. La evaluación se desarrolló en macetas plásticas de 0.5 L de capacidad en la que se sembró un bulbillo de ajo, la concentración de S. cepivorum utilizada correspondió a 200 esclerocios por gramo de suelo (seleccionada en estudios previos no publicados por obtener una mortalidad del 83%). Se realizó la inmersión de los bulbillos durante 10 min en las suspensiones de microorganismos, aceites esenciales y Tebuconazol, posteriormente se sembraron en las macetas y en cada una se aplicó en drench 20 mL de las suspensiones según el tratamiento. Se efectuaron dos aplicaciones más en drench con una frecuencia de 15 días, manteniendo el ensayo por 90 días (aunque el ciclo del cultivo esta entre los cinco y seis meses, la enfermedad puede presentarse en cualquier momento). El ensayo se estableció mediante un diseño completo al azar, la unidad experimental constó de ocho macetas con tres repeticiones; se contó con un testigo inoculado con el patógeno y un control sin inocular, las cuales se mantuvieron en una casa de malla con riego diario a una temperatura promedio en el día de 20 °C, las variables evaluadas fueron la incidencia de la enfermedad (número de plantas con síntomas sobre el número total de plantas multiplicado por 100) y la mortalidad de la enfermedad (número de plantas muertas sobre el número total de plantas multiplicado por 100).
Cuadro 1. Aceites esenciales y concentraciones evaluadas en la inhibición del crecimiento de Sclerotium cepivorum in vitro.
| Aceites esenciales | Concentración (ppm) | ||
|---|---|---|---|
| 1 | 2 | 3 | |
| Canela (Cinnamomum verum) | 150 | 200 | 250 |
| Clavo (Syzygium aromaticum) | 250 | 500 | 750 |
| Eucalipto (Eucalyptus sp.) | 7000 | 10000 | 15000 |
| Limón (Citrus limon) | 200 | 400 | 600 |
| Orégano (Origanum vulgare) | 150 | 200 | 250 |
| Tomillo (Thymus vulgaris) | 200 | 400 | 800 |
Análisis estadístico. Para cada bioensayo los datos fueron analizados mediante un análisis de varianza y una prueba de comparación de medias Tukey (p£0.05), empleando el software estadístico Statistix 10.0.
Resultados
Actividad sobre la degradación de esclerocios. A partir de los esclerocios recuperados y sembrados en los medios de cultivo se obtuvieron colonias de los antagonistas, para las cepas de Trichoderma se observó crecimiento a partir del 100% de los esclerocios, en tanto que para las bacterias el crecimiento se observó a partir del 95% de los esclerocios, en todos los casos no se evidenció crecimiento de S. cepivorum (Figura 1A). En cuanto a los esclerocios del control, no presentaron infección germinando en el PDA, obteniendo colonias de S. cepivorum a partir de ellos. Por otra parte, la observación de los esclerocios de cada tratamiento al estereoscopio mostró que todos los antagonistas causaron la degradación parcial de los esclerocios, de acuerdo con la pérdida de su estabilidad estructural (Figura 1B) impidiendo el crecimiento del patógeno a partir de dichas estructuras.
Efecto de aceites esenciales sobre el crecimiento de S. cepivorum in vitro. En el agar PDA suplementado con los aceites de clavo, limón en las tres concentraciones y tomillo (200 y 400 ppm) se obtuvo una inhibición del crecimiento entre el 2 y 12%, sin presentar diferencias significativas con respecto al control; en contraste, con eucalipto, orégano (200 y 250 ppm) y Tebuconazol, la inhibición superó el 92%, con los aceites de canela, orégano (150 ppm) y tomillo (800 ppm) se inhibió el crecimiento entre un 50 y 86% (Figura 2).
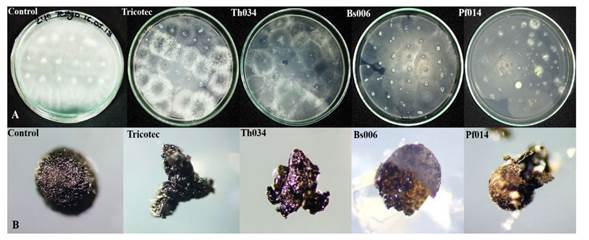
Figura 1 A. Crecimiento de los antagonistas a partir de los esclerocios inoculados. B. Degradación de los esclerocios por los antagonistas. Control (tratamiento sin aplicación de antagonistas), Tricotec (biofungicida a base de T. koningiopsis cepa Th003), Th034 (T. asperellum cepa Th034), Bs006 (B. amyloliquefaciens cepa Bs006), Pf014 (P. fluorescens cepa Pf014).
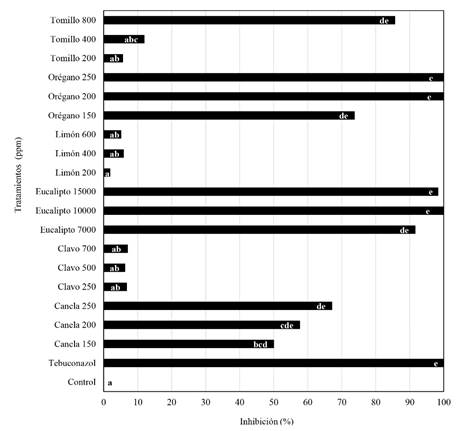
Figura 2. Inhibición del crecimiento de S. cepivorum en medio suplementado con aceites esenciales después de 12 días de incubación a 18 °C. Valores con las mismas letras no presentan diferencias significativas para la prueba de Tukey (*=P>0.05).
Control de S. cepivorum en condiciones controladas. Los tratamientos evaluados, mostraron actividad de control del patógeno a excepción de los aceites esenciales, particularmente el aceite de eucalipto, en el cual se mostró un efecto negativo sobre los bulbillos (Datos no mostrados), al parecer por un efecto fitotóxico que provocó necrosis del tejido afectando su germinación. Con las aplicaciones del aceite de orégano se obtuvo un comportamiento similar al observado en el tratamiento patógeno, incluso presentando diferencias estadísticas significativas (Figura 3).
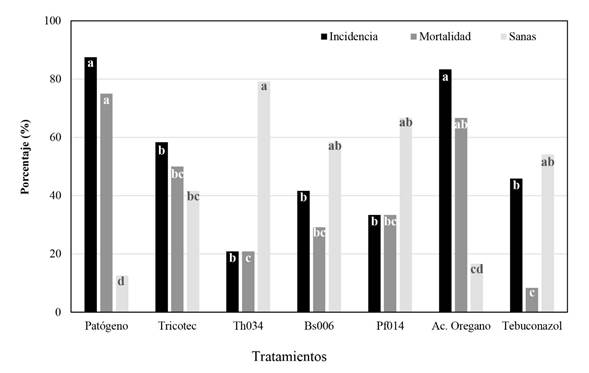
Figura 3. Incidencia, mortalidad y de plantas sanas de ajo por tratamiento después de 90 días de evaluación. Columnas con la misma letra no son significativamente diferentes de acuerdo con la prueba de Tukey (*= P>0.05).
La menor incidencia de la enfermedad con un 21% se obtuvo con las aplicaciones de T. asperellum Th034, así como la mayor cantidad de plantas sanas o asintomáticas con un 79%, (Figura 3); mientras que, con las aplicaciones de las bacterias se obtuvo un comportamiento similar a las aplicaciones de Tebuconazol, sin presentar diferencias significativas entre sí, aunque numéricamente la incidencia de la enfermedad fue menor y el porcentaje de plantas sanas mayor en las bacterias (Figura 3). Por otra parte, el tratamiento con T. koningiopsis Th003 (Tricotec®) fue el menos eficiente en la reducción de la incidencia y mortalidad de la enfermedad (Figura 3). Las plantas del control sin inocular no presentaron signos o síntomas de la pudrición blanca.
Discusión
La degradación de los esclerocios es una característica por considerar al momento de seleccionar un microorganismo antagonista ya que dichas estructuras pueden persistir durante décadas en los suelos limitando la producción y rendimiento de los cultivos de aliáceas (Metcalf et al., 2004; Velásquez et al., 2012; Pérez et al., 2015). Esta acción está relacionada principalmente con la capacidad del antagonista para producir metabolitos secundarios tóxicos y enzimas extracelulares, las cuales le posibilitarán acceder a los esclerocios como una fuente de nutrientes; en especies del género Trichoderma esta acción se relaciona con el micoparasitismo, involucrando la producción y secreción de enzimas como la β 1-3 glucanasa, β 1-6 glucanasa, N-acetylhexosaminidasa, polisacaridasas, proteasas y lipasas, las cuales intervienen en la degradación de la pared celular y su producción se ha reportado en cepas de T. asperellum y T. koningiopsis (Vinale et al., 2008; Schuster y Schmoll, 2010; Mukherjee et al., 2012; Pérez et al., 2015; Fuga et al., 2016).
Igualmente, para B. amyloliquefaciens y P. fluorescens se conoce que producen β glucanasas y quitinasas; adicionalmente se sabe que B. amyloliquefaciens produce lipopéptidos como iturrinas y fengicinas o ácidos grasos y fenoles como cloroxilenol, ácido pentadecanoico, ácido hexadecanoico, ácido heptadecanoico, ácido octadecanoico y pirrol, con acción antifúngica contra patógenos como Sclerotinia sclerotiorum o F. oxysporum. En P. fluorescens se conoce que esta especie produce ácido cianhídrico, pyrrolnitrin y sideróforos responsables de la actividad antifúngica entre otros sobre Sclerotium rolfsii (Ganeshan y Arthikala, 2005; Shafi et al., 2017; Vinodkumar et al., 2017; Ley et al., 2018).
En este sentido, es posible que el control de la pudrición blanca en este trabajo esté relacionada con el parasitismo de los esclerocios en el suelo mediada eventualmente por la producción de metabolitos secundarios, particularmente para T. koningiopsis Th003 y T. asperellum Th034 se ha demostrado su actividad de control sobre patógenos que producen esclerocios; por ejemplo, se observó que el tratamiento previo a la siembra de tubérculos de papa con presencia de esclerocios de Rhizoctonia solani con dos formulaciones a base de estos hongos redujo la incidencia del patógeno en un 80%, en comparación con los tubérculos no tratados, cuya incidencia fue del 100% (Beltrán et al., 2010).
De mismo modo, en el control de S. sclerotiorum y Sclerotinia minor mediante el uso de Tricotec® se redujo en un 34% la incidencia del moho blanco en cultivos de lechuga en condiciones comerciales (Moreno et al., 2010); para T. asperellum Th034 Smith et al. (2013) determinaron su capacidad para degradar esclerocios de S. sclerotiorum. Por otra parte, se ha demostrado que B. amyloliquefaciens Bs006 y P. fluorescens Pf014 presentan actividad de control sobre F. oxysporum en plantas de uchuva, aumentando en condiciones de campo la supervivencia de las plantas, permitiendo obtener cosecha a partir de estas (Díaz et al., 2012).
Respecto a los aceites esenciales es necesario tener en cuenta que el efecto puede ser diferente sobre el micelio y en los esclerocios dada la resistencia de estas estructuras. Diferentes estudios han demostrado el efecto inhibitorio sobre el crecimiento de fitopatógenos de los aceites esenciales utilizados en la presente investigación, por ejemplo, Ranasinghe et al. (2002) describieron la inhibición de Colletotrichum musae, Lasiodiplodia theobromae y Fusarium proliferatum mediante el uso del aceite de clavo en concentraciones de entre 300 - 1100 ppm; del mismo modo, Barrera et al. (2009) reportaron la inhibición del 100% sobre el crecimiento de F. oxysporum f. sp. gladioli con los aceites de clavo, tomillo y canela en concentraciones de 100, 150, 200, 250 y 300 ppm.
A pesar de que en condiciones in vitro se observó la inhibición del crecimiento de S. cepivorum, en el bioensayo en el suelo no se evidenció el control de la enfermedad particularmente con las aplicaciones del aceite de orégano; es posible que esto se deba a que el aceite no tuvo un efecto sobre los esclerocios y que, al germinar, posiblemente el aceite ya se había degradado en el suelo. En contraste, el efecto fitotóxico observado con el aceite esencial de eucalipto en la concentración aplicada lo hace inviable para su uso en el cultivo de ajo, si bien se conoce que este aceite presenta propiedades pesticidas de amplio espectro ya que diferentes trabajos han demostrado su actividad como compuesto antimicrobiano afectando tanto bacterias como hongos, así como plaguicida, acaricida o herbicida (Batish et al., 2008; Haouel et al., 2015; Tomazoni et al., 2017); en este sentido, es necesario evaluar otras concentraciones o formas de aplicación para considerar su uso como alternativa de control de la pudrición blanca.
Si bien los resultados muestran que los antagonistas reducen el impacto negativo de la enfermedad, para su uso en campo, es necesario realizar estudios que permitan determinar las formas y frecuencias de aplicación, particularmente su incorporación durante la etapa de preparación del terreno, con el objetivo de reducir el inóculo de patógeno, esto de acuerdo con los resultados obtenidos por Velásquez et al. (2012), quienes demostraron el potencial de movimiento de los esclerocios de zonas profundas (20 a 40 cm) a la capa superior y viceversa, durante la preparación del suelo.
Conclusiones
A pesar de que los aceites esenciales de orégano (200 y 250 ppm) y eucalipto inhibieron el crecimiento de S. cepivorum en ensayos in vitro, al ser aplicados en los bulbillos y al suelo, el primero presentó un comportamiento similar al testigo patógeno mientras que el segundo presentó un efecto tóxico que afectó la germinación del bulbillo. En contraste con el uso de los microorganismos antagonistas se redujo la incidencia y mortalidad de la enfermedad destacando sobre todos a T. asperellum Th034 como el más eficiente.











 text in
text in 


