Existen pocos estudios sobre el género Taphrina, que pertenece a la clase Taphrinomycetes. El orden Taphrinales está formado por dos familias (Protomycetaceae y Taphrinaceae), ocho géneros y 140 especies. El género Taphrina contiene solo parásitos de plantas vasculares y causa deformación de los tejidos vegetales (Rodrigues y Fonseca, 2003; Fonseca y Rodrigues, 2011).
Taphrina caerulescens es el hongo fitopatógeno responsable de la enfermedad conocida como ampolla de la hoja del encino. Cuando este fitopatógeno infecta las hojas jóvenes estimula la hipertrofia y la hiperplasia de las células del hospedero. El crecimiento celular anormal produce la formación de lesiones irregulares y abultadas en las hojas infectadas; las lesiones pueden medir desde unos cuantos milímetros de diámetro o deformar toda la superficie de la hoja. La ampolla de la hoja del encino causa una tasa acelerada de necrosis y senescencia prematura en las hojas y muerte de las hojas infectadas (Taylor y Birdwell, 2000; Horst, 2008).
En 2015, se observó que los síntomas de la ampolla del encino causados por T. caerulescens afectaron severamente Quercus spp. en la Sierra Fría de Aguascalientes, México. Esa fue la primera vez que la enfermedad se reportó en México (Moreno-Rico et al., 2015).
Todos los miembros del género Taphrina son dimórficos con fases parasitaria y saprofítica. En la fase parasitaria, Taphrina spp. infecta las hojas durante la apertura de las yemas (Rossi y Languasco, 2007). La fase infecciosa son las blastosporas (también llamadas conidios) que se originan en las ascosporas como resultado de la gemación. En T. caerulescens no es común observar ascosporas en las ascas (Nagao y Katumoto, 1998; Fonseca y Rodrigues, 2011). Por lo general, las blastosporas son esféricas a ovoides, uninucleadas y haploides, las cuales continúan dividiéndose después de que se forman, pero si entran en contacto con un hospedero adecuado forman un tubo germinativo e infectan el tejido del hospedante a través de los estomas (Nagao y Katumoto, 1998; Taylor y Birdwell, 2000).
El objetivo de este estudio fue observar los cambios que se producen en el inóculo (conidios/blastosporas), antes de que la hoja del hospedero sea infectada a medida que cambia de saprófito a parásito, de un nuevo aislado que se encuentra infectando especies endémicas de encino en México.
El parque nacional de la Sierra Fría abarca una superficie de 1419 km² y se eleva a una altitud de aproximadamente 2450 metros. El parque se encuentra en las siguientes latitudes: N: 21° 52’ 45” - 23° 31’ 17”, y longitudes O: 102° 22’ 44” - 102° 50’ 53”. Quercus spp. constituye la comunidad más grande de árboles. La Sierra Fría se caracteriza por su clima templado subhúmedo (Arriaga et al., 2000).
El tejido de hojas de Quercus eduardii que contenía ascas maduras de Taphrina caerulescens se fijó en las tapas de placas Petri sobre papa-dextrosa-agar (PDA) (4 g de extracto de papa, 20 g de dextrosa, 20 g de agar, 1.0 L de agua destilada, pH final 5.6±0.2) (Nagao y Katumoto, 1998; Taylor y Birdwell, 2000). Las esporas fueron descargadas en un medio de cultivo PDA por 24 h. Las colonias que se formaron fueron transferidas a un nuevo medio de cultivo e incubadas a 20 °C. El crecimiento de las colonias formadas fue parecido al de las células de la levadura y mostraron frecuente gemación. No se observó desarrollo micelial, características congruentes con reportes anteriores: células parecidas a las de la levadura que mostraron frecuente gemación, con colonias opacas a rosa claro, que adquirían un tono de rosa más oscuro con la edad. Las colonias eran circulares con márgenes completos en la base y consistencia viscosa, de apariencia suave y brillante (Nagao y Katumoto, 1998; Taylor y Birdwell, 2000; Rodrigues y Fonseca, 2003).
Las semillas se lavaron varias veces, primero con agua de la llave a la que se agregó Tween al 80% por 5 min, y posteriormente con una solución de etanol al 70% por 45 s; inmediatamente después se enjuagaron tres veces con agua destilada estéril y se sumergieron en una solución de hipoclorito de sodio al 1.0% por 20 min; por último, se enjuagaron tres veces más con agua destilada estéril (Lindsey et al., 2017). Las semillas fueron germinadas en condiciones asépticas y después transferidas a recipientes estériles transparentes de 1.0 L. Para asegurarse de que las muestras de suelo estuvieran libres de otros patógenos, se esterilizaron en autoclave a 121 °C a 1.1 atm (aprox. 16 lbs pulg-1; 1.137 kg cm-1) durante 15 min como mínimo, tres días consecutivos.
Se utilizaron dos métodos de inoculación. La primera de las pruebas se realizó aplicando el método de la hoja desprendida, con una modificación, de acuerdo con Rossi et al. (2006), quienes realizaron una prueba similar con Taphrina deformans utilizando hojas de Prunus persica. Dos días después de que las hojas emergieron de las yemas, se separaron de las plantas y se esterilizaron en una solución de hipoclorito de sodio al 1.0% por 60 s; a continuación, se enjuagaron tres veces con agua destilada estéril antes de colocarlas sobre papel filtro estéril húmedo (Whatman de 90 mm de diámetro) en una placa Petri estéril de 90 x 15 mm de la marca Interlux; posteriormente las hojas fueron inoculadas en la superficie abaxial o inferior. Un total de cinco hojas de cada especie vegetal se colocaron en cuatro placas Petri; tres placas con hojas fueron inoculadas con la suspensión de T. caerulescens y la otra muestra fue inoculada con agua pura estéril. Este procedimiento se repitió tres veces.
En el segundo método se utilizó toda la planta. Las plantas, que tenían aproximadamente seis meses de edad, se sembraron en recipientes de plástico transparente de 1 L. Aunque las plantas se sembraron en condiciones asépticas, 30 días antes de realizar las pruebas, fueron tratadas con fungicida oxicloruro de cobre (Cupravit®, Bayer Crop science), de acuerdo con las instrucciones del fabricante. Para cada experimento se utilizaron cuatro recipientes con cinco plantas en cada uno, tres de los cuales fueron inoculados con la suspensión del inóculo y la cuarta con agua pura estéril. El experimento se repitió tres veces.
El inóculo de T. caerulescens se obtuvo de un aislado con crecimiento activo de 14 días que fue sembrado en medio de cultivo PDA a 20 °C. Las blastosporas fueron suspendidas en agua destilada estéril con Tween 80 al 0.01%. La suspensión final fue de aproximadamente 1.35’ 109 conidios/mL, la cual posteriormente se roció en la superficie inferior de las hojas desprendidas, de dos días de edad, y hojas unidas al tallo (Taylor y Birdwell, 2000). Las plantas en recipientes separados también fueron inoculadas con agua destilada estéril. Los recipientes con las plántulas inoculadas fueron cubiertas y se mantuvieron en una cámara de crecimiento (20 °C). Asimismo, una especie no hospedera de Pittosporum tobira fue inoculada de la misma manera con la suspensión de blastosporas. Para el análisis microscópico se tomaron muestras a las 24 h, 48 h y 72 h después de la inoculación.
Los especímenes se analizaron a 10 KV y 12 KV usando un microscopio electrónico de barrido (MEB) modelo JSM-35C® (JEOL LTD, Tokio, Japón) en el laboratorio de Microscopía Electrónica del Departamento de Biología de la Universidad Autónoma de Aguascalientes. Cada uno de los especímenes se fijó en glutaraldehído al 3% en una solución amortiguadora de 0.1 M fosfato de sodio 0.1 M (pH 7.2) por 1.5 h a temperatura ambiente, y después se procesó de acuerdo con el método de Dykstra y Reuss (2003). Se analizaron las dimensiones (largo y ancho) de las blastosporas originales y de las blastosporas secundarias, y se obtuvieron los promedios. Para determinar si las dimensiones de los dos grupos de blastosporas eran similares, se hizo una comparación de promedios utilizando la prueba t-Student. Se analizaron también la tasa de gemación de las blastosporas después de 24 h, 48 h y 72 h, y el crecimiento direccional de los tubos germinativos.
La microscopía electrónica de barrido reveló que las blastosporas en las hojas de Quercus spp. tuvieron gemación moderada 24 h después de la inoculación, y que en las hojas de Q. eduardii (Figuras 1 A-B) y de Q. potosina (Figuras 1 C-D) aumentó significativamente después de 48 h y 72 h. No se observaron cambios significativos en las hojas de la especie no hospedera e incluso después de 72 h (Figuras 1 E-F) no se observó gemación. Después de 48 h, se observaron numerosas blastosporas más pequeñas (Figura 2 A-B) de 0.87 - 1.77 µm × 0.191 - 0.485 µm en las hojas de Q. eduardii. Un análisis descriptivo de las mediciones arrojó las siguientes medidas (n=30): largo: media = 1.41 µm, s=0.05, SD (desviación estándar) = 0.27 µm de largo, para el ancho los valores fueron: media = 0.34 µm, s = 0.01, SD = 0.08 µm.
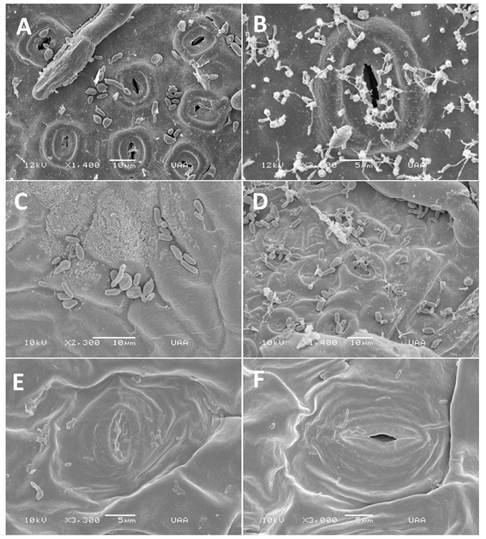
Figura 1 MEB de blastosporas en hojas inoculadas. A. Blastosporas en Q. eduardii 24 h después de la inoculación. B. Blas tosporas en Q. eduardii 72 h después de la inoculación. C. Formación de blastosporas en Q. potosina 24 h después de la inoculación. D. Formación de blastosporas en Q. potosina 72 h después de la inoculación. E. Blastosporas en P. tobira 24 h después de la inoculación. F. Blastosporas en P. tobira 72 h después de la inoculación.
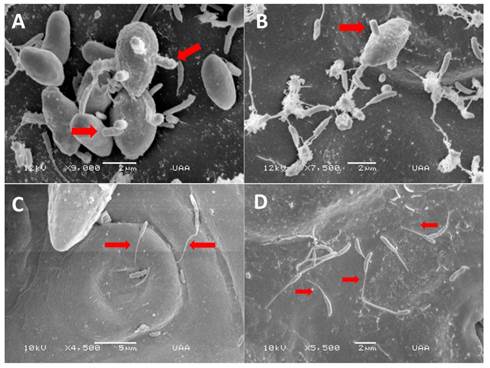
Figura 2 MEB del desarrollo de blastosporas secundarias. A-B Formación de múltiples blastosporas secundarias en la su perficie del inóculo original (las flechas señalan las blastosporas secundarias). C. Tubos germinativos formados en el extremo apical de las blastosporas secundarias que crecen hacia los estomas. D. Tubos germinativos con patrón de crecimiento es al azar (las flechas señalan los tubos germinativos).
Se hizo una comparación de las dimensiones de las blastosporas más pequeñas con las de las blastosporas originalmente inoculadas. Las dimensiones de las blastosporas originales fueron 3.06 - 5.49 µm × 1.09 - 3.01 µm, y el análisis descriptivo de las mediciones (n= 30) fue el siguiente: media = 4.12 µm, s = 0.12, SD = 0.68 µm para el ancho los valores fueron: media = 1.94 µm, s = 0.09, SD = 0.50 µm. Para comparar la diferencia entre los dos grupos de blastosporas se realizó una prueba t-Student. Al comparar el ancho de las blastosporas secundarias (media = 0.34 µm) con el ancho de las dimensiones de las blastosporas originales (media = 1.94 µm), se observó una diferencia significativa entre las dos medias, prueba t-Student = -17.69, p<.005. Asimismo, se encontraron diferencias significativas entre la longitud de las blastosporas secundarias (media = 1.41 µm) y la de las blastosporas originales (media = 4.12 µm), prueba t-Student = -23.05, p< .005.
Cuando terminaron de formarse, las blastosporas secundarias produjeron tubos germinativos. La formación de los tubos germinativos se registró 48 h después de la inoculación en Q. eduardii. Aunque muchos de los tubos germinativos crecieron hacia los estomas (Figura 2C), se observó que algunos crecieron al azar (Figura 2D). En promedio, los tubos germinativos midieron 1.69 µm después de 48 h, y 5.18 µm después de 72 h.
Aunque hubo gemación en la superficie de Q. potosina 48 h después de la inoculación, no se observaron blastosporas secundarias y tampoco hubo formación de tubos germinativos. Los síntomas de la enfermedad se manifestaron después de un mes únicamente en las hojas de Q. eduardii, en 30% de las plantas que fueron inoculadas (Figuras 3 A-D). Estos resultados son similares a los obtenidos por Taylor y Birdwell (2000).
Desde que Taylor y Birdwell publicaron los resultados de su estudio en 2000, no ha habido ningún otro estudio detallado de la interacción entre Quercus spp. y T. caerulescens. Una de las principales diferencias entre el presente estudio y el estudio de Taylor y Birdwell reside en que, en el presente estudio se utilizó un aislado de T. caerulescens obtenido de Quercus eduardii (encino blanco), que es endémico de la Sierra Fría, Aguascalientes, en tanto que en sus experimentos, Taylor y Birdwell utilizaron uno derivado de Quercus nigra (encino rojo) originario de la región del este y sur-centro de Estados Unidos, que crece en los estados de la zona costera. Taylor y Birdwell (2000) llegaron a la conclusión de que los tubos germinativos se formaron después de 48 h; el presente estudio confirma sus observaciones respecto a que los tubos germinativos se formaron 48 h después de entrar en contacto con un hospedante adecuado. Aunque muchos de los tubos germinativos crecieron hacia los estomas, se observó que también crecieron arbitrariamente, es decir, crecieron encima y fuera de los poros estomáticos abiertos. Este patrón de crecimiento fue también descrito por Taylor y Birdwell (2000), quienes afirmaron que los tubos germinativos con frecuencia crecían hasta alcanzar grandes longitudes y que el crecimiento de los tubos germinativos más largos parecía ser al azar más bien que direccional. Debido al patrón de crecimiento de los tubos germinativos ha surgido la hipótesis de que la orientación de éstos está siendo afectada por otros factores además de los gradientes quimiotácticos que emanan de los estomas (concentración de dióxido de carbono). Sin embargo, dado el limitado alcance de esta investigación, no fue posible determinar los otros factores que intervienen.

Figura 3 Formación de ampollas en hojas de Q. eduardii 40 días después de haber sido inoculadas con T. caerulescens.
Taylor y Birdwell (2000) mencionaron que los tubos germinativos se formaron desde los extremos apicales de las células originales (conidios/blastosporas) que se utilizaron para inocular las hojas. Este estudio presenta un marcado contraste con los resultados obtenidos por Taylor y Birdwell. El aislado de la Sierra Fría se comportó de manera muy diferente, ya que los primeros conidios originales produjeron un número de células significativamente más pequeñas que fueron consideradas como blastosporas secundarias. Las blastosporas secundarias fueron las únicas células que pudieron formar tubos germinativos; no se observó que las blastosporas más grandes produjeran tubos germinativos. En esta investigación se da a conocer, por primera vez, la formación de estas blastosporas secundarias.
Otro resultado de interés es que, aunque el aislado que se utilizó se obtuvo de Q. eduardii, éste tuvo la capacidad de multiplicarse en la superficie de Q. potosina y, por tanto, debilita el argumento de que T. caerulescens (al menos este aislado) es ultraespecífico y no tiene la capacidad de crecer en otra especie de Quercus además de las especies de las cuales se obtuvo el aislado (Taylor y Birdwell, 2000). Los investigadores atribuyeron este nuevo hallazgo al hecho de que en México existe un alto grado de hibridación entre las especies endémicas de Quercus spp. (Valencia, 2004), y que es posible que debido a la similitud de la información genética de estas especies este aislado se desarrolle y posiblemente infecte múltiples especies de Quercus.
En el presente estudio se determinó que las blastosporas del aislado de T. caerulescens que infectaron la especie Q. eduardii de la Sierra Fría de Aguascalientes no tuvieron la capacidad de formar tubos germinativos directamente, y que, en lugar de esto, el inóculo original produjo numerosas blastosporas pequeñas que formaron tubos germinativos. En esta investigación se reporta por primera vez la observación de blastosporas secundarias en Taphrina spp. Asimismo, nuestro estudio muestra que, aunque las blastosporas tuvieron la capacidad de multiplicarse en Q. potosina, no hubo formación de tubos germinativos.











 text in
text in 


