México ostenta la Denominación de Origen del Tequila (DOT) conformada por 181 municipios de los estados de Guanajuato (7), Michoacán (30), Nayarit (8), Tamaulipas (11) y la totalidad de Jalisco (125). La DOT representa el 73.4% (81,053 ha) del agave azul (Agave tequilana Weber var. Azul) cultivado a nivel nacional, siendo Jalisco el más representativo con 64,499 ha (SIAP 2018). La DOT, a través de la industria tequilera, genera de forma directa una derrama económica regional estimada en 1,600 millones de pesos anuales y representa el sustento de 70,000 familias (SIAP 2015). Las implicaciones de mantener la región DOT agavera, legalmente definida en el tiempo y espacio, es multidimensional pero se fundamenta en el reto de garantizar la sustentabilidad productiva y rentabilidad bajo un modelo resiliente a largo plazo.
A partir de la década de los 90´s, los inventarios productivos del agave en Jalisco han sido fuertemente afectados por factores fitosanitarios entre los que destacan el picudo (Scyphophorus acupunctatus), la marchitez por Fusarium spp, y la mancha gris causada por Cercospora agavicola. Ante los recurrentes desabastos de planta de siembra y la tendencia creciente del precio de la piña (tallo del agave) se ha incrementado el volumen de hijuelos movilizados dentro y entre estados acrecentando los riesgos fitosanitarios por lo que es importante fortalecer el monitoreo y muestreo en el marco de la Campaña Contra Plagas Reglamentadas del Agave (SENASICA, 2017). Así mismo, es importante desarrollar algoritmos de prevención y control para su integración en SIVEA (Sistema Integral de Vigilancia Epidemiológica del Agave), un sistema fitosanitario web operado por el SENASICA-DGSV (www.sivea.org.mx). Actualmente, una de las preocupaciones de productores es la dificultad del control de C. agavicola, por lo que este trabajo se enfocó a estudiar la mancha gris en Jalisco, estado en el cual históricamente se han reportado daños en Los Altos (Acatic, San Juan de los Lagos, Tepatitlán y Yahualica), Valles (Amatitán, Ahualulco, Arenal, Magdalena, San Juanito de Escobedo y Tequila), Sur (Autlán, El Grullo, El Limón y Unión de Tula) y Sierra Occidental (Atenguillo, Mascota y Mixtlán) (Rubio, 2007). La mancha gris se reportó en 2003 en Pénjamo, Guanajuato y en 2005 se identificó al agente causal como C. agavicola (Ayala-Escobar et al., 2005). La infección del hongo aparentemente ocurre en los periodos de octubre a marzo en condiciones favorables de humedad relativa ≥80% y temperatura media entre 15 y 22 °C (Ángeles-Espino et al., 2016; Valencia, 2011; Rubio, 2007). La infección primaria causa lesiones negras, ovaladas de hasta 1-3 cm, generalmente en el tercio medio a superior de hojas no expandidas del cogollo. La enfermedad desarrolla rápidamente produciendo manchas coalescentes, deprimidas grisáceas y termina con colapso del cogollo y muerte de planta.
Aunque no se ha comprobado la implicación de cercosporina en el síntoma, toxina no específica producida por Cercospora spp, activada por luz y temperatura (Daub y Ehrenshaft, 2000; Jens et al., 1989), este estudio se planteó bajo la premisa de que es posible pronosticar el proceso infeccioso primario, independiente del efecto de dicha toxina; así mismo, se propuso caracterizar atributos espacio-temporales a nivel parcelario-región con el fin de comprender procesos de dispersión, prevalencia e intensidad epidémica aplicables a la generación de alertas tempranas para fortalecer el manejo preventivo de la mancha gris del agave.
Materiales y métodos
Red de monitoreo e inductividad epidémica regional. De octubre 2016 a diciembre 2017, se estableció y evaluó una red de monitoreo de 41 parcelas distribuidas en predios comerciales de agave de 3-4 años en Los Altos (20), Valles (11) y Sur (10) del estado de Jalisco. Las parcelas se seleccionaron con base a un análisis de inductividad epidémica regional, para lo cual se emplearon datos de ocurrencia de focos de infestación generados durante 2012-2015 por la Campaña de Plagas Reglamentadas del Agave (www.sivea.org.mx), superficie cultivada (SIAP, 2015), clima (CONAGUA 2015) y factores edáficos. Se empleó la metodología Reg-N a la matriz integrada de datos para generar un indicador epidémico multivariado de inductividad y para seleccionar parcelas que maximicen la variabilidad epidémica regional de la enfermedad (Cuadro 1) (Acevedo-Sánchez et al., 2017; Mora-Aguilera y Acevedo-Sánchez, 2016). El indicador epidémico se usó para generar un mapa de inductividad regional mediante ArcMap de ArcGis v10.3. Por predio comercial se seleccionó una parcela con una población de plantas de aproximadamente 0.5 ha; 25 parcelas tuvieron un foco central de 1-94 plantas enfermas con una severidad de macha gris entre 6-65%. Este foco constituyó el Yo o intensidad inicial de epidemia. En 16 parcelas se tuvieron únicamente poblaciones de plantas aparentemente sanas. Al centro de la parcela se colocó una trampa TIDE modificada con un dispositivo pasivo de impacto y deposición (Mora-Aguilera et al., 2014). En cada trampa se colocaron tres portaobjetos con cinta adhesiva doble cara, dos el dispositivo de deposición y uno en la de impacto. En el mismo soporte de la trampa se instaló un datalogger Hobo® Pro V2 configurado a intervalos de 30 minutos con el propósito de relacionar cambios de intensidad de enfermedad con variables de temperatura y humedad relativa ambiental. Quincenalmente se colectaron los portaobjetos de trampas y se realizó la extracción in situ de datos climáticos.
Diagnóstico molecular de C. agavicola . Con el objetivo de confirmar la asociación del agente causal con la mancha gris se colectó en 13 parcelas de monitoreo muestras vegetales con lesiones típicas de la enfermedad. En laboratorio, el tejido se desinfestó con hipoclorito de sodio al 1.5% durante dos minutos, se enjuagó 3 veces con agua estéril y se incubó en cámara húmeda a 24-28 °C alternando 12:12 h luz:oscuridad durante 3 días. A partir del crecimiento micelial se aisló y cultivó al hongo en medio Agave-agar (Ayala-Escobar et al., 2005). La extracción de DNA se realizó por el método AP modificado (Sambrook y Russel, 2001) y se amplificó por PCR la región ITS 1-4 (White et al., 1990). El producto de PCR fue enviado a Macrogen (Seoul Corea) para su secuenciación. La identidad de las secuencias se realizó por medio del programa web Blast® blastn suite en NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi).
Cuadro 1 Localización de 41 parcelas de monitoreo en plantaciones comerciales de agave azul de 3-4 años de edad seleccionadas por criterio de inductividad epidémica para el estudio regional de la mancha gris, y condición inicial (Y 0 ) de ocurrencia de la enfermedad representado por número de plantas sintomáticas (P.enf) y severidad promedio de planta enferma (SProm) por parcela. Jalisco, México. 2016-2017.
| Región | Municipio | Latitud | Longitud | ID Plantación | P.enf (Y0)x | SProm(Y0)y |
|---|---|---|---|---|---|---|
| Altos | Arandas | 20.6973 | -102.2572 | A-ARA-CP01 | 94 | 32.8 |
| 20.8508 | -102.1592 | A-ARA-CP04 | 1 | 100 | ||
| 20.7618 | -102.2936 | A-ARA-CP05 | 3 | 63.6 | ||
| 20.7624 | -102.3470 | A-ARA-CP06 | 7 | 31.4 | ||
| 20.6954 | -102.3241 | A-ARA-CP20 | 22 | 22.5 | ||
| Jesús María | 20.6161 | -102.1381 | A-JM-CP02 | 12 | 58.5 | |
| 20.6698 | -102.0802 | A-JM-CP03 | 0 | 0.0 | ||
| 20.5931 | -102.1582 | A-JM-CP19 | 4 | 57.2 | ||
| Tepatitlán M. | 20.7891 | -102.5530 | A-TEP-CP08 | 0 | 0.0 | |
| 20.8581 | -102.6558 | A-TEP-CP09 | 1 | 6.0 | ||
| 20.6605 | -102.6456 | A-TEP-CP14 | 0 | 0.0 | ||
| Zapotlanejo | 20.5797 | -102.8915 | A-ZAP-CP10 | 1 | 85.0 | |
| Cerro Gordo | 20.6842 | -102.5042 | A-SICG-CP15 | 10 | 43.5 | |
| 20.7505 | -102.4838 | A-SICG-CP07 | 18 | 61.1 | ||
| Ocotlán | 20.4247 | -102.7568 | A-OCO-CP11 | 0 | 0.0 | |
| Atotonilco A. | 20.5151 | -102.6127 | A-ATO-CP12 | 2 | 85.0 | |
| Mextican | 21.2626 | -102.7186 | A-MEX-CP16 | 1 | 22.0 | |
| Yahualica G. G. | 21.1117 | -102.8675 | A-YAH-CP17 | 0 | 0.0 | |
| 21.1674 | -102.8727 | A-YAH-CP18 | 2 | 2.0 | ||
| Ayotlán | 20.5357 | -102.3696 | A-AYO-CP13 | 1 | 65.0 | |
| Valles | Hostotipaquillo | 21.0404 | -104.1994 | V-HOS-CP01 | 3 | 42.6 |
| Magdalena | 20.9298 | -104.1078 | V-MAG-CP02 | 0 | 0.0 | |
| 20.8982 | -103.9450 | V-MAG-CP03 | 1 | 85 | ||
| 20.9674 | -104.0410 | V-AMA-CP11 | 0 | 0.0 | ||
| Tequila | 20.9362 | -103.8726 | V-TEQ-CP04 | 0 | 0.0 | |
| Amatitán | 20.8589 | -103.7688 | V-AMA-CP05 | 0 | 0.0 | |
| 20.8344 | -103.6795 | V-AMA-CP06 | 1 | 6.0 | ||
| San Juanito E. | 20.7724 | -103.9958 | V-SJE-CP07 | 0 | 0.0 | |
| Ahualulco M. | 20.7388 | -103.9321 | V-AHU-CP08 | 0 | 0.0 | |
| Ameca | 20.5029 | -103.9862 | V-AME-CP09 | 1 | 2.0 | |
| Cocula | 20.3672 | -103.8636 | V-COC-CP10 | 0 | 0.0 | |
| Sur | Tecolotlán | 20.1896 | -104.0236 | S-TEC-CP01 | 0 | 0.0 |
| Juchitlán | 20.0756 | -104.1008 | S-JUC-CP02 | 0 | 0.0 | |
| Autlán de N. | 19.8322 | -104.3041 | S-AUT-CP03 | 0 | 0.0 | |
| Tuscacuesco | 19.7397 | -103.8802 | S-TUS-CP04 | 0 | 0.0 | |
| San Gabriel | 19.6659 | -103.8135 | S-SGA-CP05 | 4 | 56.0 | |
| San Andrés I. | 19.8257 | -103.5072 | S-GF-CP06 | 3 | 64 | |
| Teocuitatlán C. | 20.0920 | -103.4223 | S-TEO-CP07 | 5 | 39 | |
| 20.1270 | -103.3524 | S-TEO-CP08 | 1 | 6 | ||
| Zacoalco de T. | 20.2014 | -103.5321 | S-ZAC-CP09 | 14 | 35.2 | |
| Acatlán de J. | 20.4808 | -103.6357 | S-ACA-CP10 | 1 | 85 | |
x Penf=Número de plantas enfermas con mancha gris al seleccionar el sitio localizadas al centroide de parcela. / Penf = Number of diseased plants with gray spot when selecting the site located at the plot centroid.
y SPromY0= Severidad promedio en planta enferma al seleccionar el sitio / SPromY0 = Average severity of diseased plant when selecting the site.
Variables de evaluación. En cada parcela se evaluó mensualmente la incidencia de plantas enfermas y la severidad en planta mediante una escala diagramática de 7 clases (0=sana, 1=2%, 2=6%, 3=22%, 4=65%, 5=85% y 6=100%) (Jiménez-González et al., 2017). La evaluación se realizó siempre en las mismas en plantas para lo cual se seleccionaron y marcaron en un patrón sistemático discontinuo de 1x2 surcos y 1x3 plantas/surco, totalizando 273 plantas. El registro de las evaluaciones y su localización espacial se realizó directamente en App-SIVEA v1.1, una aplicación Android para telefonía móvil generada por COLPOS-LANREF (Guzmán-Hernández et al., 2017). Los datos se enviaron por vía satelital a la plataforma SIVEA (www.sivea.org.mx) para la integración automática de la matriz de datos regional. Para el monitoreo aerobiológico se contabilizó el número de esporas en 7 cm2 de cada portaobjeto por trampa.
Caracterización de epidemias, análisis espacial y temporal. Se caracterizó temporal y espacialmente un total de 41 epidemias inducidas por C. agavicola. Con base en un análisis gráfico exploratorio de parámetros epidémicos (Mora-Aguilera et al.,1993) se seleccionaron 14 epidemias, ocho en Los Altos, tres en Valles y tres en Sur para la estimación de tasas epidémicas representativas regionalmente. Para este fin se empleó el modelo flexible Weibull, el cual describe y ajusta curvas epidémicas de forma diversa (Mora-Aguilera et al., 1996). Para el ajuste del modelo se realizó la transformación de los datos de severidad en planta y número de plantas enfermas acumuladas a proporción dividido entre su respectivo valor máximo acumulado por cada región con el propósito de estandarizar las diferentes epidemias. El modelo Weibull, con dos parámetros fue ajustado con el procedimiento NLIN de SAS® v9.4 mediante la ecuación y = 1 - exp (t/b) c donde: y = severidad o número de plantas enfermas en proporción, t = tiempo, b = parámetro estimador de tasa y c = parámetro de forma de la curva. Adicionalmente, se estimó el Área Bajo la Curva de Progreso de Enfermedad (ABCPE) con datos de severidad de planta enferma y con el número de plantas enfermas. La combinación aditiva se empleó como un estimador de índice de daño (ID). Para el análisis espacial se seleccionó la epidemia con mayor intensidad por cada región para analizar el comportamiento de contagio intraparcelario. Con las evaluaciones en Y o (Nov-2016) y Y max (pico de incremento absoluto máximo) (Dic-2017) se generaron mapas interpolados y se analizaron los semivariogramas geostadísticos con el programa Surfer® v10.6 (Golden software, EUA). Adicionalmente, a través del programa MorLloyd versión 1.0 desarrollado en MS Excel (Rivas-Valencia y Mora-Aguilera 2010. No publicado) se calculó el índice de Morisita y Loyd para estimar el patrón de dispersión espacial parcelario de la enfermedad (Campbell y Madden, 1990).
Detección de focos con dron. Para analizar la capacidad de detección temprana de focos asistido con vehículos no tripulados, se empleó el drone Phantom4 de DJI® con cámara RGB 14mpx. Se eligieron predios de 3-5 años con incidencia-severidad variable de mancha gris. Para optimizar tiempo, recursos energéticos, almacenamiento digital y analíticos, necesarios en enfoques regionales, los vuelos se realizaron en trayectoria vertical partiendo del centroide/predio para captura de imágenes a alturas entre 10-200m. Las capturas se realizaron entre 8:00 y 18:00h para evaluar efecto de luz reflejada. El análisis de imágenes mediante método de clasificación por máxima probabilidad y mejora de resolución se realizó con ArcMap® v10.1 y QGIS® v2.18.2.
Desarrollo de modelos de pronóstico. La generación de modelos estocásticos de pronóstico para estimar cambios en la intensidad de enfermedad se desarrolló en dos etapas: 1) Selección de epidemias representativas para cada región, y 2) Generación de modelos de regresión lineal múltiple entre cinco variables dependientes Y i con respecto a ocho variables independientes X i con desfases (LAG) de 2-20 semanas para incluir el efecto del periodo de incubación. Los modelos se generaron para dos ventanas de inductividad epidémica (VI i ) correspondientes a los periodos enero-abril 2017 (VI 1 ) y junio-octubre 2017 (VI 2 ), los cuales se definieron por exploración gráfica entre horas favorables y Y i . La bondad de ajuste de los modelos se evaluó con CP-Mallow, factor de inflación de la varianza (VIF en inglés) y el coeficiente de regresión ajustado R2 Adj (Mora-Aguilera et al., 1993). La generación de modelos se realizó en los procedimientos REG y GLM del programa estadístico SAS v9.4.
Selección de variables independientes. Debido a las características parasíticas de C. agavicola se eligieron variables climáticas para correlacionar con variables dependientes. Se usó el promedio, máximo y mínimo acumulado semanal de temperatura y humedad relativa. Una infección exitosa del hongo requiere humedad relativa mayor a 80% y entre 15-22 °C (Ángeles-Espino et al., 2016). Con esta base, se calculó el número acumulado semanalmente de horas favorables que cumplieran los dos requerimientos para la germinación de conidios de C. agavicola. El cálculo se realizó con el programa MS CalculaHF (Santana-Peñaloza et al., 2015). En total, ocho variables independientes X i se emplearon para generar modelos de pronóstico (Cuadro 2).
Selección de variables dependientes. Las variables dependientes analizadas incluyeron el número de plantas enfermas (Y 1 ), sumatoria del número de plantas enfermas (Y 2 ), severidad de planta (Y 3 ), severidad de planta en proporción (Y 4 ) y número de plantas enfermas en proporción (Y 5 ). Todas las variables representaron incrementos absolutos por cada intervalo de tiempo t i -t i-1 , por parcela (Y 1 , Y 3 -Y 5 ) o por las n-parcelas de cada región (Y 2 ) (Cuadro 2).
Cuadro 2. Variables dependientes e independientes para generar modelos estocásticos de pronóstico de cambios de intensidad de la enfermedad mancha gris del agave azul en Jalisco, México.
| Variables | Símbolo |
|---|---|
| Independientes (Xi)x | |
| Temperatura promedio semanal | Tprom(2-20 semanas) |
| Temperatura mínima semanal | Tmin(2-20 semanas) |
| Temperatura máxima semanal | Tmax(2-20 semanas) |
| Humedad relativa promedio semanal | HRprom(2-20 semanas) |
| Humedad relativa mínima semanal | HRmin(2-20 semanas) |
| Humedad relativa promedio semanal | HRmax(2-20 semanas) |
| Número de horas favorables con desfase (lag) de n semanas | HFav(2-20 semanas) |
| Número de horas supresivas con desfase (lag) de n semanas | HSup(2-20 semanas) |
| Dependientes en incrementos absolutos (Yi)y | |
| Número de plantas enfermas | Y1 |
| Sumatoria de plantas enfermasz | Y2 |
| Severidad en planta enferma (%) | Y3 |
| Proporción de severidad en planta | Y4 |
| Proporción del número de plantas enfermas | Y5 |
xEl cálculo de variables se realizó por parcela de monitoreo / The calculation of variables was done per each monitoring plot.
yIncremento absoluto: Yi t -Yi t-1 / Absolut increment: Yi t -Yi t-1
zLa sumatoria se realizó para las n-parcelas de monitoreo de cada región (Los Altos, Valles y Sur) por cada tiempo-i de evaluación. / The summatory was made for the n-monitoring plots per each region (Los Altos, Valleys and South) for evaluation time-i.
Resultados
Caracterización del hongo. Las características culturales, morfológicas y moleculares de 13 aislados fungosos correspondieron a C. agavicola. Las secuencias de ADN de los aislados se analizaron con el programa Blast® blastn suit resultando 99% de homología con respecto a la secuencia con número de accesión AY647237 correspondiente a C. agavicola (Ayala-Escobar et al., 2005). Las muestras secuenciadas fueron registradas en el GenBank con números de accesión MH458575- MH458587.
Inductividad epidémica regional. El mapa de inductividad epidémica a nivel del estado de Jalisco mostró el potencial de C. agavicola para inducir epidemias con intensidad espacialmente heterogénea. El mayor potencial se estimó para Los Altos con niveles de moderado a muy alto resaltando municipios de Jesús María, Atotonilco, Ayotlán, Degollado, San Ignacio, Cerro Gordo, Arandas, Tepatitlán y Cuquio (Figura 1). En Valles, el potencial se categorizó de bajo a moderado sobresaliendo Ahualulco, San Juan y Magdalena. La región Sur exhibió condiciones homogéneas de baja inductividad (Figura 1).
Caracterización de epidemias. En un total de 12 evaluaciones mensuales de incidencia y severidad, la mancha gris del agave se presentó con baja intensidad en 33 de las 41 parcelas de monitoreo. En los ocho restantes la ocurrencia de la enfermedad fue nula. En Y o , la incidencia regional promedio en Los Altos fue 3.6%, Valles 0.33% y Sur 0.51%. En la fase final del estudio epidémico (Y f ) se observó poca variación con 2.0, 0.9 y 0.1% con incrementos absolutos máximos en el periodo de marzo a mayo 2017 de 4.4, 1.3 y 0.2%, respectivamente. En general, la severidad de plantas enfermas estuvo en el rango de 2-100%, con severidad promedio entre 0.01-12.8%. La incidencia total absoluta anual regional estuvo en el rango de 0-11%. Por parcela, el mayor incremento absoluto del número de plantas enfermas de Y o a Y max fue de 94 a 125 plantas en Los Altos, 1 a 6 en Valles y 14 a 17 en Sur. De estas plantas, la mortalidad fue de 9, 1 y 9 en Y f , respectivamente. La severidad absoluta incrementó de 11.3-28.1% en Altos, 1.8-5.7% en Sur y 0.02-0.7% en Valles. A partir de epidemias de 14 parcelas seleccionadas para modelaje temporal, la región Los Altos tuvo el mayor índice de daño (ID) con 74.1-329.9 %núm.dia-1 seguido de Sur con 108-144.5 y Valles 0-51.2 (Cuadro 3).

Figura 1 Mapa de inductividad epidémica de Cercospora agavicola estimado con un indicador multivariado de ocurrencia de enfermedad (2012-2015), clima, tipología de suelo y superficie municipal de agave azul (Agave tequilana). Par celas de monitoreo epidémico (puntos blancos) en plantaciones de agave comerciales de 3-4 años de edad. Jalisco, México.
Análisis Espacial. El análisis de patrones espaciales a nivel parcela demostró un limitado incremento de Y o a Y max en el número y expansión de focos en un periodo de 5-8 meses. El mayor incremento, incluyendo coalescencia de focos, se observó en una parcela de Los Altos, una condición extrema no observada en otros predios estudiados (Figura 2). En parcelas de Sur y Valles, el incremento fue principalmente en número e intensidad de foco estimado con la severidad de enfermedad. Los focos mantuvieron prácticamente su tamaño original en Y o y se incrementaron de 5 a 9 y de 0 a 2, respectivamente (Figura 2). El índice de agregación de Morisita estuvo en el rango de 2.4-10.9, indicando agregación moderada a fuerte (focos). Sin embargo, los variogramas de autocorrelación mostraron una dependencia espacial limitada de 2 y 4 plantas para Sur y Los Altos, respectivamente. En la región Valles se observó la menor dependencia espacial con valor de uno, indicativo de una fuerte restricción de contagio. La detección de focos tempranos de mancha gris fue posible en vuelos verticales a alturas 50-100m. La eficiencia detección-delimitación focos fue >85%. La caracterización de daño más preciso fue la variable de incidencia con error ±7%. La precisión estuvo en función al desarrollo de enfermedad, edad, maleza, altura y hora/vuelo (Figura 3).
Cuadro 3 Parámetros de ajuste del modelo Weibull e Índice de Daño (ID) de curvas de proporción estandarizada de severidad (Y 4 ) de 14 epidemias seleccionadas regionalmente para estimar la tasa de epidémica (1/b) e intensidad epidémica (ID) inducida por C. agavicola en Jalisco, México. 2016-2017.
| Región | Parcela | Latitud | Longitud | Modelo | 1/b | IDX | R2 | Pr > F |
|---|---|---|---|---|---|---|---|---|
| Altos | A1 | 20.69727 - 102.25716 | Y4 =1- EXP (t/112.7)1.24 | 0.003 | 329.9 | 0.98 | <.0001 | |
| A4 | 20.85077 - 102.15921 | Y4=1- EXP (t/65149.7)0.74 | 0.005 | 168.0 | 0.71 | 0.001 | ||
| A7 | 20.75053 - 102.48384 | Y4=1- EXP (t/1197.1)0.86 | 0.003 | 161.4 | 0.96 | <.0001 | ||
| A10 | 20.57965 - 102.89150 | Y4=1- EXP (t/28742.1)0.85 | 0.004 | 149.9 | 0.62 | 0.004 | ||
| A13 | 20.53568 - 102.36955 | Y4=1- EXP (t/1716.4)2.76 | 0.0008 | 74.1 | 0.77 | 0.0003 | ||
| A15 | 20.68421 - 102.50424 | Y4=1- EXP (t/116.3)1.14 | 0.003 | 120.0 | 0.96 | <.0001 | ||
| A17 | 21.11167 - 102.86754 | Y4=1- EXP (t/3311)1.90 | 0.003 | 93.0 | 0.75 | 0.0005 | ||
| A20 | 20.69541 - 102.32411 | Y4=1- EXP (t/472)1.60 | 0.003 | 130.4 | 0.99 | <.0001 | ||
| Sur | S5 | 19.66587 - 103.81346 | Y4=1- EXP (t/113353)0.58 | 0.004 | 131.1 | 0.86 | <.0001 | |
| S7 | 20.09198 - 103.42234 | Y4=1- EXP (t/25831.5)0.83 | 0.003 | 102.8 | 0.85 | <.0001 | ||
| S9 | 20.20140 - 103.53209 | Y4=1- EXP (t/3629.6)0.86 | 0.004 | 144.5 | 0.99 | <.0001 | ||
| Valles | V9 | 20.50290 - 103.98623 | Y4=1- EXP (t/5740.9)5.15 | 0.0002 | 0.0 | 0 | - | |
| V10 | 20.36717 - 103.86355 | Y4=1- EXP (t/6490.9)1.26 | 0.004 | 30.6 | 0.87 | <.0001 | ||
| V11 | 20.96739 - 104.04096 | Y4=1- EXP (t/28742.1)0.85 | 0.006 | 51.2 | 0.63 | 0.004 | ||
XÍndice de daño=ABCPE del número de plantas enfermas + ABCPE de la severidad de plantas enfermas / Damage index = AUDPC of the number of diseased plants + AUDPC of the severity of diseased plants.

Figura 2. Patrón espacial en las fases epidémicas Y0 y Ymax en tres parcelas comerciales seleccionadas por el mayor número de plantas enfermas en tres regiones agaveras de Jalisco, México. Y0 para Altos y Sur fue octubre 2016; Y0 en Valles noviembre 2016. Ymax en Altos y Sur Junio y Julio 2017, respectivamente; Valles septiembre 2017.
Análisis Temporal. El comportamiento epidémico estimado con la proporción de severidad de planta estandarizada y acumulada (Y 4 ) fue la más adecuada para estimar tasas epidémicas en las 14 epidemias seleccionadas. El modelo Weibull con dos parámetros tuvo una moderada bondad de ajuste en 8/13 epidemias con un rango de R2 de 0.62-0.87 (p≤0.001). En 4/13 el coeficiente de regresión (R2) estuvo en el rango de 0.96-0.99 (p < 0.0001). Una parcela de Valles tuvo una sola planta enferma en el periodo de 12 meses, por lo que no se requirió el ajuste del modelo (Figura 4, Cuadro 3). Las tasas epidémicas estimadas (b -1 ) estuvieron en el rango de 0.0008-0.006 unidades semana-1, correspondiendo con epidemias de muy baja intensidad. Las tasas epidémicas relativamente superiores se observaron en Los Altos seguido de Sur. La forma de las curvas epidémicas (c) estuvieron en el rango de 0.58-5.15 y representaron un progreso de tipo lineal, atípico para un proceso infeccioso multiplicativo (Campbell y Madden, 1990).
Modelos de Pronóstico. Se seleccionaron 14 epidemias por tipología de forma e intensidad contrastante en el tiempo para el desarrollo de modelos regionales de pronóstico. Se generaron y analizaron un total de 82 modelos a partir del número de epidemias mencionadas y las variables dependientes Y i , los cuales resultaron con R2 adj de 0.15-0.60. Aunque con baja capacidad de pronóstico, los mejores modelos se obtuvieron con Y 2 , la sumatoria del número de plantas enfermas por unidad de tiempo y por región, y con las variables HFav y HRprom, con un LAG de 2 y 12 semanas como variables independientes. Estos modelos tuvieron R2 adj en rango de 0.29-0.60, C(p) de 0.03-8.8, VIF de 1-5.9 y p<0.003. Los mejores modelos de pronóstico fueron para la VI 1 (enero-abril 2017) para Los Altos y Sur (Cuadro 4, Figura 5).

Figura 3 A. Imagen RGB capturada las 13 horas a 220 m de altura en vuelo centroide-vertical sobre una hectárea de agave azul de 3 años con incidencia de mancha gris en Arandas, Jalisco. B. Imagen procesada en ArcGis para estimación del número de plantas e incidencia de plantas enfermas. Censo terrestre: 3600 plantas vs Censo estimado por análisis de imagen: 3717. Incidencia censada vs estimada: 40.5 y 38.3%, respectivamente. Notar la discontinuidad dentro de surcos (ausencia de color verde o pérdida del bandeado) representando focos simples o coalescentes de enfermedad.
Discusión
El agente causal de la mancha gris del agave azul, causado por C. agavicola, tiene un potencial epidémico regional heterogéneo con mayor riesgo para Los Altos (Figura 1). Este resultado se confirmó con datos exhaustivos de 12 meses obtenidos a partir de una red de monitoreo de 41 parcelas en condición productiva comercial de Jalisco. Sin embargo, todos los parámetros, indicadores y variables estimados demostraron consistentemente la baja capacidad epidémica de C. agavicola. Debido al enfoque regional aplicado, el cual permite optimizar el sistema epidemiológico, para captar la variabilidad epidémica regional, estos resultados son inherentemente robustos. Así, tasas epidémicas muy bajas (0.0008-0.006 unidades semana-1), contagio fuertemente restringido (1-4 plantas), reducido incremento anual de plantas enfermas (0-32 plantas) y nula captura de esporas en 41 trampas muestran la baja aptitud parasítica del hongo (Cuadro 2-3, Figura 2).
Cuadro 4. Modelos estocásticos seleccionados para el pronóstico en dos ventanas de inductividad, VI 1 (enero-abril) y VI 2 (junio-octubre), del incremento absoluto de la sumatoria de plantas enfermas (Y 2 ) de mancha gris del agave azul en tres regiones agaveras de Jalisco. 2016-2017.
| Región | Modelos X | F | C(p)Y | VIF | R2 adj Z |
|---|---|---|---|---|---|
| Altos /VI1 | Y2= 1.31(HFav12) | <.0001 | 8.84 | 2.04 | 0.47 |
| Altos / VI1 | Y2= 0.8(HFav2) | <.0001 | 0.03 | 1.00 | 0.51 |
| Altos / VI1 | Y2 = 0.95(HFav12) + 0.25 (HRprom12) | <.0001 | 2.00 | 2.04 | 0.50 |
| Altos /VI2 | Y2 = 0.0.005(HFav12) + 0.17 (HRprom12) | <.0001 | 2.00 | 2.54 | 0.23 |
| Sur / VI1 | Y2 = -0.04(HFav12) + 0.25(HRprom12) | <.0001 | 2.00 | 4.75 | 0.60 |
| Sur / VI1 | Y2 = 0.04(HRprom2) | <.0001 | 6.46 | 4.00 | 0.57 |
| Sur / VI2 | Y2 = 0.002(HFav12) + 0.02(HRprom12) | <.0001 | 2.00 | 3.67 | 0.31 |
| Sur / VI2 | Y2 = 0.004(HFav2) | <.0001 | 1.04 | 1.00 | 0.32 |
| Valles/ VI1 | Y2 = -0.006(HFav12) + 0.01(HRprom12) | 0.0003 | 2.00 | 3.67 | 0.32 |
| Valles/ VI1 | Y2 = -0.003(HFav2) + 0.008(HRprom2) | <.0001 | 2.00 | 3.25 | 0.31 |
| Valles/ VI2 | Y2 = -0.001(HFav12) + 0.02(Hprom12) | <.0001 | 2.00 | 4.15 | 0.32 |
| Valles/VI2 | Y2= -0.001(HFav2) + 0.014(Hprom2) | <.0001 | 2.00 | 5.93 | 0.29 |
xHRprom2,12=porcentaje de humedad relativa promedio semanal, HFav2,12= horas favorables acumuladas por una semana y desfasadas 2 o 12 semanas a partir de la evaluación de Y 2 / HRprom2,12 = percentage of weekly relative humidity, HFav2,12 = favorable hours week accumulated and lag-2 or lag-12 weeks from the evaluation of Y 2 .
YEstadísticos de bondad de ajuste: Cp-Mallow. VIF=Factor de inflación de la varianza. R2 adj=Coeficiente de regresión ajustado / Statistics of goodness of fit: Cp-Mallow. VIF = Variance inflation factor. R2 adj = Adjusted regression coefficient.
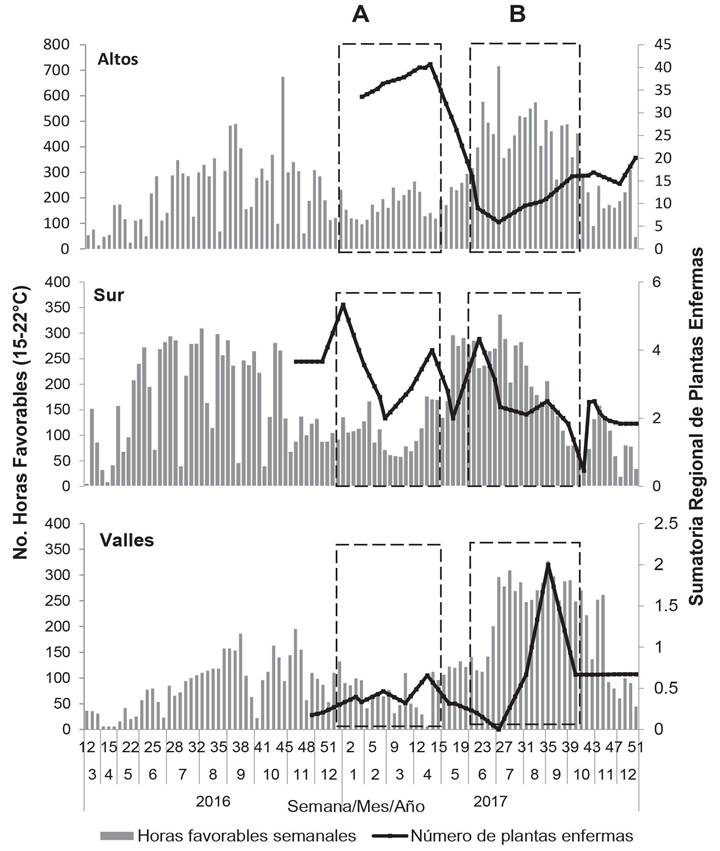
Figura 5 Curvas epidémicas de la sumatoria del número de plantas enfermas de agave azul con mancha gris en 8, 3 y 3 parcelas de monitoreo para Los Altos, Sur y Valles, respectivamente (líneas). Número acumulado por semana de horas favorables para la infección de C. agavicola obtenidas de marzo 2016 a dic 2017 (barras). A) Ventana de inductividad epidémica correspondiente al periodo enero-abril 2017 (VI1). B) Ventana de inductividad epidémica correspondiente al periodo jun-oct 2017 (VI2).
Los modelos estocásticos de pronóstico son recurrentes en la epidemiología por la facilidad analítica de incluir un conjunto de variables en un proceso estadístico automática de selección de variables y modelos (Mora-Aguilera et al., 1993; Chuang y Jeger, 1987; Coakley et al., 1985). Sin embargo, la aplicación práctica de estos modelos puede ser limitada por la captación restringida de la variabilidad implícita en estudios parcelarios en contraposición con enfoques regionales (Mora-aguilera et al., 2015; Carmona et al., 2010). Por otra parte, una condición obligada para la viabilidad del pronóstico es la ocurrencia de epidemias con picos de variable intensidad para garantizar la identificación de variables independientes con una significativa capacidad descriptiva (Mora-Aguilera et al., 1993). En este trabajo, aunque exhaustivo en la caracterización de la varianza epidémica regional con el estudio de 41 epidemias, la baja intensidad de la enfermedad no permitió la generación de modelos con aceptable capacidad predictiva (i.e. R2 > 0.70). Esta restricción, más que temporal puede ser inherente a la limitada aptitud parasítica del C. agavícola y al rol de la toxina en la intensidad del daño (Apoga et al., 2002; Franco-Navarro y Zavaleta-Mejía, 2001; Daub y Ehrenshaft, 2000; Jens et al., 1989; Kurppa, 1985), el cual puede ser importante debido a la ausencia de una curva típica de procesos infecciosos con tendencias temporales lineales (Figura 4). En consecuencia, la premisa de esta investigación de pronosticar el proceso infeccioso primario con éxito, independiente del efecto de la toxina, podría descartarse y en el futuro serían necesarios modelos mixtos que incluyan el proceso infeccioso y el tóxico. Sobre todo, considerando la adaptación del agave a climas secos con alta radiación solar posiblemente óptimos para la activación de la cercosporina (Daub y Ehrenshaft, 2000). Las implicaciones de toxinas fungosas y otros factores abióticos en procesos epidémicos y de patogénesis atípicos han sido reconocidos por Vanderplank (1984) y otros (Apoga et al., 2002; Liljeroth, 1994, Kurppa, 1985; Ludwig, 1957). Sin embargo, a pesar de la limitada capacidad predictiva, aun de los mejores modelos generados, correspondientes a Los Altos y Sur (R2 adj 0.51-0.60), se observaron tendencias analíticas consistentes: 1). Identificación de dos ventanas de inductividad de enfermedad siendo más importante la de enero-abril, posiblemente por las condiciones más ideales para el desarrollo de la infección primaria con limitado efecto de toxina (Ángeles-Espino et al., 2016). 2). Selección de un periodo LAG de 2 y 12 semanas que podrían estimar el periodo de incubación y latencia del hongo, respectivamente. En Pseudocercospora opuntiae, un hongo con similar comportamiento epidémico (Hernández-Sánchez et al., 2014), se reporta un periodo de latencia de 14 semanas (Quezada-Salinas et al., 2013). 3). La inclusión de horas favorables acumuladas (HFav) respecto a la infección del hongo, lo cual sugiere que este indicador puede integrarse a SIVEA (www.sivea.org.mx) mediante un algoritmo que automatice su cálculo para representar un indicador de riesgo o inductividad. Este indicador, podría activar el monitoreo de plantas enfermas a nivel de predio y región para su temprana eliminación. Una práctica que los productores de agave ya realizan sobre la base observacional. La eliminación de plantas dañadas, asistida por HFav con énfasis en ventanas de inductividad (VI i ), puede ser exitosa considerando que la enfermedad tiene una fuerte restricción de contagio, idea reforzada por la ausencia de captura de esporas en los dispositivos de impacto y deposición, limitándose a un máximo de 1-4 plantas en focos iniciales a avanzados. En este contexto el empleo de drones pueden ser una estrategia promisoria para la vigilancia de focos tempranos a nivel de predio (Figura 3), tanto por productores líderes y empresas, como por personal de la Campaña contra Plagas Reglamentadas del Agave (www.sivea.org.mx).
Finalmente, a pesar de la baja aptitud parasítica y epidémica del C. agavicola, la estimación en el impacto productivo, a jima comercial (6 años), puede ser significativo a nivel regional bajo un escenario de las tasas epidémica encontradas en este trabajo, 84% de predios afectados a partir de los 3 años y ausencia de jimas sanitarias que reduzcan la carga de inóculo. Así, a precio/kilo promedio 2018 de 24 pesos MXN y piñas/50 kg, las pérdidas regionales pueden ser de 2,058,187,075 MXN (98.01 MDD) a 4,985,330 MXN (237 mil USD). A nivel de una hectárea, bajo los mismos supuestos, las pérdidas pueden oscilar entre 915,448 MXN a 124,500 MXN, respectivamente. Para una industria que depende de inventarios productivos planeados a mediano plazo; una creciente exportación de tequila, ubicándose en 2018 en cuarto lugar en captación de dividas agrícolas; competencia con la industria de inulina de agave, y la reconversión de predios al cultivo de berries, hace imperativo la eficiencia sanitaria y productiva.
Conclusiones
Este trabajo constituye el primer estudio epidemiológico regional en Jalisco de Cercospora agavicola, agente causal de la mancha gris del agave azul (Agave tequilana). La inductividad epidémica regional de C. agavicola fue heterogénea con mayor riesgo para al menos nueve municipios de Los Altos. Sin embargo, todos los parámetros, indicadores y variables estimadas demostraron consistentemente la baja capacidad epidémica de C. agavicola. Por lo anterior, se encontró una limitada capacidad predictiva aun con los mejores modelos generados (R2 adj 0.51-0.60). La variable horas favorables acumuladas (HFav) respecto a la infección del hongo fue consistente entre los mejores modelos, lo cual sugiere que este indicador puede integrarse a SIVEA (www.sivea.org.mx) con fines preventivos y de control. Es necesario fortalecer la comprensión de la biología del hongo con énfasis en la patogénesis, dispersión, carga de inóculo, y el efecto de la cercosporina. A pesar de la baja aptitud parasítica de C. agavicola, las pérdidas regionales pueden oscilar entre 98.01 MDD y 237 mil dólares americanos.











 text in
text in 



